Synaptotagmin1影響小鼠卵母細胞減數分裂和皮質反應的研究
朱秀蘭,易艷紅,唐婷,張春暉,劉風華*
(1.廣東省婦幼保健院生殖健康與不孕癥科,廣州 510000;2.北京大學深圳醫院生殖醫學科,深圳 518000)
Synaptotagmin1影響小鼠卵母細胞減數分裂和皮質反應的研究
朱秀蘭1,易艷紅1,唐婷1,張春暉2,劉風華1*
(1.廣東省婦幼保健院生殖健康與不孕癥科,廣州 510000;2.北京大學深圳醫院生殖醫學科,深圳 518000)
目的 探討Synaptotagmin1(Syt1)對小鼠卵母細胞減數分裂過程和皮質反應的影響。 方法 免疫印跡檢測Syt1在小鼠卵母細胞的表達;免疫熒光分析Syt1在卵母細胞中定位以及對減數分裂過程的影響;活細胞實時拍攝系統觀察皮質反應以及紡錘體、染色體在降調Syt1表達的動態變化。 結果 (1)Syt1和小鼠卵母細胞皮質顆粒完全共定位;(2)降調Syt1表達,小鼠卵母細胞減數分裂進程受到阻礙;(3)活細胞實時拍攝系統證實了降調Syt1會影響中后期轉換、第一極體釋放以及進一步的皮質反應。 結論 Syt1參與調控卵母細胞的減數分裂的成熟過程和皮質反應的發生。
Synaptotagmin1; 減數分裂; 皮質反應; 卵母細胞
(JReprodMed2017,26(2):163-167)
Synaptotagmin1(Syt1)是一種神經突觸囊泡蛋白,用于調節神經遞質的釋放,近來被發現在神經元樹突和軸突的分化中也有重要的作用[1-3]。目前為止,Syt1在生殖細胞中的功能研究較少。本文通過Syt1特定寡核苷酸序列(morpholino,MO)降調小鼠卵母細胞Syt1的表達,深入系統地研究了Syt1在小鼠卵母細胞發育過程和孤雌激活后的表達和作用;用活細胞工作站成像系統實時觀察發現Syt1參與了小鼠卵母細胞減數分裂的成熟過程和皮質反應的發生。
資料與方法
一、研究對象及試劑
1.研究對象:4~6周齡ICR品系雌性小鼠(購自北京維通利華,SPF級,SCXK京,2012-0001)。
2.主要試劑:兔抗Syt1抗體(Abcam,英國);TMA-DPH探針(Molecular Probes,美國);CY5標記的羊抗兔IgG(Jackson,美國);FITC-LCA,M2/M16培養液及其他化學用品來自美國Sigma公司。
3.主要儀器:激光共聚焦顯微鏡(Zeiss LSM 510 META,德國蔡斯);活細胞共聚焦成像系統(Perkin Elmer precisely Ultra VIEW VOX,Perkin Elmer,美國)。
二、實驗方法
1.卵母細胞的收集和培養:斷頸法快速處死小鼠后取出卵巢,將卵巢切碎于一次性培養皿中,收集GV期卵母細胞置于M2培養滴中,清洗5~6次后,移至覆蓋有礦物油的M16培養滴或者含有2.5 μM米力農(深圳思科達生物公司,深圳)的M2培養滴,置于培養箱中培養(37℃,5% CO2,95%濕度)。培養到不同時期后取出用于免疫印跡、免疫熒光、激光共聚焦掃描顯微鏡及其活細胞動態觀察。
2.MO和β5-tubulin-GFP mRNA、H2B-RFP mRNA聯合注射:MO是經過修飾的人工合成反義寡核苷酸鏈小分子。本實驗所用的MO購自美國GENE TOOLS 公司。Syt1-MO序列信息如下:5'-GACTGGCACTCACCATTTTTGGTTC-3';對照MO序列信息如下:5'-CCTCTTACCTCAgTTACAATTT ATA-3'。用Sigma水稀釋,工作濃度為4 mM。通過注射5~10 pL的4 mM MO或者和同體積的β5-tubulin-GFP mRNA(紡錘體)和H2B-RFP mRNA(染色體)的混和物。然后卵母細胞在含2.5 μM米力農的M2培養液中培養24 h。新鮮M2培養液中洗5遍,置于新鮮M16培養液培養約2~3 h,然后放置活細胞工作站繼續培養14~15 h左右,并實時動態觀察其變化。注射過程中GV期卵母細胞均置于含有2.5 μM米力農的M2培養液中,30 mins內完成操作。
3.卵母細胞的活細胞動態觀察實驗:向GV期卵母細胞中注射上述Syt1或對照MO和mRNA的混合物用于追蹤紡錘體、染色體在卵母細胞成熟過程中的動態變化。經注射的卵母細胞培養至GVBD(約4~5 h)后放置Perkin Elmer precisely Ultra VIEW VOX 活細胞共聚焦成像系統,繼續培養14~15 h左右,使用窄帶通濾波器和一個綠色熒光蛋白和紅色熒光蛋白30%的削減中性密度日色度過濾器,根據tubulin-GFP和H2B-RFP的熒光強度,曝光時間在300毫秒到800毫秒之間,用IP Lab(Scanalytics) 或 AQM6(Andor/Kinetic-imaging)的軟件系統支持數字化的延時成像技術。
4.孤雌激活和皮質反應的觀察:為明確Syt1對小鼠卵母細胞皮質顆粒發生皮質反應的影響,首先收集正常培養的MⅡ期成熟卵母細胞,臺氏酸去除透明帶,放置在現配現用的SrCl2-CZB培養液(10 mM)中進行孤雌激活,收集激活后不同時間點的受精卵用免疫印跡法檢測Syt1的表達水平。其次用活細胞成像系統觀察降調Syt1的表達對卵母細胞SrCl2孤雌激活后的皮質反應是否有影響。向GV期卵母細胞中注射Syt1-MO或者對照MO,每個卵母細胞大約注射10 pL。經注射的卵母細胞繼續培養12 h。收集Syt1降調后仍有第一極體釋放和對照組的MⅡ卵母細胞,同上方法進行孤雌激活,同時用TMA-DPH探針標記皮質顆粒。然后放置Perkin Elmer precisely Ultra VIEW VOX活細胞共聚焦成像系統觀察。
三、統計分析
結 果
一、Syt1和皮質顆粒在小鼠卵母細胞中的共定位和表達
體外培養小鼠卵母細胞0 h、8 h和12 h分別對應GV、MⅠ和MⅡ期,用免疫印跡法半定量檢測其表達水平,結果顯示:在小鼠卵母細胞發育的各個時期均有Syt1的表達(圖1A)。免疫熒光檢測Syt1和皮質顆粒的亞細胞定位,結果顯示Syt1和皮質顆粒兩者完全共定位,主要分布在皮質區,MⅠ期,染色體靠近的1/3皮質區域沒有表達(圖1B)。
二、降調Syt1對小鼠卵母細胞第一次減數分裂前中期/中期阻滯及極體排出率的影響
使用Syt1特異性反義寡核苷酸MO注射,結果顯示Syt1-MO顯著降調了Syt1的表達(圖2A)。經注射的GV期卵母細胞,轉移到M16培養液中繼續培養10 h或者12 h,10 h收集AI期卵母細胞,Syt1-MO注射組Pro-MⅠ/MⅠ阻滯率為91.80 %(n=49),較對照MO注射組31.48%(n=54)顯著增加,差異有統計學意義(P=0.001)(表1);12 h收集的卵母細胞中,Syt1-MO注射組極體排出率(45.33%,n=154)與對照組(60.76 %,n=161)相比,差異有統計學意義(P<0.005)(表2)。

GV:生發泡期卵母細胞,MⅠ:第一次減數分裂中期卵母細胞,MⅡ:第二次減數分裂中期卵母細胞;CGs:皮質顆粒。圖1 Syt1和皮質顆粒在小鼠卵母細胞中的共定位和表達。1A:小鼠卵母細胞體外培養GV、MⅠ、MⅡ時期Syt1的表達,Syt1和標準量β-actin的分子量分別為47 kDa 和42 kDa;1B:Syt1和皮質顆粒的亞細胞定位,Syt1(粉紅色),CGs(綠色),DNA(紅色),merge(sytl+CGs+DNA)。

組別無Pro-MⅠ/MⅠ阻滯有Pro-MⅠ/MⅠ阻滯Syt1-MO組4/49(8.20)*45/49(91.80)*對照MO組37/54(68.52)17/54(31.48)
注:與對照組比較,*P<0.001

表2 Syt1-MO組與對照組極體排出率的比較[n(%)]
注:與對照組比較,*P<0.005
三、降調Syt1對小鼠卵母細胞染色體分離和第一次減數分裂過程的影響
向卵母細胞內注射了β5-tubulin-GFP mRNA、H2B-RFP mRNA和Syt1-MO或對照-MO的混合物,并應用活細胞工作站延時拍攝系統去捕捉紡錘體和染色體的動態變化。結果顯示,對照組中約GVBD后2 h開始形成紡錘體,之后完整的雙極紡錘體逐漸移至皮質區,接著中后期轉換完成,約觀察7 h發現第一極體(圖2B)。共觀察約40個對照組卵母細胞,幾乎所有細胞在不同的減數分裂時期均呈現出對應各時期的正常形態紡錘體和排列正常的染色體,大部分均能完成第一極體釋放。然而,在Syt1-MO注射組卵母細胞出現各種形態異常的紡錘體,染色體不能正確分離,染色體和紡錘體均出現紊亂分散在胞內,且部分染色體脫離紡錘體,接著出現異常的紡錘體和染色體重新聚合又分離現象,直至最后仍無第一極體出現(圖2C)。大部分卵母細胞均出現類似上述現象,只有少數卵母細胞出現第一極體釋放。
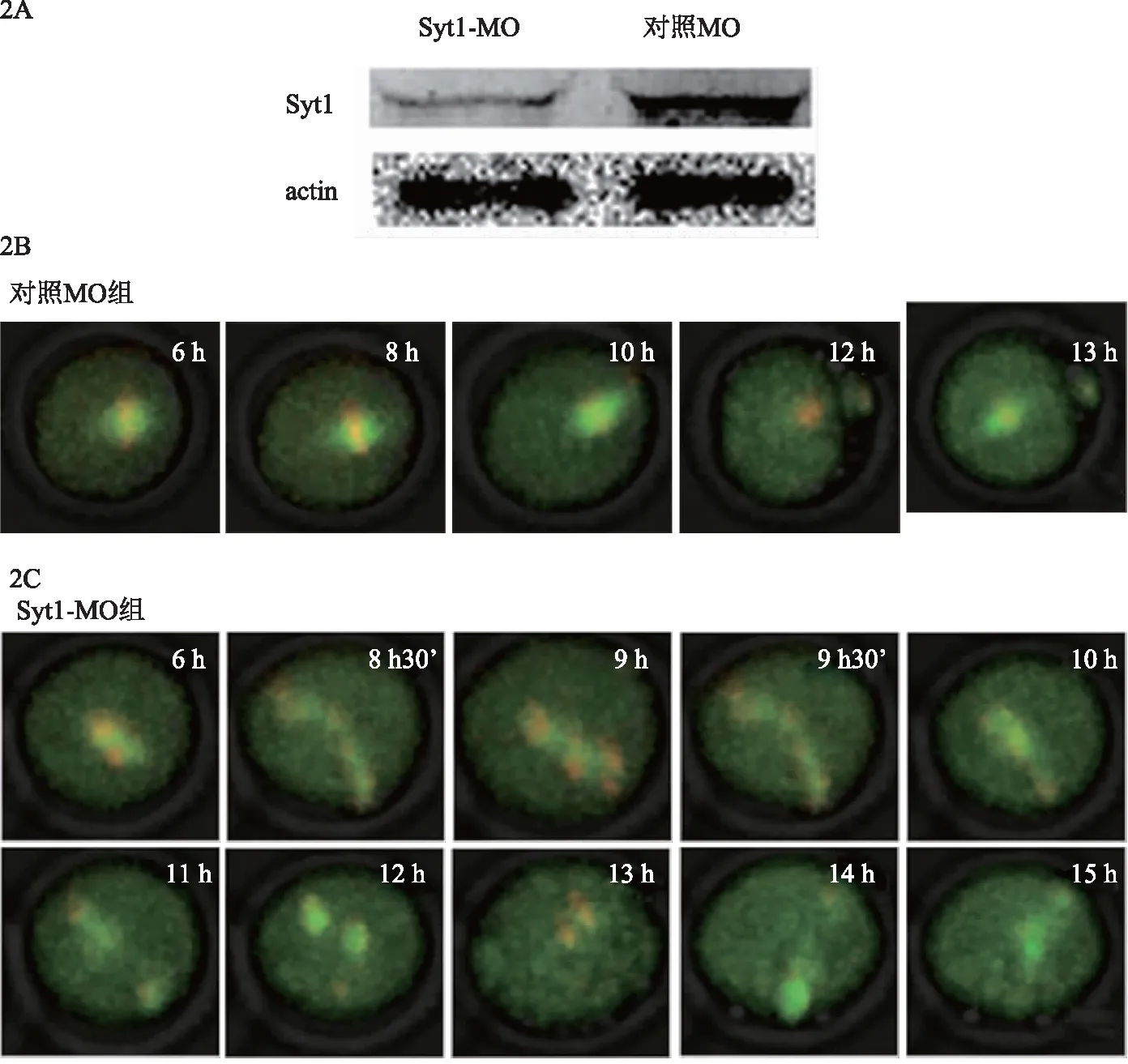
圖2 降調Syt1對染色體分離及第一次減數分裂過程和極體釋放的影響。2A:免疫印跡驗證降調Syt1的表達;2B:對照MO組卵母細胞紡錘體和染色體的動態變化;2C:Syt1-MO組卵母細胞紡錘體和染色體的動態變化。Tubulin(綠色);DNA(紅色).
四、小鼠卵母細胞孤雌激活后Syt1的蛋白表達
體外培養小鼠卵母細胞12 h對應MⅡ期成熟卵母細胞,觀察SrCl2孤雌激活后30 min、1 h、2 h、8 h、12 h和24 h的Syt1的表達情況,結果顯示:孤雌激活后30 min和1 h時表達量最少,之后隨著受精卵的形成表達逐漸增加(圖3)。

圖3 Syt1在SrCl2孤雌激活后的表達:Syt1和標準量GADPH的分子量分別為47 kDa和36 kDa
五、降調Syt1的表達對卵母細胞皮質反應的發生影響
用活細胞成像系統觀察降調Syt1的表達對卵母細胞SrCl2孤雌激活后的皮質反應是否有影響,觀察TMA-DPH熒光強度的變化,計算熒光強度快速增強時變化的時間,結果顯示:Syt1-MO注射組時間為(10.80±2.47)s(n=10),較對照MO注射組(4.61±1.40)s(n=15)顯著延長,兩組相比差異有統計學意義(P<0.01)(表3)。

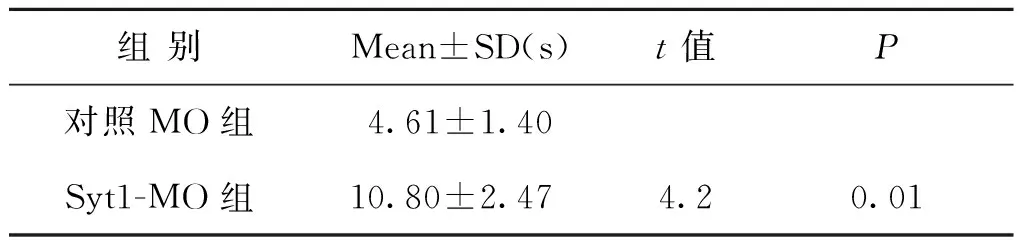
組別Mean±SD(s)t值P對照MO組4.61±1.40Syt1-MO組10.80±2.474.20.01
討 論
Syt1是神經突觸囊泡蛋白,與神經和內分泌細胞中鈣離子結合引起神經遞質和內分泌細胞顆粒釋放進一步引起相應的生物學行為甚至導致疾病的發生[4-6]。本研究我們對Syt1在小鼠卵母細胞減數分裂成熟過程和皮質反應的新功能進行了探討。MO廣泛應用于降調特定基因的表達,比如,MO降調SGK1基因會改變成年鳉魚中囊性纖維化跨膜轉導調節因子(CFTR)的表達從而改變其生存環境[7]。紡錘體檢點蛋白阻止后期促進因子復合物(APC)的活性直至所有著絲粒全部連接到紡錘體上,卵母細胞分裂后期才開始啟動[8],近來也不斷發現新的蛋白分子參與卵母細胞減數分裂過程的調節[9-10]。紡錘體檢驗點蛋白Bub3突變會阻礙SAC激酶Bub1的著絲粒募集,提示其是在減數分裂信號通路中所必須[11]。本實驗結果表明Syt1在小鼠卵母細胞中和皮質顆粒完全共定位。本實驗運用MO方法降調Syt1的表達,結果顯示:卵母細胞發育阻滯在Pro-MⅠ/MⅠ階段、第一極體釋放和皮質反應受阻。
哺乳動物卵母細胞成熟過程經歷兩個重要的調節階段:第一次減數分裂前中期和第一次減數分裂中期的調控。正確的染色體分離過程受多重嚴密的信號網絡調節,否則會導致卵母細胞成熟障礙、胚胎非整倍體發生甚至會進一步影響到子代健康[12-13]。本實驗中一個重要發現是Syt1降調的卵母細胞在分裂進程中阻滯在Pro-MⅠ/MⅠ時期。活細胞成像系統結果表明Syt1-MO組卵母細胞紡錘體異常;染色體分離失敗,部分染色體脫離微管;而且極體釋放受阻;研究結果提示,Syt1很可能參與了小鼠卵母細胞成熟過程中的中后期轉換環節。
卵母細胞中存在有皮質顆粒,當其受精或者孤雌激活時會引起皮質顆粒和胞膜的融合,發生皮質反應,即皮質顆粒的胞吐作用。皮質反應是卵母細胞受精過程的初始事件,是阻止多精受精重要的一個環節,對后續胚胎正常受精及其妊娠是重要的基礎[14]。皮質反應的具體機制尚不是很清晰,Bello等[15]最近發現作為GTP結合蛋白亞族成員的Rab3A蛋白,可能參與到小鼠卵母細胞的皮質反應過程。本實驗中發現Syt1與皮質顆粒完全共定位,Syt1在小鼠卵母細胞減數分裂過程中發揮重要作用。雖然Syt1降調后對第一極體釋放有阻礙,但是仍有部分卵母細胞在Syt1降調后有極體釋放,所以選擇Syt1降調后形態學上觀察有極體釋放的MⅡ卵母細胞,用活細胞成像系統觀察降調Syt1的表達對卵母細胞SrCl2孤雌激活后的皮質反應是否有影響,結果發現Syt1降調后影響了皮質反應的發生,孤雌激活后30 min和1 h Syt1的表達量很少,之后隨著受精卵的形成Syt1表達也逐漸增多,這個變化與皮質顆粒發生皮質反應的過程也相符合,推測Syt1很可能參與到小鼠卵母細胞的皮質反應過程。
總之,本實驗結果表明Syt1作為神經突觸囊泡蛋白分子,在小鼠卵母細胞減數分裂成熟過程、第一極體釋放和皮質反應方面發揮著重要的功能。
[1] Belluzzi E,Gonnelli A,Cimaru MD.LRRK2 phosphorylates pre-synaptic N-ethylmaleimide sensitive fusion(NSF) protein enhancing its ATPase activity and SNARE complex disassembling rate[J].Mol Neurodegener,2016,11: 1-16.
[2] Ramakrishnan NA,Drescher MJ,Drescher DG.The SNARE complex in neuronal and sensory cells[J].Mol Cell Neurosci,2012,50: 58-69.
[3] Wen PJ,Osborne SL,Meunier FA.Phosphoinositides in Neuroexocytosis and Neuronal Diseases.Microbiology and Immunology[J].Curr Top Microbiol Immunol,2012,362: 87-98.
[4] Inoue Y,Kamikubo Y,Ezure H,et al.Presynaptic protein Synaptotagmin1 regulates the neuronal polarity and axon differentiation in cultured hippocampal neurons[J].BMC Neurosci,2015,16: 92-100.
[5] Zanetti MN,Bello OD,Wang J,et al.Ring-like oligomers of Synaptotagmins and related C2 domain proteins[J].Elife,2016,19: 17262-17276
[6] Lai Y,Lou X,Wang C,et al.Synaptotagmin 1 and Ca2+drive trans SNARE zippering[J].Sci Rep,2014,4: 4575-4582.
[7] Notch EG,Shaw JR,Coutermarsh BA,et al.Morpholino gene knockdown in adult fundulus heteroclitus: role of SGK1 in seawater acclimation[J/OL].PLoS ONE,2011,6: 29462-29470.
[8] Touati SA,Wassmann K.How oocytes try to get it right: spindle checkpoint control in meiosis[J].Chromosoma,2016,125:321-325.
[9] Wang H,Jo YJ,Namgoong S,et al.Inhibition of CDK7 bypasses spindle assembly checkpoint via premature cyclin B degradation during oocyte meiosis [J].Biochim Biophys Acta,2016,1863:2993-3000.
[10] Zhang T,Zhou Y,Qi ST,et al.Nuf 2 is required for chromosome segregation during mouse oocyte meiotic maturation[J].Cell Cycle,2015,14:2701-2710.
[11] Ivana Primorac,John R Weir,Elena Chiroli,et al.Bub3 reads phosphorylated MELT repeats to promote spindle assembly checkpoint signaling[J].eLife,2013,2: 01030-01049.
[12] Wang WH,Sun QY.Meiotic spindle,spindle checkpoint and embryonic aneuploidy[J].Front Biosci,2006,11:620-636.
[13] Nabti I,Marangos P,Bomann J,et al.Dual-mode regulation of the APC/C by CDK1 and MAPK controls meiosis I progression and fidelity[J].J Cell Biol,2014,204: 891-900.
[14] Burkart AD,Xiong B,Baibakov B,et al.Ovastacin,a cortical granule protease,cleaves ZP2 in the zona pellucida to prevent polyspermy[J].Cell Biol,2012,197: 37-44.
[15] Bello OD,Cappa AI,de Paola M,et al.Rab3A,a possible marker of cortical granules,participates in cortical granule exocytosis in mouse ggs[J].Exp Cell Res,2016,347:42-51.
[編輯:辛玲]
Synaptotagmin 1 affects meiosis and cortical reaction in mouse oocytes
ZHUXiu-lan1,YIYan-hong1,TANGTing1,ZHANGChun-hui2,LIUFeng-hua1*
1.DepartmentofReproductiveHealthandInfertility,MaternalandChildHealthHospitalofGuangdongProvince,GuangzhouMedicalUniversity,Guangdong510000 2.DepartmentofReproductiveMedicinePekingUniversityShenzhenHospital,MedicalCenterofPekingUniversity,Guangdong518000
Objective:To identify the effect of Synaptotagmin 1(Syt1) on meiosis and cortical reaction in mouse oocyte.Methods:Syt1 expression was determined by immunoblotting analysis.The localization of Syt1 in oocytes and the effect on meiosis processes were analyzed by immunofluorescence.Cortical reaction and the dynamics of microtubule and chromosome were filmed with Perkin Elmer precisely Ulta VIEW VOX Confocal Imaging System.Results:Syt1 expression was localized at the same position as cortical granules(CGs) in mouse oocyte.Down-regulation of Syt1 expression interrupted the meiotic process in mouse oocyte.The results of Perkin Elmer precisely Ulta VIEW VOX Confocal Imaging System confirmed that down-regulation of Syt1 affected MI and MII conversion,the first polar body release and further cortical response.Conclusions:Syt1 is involved in mouse oocyte meiotic maturation process and cortical reaction.
Synaptotagmin1; Meiosis; Cortical reaction; Oocyte
10.3969/j.issn.1004-3845.2017.02.012 ·實驗研究·
2016-10-17;
2016-10-30
國家自然科學基金(2013-81300479)&深圳市科創委面上項目(JCY20120616144719076)
朱秀蘭,女,安徽碭山人,博士,主治醫師,生殖醫學專業.(*
,Email:liushine2006@163.com)

