探討鍵合表阿霉素納米膠束對肝癌Walker-256細胞周期的影響
宋曉斌,李晨玉,方曉白,張 鑫,宋金明,劉銅軍,饒艷偉,楊 威
(1.吉林省人民醫院 急診外科,吉林 長春130021;2.吉林大學第一醫院;3.吉林大學中日聯誼醫院)
探討鍵合表阿霉素納米膠束對肝癌Walker-256細胞周期的影響
宋曉斌1,李晨玉1,方曉白1,張 鑫1,宋金明1,劉銅軍3,饒艷偉1,楊 威2*
(1.吉林省人民醫院 急診外科,吉林 長春130021;2.吉林大學第一醫院;3.吉林大學中日聯誼醫院)
原發性肝癌是我國最常見的惡性腫瘤之一,早期診斷困難,手術切除率低,臨床治療以化學療法為主。傳統的小分子化療藥物缺乏對腫瘤組織的特異性,間斷性的沖擊化療在殺死腫瘤細胞的同時,也會對正常組織產生毒副作用,并易導致腫瘤細胞耐藥性的產生,遠期療效并不滿意[1]。因此,以提高藥效和降低藥物副作用為目的的納米靶向控釋系統應用在肝癌化學療法中逐漸成為國內外學者研究的熱點。
表阿霉素(EPI)是蒽環類抗癌抗生素的新成員,目前在臨床上已逐漸代替阿霉素(ADM),成為肝癌、胃癌、乳腺癌、胰腺癌等多種惡性腫瘤的一線用藥。Cyclin1是P53基因的一個靶向轉錄因子,Cyclin1啟動子中包含兩個P53結合位點[2],當發生基因損傷時,P53激活,Cyclin G1表達增高,抑制細胞發生增殖。Cyclin G被認為是在細胞周期G2/M期起主要調節作用[3]。
所以,本研究設想以EPI為前體藥物,采用透析法制備化學鍵合的載表阿霉素納米膠束(EPI-NPs),研究EPI-NPs對Walker-256細胞的增殖相關蛋白的作用機制。
1 材料與方法
1.1 藥品及主要試劑 表阿霉素(EPI)原藥購于浙江海正制藥有限公司,空白及鍵合表阿霉素納米膠束于中國科學院長春應用化學研究所制備,Cyclin G1蛋白抗體(美國 Abcam公司)。肝癌Walker-256細胞株購自北京醫科院腫瘤研究所。
1.2 細胞培養
Walker-256細胞株為液氮冷凍保存,實驗復蘇Walker-256細胞株,加入DMEM培養液,以2×104/cm2的密度接種于25 cm2培養瓶中,置于37℃,5%CO2的恒溫培養環境中培養,Walker-256細胞為貼壁生長細胞。細胞傳代采用0.4%胰酶消化,正常組給予更換培養液;空白鍵束組給予更換含0.5 μg/ml的空白鍵束培養液;EPI組給予更換含5 μg/ml的EPI培養液;EPI-NPs組為更換含5 μg/mlEPI-NPs培養液,進行72小時培養,之后進行相關分子生物學檢測。
1.3 MTT法檢測胃癌細胞存活率 按使用說明書用MTT法(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽)檢測細胞增殖能力。全自動酶標儀(波長492 nm)測定各孔OD值,計算細胞增殖率。
1.4 流式細胞術檢測細胞周期 取對數生長期的Walker-256細胞,消化后以5×105接種于50 cm2培養瓶,分別按前述方式加入5 μg/ml的EPI和EPI-NPs,以及0.5 μg/ml的PEG-b-P(LA-co-DHP/NPC)空白膠束,對照組加入等體積DMEM培養液。72 h后,分別用胰酶消化,收集細胞2×106個,1 000 rpm離心5 min,棄去培養液。按照試劑盒說明書處理后,混勻后上流式細胞儀做單參數分析。實驗數據用累積曲線分割法計算各期細胞所占比例。
1.5 Western Blot檢測肝癌Walker-256細胞中Cyclin G1蛋白表達 提取細胞總蛋白,Bio-Rad法測定蛋白含量,測定樣品的蛋白濃度。用Image J圖像處理軟件計算各條豆類灰度值,分析Cyclin G1蛋白的表達情況。目的蛋白與內參照β-肌動蛋白(β-actin)灰度值的比值進行表述。
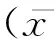
2 結果
2.1MTT法檢肝癌Walker-256細胞的增殖率
細胞增殖率顯示:與正常組相比,空白鍵束組沒有明顯的改變,但是在EPI組和EPI-NPs組的Walker-256細胞增殖率顯著降低,有顯著的統計學意義(P<0.01)。與EPI組相比,EPI-NPs組的Walker-256細胞增殖率降低,有統計學意義(P<0.05),見圖1。

**P<0.01:與對照組相比,有顯著的統計學意義;#P<0.05:與EPI組相比,有統計學意義。
圖1 MTT檢測肝癌Walker-256細胞增殖率
2.2 流式細胞術檢測肝癌Walker-256細胞經EPI-NPs處理后細胞周期的改變
流式細胞術結果顯示:發現Walker-256細胞在對照組和空白鍵束組沒有明顯的區別;EPI組和EPI-NPs組細胞停滯于G2/M期的細胞數均明顯高于對照組(P<0.05);與EPI組相比,EPI-NPs組的G2/M期的細胞數明顯增高(P<0.01),見表1。

表1 流式細胞術檢測肝癌細胞細胞 周期分布
**P<0.01:與對照組相比,有顯著的統計學意義;#P<0.05:與EPI組相比,有統計學意義。
2.3 Western Blot檢測肝癌Walker-256細胞Cyclin G1蛋白表達
與正常組相比,空白鍵束組的組中Cyclin G1表達沒有明顯變化,而EPI組和EPI-NPs組中的Cyclin G1蛋白表達明顯降低,有顯著統計學意義(P<0.01)。與空白鍵束組相比,EPI組和EPI-NPs組中的Cyclin G1表達也明顯降低(P<0.01)。與EPI組相比,EPI-NPs組中的Cyclin G1明顯降低,有統計學意義(P<0.05),見圖2。
3 討論
原發性肝癌是我國最常見的惡性腫瘤之一,早期診斷困難,手術切除率低,臨床治療以化學療法為主。傳統的小分子化療藥物缺乏對腫瘤組織的特異性,間斷性的沖擊化療在殺死腫瘤細胞的同時,也會對正常組織產生毒副作用,并易導致腫瘤細胞耐藥性的產生,遠期療效并不滿意。本研究以提高藥效和降低藥物副作用為目的采用EPI-NPs治療肝癌。前期研究結果表明了EPI-NPs在肝癌Walker-256細胞中有良好的緩釋性,其釋放速率隨著PH的降低而升高,且其隨著作用時間的增加,而表現出了良好的細胞毒性。介于其良好的緩釋性和細胞毒性,我們進步探討其在肝癌細胞中的作用機制。首先我們檢測細胞的增值率,發現在培養72 h后,EPI-NPs組的細胞增殖率的抑制作用明顯比EPI組高,這說明在肝癌的化療過程中EPI-NPs有很高的抑制作用。在細胞周期中,G2/M期是細胞增殖的重要階段,是細胞周期的兩個調節點之一。表阿霉素的主要作用機制即是在DNA復制過程中誘導TOPOⅡ抑制劑,DNA斷裂物復合物的形成,誘導細胞凋亡并使細胞阻滯于G2/M期[4]。我們通過流式細胞術檢測細胞周期,發現了細胞絕大多數都被抑制在G2/M,且EPI-NPs組與EPI組相比,抑制數明顯增高。所以,我們進一步的懷疑了EPI-NPs是否通過影響細胞周期性蛋白來調控細胞的轉歸。

圖2 Western Blot檢測肝癌Walker-256
現階段認為Cyclin1蛋白是P53基因的靶向轉錄因子,Cyclin1啟動子中有兩個P53結合位點[2],當細胞發生基因損傷時,P53被激活,Cyclin G1表達增高,抑制細胞發生增殖。在我們的前期的研究發現,經過EPI-NPs處理的肝癌細胞中P53是被激活的。為了驗證EPI-NPs是否通過影響細胞周期性蛋白來調控細胞轉歸的,我們通過Western Blot法檢測了細胞周期性相關蛋白Cyclin G1的表達,研究結果與我們預期一致,在EPI-NPs組中Cyclin G1蛋白高表達,而且其表達水平明顯高于EPI組。所以,這充分的說明了EPI-NPs通過影響細胞周期性相關蛋白Cyclin G1來改變細胞的增值率的。在Xiaoming Zhao[5]等的研究結果中證明了Cyclin G1和MEF2D可以通過miR-122的作用下調了肺癌細胞的生存率。這進一步說明了Cyclin G1對細胞的增值的影響。
總之,本研究證明了EPI-NPs能增加肝癌Walker-256細胞的增值抑制作用,其主要通過改變細胞周期的G2/M的來實現的,可能通過P53/Cyclin G1細胞途徑來實現的。
[1]Nori A,KoPecek J.Intracellular targeting of polymer-bound drugs for cancer chemotherapy[J].Adv Drug Deliv Rev,2005,57(4):609.
[2]Thomas M,Deiters A .MicroRNA miR-122 as a therapeutic target for oligonucleotides and small molecules[J].Curr Med Chem,2009,20:3629.
[3]Jiang L,Liu R,Wang Y,et al.The role of Cyclin G1 in cellular proliferation and apoptosis of human epithelial ovarian cancer[J].J Mol Histol,2015,46(3):291.
[4]Zimmermann M,Arachchige-Don AS,Donaldson MS,et al.Elevated Cyclin G2 expression intersects with DNA damage checkpoint signaling and is required for a potent G2/M checkpoint arrest response to doxorubicin[J].J Biol Chem,2012,287(27):22838.
[5]Zhao X,Liu M,Li D.Oleanolic acid suppresses the proliferation of lung carcinoma cells by miR-122/Cyclin G1/MEF2D axis[J].Mol Cell Biochem,2015,400(1-2):1.
吉林省科技廳資助項目(No.20130206033SF)
1007-4287(2017)02-0313-03
宋曉斌,男,副主任醫師,博士研究生;楊威,女,副主任醫師,博士研究生。
2016-10-16)
*通訊作者

