甲狀腺乳頭狀癌組織中miRNA-106a的表達變化及其意義
徐慧,郇金亮(江蘇大學附屬上海第八人民醫院,上海200235)
甲狀腺乳頭狀癌組織中miRNA-106a的表達變化及其意義
徐慧,郇金亮
(江蘇大學附屬上海第八人民醫院,上海200235)
目的 觀察甲狀腺乳頭狀癌(PTC)組織中miRNA-106a的表達變化,并探討其意義。方法 30例PTC患者,均行PTC切除手術,術中留取PTC組織及瘤旁正常組織標本。12例甲狀腺腺瘤手術患者,術中留取甲狀腺腺瘤組織。采用RT-PCR法檢測PTC組織、癌旁正常組織及甲狀腺腺瘤組織中miRNA-106a表達。分析miRNA-106a表達與PTC臨床病理參數的關系,采用受試者工作特征曲線(ROC曲線)判斷miRNA-106a表達在PTC診斷中的靈敏度、特異度。結果 PTC組織、癌旁正常組織及甲狀腺腺瘤組織中miRNA-106a相對表達量分別為3.63±0.36、1.04±0.08、1.71 ± 0.48,PTC組織中miRNA-106a相對表達量高于癌旁正常組織、甲狀腺腺瘤組織(P均<0.05)。miRNA-106a表達與PTC淋巴結轉移、TNM分期有關(P均<0.05),與PTC患者的性別、年齡、腫瘤直徑無關(P均>0.05)。miRNA-106a診斷PTC的ROC曲線下面積為0.838(95%CI為0.721~0.956),以相對表達量3.14為界值時,miRNA-106a診斷PTC的敏感度和特異度分別為70%、80%。結論 PTC組織中miRNA-106a高表達,其可能與PTC的發生、發展有關。miRNA-106a檢測PTC的敏感度和特異度均較高。
甲狀腺乳頭狀癌; 組織;MicroRNA-106a;生物標記物
甲狀腺癌是最常見的內分泌系統惡性腫瘤,其發病率呈逐年上升趨勢。甲狀腺乳頭狀癌(PTC)是甲狀腺癌中最常見且病程進展最快的類型,約占甲狀腺癌的80%~90%[1]。40%~60%的PTC患者,尤其是年齡≥45歲的中老年患者,存在淋巴結轉移現象[2]。淋巴結轉移可增加甲狀腺癌的復發幾率[2]。目前,臨床上常用的甲狀腺癌診斷方法主要包括血清學檢測、超聲診斷檢查、細針穿刺(FNA)活檢及組織細胞形態學檢查等。FNA被認為是診斷甲狀腺癌的金指標,但臨床中約30%的FNA報告顯示為“不確定性”[2,3],進一步確診仍需切除甲狀腺側葉后進行組織學診斷分析。甲狀腺切除術是臨床常用的PTC治療方法[2,4]。微小RNA(miRNAs)是一類由18~25個核苷酸組成的內源性非編碼單鏈RNA。近年來,miRNAs在基因調控過程中的作用逐漸被揭示,其對癌細胞增殖、凋亡及生物進程等各方面的調節功能引起了人們的廣泛關注[5,6]。miRNAs在甲狀腺癌中的潛在診斷能力已得到初步證實[7]。研究[8]發現,miRNA-146b、miRNA-211、miRNA-222等miRNAs在癌組織中高表達,可反映PTC的病理階段。最新研究表明,miRNA-106a 在食管癌[9]、胃癌[10]、大腸癌[11]、肺癌[12]等多種癌癥組織中均表達上調,但關于miRNA-106a在PTC組織中的表達報道則較少。我們觀察了PTC組織中miRNA-106a的表達變化,并探討其對PTC的診斷效能。
1 資料與方法
1.1 臨床資料 選擇2015年12 月~2016年3月間在我院住院的PTC患者30例,其中男10例、女20例,年齡22~65歲;均行PTC切除手術,術中留取PTC組織及瘤旁正常組織標本。納入標準:①年齡≥18周歲;②術前經超聲診斷及術后病理確診是PTC及腺瘤組織。排除標準:①既往存在甲狀腺手術史者;②術前均接受過放療或化療者;③哺乳期婦女及孕婦;④存在嚴重心肺疾病、肝腎功能衰竭及惡性腫瘤者。另選擇12例甲狀腺腺瘤患者,其中男6例、女8例,年齡18~66歲;均行甲狀腺腺瘤切除術,術中留取甲狀腺腺瘤組織,所有標本經液氮冷凍,-80 ℃冰箱保存備用。本研究經本院倫理委員會批準。
1.2 PTC組織、癌旁正常組織及甲狀腺腺瘤組織中miRNA-106a檢測 采用RT-PCR法。取 PTC組織、癌旁正常組織及甲狀腺腺瘤組織,按照TAKARA RNA提取說明書提取人甲狀腺組織總RNA。miRNA-106a和U6的引物均由銳博生物有限公司(廣州)設計及合成。逆轉錄合成cDNA,所有操作均參考銳博生物引物使用說明書進行操作,使用來自寶生物工程有限公司的逆轉錄試劑盒(PrimeScriptTM RT reagent Kit),合成目的基因cDNA的第一條鏈。采用SYBR Green Realtime PCR Master Mix進行qRT-PCR。qPCR反應條件如下:95 ℃預變性20 s,95 ℃變性10 s,60 ℃退火20 s,70 ℃延伸10 s。qRT-PCR用SYBR熒光染料標記,內參是U6。重復3次。
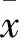
2 結果
2.1 PTC組織、癌旁正常組織及甲狀腺腺瘤組織中miRNA-106a相對表達量比較 PTC組織、癌旁正常組織及甲狀腺腺瘤組織中miRNA-106a相對表達量分別為3.63±0.36、1.04±0.08、1.71 ± 0.48,PTC組織中miRNA-106a相對表達量明顯高于癌旁正常組織及甲狀腺腺瘤組織(P均< 0.05)。
2.2 miRNA-106a表達與PTC患者臨床病理參數的關系 miRNA-106a表達與PTC淋巴結轉移、TNM分期有關(P均<0.05),與PTC患者的性別、年齡、腫瘤直徑無關(P均>0.05)。見表1。
2.3 miRNA-106a表達診斷PTC的敏感度和特異度 ROC曲線分析結果顯示,miRNA-106a診斷PTC的ROC曲線下面積為0.838(95%CI:0.721~0.956),以3.14為界值時,miRNA-106a診斷PTC的敏感度和特異度分別為70%、80%。見圖1。

表1 miRNA-106a表達與PTC臨床病理參數的關系±s)

圖1 miRNA-106a表達診斷PTC的ROC曲線
3 討論
miRNAs是一類由內源性基因編碼的長度約為22個核苷酸的非編碼單鏈RNA分子[13],廣泛存在于病毒、植物及動物體內,參與機體的生長、發育、分化等過程。miRNAs主要通過與靶mRNA的3′端非編碼區完全或不完全互補結合,誘導RNA干擾途徑,降低mRNA的穩定性,抑制編碼蛋白質的翻譯,進而抑制蛋白質合成[14]。基因表達譜檢測發現,多種腫瘤組織中均存在miRNAs表達異常的現象[15],提示miRNAs可作為腫瘤診斷、治療和預后的潛在生物標志物[16]。
腫瘤的發生發展與抑癌基因和致癌基因之間的表達失衡有關,抑癌基因表達下調或致癌基因表達上調均能促進癌癥的發生。大量的基因譜數據分析表明,多種miRNAs參與到了復雜的癌癥生成過程中。一方面,某些表達異常上調的miRNAs抑制了抑癌基因的表達。另一方面,某些miRNAs的下調間接誘導了致癌基因的活化[17]。此外,miRNAs在不同類型的腫瘤中、相同類型腫瘤的不同階段、轉移瘤與非轉移瘤中的表達存在明顯差異性,暗示miRNAs的表達異常在癌癥的早期診斷、病理分期及治療中意義重大,檢測不同類型腫瘤中特異性miRNA的表達變化可能成為腫瘤臨床診斷新方法。
PTC是最常見的甲狀腺癌類型,約占甲狀腺癌的80%以上。近年來,PTC的發生與miRNA的表達異常之間的聯系逐漸被揭示。He等[8]首次將miRNAs表達譜應用到了PTC診斷中。研究發現,PTC腫瘤組織中存在多種表達明顯上調的miRNAs。Yao等[16]采用qRT-PCR法進一步確認了PTC癌組織與正常組織中miRNAs的表達差異。現已明確在PTC腫瘤組織中上調的miRNAs有miRNA-221-5P、miRNA-222-5P、miRNA-34a-5P、miRNA-146b-5P、miRNA-21-5P和miRNA-31- 5P,下調的miRNAs有miRNA-181-5P和miRNA-138-5P。
miRNA-106a由23個核苷酸組成,其基因位于染色體Xq26.2。miRNA-106a屬于miRNA-17家族成員,與miRNA-17-5p、miRNA-20a、miRNA-106b、miRNA-93、miRNA-20b等有同源的基因結構[18]。miRNA-106a是一種致癌的miRNA,在結直腸癌、胃癌、胰腺癌等多種癌組織中表達明顯上調,并且其表達與腫瘤分期、分化程度、瘤體大小以及有無淋巴結轉移和遠處浸潤現象存在不同程度的相關性。多項機制研究發現,miRNA-106a能夠促進腫瘤細胞增殖、抑制腫瘤細胞凋亡、誘導腫瘤血管生成,進而促進腫瘤發生發展[9]。Zhu等[19]研究發現,胃癌組織中miRNA-106a的表達量與腫瘤轉移率呈正相關,同時抑制miRNA-106a表達能顯著降低癌細胞的增殖、遷移和侵襲能力。Li等[20]證實,胰腺癌組織中強烈高表達的miRNA-106a能夠促進癌細胞增殖和上皮間質轉化,并抑制下游基因基質金屬蛋白酶抑制因子2的表達,進而促進胰腺癌的發生。這一系列研究發現提示我們miRNA-106a在多種腫瘤多階段演進過程中扮演了不可或缺的角色。
本研究中,PTC組織中miRNA-106a相對表達量明顯高于癌旁正常組織及甲狀腺腺瘤組織。miRNA-106a表達與PTC淋巴結轉移、TNM分期有關,與PTC患者的性別、年齡、腫瘤直徑無關。miRNA-106a表達診斷PTC的ROC曲線下的面積為0.838(95%CI:0.721~0.956),以3.14為界值時,miRNA-106a表達診斷PTC的敏感度和特異度分別為70%、80%。說明PTC組織中miRNA-106a高表達,其可能與PTC的發生、發展有關。miRNA-106a診斷PTC的敏感度和特異度均較高。
[1] Benvenga S, Koch CA. Molecular pathways associated with aggressiveness of papillary thyroid cancer [J]. Curr Genomics, 2014,15(3):162-170.
[2] Saiselet M, Gacquer D, Spinette A, et al. New global analysis of the microRNA transcriptome of primary tumors and lymph node metastases of papillary thyroid cancer [J]. BMC Genomics, 2015,16(1):1-18.
[3] Piana S, Frasoldati A, Ferrari M, et al. Is a five-category reporting scheme for thyroid fine needle aspiration cytology accurate? Experience of over 18,000 FNAs reported at the same institution during 1998-2007 [J]. Cytopathology, 2011,22(3):164-173.
[4] Grogan RH, Mitmaker EJ, Hwang J, et al. A population-based prospective cohort study of complications after thyroidectomy in the elderly [J]. J Clin Endocrinol Metab, 2012,97(5):1645-1653.
[5] Perdas E, Stawski R, Nowak D, et al. The Role of miRNA in Papillary Thyroid Cancer in the Context of miRNA Let-7 Family [J]. Int J Mol Sci, 2016,17(6):909.
[6] Santos MC, Tegge AN, Correa BR, et al. miR-124, -128, and -137 Orchestrate Neural Differentiation by Acting on Overlapping Gene Sets Containing a Highly Connected Transcription Factor Network [J]. Stem Cells, 2016,34(1):220-232.
[7] Wei WJ, Shen CT, Song HJ, et al. MicroRNAs as a potential tool in the differential diagnosis of thyroid cancer: a systematic review and meta-analysis [J]. Clin Endocrinol (Oxf), 2016,84(1):127-133.
[8] He H, Jazdzewski K, Li W, et al. The role of microRNA genes in papillary thyroid carcinoma [J]. Proc Natl Acad Sci U S A, 2005,102(52):19075-19080.
[9] Hummel R, Hussey DJ, Michael MZ, et al. MiRNAs and their association with locoregional staging and survival following surgery for esophageal carcinoma [J]. Ann Surg Oncol, 2011,18(1):253-260.
[10] Hou X, Zhang M, Qiao H. Diagnostic significance of miR-106a in gastric cancer [J]. Int J Clin Exp Pathol, 2015,8(10):13096-13101.
[11] Catela Ivkovic T, Aralica G, Cacev T, et al. miR-106a overexpression and pRB downregulation in sporadic colorectal cancer [J]. Exp Mol Pathol, 2013,94(1):148-154.
[12] Jiang Y, Wu Y, Greenlee AR, et al. miR-106a-mediated malignant transformation of cells induced by anti-benzopyrene-trans-7,8-diol-9,10-epoxide [J]. Toxicol Sci, 2011,119(1):50-60.
[13] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function [J]. Cell, 2004,116(2):281-297.
[14] Bartel DP. MicroRNAs: target recognition and regulatory functions [J]. Cell, 2009,136(2):215-233.
[15] Iorio MV, Croce CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review [J]. EMBO Mol Med, 2012,4(3):143-159.
[16] Yao Y, Hu J, Shen Z, et al. MiR-200b expression in breast cancer: a prognostic marker and act on cell proliferation and apoptosis by targeting Sp1 [J]. J Cell Mol Med, 2015,19(4):760-769.
[17] Suresh R, Sethi S, Ali S, et al. Differential Expression of MicroRNAs in Papillary Thyroid Carcinoma and Their Role in Racial Disparity [J]. J Cancer Sci Ther, 2015,7(5):145-154.
[18] Wang Z, Liu M, Zhu H, et al. miR-106a is frequently upregulated in gastric cancer and inhibits the extrinsic apoptotic pathway by targeting FAS [J]. Mol Carcinog, 2013,52(8):634-646.
[19] Zhu M, Zhang N, He S, et al. MicroRNA-106a targets TIMP2 to regulate invasion and metastasis of gastric cancer [J]. FEBS Lett, 2014,588(4):600-607.
[20] Li P, Xu Q, Zhang D, et al. Upregulated miR-106a plays an oncogenic role in pancreatic cancer [J]. FEBS Lett, 2014,588(5):705-712.
郇金亮(E-mail: huanjl2000@126.com)
10.3969/j.issn.1002-266X.2017.07.015
R574.6
B
1002-266X(2017)07-0049-03
2016-09-12)

