淺談設備采購驗收中的風險管理
趙小明++朱麗瓊
摘 要:社會經濟的不斷發展,促進了經濟結構與經濟建設的完善,使得設備采購、驗收工作量大大增加。在設備的采購與驗收過程中,風險控制與管理是一個相當重要的流程,必須要給予高度重視。設備采購、驗收過程中,每一階段都存在不同程度且不一樣的風險,而我們能做到的就是盡最大可能把風險降到最低限度,使我們采購到的設備能盡快順利投入生產運行之中。那么,如何在設備采購、驗收過程中做好每一步的風險管理,對此,作者參考一些資料,談了一點看法。
關鍵詞:風險評估 URS DQ FAT
中圖分類號:F274 文獻標識碼:A 文章編號:1674-098X(2016)10(a)-0114-02
1 法規要求
《藥品生產質量管理規范》2010版第五章——設備,共分六節、31條。其中涉及到設備采購、驗收方面的條款要求共7條,條款規定詳情如下。
第七十一條 設備的設計、選型、安裝、改造和維護必須符合預定用途,應當盡可能降低產生污染、交叉污染、混淆和差錯的風險,便于操作、清潔、維護以及必要時進行的消毒或滅菌。
第七十三條 應當建立并保存設備采購、安裝、確認的文件和記錄。
第七十四條 生產設備不得對藥品質量產生任何不利影響。與藥品直接接觸的生產設備表面應當平整、光潔、易清洗或消毒、耐腐蝕,不得與藥品發生化學反應、吸附藥品或向藥品中釋放物質。
第七十五條 應當配備有適當量程和精度的衡器、量具、儀器和儀表。
第七十六條 應當選擇適當清洗、清潔設備,并防止這類設備成為污染源。
第七十七條 設備所用的潤滑劑、冷卻劑等不得對藥品或容器造成污染,應當盡可能使用食用級或級別相當的潤滑劑。
第七十八條 生產用模具的采購、驗收、保管、維護、發放及報廢應當制定相應操作規程,設專人專柜保管,并有相應記錄。
2 風險評估
2.1 系統影響性評估(GEP)
系統影響性評估是用于確定項目的調試和驗證范圍的活動。此過程用于判定哪些系統除了需要遵循GEP之外還需要進行驗證,哪些系統僅需要遵循GEP進行調試。
2.2 部件關鍵性評估(CCA)
針對設計文件可進行部件關鍵性評估(Component Criticality Assessment,CCA)工作,其可用于判定系統的哪些部件除了遵循GEP之外還需要進行確認。
2.3 風險評估
風險評估是一種用于評估并描述系統、設備或工藝的關鍵方面,以構成編寫驗證方案的基礎方法。
在判斷出關鍵部件/功能后,對關鍵部件/功能繼續進行風險評估,并確定適宜的控制方法。
3 設備采購、驗收流程中的風險管理
3.1 設備的投資計劃——購買
對于新設備投資計劃,由相應職能部門根據公司生產、研發、生產效率、設備更新等方面的需求發起項目。項目立項需納入變更控制程序以評估GMP風險并跟蹤實施過程,經批準立項。
3.2 用戶需求URS書
是指使用方對廠房、設施、設備和檢驗儀器等硬件設施系統等提出的自己的期望使用需求說明,是使用方綜合自己的使用目的、用途、環境等提出的具體方案。
3.3 設計確認
設計確認(DQ)是文件證據證明廠房、設施、支持系統、公用系統等要求設計。設計確認是一項可以有效規避風險的工作,是所有確認的起點和基礎。
3.4 工廠驗收測試(FAT)
設備依據設計完成生產建造,發貨前在客戶見證下,由供應商在設備制造場地對待交付的設備進行工廠驗收測試,該測試旨在保證設備已經嚴格按照要求完成了組裝調試。
3.5 設備調試與現場驗收測試(SAT)
與FAT相似的是,現場驗收測試也是為了保證設備已經按要求完成了組裝和調試,所以有些測試項目與FAT相同。所不同的是,FAT是由設備的制造商在制造工廠測試,而現場驗收測試是由設備的使用方在設備的使用場所進行的測試,所以更偏向于一些在設備制造工廠無法進行的測試。
現場驗收測試將由供應商在設備/系統到使用現場后進行檢查以保證其文件、安裝和功能的正確性,并由用戶指定的人員進行見證。
現場驗收測試包含靜態和動態測試活動。測試活動在現場由供應商在移交設備給使用方之前進行,每一項現場驗收測試工作都用文件記錄下來。
3.6 安裝確認(IQ)、運行確認(OQ)、性能確認(PQ)前的風險評估
(1)2010版GMP要求。
第一百三十八條 企業應當確定需要進行的確認或驗證工作,以證明有關操作的關鍵要素能夠得到有效控制。確認或驗證的范圍和程度應當經過風險評估來確定。
第一百四十條 應當建立確認與驗證的文件和記錄,并能以文件和記錄證明達到以下預定的目標。
①設計確認應當證明廠房、設施、設備的設計符合預定用途和本規范要求。
②安裝確認應當證明廠房、設施、設備的建造和安裝符合設計標準。
③運行確認應當證明廠房、設施、設備的運行符合設計標準。
④性能確認應當證明廠房、設施、設備在正常操作方法和工藝條件下能夠持續符合標準。
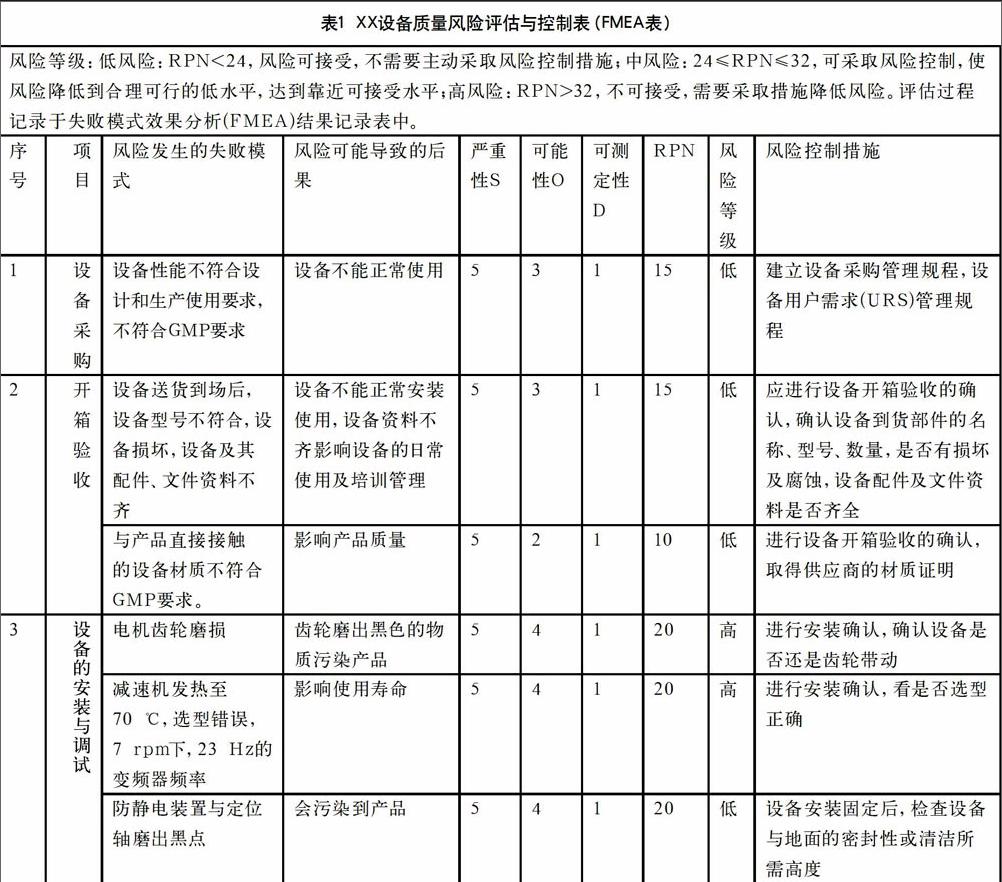
(2)下面以實際案例來進行風險評估。
實際案例見表1。
4 結語
通過對設備采購、驗收(各階段確認)的風險評估,同時也簡述了如何證明、規避、降低各項目中存在的風險。通過對新設備采購、驗收的風險分析得知:經過確認與驗證,能及時發現風險點,為后續進一步采取措施提供了書面依據。
參考文獻
[1] 國家食品藥品監督管理局認證中心.藥品GMP指南:質量管理體系分冊[M].北京:中國醫藥科技出版社,2011.
[2] 何國強.制藥工藝驗證實施手冊[M].北京:化學工業出版社,2012:10.
[3] 何國強.制藥工藝驗證實施手冊[M].北京:化學工業出版社,2012:12-14.

