申克孢子絲菌酵母相對人急性單核細胞白血病細胞NF-κB信號通路及TNF-α的影響
劉彩霞段志敏杜蕾蕾曾 榮沈永年胡素泉劉維達陳 青李 岷
申克孢子絲菌酵母相對人急性單核細胞白血病細胞NF-κB信號通路及TNF-α的影響
劉彩霞1段志敏1杜蕾蕾1曾 榮1沈永年1胡素泉1劉維達1陳 青2李 岷1
目的:明確申克孢子絲菌酵母相對人急性單核細胞白血病細胞(THP-1)NF-κB信號通路激活和腫瘤壞死因子α(TNF-α)分泌的影響。方法:實時熒光定量PCR分析申克孢子絲菌酵母相刺激THP-1細胞TNF-αmRNA的表達,酶聯免疫吸附法檢測TNF-α分泌量,免疫印跡法分析申克孢子絲菌酵母相體外作用于THP-1細胞后IκBα和磷酸化IκBα的水平,免疫熒光法觀察NF-κB-p65核轉位。同時設置地塞米松(NF-κB抑制劑)抑制組,并檢測100 nM地塞米松預處理THP-1細胞后TNF-αmRNA水平的變化。結果:申克孢子絲菌酵母相刺激THP-1細胞后6 h TNF-αmRNA水平顯著高于空白對照組(P<0.001)。申克孢子絲菌酵母相刺激THP-1細胞后24 h,TNF-α蛋白水平為(4610.419±121.501)pg/mL,顯著高于空白對照組(186.964±98.073)pg/mL,差異具有統計學意義(P<0.001)。申克孢子絲菌酵母相作用THP-1細胞后30~60 min,磷酸化IκBα蛋白水平顯著升高,為時間依賴性。申克孢子絲菌酵母相組細胞核內NF-κB-p65較空白對照組熒光強度增強。100 nM地塞米松預處理各組THP-1細胞后,TNF-αmRNA水平較前明顯降低。結論:人THP-1細胞體外與申克孢子絲菌酵母相作用后激活NF-κB信號通路并上調TNF-α分泌。
申克孢子絲菌;單核細胞白血病;腫瘤壞死因子α;NF-κB
孢子絲菌病(sporotrichosis)是一種由雙相病原真菌申克孢子絲菌(Sporothrix schenckii)感染引起的亞急性或慢性肉芽腫性疾病。申克孢子絲菌是一種分布于自然界的腐生菌,可從土壤、木材、植物、水果、昆蟲、海藻、海生動物及動物糞便中分離出來。孢子絲菌病遍布世界各地,熱帶及亞熱帶地區多見,在我國主要集中于東北及長江中下游地區,多為局部微創傷后接觸孢子絲菌污染物致病,通常散發,偶因爆發洪水或飼養寵物而引起小范圍爆發流行[1-3]。近年孢子絲菌病發病率較前攀升,隨著抗真菌藥物的應用,多藥耐藥菌株不斷出現,威脅人類健康[4]。因此,研究人體天然免疫反應在抗申克孢子絲菌感染過程中的作用極為重要。單核巨噬細胞作為宿主天然免疫中重要的反應細胞,能夠識別并吞噬、殺傷、清除入侵的申克孢子絲菌病原體[5]。本研究旨在探討申克孢子絲菌酵母相能否激活人急性單核細胞白血病細胞(Human acute monocytic leukemia cell line,THP-1)的核轉錄因子kappaB(NF-κB)信號通路并誘導分泌TNF-α。
1 材料和方法
1.1 材料細胞、菌株、主要試劑:申克孢子絲菌標準株CMCC(F)D1a,由中國微生物菌種保藏管理委員會醫學真菌中心提供。人THP-1細胞株購自美國模式培養物集存庫(American Type Culture Collection,ATCC)。兔抗人IκBα、磷酸化IκBα抗體和β肌動蛋白抗體為美國Cell Signaling Technology公司產品。TNF-α酶聯免疫吸附(ELISA)試劑盒為欣博盛公司產品。PrimeScript RT Master Mix逆轉錄酶試劑盒為日本TaKaRa公司產品。iTaq Universal SYBR Green Supermix為美國Bio-rad公司產品。佛波酯(PMA)、Curdlan為美國Sigma公司產品,地塞米松為美國Invivogen公司產品。
1.2 方法(1)申克孢子絲菌酵母相誘導:將申克孢子絲菌接種至沙堡弱固體培養基25℃培養7 d,活化3次后轉種于含2%葡萄糖的腦心浸液瓊脂培養基,37℃5%CO2下培養,每14天傳代,觀察菌落及革蘭染色后顯微鏡下形態是否完全轉化為酵母相。培養14~28天制備酵母相菌液,生理鹽水沖洗2遍,計數后配制成109CFU/mL濃度菌懸液待用。(2)細胞培養:人THP-1細胞用含10%胎牛血清、1%青鏈霉素的RPMI 1640培養基,于37℃、5%CO2細胞培養箱中培養、傳代。將細胞制備成2×105/mL細胞懸液,接種于12孔細胞培養板(每孔1 mL)及6孔細胞培養板(每孔2 mL),加入100 ng/mL PMA刺激48 h后誘導形成巨噬細胞,根據預實驗,分別加入終濃度為2×106CFU/mL的申克孢子絲菌酵母相及100μg/mL的Curdlan共培養。(3)實時熒光定量逆轉錄PCR:申克孢子絲菌與THP-1細胞共孵育,并設陽性刺激物Curdlan組、空白對照組、地塞米松抑制組(100 nM NF-κB抑制劑地塞米松預先30 min與THP-1細胞共培養)。預實驗中曾設置多個申克孢子絲菌與THP-1細胞共孵育時間點,刺激后隨時間延長,TNF-α mRNA表達水平漸升高,6 h后達最高峰,繼續延長作用時間則開始降低。本實驗選擇3、6 h作為觀察時間,而地塞米松抑制組選擇6 h。TRIzol法抽提總RNA,按PrimeScript RT Master Mix逆轉錄酶試劑盒說明書將1μg總RNA反轉錄為cDNA。使用ABI 7300 PCR儀,采用Syber green法對目的基因進行擴增。以β-肌動蛋白作為內參照,引物TNF-α及β-肌動蛋白由生工生物工程(上海)股份有限公司合成,引物序列TNF-α上游5'-CGAGTGACAAGCCTGTAGC-3',下游5'-GGTGTGGGTGAGGAGCACAT-3',β-肌動蛋白上游5'-TCTGGCACCACACCTTCAT-3',下游5'-AGGCATACAGGGACAGCAC-3',反應條件:預變性95℃10 min,變性95℃15 s,退火60℃30 s,延伸72℃30 s,循環數40。采用2-△△Ct法計算目的基因的變化水平,△Ct=目的基因-內參照(β肌動蛋白);某一樣品的△△Ct=某一樣品△Ct–對照組樣品的△Ct。2-△△Ct值即為實驗組目的基因較對照組目的基因表達的倍數。(4)ELISA法:刺激THP-1細胞后24 h,收集上清液,按照試劑盒說明書檢測TNF-α含量。根據預實驗,申克孢子絲菌酵母相刺激THP-1細胞后,上清液TNF-α含量升高更明顯。設置不同的共孵育時間,發現刺激24 h后上清液TNF-α含量達到最高。本實驗選擇24 h作為觀察時間。(5)Western印跡分析:收集處理后的THP-1細胞,裂解細胞,提取總蛋白。應用BCA定量法計算蛋白濃度,煮沸變性,SDS-聚丙烯酰胺凝膠電泳分離,濕轉至PVDF膜上。5%血清白蛋白(BSA)封閉2 h,兔抗人單克隆抗體4℃孵育過夜。TBST液(Tris-Buffered Saline Tween-20)洗膜3次后,辣根過氧化物酶標記的山羊抗兔IgG第二抗體孵育2 h,Supersignal試劑顯色發光,檢測申克孢子絲菌酵母相與THP-1細胞共孵育30、60 min后IκBα和磷酸化IκBα水平變化。(7)免疫熒光法觀察NF-κB-p65核轉位:THP-1細胞以5×104/孔的密度接種于培養皿內,細胞培養同上。共孵育16 h后吸棄培養基,細胞待PBS清洗后用4%多聚甲醛室溫固定30 min,并用0.1% Triton X-100室溫通透15 min。3%BSA室溫封閉1 h后,細胞與NF-κB-p65抗體4℃孵育過夜,TBST洗后與Texas Red-羊抗兔IgG室溫避光孵育1 h,TBST漂洗干凈后用500 ng/mL DAPI染核,避光孵育10 min,熒光顯微鏡下觀察,NF-κB-p65呈紅色熒光,細胞核為藍色,核轉位時紅色熒光進入細胞核。
1.3 統計學方法應用SPSS 19.0統計軟件,計量數據以珋x±s表示。不同時間不同組別間TNF-αmRNA比較采用多因素方差分析;不同組別間TNF-α蛋白含量的比較采用單因素方差分析,并采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 申克孢子絲菌酵母相對THP-1細胞TNF-α mRNA水平的影響申克孢子絲菌酵母相刺激THP-1細胞后3、6 h,TNF-αmRNA水平逐漸增高,均顯著高于空白對照組,各組間差異有統計學意義(F= 4503.89,P<0.001)。TNF-αmRNA水平的變化情況,見表1。
2.2 申克孢子絲菌酵母相對THP-1細胞TNF-α表達的影響申克孢子絲菌酵母相與THP-1細胞共孵育24 h,申克孢子絲菌組、Curdlan組、空白對照組的上清液中TNF-α蛋白濃度分別為(4610.419± 121.501)pg/L、(4505.824±198.124)pg/L、(186.964± 98.073)pg/L,申克孢子絲菌組、Curdlan組與空白對照組比較TNF-α蛋白濃度均升高,差異有統計學意義(F=1802.37,P<0.001)。
表1 申克孢子絲菌酵母對TNF-αmRNA水平的影響

表1 申克孢子絲菌酵母對TNF-αmRNA水平的影響
注:a與空白對照組比較,P<0.01
?
2.3 申克孢子絲菌酵母相對THP-1細胞IκBα激活的影響刺激后30 min,與空白對照組比,申克孢子絲菌酵母相刺激后30 min磷酸化IκBα蛋白水平已升高,60 min時磷酸化IκBα蛋白水平顯著升高;IκBα蛋白水平則相應有所降低,如圖1示申克孢子絲菌酵母相能夠激活THP-1細胞信號分子IκBα,并呈時間依賴性。
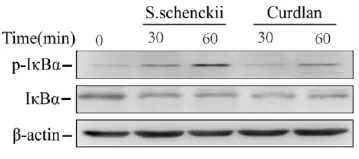
圖1 申克孢子絲菌酵母對THP-1細胞IκBα活化的影響
2.4 申克孢子絲菌酵母相對THP-1細胞NF-κB-p65核轉位的影響結果見圖2,空白對照組的NF-κB-p65主要位于細胞漿,細胞核內僅少量分布;而申克孢子絲菌酵母相刺激THP-1細胞后,細胞核內NF-κB-p65熒光強度增強,進一步提示申克孢子絲菌酵母相能夠激活NF-κB通路。
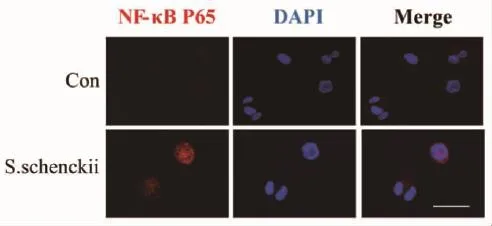
圖2 申克孢子絲菌酵母對THP-1細胞NF-κB-p65核轉位的影響
2.5 地塞米松對申克孢子絲菌酵母相上調THP-1細胞TNF-αmRNA的影響100 nM地塞米松預處理THP-1細胞30 min后,分別與申克孢子絲菌酵母相、Curdlan共培養6 h,TNF-αmRNA水平見表2。用地塞米松阻斷后各組TNF-αmRNA水平較未用地塞米松組明顯降低,差異具有統計學意義(F=564.81,P<0.001),表明100 nM地塞米松抑制申克孢子絲菌酵母相誘導的TNF-αmRNA上調。
表2 地塞米松對申克孢子絲菌酵母上調THP-1細胞TNF-αmRNA轉錄的影響

表2 地塞米松對申克孢子絲菌酵母上調THP-1細胞TNF-αmRNA轉錄的影響
注:a與空白對照組比較,P<0.001;b與未用地塞米松阻斷組比較,P<0.01
?
3 討論
天然免疫在抗真菌感染中發揮重要作用,單核細胞、巨噬細胞、中性粒細胞等作為主要的天然免疫細胞,識別、吞噬入侵的真菌,啟動細胞內信號傳導通路,誘導特異性基因表達,最終合成分泌多種細胞因子,構成抵御病原微生物入侵的第一道防線[6,7]。THP-1細胞是一種人急性單核細胞白血病細胞,經PMA誘導可分化為成熟的巨噬細胞,常用于單核-巨噬細胞的功能研究[8]。申克孢子絲菌是一種雙相致病真菌,該菌宿主體內和37℃培養為酵母相,室溫下為分生孢子或菌絲相,皮膚創傷感染菌絲相待其轉換為酵母相后致病,本病患者的組織病理和電鏡檢查證實申克孢子絲菌在宿主體內僅為酵母相[9]。因此,本研究選用申克孢子絲菌酵母相為研究對象,探討THP-1細胞經申克孢子絲菌酵母相刺激后能否激活NF-κB信號通路并誘導分泌TNF-α。TNF-α是具有廣泛生物學效應的前炎癥因子,主要由激活的單核巨噬細胞或淋巴細胞分泌,能促進IL-12、IFN-γ表達,增強巨噬細胞吞噬功能,促進中性粒細胞和單核細胞趨化及樹突狀細胞遷移,誘發炎癥反應[10]。有研究指出,TNF-α在抗白念珠菌感染中發揮重要作用[11]。Carlos等[12]對申克孢子絲菌感染的小鼠模型研究發現,TNF-α表達降低時小鼠感染的病情加重。我們研究中發現,申克孢子絲菌酵母相刺激THP-1細胞后,TNF-αmRNA表達呈現時間依賴效應,刺激后3 h已經出現升高,6 h時為3 h的4.63倍。Curdlan是一種β-1,3-D-葡聚糖,被單核巨噬細胞表面C-型凝集素受體-1(Dectin-1)識別后,能激活細胞內信號通路,合成分泌多種細胞因子[13]。我們選用Curdlan做為激活THP-1細胞的陽性對照物,本實驗誘導出與申克孢子絲菌酵母相相似的效應,刺激后6 h TNF-α mRNA水平比3 h時升高3.95倍。申克孢子絲菌酵母相作用THP-1細胞后24 h,上清液TNF-α蛋白含量顯著高于空白對照組。此研究表明申克孢子絲菌酵母相在轉錄及翻譯水平均能誘導THP-1細胞TNF-α表達上調。Negrini等[14]和Sass 等[15]用申克孢子絲菌酵母相或脂類抗原刺激小鼠腹腔巨噬細胞,能誘發炎癥反應使TNF-α等表達增加。Romo-Lozano等[16]用申克孢子絲菌酵母相刺激肥大細胞,激活ERK信號通路,誘導分泌IL-6、TNF-α,引發固有免疫反應。Verdan等[17]用申克孢子絲菌酵母相刺激樹突狀細胞也能誘導TNF-α分泌增強。以上研究與本研究結果一致,可見TNF-α在抗申克孢子絲菌感染中發揮重要作用。
細胞內信號分子NF-κB在調控前炎癥因子轉錄過程中起重要作用,在無外界刺激因素時,p50和p65組成的亞單位與IκBα結合成復合體,在細胞漿中處于失活狀態;適宜刺激后,IκB激酶復合體的激活可使IκBαN端保守的絲氨酸殘基磷酸化、降解,導致NF-κB p50、p65二聚體與IκBα解離,隨后移位入核,結合到NF-κB特異性結合位點,進而調控相應的基因轉錄[18]。申克孢子絲菌酵母相刺激THP-1細胞后能使磷酸化IκBα水平升高,促進NF-κB-p65移位入核,最終激活NF-κB信號通路。
有研究證實,100 nM地塞米松能夠阻斷NF-κB信號通路并抑制多種細胞因子的表達[19]。100 nM地塞米松預處理THP-1細胞抑制了申克孢子絲菌酵母誘導的TNF-αmRNA上調,以上研究提示申克孢子絲菌酵母相可能通過激活NF-κB信號通路調控TNF-α的合成。但選用地塞米松作為NF-κB信號通路阻斷劑,不能排除對實驗的其他影響,為本研究的不足之處。
本研究發現,人THP-1細胞經申克孢子絲菌酵母相刺激后激活NF-κB信號通路并誘導分泌TNF-α,參與機體抗申克孢子絲菌天然免疫反應。Toll樣受體2(TLR2)、TLR 4和Dectin-1是識別真菌的主要模式識別受體,已有研究表明TLR2和TLR4在抗申克孢子絲菌感染的天然免疫中發揮重要作用[7,14,15,20-22],我們將進一步研究Dectin-1及其下游信號通路在抗申克孢子絲菌感染免疫中的作用。
[1]Chakrabarti A,Bonifaz A,Gutierrez-Galhardo MC,et al.Global epidemiology of sporotrichosis[J].Medical Mycology,2015,53(1):3-14.
[2]Song Y,Li SS,Zhong SX,et al.Report of457 sporotrichosis cases from Jilin province,northeast China,a serious endemic region[J].J Eur Acad Dermatol Venereol,2013,27(3):313-318.
[3]Gremiao IDF,Menezes RC,Schubach TMP,et al.Feline sporotrichosis:epidemiological and clinical aspects[J].Medical Mycology,2015,53(1):15-21.
[4]López-Romero E,Reyes-Montes MDR,Pérez-Torres A,et al.Sporothrix schenckii complex and sporotrichosis,an emerging health problem[J].Future Microbiology,2011,6(1):85-102.
[5]Guzman-Beltran S,Perez-Torres A,Coronel-Cruz C,et al.Phagocytic receptors on macrophages distinguish between dif-ferent Sporothrix schenckii morphotypes[J].Microbes and Infection,2012,14(12):1093-1101.
[6]Rivera A,Siracusa MC,Yap GS,et al.Innate cell communication kick-starts pathogen-specific immunity[J].Nature Immunology,2016,17(4):356-363.
[7]Becker KL,Ifrim DC,Quintin J,et al.Antifungal innate immunity:recognition and inflammatory networks[J].Semin Immunopathol,2015,37(2):107-116.
[8]Chanput W,Mes JJ,Wichers HJ.THP-1 cell line:an in vitro cell model for immune modulation approach[J].Int Immunopharmacol,2014,23(1):37-45.
[9]Lopes-Bezerra LM,Schubach A,Costa RO.Sporothrix schenckiiand sporotrichosis[J].An Acad Bras Cienc,2006,78(2):293-308.
[10]Brenner D,Blaser H,Mak TW.Regulation of tumour necrosis factor signalling:live or let die[J].Nature Reviews Immunology,2015,15(6):362-374.
[11]段志敏,杜蕾蕾,曾榮,等.白念珠菌對人急性單核細胞白血病細胞系產生腫瘤壞死因子α、活化信號分子p38MAPK的影響[J].中華皮膚科雜志,2015(8):535-538.
[12]Carlos IZ,SassáMF,Da Gra a Sgarbi DB,et al.Current research on the immune response to experimental sporotrichosis[J].Mycopathologia,2009,168(1):1-10.
[13]Tukulula M,Hayeshi R,Fonteh P,et al.Curdlan-conjugated PLGA nanoparticles possess macrophage stimulant activity and drug delivery capabilities[J].Pharma Res,2015,32 (8):2713-2716.
[14]Negrini TC,Ferreira LS,Alegranci P,et al.Role of TLR-2 and fungal surface antigens on innate immune response against Sporothrix schenckii[J].Immunol Invest,2013,42 (1):36-48.
[15]Sassa MF,Saturi AE,Souza LF,et al.Response of macrophage Toll-like receptor 4 to a sporothrix schenckii lipid extract during experimental sporotrichosis[J].Immunology,2009,128(2):301-309.
[16]Romo-Lozano Y,Hernandez-Hernandez F,Salinas E.Sporothrix schenckii yeasts induce ERK pathway activation and secretion of IL-6 and TNF-alpha in rat mast cells,but no degranulation[J].Med Mycol,2014,52(8):862-868.
[17]Verdan FF,Faleiros JC,Ferreira LS,et al.Dendritic cell are able to differentially recognize Sporothrix schenckii antigens and promote Th1/Th17 response in vitro[J].Immunobiology,2012,217(8):788-794.
[18]Hatada EN,Krappmann D,Scheidereit C.NF-kappaB and the innate immune response[J].Curr Opin Immunol,2000,12(1):52-58.
[19]Bhattacharyya S,Ratajczak CK,Vogt SK,et al.TAK1 targeting by glucocorticoids determines JNK and IkappaB regulation in Toll-like receptor-stimulated macrophages[J].Blood,2010,115(10):1921-1931.
[20]Sass MF,Ferreira LS,de Abreu Ribeiro LC,et al.Immune response against sporothrix schenckii in TLR-4-Deficient mice[J].Mycopathologia,2012,174(1):21-30.
[21]Li M,Chen Q,Sun J,et al.Inflammatory response of human keratinocytes triggered by Sporothrix schenckii via Toll-like receptor 2 and 4[J].J Dermatol Sci,2012,66(1):80-82.
[22]de CNT,Ferreira LS,Arthur RA,et al.Influence of TLR-2 in the immune response in the infection induced by fungus Sporothrix schenckii[J].Immunol Invest,2014,43(4):370-390.
(收稿:2016-09-13修回:2016-11-17)
Effects of Sporothrix schenckii yeasts on the activation of NF-κB signal pathway and secretion of TNF-αin human acute monocytic leukemia cells
LIUCaixia1,DUANZhimin1,DULeilei1,ZENGRong1,SHENYongnian1,HUSuquan1,LIUWeida1,CHENQing2,LIMin1.
1.InstituteofDermatology,ChineseAcademyofMedicalSicencesandPekingUnionMedicalCollege,Jiangsu KeyLaboratoryofMolecularBiologyforSkinDiseases,Nanjing210042,China;2.JiangsuProvinceBlood Center,Nanjing210042,China
Correspondingauthors:LIMin,E-mail:drlimin@sina.cn
CHENQing,E-mail:qngchen@hotmail.com
Objective:To determine the effects of Sporothrix schenckii yeasts on the activation of NF-κB signal pathway and secretion of TNF-αin human acute monocytic leukemia cells(THP-1).Methods:The expression of TNF-αmRNA was detected by Real-time fluorescence quantitative PCR and enzyme-linked immunosorbent assay respectively.The level of phosphorylated IκBαwas detected by Western blot.NF-κB-p65 nuclear translocation was measured by immunofluorescence.The level of TNF-αmRNA in THP-1 pretreated with 100 nM Dexamethasone(a NF-κB inhibitor)for 30 minutes was detected by Real-time fluorescence quantitative PCR.Results:The levels of TNF-αmRNA in THP-1 cells treated with Sporothrix schenckii yeasts for 6 hours were increased compared with the blank control group(P<0.001).The secretion level of TNF-αin the Sporothrix schenckii yeasts group was 4610.419±121.501 pg/mL,which was higher than that inthe blank group(186.964±98.073 pg/mL),with a significant difference(P<0.001).Phosphorylation IκBα protein increased obviously and in a time-dependent manner after treated with Sporothrix schenckii yeasts from 30 minutes to 60 minutes.The fluorescent intensity of NF-κB-p65 in the Sporothrix schenckii yeasts group was stronger than that in the blank group.The level of TNF-αmRNA was decreased in the THP-1 macrophages treated with 100 nM dexamethasone in the three groups.Conclusion:Sporothrix schenckii yeasts can increase the expression of TNF-αthrough enhancing the activation of NF-κB pathway.
sporothrix schenckii;monocytic leukemia;TNF-α;NF-κB
國家自然科學基金(編號:81502739)江蘇省自然科學基金(編號:BK20150068)
1中國醫學科學院北京協和醫學院皮膚病研究所,江蘇省皮膚性病分子生物學重點實驗室,南京,210042 2江蘇省血液中心,南京,210042
李岷,E-mail:drlimin@sina.cn陳青,E-mail:qngchen@hotmail.com

