石榴果皮POD基因的克隆與序列分析
馮立娟+焦其慶+尹燕雷+楊雪梅+程云


摘要:本研究以‘泰山紅石榴果實為試材,利用RT-PCR和RACE技術克隆果皮中POD基因cDNA片段,利用BLAST和ORF Finder分析其核苷酸序列,并利用ProtParam、SPOMA、DANMAN等軟件分析其氨基酸序列。結果表明,克隆得到1 092 bp的cDNA片段,該基因含828 bp的CDS序列,編碼276個氨基酸。該基因核苷酸序列與煙草、茜草、花生二倍體雜生種和潘那利番茄等植物的相似性分別為77%、77%、76%和76%;氨基酸序列與荔枝、克萊門柚、蘋果和白梨的相似性分別為89%、87%、84%和84%;GenBank登錄號為KY129694。預測蛋白質理論分子量為30 582.59 D,等電點(pI)為8.83,具有過氧化物酶完整的保守結構域,含有Cd00693和 Cl00196兩個保守功能域,為親水性蛋白;蛋白質二級結構主要由無規則卷曲(38.41%)、α-螺旋(37.68%)、延伸鏈(13.77%)和β-轉角(10.14%)組成。該研究結果為揭示石榴果實褐變機理奠定了理論基礎。
關鍵詞:石榴;POD基因;RT-PCR;克隆;序列分析
中圖分類號:S665.4 文獻標識號:A文章編號:-4942(2017)03-0016-05
AbstractThe cDNA sequence of POD was cloned from Taishanhong pomegranate peel by RT-PCR and RACE technique. The nucleotide sequence of POD was analyzed by BLAST and ORF Finder. The amino acid sequence of POD was analyzed by ProtParam, SPOMA and DANMAN softwares. The results indicated that 1 092 bp cDNA sequence of POD was obtained. It contained 828 bp CDS sequence and encoded 276 amino acids. The similarity of POD nucleotide sequence in pomegranate with Nicotiana tabacum, Rubia cordifolia, Arachis ipaensis and Solanum pennellii was 77%, 77%, 76% and 76%, respectively. Based on the deduced amino acid sequences of POD genes, the similarity of pomegranate with Litchi chinensis, Citrus clementina, Malus domestica and Pyrus bretschneideri was 89%, 87%, 84% and 84%, respectively. The GenBank accession number was KY129694. The theoretical molecular mass of POD protein was 30 582.59 D, and the isoelectric point was 8.83. The protein of POD gene was hydrophilic protein, which had the complete conservative structure domain of peroxidase, and contained two conservative functional domains, Cd00693 and Cl00196. The secondary structure of POD protein was composed by random coil (38.41%), α-helix (37.68%), extended strand (13.77%) and β-turn (10.14%). The results established a theoretical foundation for revealing the mechanism of peel browning in pomegranate fruit.
KeywordsPomegranate; POD gene; RT-PCR; Cloning; Sequence analysis
過氧化物酶(peroxidase,POD)是植物中普遍存在的一類氧化還原酶,它既可以還原細胞內積累的H2O2,也可以降解逆境和生長條件下的活性氧[1,2]。POD由一大類基因家族編碼,通過內質網運輸到其他組織細胞或亞細胞部位,調控植物生長發育[3,4]。大量研究表明, POD在植物形態建成[5]、木質素代謝[6]、組織褐變[7]和逆境響應[8]等方面起重要作用。
石榴(Punica granatum L.)是我國重要的果樹樹種之一,其果實富含可溶性酚類物質,保健功能強,越來越受到消費者青睞[9]。果實褐變是石榴極易發生的生理病害,嚴重影響其商品價值,制約其產業發展[10]。石榴褐變是酚類物質在多酚氧化酶(polyphenol oxidase,PPO)和POD等一系列酶作用下,酶與底物區域化被解除而發生的[11]。從生理生化角度已證實,POD是荔枝和龍眼果實褐變的主導酶類[12],其與石榴果皮褐變也存在密切正相關關系[13]。但在分子水平關于石榴果實POD基因與褐變關系方面的研究國內外尚未見報道。目前,GenBank登錄的POD基因序列有1 000多個,已從數百種物種中克隆到POD基因,如荔枝(Litchi chinensis Sonn)[7]、山楂(Crataegus pinnatifida)[14]和鴨梨(Pyrus bretschneideri Rehd cv. Yali)[15]等多種果樹作物的POD基因已被分離出,但石榴POD基因及相關信息還未見報道。因此,本研究以‘泰山紅石榴為試材,利用RT-PCR和RACE技術克隆其POD基因cDNA片段,并進行生物信息學分析,為從分子水平揭示石榴果實褐變機理提供理論依據。
1材料與方法
1.1試驗材料
以山東主栽石榴品種‘泰山紅幼果(果實直徑2~3 cm)為試材,果實洗凈擦干后,用削皮刀取果皮,液氮速凍后放入-80℃冰箱保存備用。
1.2試驗方法
1.2.1總RNA提取和cDNA第一鏈的合成采用RNA prep Pure Plant Kit試劑盒(DP441,北京天根生化有限公司)提取石榴果皮總RNA。瓊脂糖凝膠電泳檢測RNA完整性,采用Nanodrop 紫外分光光度計測其OD值。采用TaKaRa RNA PCR Kit(AMV)Ver.3.0(Code No. DRR019S)合成cDNA第一鏈。
1.2.2石榴POD基因的克隆根據已知物種POD基因同源序列中間片段設計簡并引物F1和R1(表1),以合成的cDNA為模板進行PCR擴增。反應體系總體積50 μL:2 × Ex Taq buffer 25 μL,dNTP(10 mmol/L)1 μL,上、下游引物各1.5 μL,cDNA 5 μL,Ex Taq酶1 μL,滅菌蒸餾水15 μL。反應條件為:94℃預變性2 min;94℃變性30 s,53℃退火30 s,72℃延伸 1 min,35個循環;72℃保溫10 min,4℃保存。
分別設計3′ RACE引物和5′ RACE引物(表1),進行3′ RACE 和5′ RACE 擴增,步驟參照SMARTerTM RACE cDNA Amplification Kit(634923,Clontech)和5′ RACE System for Rapid Amplification of cDNA Ends,Version 2.0(18374-058,Invitrogen)試劑盒說明。PCR產物用1%瓊脂糖凝膠電泳檢測,膠回收純化目的片段,并連接到pMD18-T載體上,轉化大腸桿菌DH5α,測序獲得包含ORF的基因序列。
1.2.3生物信息學分析利用DNAMAN對克隆獲得的中間片段、3′ RACE和5′ RACE序列進行拼接,并進行多序列比對和同源性分析;利用ORF Finder預測拼接序列的開放閱讀框和編碼的蛋白質序列;利用NCBI的BLASTN和BLASTP分析拼接序列核苷酸和氨基酸序列的相似性;用CDD進行蛋白保守結構域分析;利用Expasy Protparam分析該蛋白質的理化性質;利用ProtScale分析蛋白質的疏水性/親水性;利用SOPMA對蛋白質的二級結構進行預測。
2結果與分析
2.1石榴POD基因cDNA片段克隆
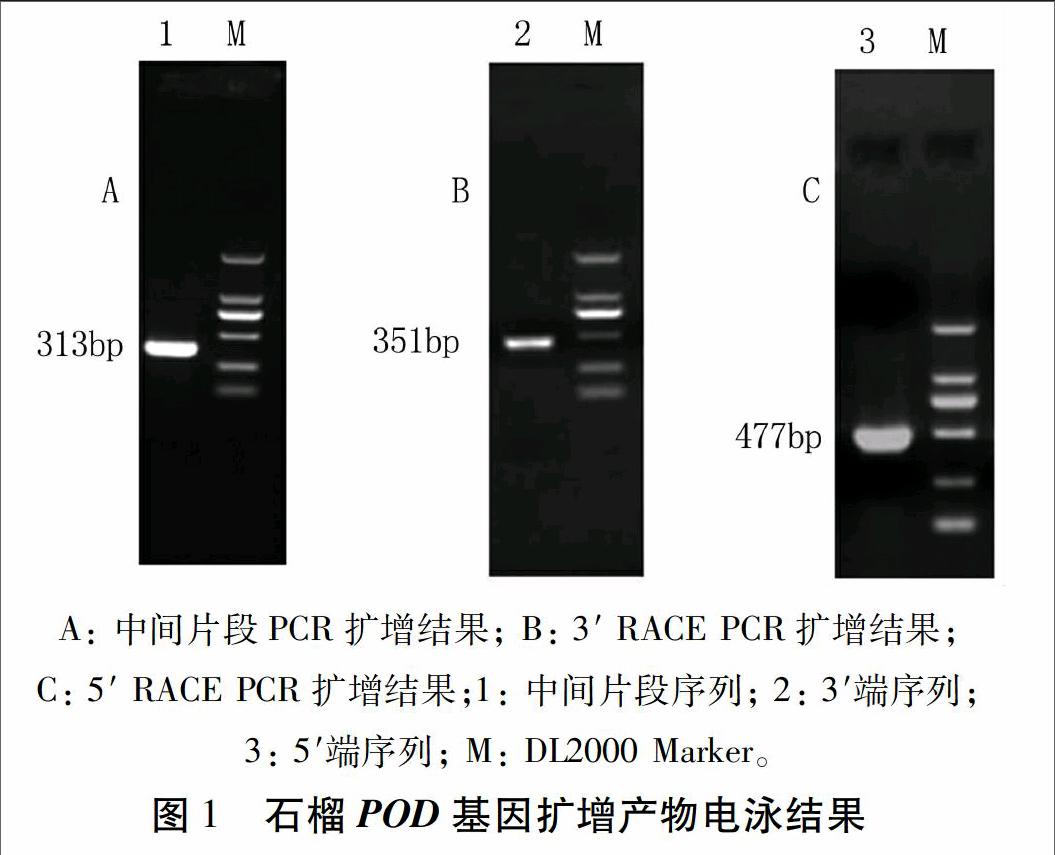
以天根RNA prep Pure Plant Kit試劑盒提取石榴果皮RNA,以反轉錄cDNA為模板,利用簡并引物F1和R1進行PCR擴增,產物經1%瓊脂糖凝膠電泳,在350 bp左右出現特異性條帶,測序結果顯示該序列長313 bp (圖1A)。用3′ RACE特異引物進行3′端序列擴增,獲得約400 bp的3′端序列,測序結果表明3′端為351 bp (圖1B)。用5′ RACE特異引物進行5′端序列擴增,獲得約500 bp的5′端序列,測序結果表明5′端為477 bp。
將中間片段、3′端和5′端序列進行拼接,得到一條長度為1 092 bp的cDNA片段。該基因含828 bp的CDS序列,編碼276個氨基酸。BLAST分析表明,該基因片段的核苷酸序列與煙草(Nicotiana tabacum)(XM_016619089.1)、茜草(Rubia cordifolia)(HM807270.1)、花生二倍體雜生種(Arachis ipaensis)(XM_016328124.1)和潘那利番茄(Solanum pennellii)(XM_015208577.1)等植物的相似性為77%、77%、76%和76%;編碼的氨基酸序列與荔枝(Litchi chinensis)、克萊門柚(Citrus clementina)和胡楊(Populus euphratica)的相似性分別為89%、87%和86%,與白梨(Pyrus bretschneideri)、蘋果(Malus domestica)、巨桉(Eucalyptus grandis)的相似性均為84%,與葡萄(Vitis vinifera)和梅花(Prunus mume)的相似性均為83%,與碧桃(Prunus persica)的相似性為82%(圖2)。這表明克隆到的片段為石榴果皮POD基因,GenBank登錄號為KY129694。
2.2保守結構域分析
CDD分析表明,石榴POD蛋白具有過氧化物酶完整的保守結構域,包括血紅結合位點、活性位點、底物結合位點、鈣離子結合位點(圖3)。還含有兩個保守功能域Cd00693(secretory peroxidase,分泌性過氧化物酶)和 Cl00196(plant-peroxidase-like superfamily,植物過氧化物酶超家族)。進一步證明所獲得基因是石榴的過氧化物酶基因。
2.3蛋白理化性質分析
ProtParam分析表明,石榴POD編碼蛋白的分子質量為30 582.59 D,等電點(pI)為8.83,分子式為C1334H2120N390O411S12;負電荷氨基酸殘基總數(Asp+Glu)為28,正電荷氨基酸殘基總數(Arg+Lys)為33,不穩定系數為41.19,是一類不穩定蛋白,脂溶性指數為79.17,親水性平均數為-0.389。
ProtScale分析表明,POD蛋白存在明顯的疏水區和親水區,其中第133位最高,為2.122,第44位最低,為-2.733,為親水性蛋白(圖4)。
2.4二級結構預測與分析
利用SOPMA 軟件預測石榴POD編碼蛋白的二級結構表明,有104個氨基酸參與形成α-螺旋(alpha helix),占總氨基酸的37.68%;有106個氨基酸參與形成無規則卷曲(random coil),占總氨基酸的38.41%;有38個氨基酸參與形成延伸鏈(extended strand),占總氨基酸的13.77%;有28個氨基酸參與形成β-轉角(beta turn),占總氨基酸的10.14%(圖5)。這說明,石榴POD基因編碼蛋白的二級結構中含有豐富的α-螺旋和無規則卷曲。
3討論與結論
POD是一種由單一肽鏈與卟啉構成的血紅素蛋白,大約由300個氨基酸殘基組成,廣泛存在于動物、植物和微生物體內[14]。本研究利用RT-PCR和RACE技術克隆得到石榴果皮POD基因cDNA片段,含828 bp的CDS序列,編碼276個氨基酸,但未獲得POD基因全長,這主要是由于石榴果皮富含酚類、鞣質、糖酸等物質,RNA純度低及部分序列發生降解使獲得的5′端序列不完整。下一步將改進試驗方案,提高RNA純度,降低RNA降解率,進一步克隆得到POD基因全長序列。
研究表明,POD分為三類,第Ⅰ類存在于線粒體、葉綠體及細菌中,第Ⅱ類存在于真菌中,第Ⅲ類是植物中典型的過氧化物酶,含有4個保守的二硫鍵和2個保守的鈣離子結合位點[16]。本試驗克隆的石榴POD蛋白具有過氧化物酶完整的保守結構域,屬于植物血紅素依賴的過氧化物酶,是第Ⅲ類過氧化物酶的成員。石榴POD蛋白具有Cd00693和 Cl00196兩個保守功能域,是分泌過氧化物酶,這與鴨梨[15]和荔枝[16]上的研究結果一致。蛋白質的功能在很大程度上取決于其空間結構,本研究中,POD蛋白二級結構以α-螺旋和無規則卷曲為主,這為深入研究該酶的功能奠定了理論基礎。
前人對POD基因表達與荔枝果皮褐變間的關系[7,17]進行了探索,但石榴果皮褐變與POD基因表達的關系尚不可知。因此,筆者在獲得石榴果皮POD基因cDNA序列的基礎上,下一步將重點探討不同石榴品種果實發育期果皮褐變與POD基因表達的關系,擬從分子水平揭示石榴果皮褐變機理。
參考文獻:
[1]Nokthai P, Lee V S, Shank L. Molecular modeling of peroxidase and polyphenol oxidase: substrate specificity and active site comparison[J]. International Journal of Molecular Sciences, 2010, 11(9):3266-3276.
[2]Venkatachalam K, Meenune M. Changes in physiochemical quality and browning related enzyme activity of longkong fruit during four different weeks of on-tree maturation[J]. Food Chemistry, 2012, 131(4) :1437-1442.
[3]Psaaard F, Longet D, Penel C, et al. The class Ⅲ peroxidase multigenic family in rice and its evolution in land plants[J]. Phytochemistry, 2004, 65(13): 1879-1893.
[4]程華, 李琳玲, 王燕, 等. 銀杏過氧化物酶基因POD1的克隆及表達分析[J]. 華北農學報, 2010, 25(6): 44-51.
[5]趙昶靈, 王樹會. 剪葉對云南烤煙漂浮苗抗氧化酶活性和根系形態建成的效應[J]. 云南農業大學學報(自然科學版), 2014, 29(1): 84-92.
[6]劉莉, 孫虹麗, 程召陽, 等. 碭山酥梨褐皮芽變果皮中木質素生物合成相關基因克隆與表達分析[J]. 華北農學報, 2013, 28(6): 88-92.
[7]李博. 采后荔枝果皮褐變與POD基因表達關系的研究[D]. 海口:海南大學, 2014.
[8]季楊, 張新全, 彭燕, 等. 干旱脅迫對鴨茅根、葉保護酶活性、滲透物質含量及膜質過氧化作用的影響[J]. 草業學報, 2014, 23(3): 144-151.
[9]馮立娟, 尹燕雷, 焦其慶, 等. 不同石榴品種果實酚類物質及抗氧化活性研究[J]. 核農學報, 2016, 30(4): 710-718.[10]張立華, 孫曉飛, 張艷俠, 等. 石榴多酚氧化酶的某些特性及其抑制劑的研究[J]. 食品科學, 2007, 28(5): 216-219.
[11]高雪. 奉節臍橙果皮褐變生理及相關基因的分離研究[D]. 重慶:重慶大學, 2006.
[12]Jiang Y M, Duan X W, Joyce D, et al. Advances in understanding of enzymatic browning in harvested litchi fruit [J]. Food Chemistry, 2004, 88: 443-446.
[13]Zhang Y L, Zhang R G. Study on the mechanism of browning of pomegranate (Punica granatum L. cv. Ganesh) peel in different storage conditions[J]. Agricultural Sciences in China, 2008, 7(1): 65-73.
[14]代紅艷, 閆玉嬌, 李曉明, 等. 山楂過氧化物酶基因的克隆及在煙草中異位表達分析[J]. 果樹學報, 2015, 32(6): 1070-1076.
[15]閆師杰, 廉雙秋, 李曉丹, 等. 鴨梨過氧化物酶基因全長克隆與序列分析[J]. 東北農業大學學報, 2013, 44(1):86-90.
[16]鄭雯, 張永麗, 王家保, 等. 荔枝果皮2 個POD同源基因的生物信息學分析及酶活測定[J]. 熱帶作物學報, 2011, 32(3):437-442.
[17]張永麗. 荔枝果皮褐變過程中POD活性變化及其基因表達分析[D]. 儋州:華南熱帶農業大學, 2007.

