帕金森病與腦腫瘤發病風險的Meta分析
楊曉東 徐紹卿 錢逸 維肖勤
·循證神經病學·
帕金森病與腦腫瘤發病風險的Meta分析
楊曉東 徐紹卿 錢逸 維肖勤
目的探討帕金森病與腦腫瘤發病風險的相關性。方法以帕金森病,腫瘤和癌癥,以及PD,Parkinson's disease,tumor,cancer,neoplasm等中英文檢索詞,計算機檢索1965年1月-2016年7月美國國立醫學圖書館生物醫學信息檢索系統、Web of Science、荷蘭醫學文摘、Cochrane圖書館,以及中國知網中國知識基礎設施工程、萬方數據庫、維普數據庫等數據庫收錄的關于帕金森病與腦腫瘤發病風險的前瞻性隊列研究或病例對照研究,同時輔助手工檢索,采用Newcastle-Ottawa量表和Stata 12.1軟件進行文獻質量評價和Meta分析。結果共獲得1832篇文獻,經剔除重復和不符合納入標準者,最終納入11項臨床研究共350 632例帕金森病患者。Meta分析顯示:帕金森病患者腦腫瘤發病風險高于健康人群(OR=1.370,95%CI:1.120~1.690;P=0.003),剔除2篇低質量文獻后結論仍一致(OR=1.360,95%CI:1.080~1.720;P=0.008);根據發病順序和地域分層分析,僅帕金森病后腦腫瘤發病風險高于健康人群(OR=1.430,95%CI:1.120~1.830;P=0.004),歐洲(OR=1.420,95%CI:1.290~1.560;P=0.000)和亞洲的中國臺灣地區(OR=2.590,95%CI:1.730~3.880;P=0.000)帕金森病患者腦腫瘤發病風險均高于健康人群。漏斗圖以及Begg法(P=0.583)和Egger法(P=0.985)證實發表偏倚較小。結論帕金森病患者腦腫瘤發病風險增加。
帕金森病;腦腫瘤;Meta分析
This study was supported by Scientific Research Plan Project of Science and Technology Commission of Shanghai Municipality(No.14ZR1425700).
帕金森病(PD)是好發于中老年人群,以靜止性震顫、肌強直和運動遲緩為主要臨床特征的神經變性病。既往諸多研究顯示,帕金森病患者除易并發黑色素瘤外,其他大多數腫瘤發病風險均較健康人群普遍降低[1-2]。既往有Meta分析顯示,顱腦創傷(TBI)后帕金森病發病風險明顯增加[3]。然而,帕金森病與腦腫瘤的發病風險尚不明確,迄今國內外尚無相關系統研究。本研究對關于帕金森病與腦腫瘤發病風險的隊列研究或病例對照研究進行全面系統評價和Meta分析,旨在明確帕金森病與腦腫瘤發病風險的關系。
資料與方法
一、文獻檢索
采用主題詞與自由詞相結合的原則,分別以帕金森病,腫瘤和癌癥,以及PD,Parkinson's disease,tumor,cancer,neoplasm等中英文詞匯為檢索詞,計算機檢索1965年1月-2016年7月美國國立醫學圖書館生物醫學信息檢索系統(Pub Med)、Web of Science、荷蘭醫學文摘(EMBASE/SCOPUS)、Cochrane圖書館,以及中國知網中國知識基礎設施工程(CNKI)、萬方數據庫、維普數據庫(VIP)等國內外知名數據庫關于帕金森病與腦腫瘤發病風險的臨床研究,同時輔助手工檢索相關文獻,并查閱納入臨床試驗的參考文獻以補充可能遺漏的相關研究。語種為中文和英文。
二、納入與排除標準
1.納入標準(1)關于帕金森病與腦腫瘤發病風險的前瞻性隊列研究或病例對照研究。(2)病例組符合原發性帕金森病診斷標準且有明確暴露因素,對照組為性別和年齡相匹配的健康人群,研究提供病例組與對照組暴露人數或暴露比例。(3)結局指標可量化。
2.排除標準(1)非隊列研究或病例對照研究。(2)重復文獻或疾病診斷不明確的文獻。(3)失訪率過高或隨訪時間不符合研究設計。(4)結局指標不明確或為非量化指標如圖像等。
三、文獻篩選和數據提取
由兩位相互獨立的評價者根據納入與排除標準,分別對文獻進行篩選。首先,通過閱讀文題和摘要,剔除重復和不符合納入標準者;其次,對可能納入的文獻進一步閱讀全文并交叉核對結果;最后,對存在異議的文獻,由兩位評價者共同討論協商,仍不能取得一致意見時,請上級醫師進一步評價。對資料存疑或資料缺失的文獻,通過與作者或通訊作者聯系,盡可能獲得確認或補充。對符合納入標準的文獻提取以下數據資料:(1)一般資料,包括文題、作者、來自國家或地區、發表日期等。(2)研究特征,包括研究對象的一般資料、各組基線可比性、觀察時間、隨訪時間等。(3)結局指標,包括帕金森病與腦腫瘤發病風險的比值比(OR)及其對應95%CI。
四、文獻質量評價
由兩位評價者獨立對所納入的文獻質量進行評價并交叉核對,如有分歧與第三位評價者討論后決定取舍。采用Newcastle-Ottawa量表(NOS)[4]分別對研究對象選擇、組間可比性、暴露因素和結局進行評價:(1)研究對象選擇,共4分,分為4項條目,即病例確定是否恰當、病例代表性、對照者的選擇和對照者的確定。(2)組間可比性,共2分,僅1項條目,即研究設計和統計分析中病例與對照者的可比性。(3)暴露因素和結局,共3分,分為3項條目,即暴露因素的確定、是否采用相同方法確定病例和對照者的暴露因素、有無應答率。總評分9分,評分>6分者為高質量文獻、評分6分者為中等質量文獻、評分<6分者為低質量文獻。
五、統計分析方法
采用Stata 12.1軟件進行Meta分析。計數資料以OR表示[對于不同文獻采用的標準化發病比(SIR/SER)、OR和相對危險度(RR),本研究均以OR替代],區間估計以95%CI表示,效應量的檢驗水準為α=0.05。各項研究之間采用Q檢驗和I2檢驗進行異質性檢驗,當P>0.100和I2≤50.000%時,無異質性,采用固定效應模型進行合并分析;當P≤0.100和I2>50.000%時,存在異質性,采用隨機效應模型進行合并分析。繪制漏斗圖并采用Begg法和Egger法對所納入文獻的潛在發表偏倚進行評價,以漏斗圖基本對稱、Begg法和Egger法P>0.05為不存在發表偏倚。
結果
一、文獻檢索結果
經初步篩選共計獲得相關文獻1832篇,英文1804篇、中文28篇,剔除重復文獻897篇,閱讀文題和摘要剔除843篇,進一步閱讀全文剔除非隊列研究或病例對照研究和不符合納入標準的文獻81篇,最終納入11篇英文文獻[5-15]350 632例帕金森病患者。10篇報道帕金森病后腦腫瘤發病風險[5-14]、3篇報道腦腫瘤后帕金森病發病風險[9,12,15],其中2篇同時報道帕金森病發病前后腦腫瘤發病情況[9,12]。據NOS量表[4]質量評價標準,7篇[6,8,11-15]為高質量文獻(評分>6分)、2篇[9-10]為中等質量文獻(評分6分)、2篇[5,7]為低質量文獻(評分<6分)。文獻篩選流程參見圖1,所納入11項臨床研究的基線資料和質量評價參見表1。
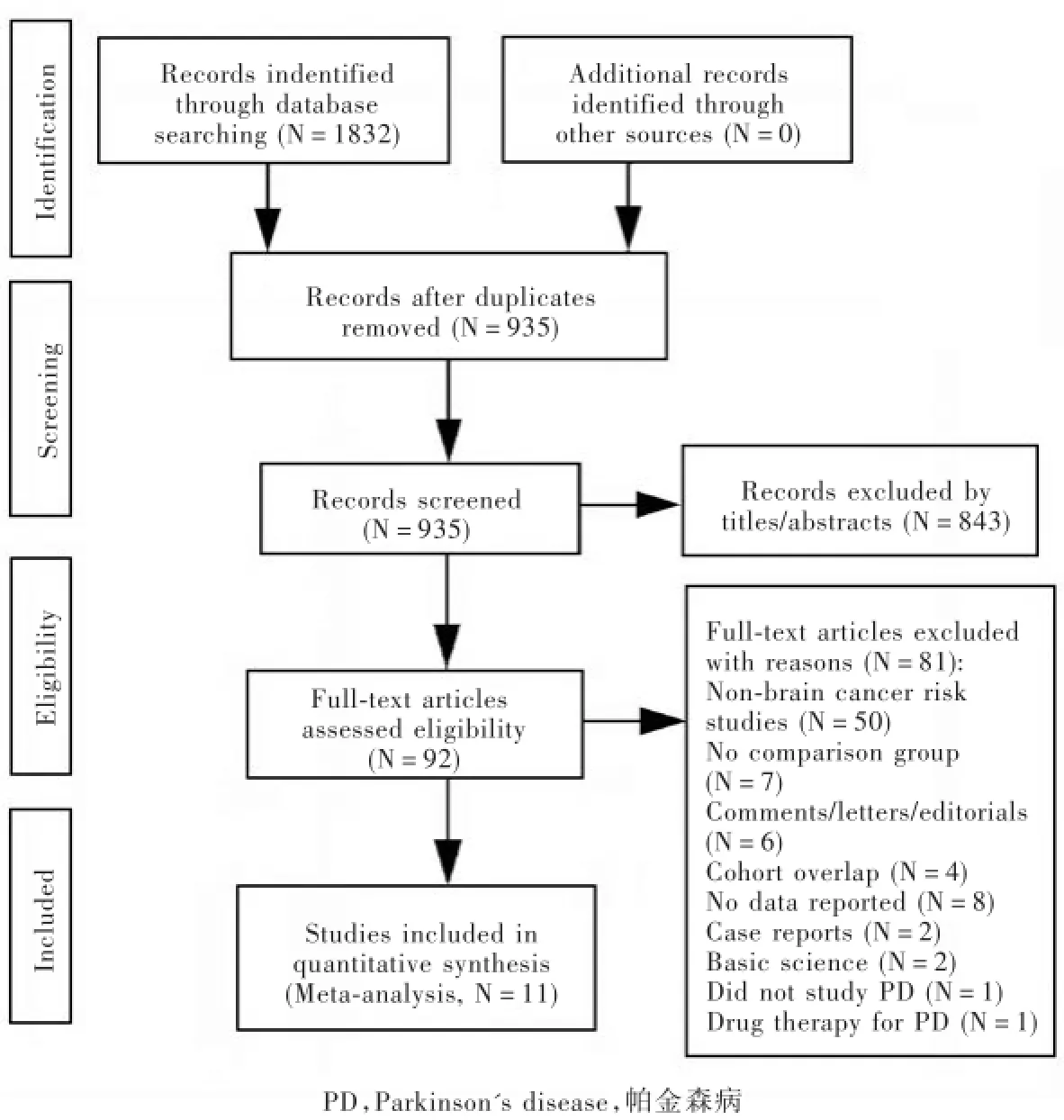
圖1 文獻檢索流程圖Figure 1 Flow chart of literature search.
二、Meta分析結果
1.帕金森病患者腦腫瘤發病率有11項研究(包括13個發病率)[5-15]對帕金森病患者腦腫瘤發病風險進行分析,各項研究之間存在異質性(P= 0.000,I2=85.400%),故采用隨機效應模型進行合并效應分析。結果顯示,帕金森病患者腦腫瘤發病風險高于健康人群(OR=1.370,95%CI:1.120~1.690,P=0.003;圖2),剔除2篇低質量文獻后,帕金森病患者腦腫瘤發病風險仍較高(OR=1.360,95%CI:1.080~1.720;P=0.008)。
2.按照發病順序行亞組分析根據帕金森病和腦腫瘤的發病順序進行分層分析,有10項研究[5-14]對帕金森病后腦腫瘤發病風險進行分析,各項研究之間存在異質性(P=0.000,I2= 88.700%),故采用隨機效應模型進行合并效應分析。3項研究[9,12,15]對腦腫瘤后帕金森病發病風險進行分析,各項研究之間不存在異質性(P=0.581,I2=0.000%),故采用固定效應模型進行合并效應分析。結果顯示,帕金森病后腦腫瘤發病風險高于健康人群(OR=1.430,95%CI:1.120~1.830;P=0.004),腦腫瘤后帕金森病發病風險與健康人群差異無統計學意義(OR=1.220,95%CI:0.900~1.640,P=0.203;圖2)。
3.按照地域行亞組分析根據各項研究所納入對象的地域來源,分為歐洲(8項研究[5-7,9-12,15])、北美洲(1項研究[8])和亞洲的中國臺灣地區(2項研究[13-14]),各項研究之間不存在異質性(歐洲:P=0.600,I2= 0.000%;亞洲的中國臺灣地區:P= 0.247,I2=25.300%),故采用固定效應模型進行合并效應分析。結果顯示,歐洲帕金森病患者腦腫瘤發病風險高于健康人群(OR=1.420,95%CI:1.290~1.560;P=0.000);亞洲的中國臺灣地區帕金森病患者腦腫瘤發病風險亦高于健康人群(OR=2.590,95%CI:1.730~3.880,P=0.000;圖3)。
三、發表偏倚評價
漏斗圖可見各點基本對稱,表明發表偏倚較小(圖4)。采用Begg法和Egger法分別對所納入臨床研究進一步評價,結果顯示發表偏倚較小(Begg法:P=0.583;Egger法:P=0.985)。
討論
帕金森病是一種逐漸進展的神經變性病,目前尚無治愈辦法。其病因和發病機制尚未完全闡明,年齡、環境因素、遺傳因素、免疫力降低和神經炎癥反應等均在帕金森病的發病中起一定作用[16]。腫瘤是細胞克隆性異常增殖形成的惡性疾病,是多種危險因素參與下癌基因激活和(或)抑癌基因失活的共同作用結果。帕金森病主要病理改變是黑質多巴胺能神經元凋亡,腫瘤則是細胞克隆性異常增殖,兩種疾病對應細胞生長發育的兩個極端,二者同時發生的機制尚不明確。
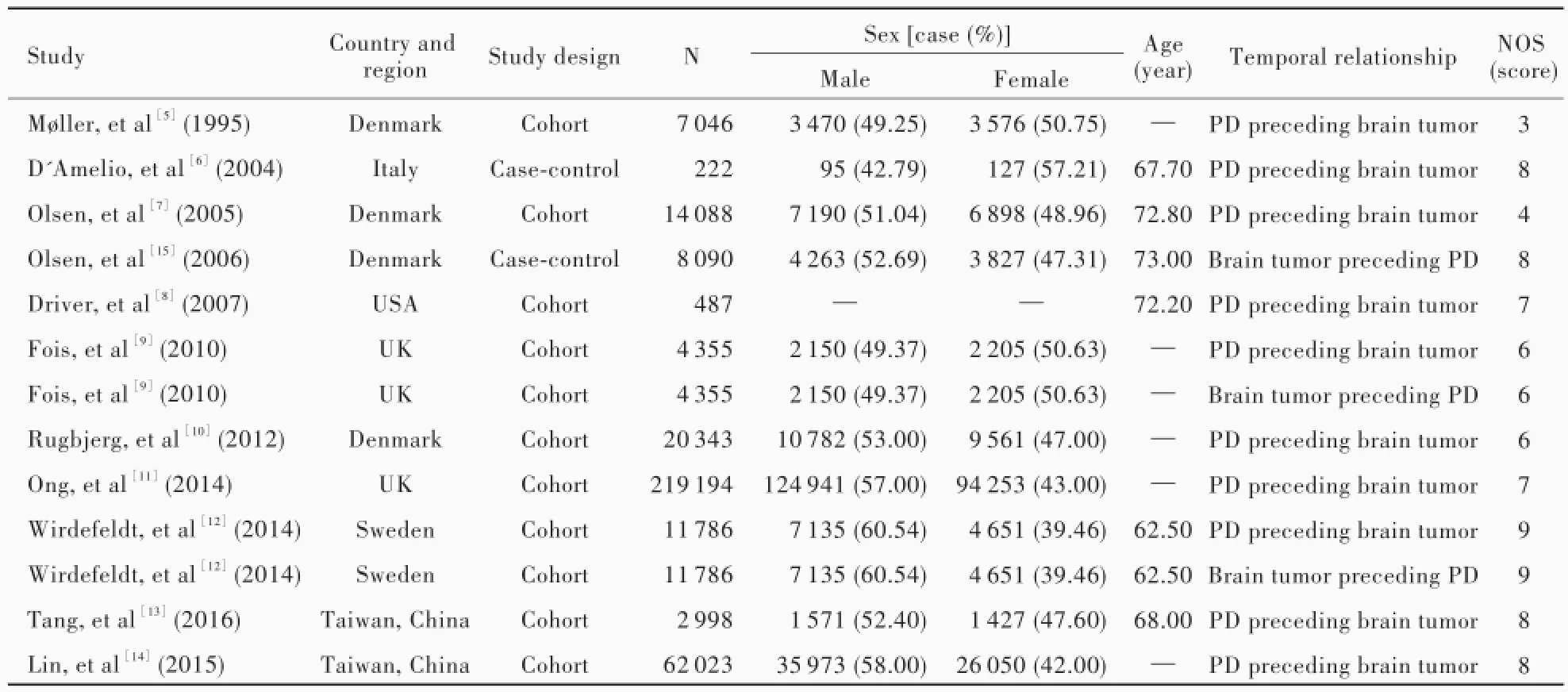
表1 所納入的11項臨床研究的基線資料和質量評價Table 1.Basic characteristics and quality assessment of the included 11 studies
早在1954年Doshay[17]發現帕金森病患者腫瘤發生率低于正常人群,自此帕金森病與腫瘤的關系逐漸受到重視,研究者們希望通過流行病學探討帕金森病與腫瘤之間的關系并從中尋找到可能的影響因素。大量流行病學調查顯示,除黑色素瘤外,其他大多數腫瘤在帕金森病患者中的發病率均較低。究其原因可能是由于帕金森病患者吸煙比例較少,但有文獻報道,帕金森病患者與吸煙無關聯性的腫瘤發生率也較低[2]。流行病學調查顯示,顱腦創傷是帕金森病危險因素[18],并且Meta分析結果證實,顱腦創傷后帕金森病發病風險增加1.57倍(95%CI:1.350~1.830,P=0.000)[3]。本研究通過Meta分析的方法,系統評價帕金森病與腦腫瘤發病風險的關系。共納入11項前瞻性隊列研究或病例對照研究計350 632例帕金森病患者,結果顯示,帕金森病患者腦腫瘤發生率是健康人群的1.37倍(95%CI:1.120~1.690,P=0.003),進一步分層分析,帕金森病患者腦腫瘤發病風險明顯增加,但有意思的是,腦腫瘤患者帕金森病發病風險與正常對照者無明顯差異,與以往的研究結果相反。既往有文獻報道,腦膜瘤、幕上腫瘤患者易發生偏側震顫麻痹和繼發性帕金森綜合征[19-20],考慮到本研究僅納入3篇報道腦腫瘤后帕金森病發病風險的文獻,故這一結果的可靠性尚待更多高質量研究的證實。按照地域進行分層分析,歐洲和亞洲的中國臺灣地區的結果與總體結果一致,即帕金森病患者腦腫瘤發病風險明顯增加。
關于帕金森病患者較高的腦腫瘤發病風險的原因,可以嘗試從以下幾方面進行解釋:(1)α-突觸核蛋白(α-Syn)。帕金森病的主要病理改變為α-Syn異常聚集,該蛋白質同樣在多種腦腫瘤中呈較高表達,如髓母細胞瘤、神經母細胞瘤、松果體母細胞瘤、節神經膠質瘤、中樞神經細胞瘤等,且表現出神經分化的特性[21]。研究顯示,成骨肉瘤MG63細胞系中高表達α-Syn的細胞表現出分化為骨母細胞的特性[22]。(2)左旋多巴。左旋多巴是黑質紋狀體多巴胺和皮膚細胞黑色素合成的底物,Skibba等[23]提出,左旋多巴可以導致帕金森病患者黑色素瘤復發。此后,左旋多巴的致癌作用尤其是導致黑色素瘤的作用受到廣泛關注。司來吉蘭聯合維生素E治療帕金森病(DATATOP)試驗顯示,與正常對照者相比,服用左旋多巴的患者黑色素瘤發生率升高,但是服用藥物前后黑色素瘤發生率相近,表明帕金森病患者黑色素瘤發病風險與左旋多巴胺無明顯關聯性[24]。因此,左旋多巴是否與腦腫瘤存在相關性尚無證據。(3)神經炎癥反應。小膠質細胞的激活及其介導的神經炎癥反應在帕金森病的病程進展中發揮重要作用[25]。炎癥反應或神經組織損傷導致的持續性炎癥反應通過DNA損傷或促炎性因子促進細胞轉化,從而誘發腫瘤生長,在腫瘤發展的不同階段,炎癥反應發揮決定性作用;此外,炎癥反應還可以改變腫瘤細胞的生存環境,同時影響免疫監視和對治療的反應[26]。炎癥血腫瘤轉變的分子機制是近年來腫瘤基礎研究領域的熱點之一。盡管腫瘤與炎癥之間的直接因果關系尚未得到證實,但炎癥反應微環境是所有腫瘤發生和發展中的重要影響因素。因此我們有理由猜測,炎癥可能作為連接帕金森病和腦腫瘤之間的橋梁,但其中具體機制,尚待進一步的研究。(4)遺傳因素。E3泛素蛋白連接酶(PARK2)基因突變認為是常染色體隱性遺傳性帕金森病早期發病的主要原因之一,PARK2基因在細胞生長和存活過程中發揮調節作用,PARK2基因突變后細胞生長抑制作用消失[27]。同源性磷酸酶-張力蛋白(PTEN)是一種抑癌基因,在腫瘤發生和發展中起重要作用,有研究顯示,DJ-1蛋白是PTEN基因的主要抑制因子,在多種腫瘤發生和發展過程中負性調節PTEN基因[28],亦可通過抑制氧化應激反應而抑制細胞凋亡[29-30]。膠質瘤細胞胞質高表達DJ-1蛋白,且與胞核高表達抑癌基因p53一致,而與原癌基因c-erbB1的表達產物血管內皮生長因子受體(EGFR)基因擴增相反[31];星形膠質細胞瘤胞核DJ-1蛋白表達變化與患者生存率相關[29]。攜帶富亮氨酸重復序列激酶2(LRRK2)基因突變的帕金森病患者非皮膚癌和血液系統腫瘤發病風險明顯增加[32-33]。
圖2 帕金森病與腦腫瘤發病風險的森林圖Figure 2 Forest plot for the correlation between PD and risk of brain tumor.
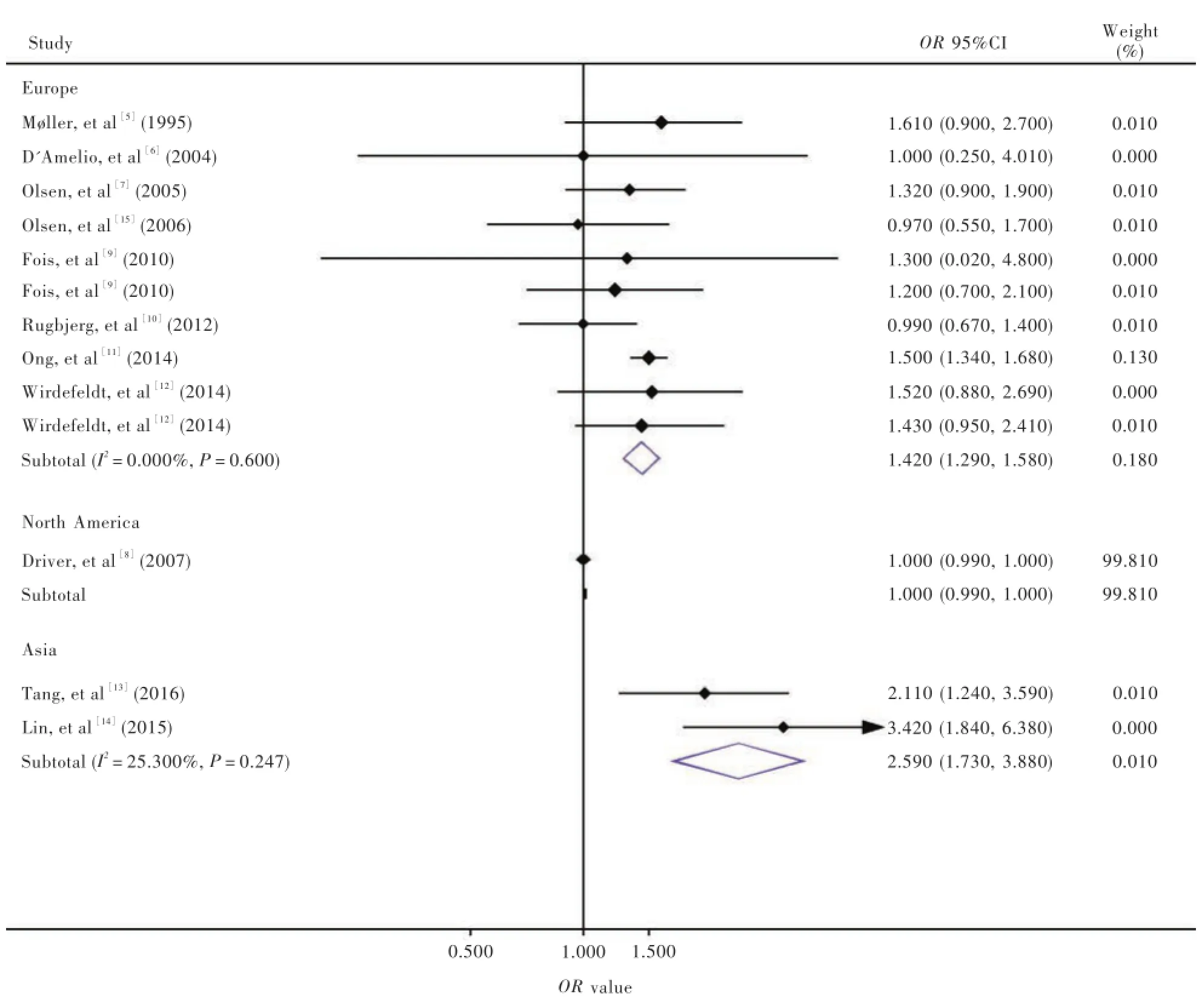
圖3 不同地區帕金森病與腦腫瘤發病風險的森林圖Figure 3 Forest plot for the correlation between PD and risk of brain tumor according to geographic region.
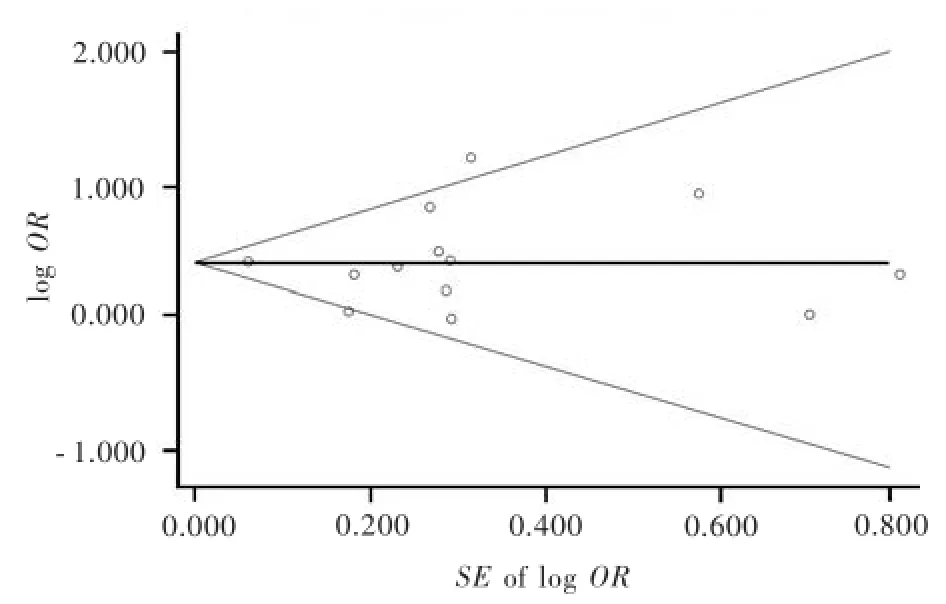
圖4 帕金森病與腦腫瘤發病風險關系的漏斗圖Figure 4 Funnel plot for correlation between PD and risk of brain tumor.
本Meta分析納入的臨床研究經過嚴格的篩選和質量評價,除2篇低質量文獻外,其余文獻質量均較高,且發表偏倚較小,具有較高的可信度,但是仍存在一些不足和局限性:(1)所納入的臨床研究異質性較高。(2)直接研究帕金森病與腦腫瘤關系的研究較少。(3)納入文獻中報道腦腫瘤分類的文獻較少,故無法根據腫瘤類別進行更細致的分層分析。(4)大部分研究報道帕金森病后腦腫瘤發病風險且主要是針對歐洲人群的研究,而關于腦腫瘤后帕金森病的發病風險以及北美洲和亞洲人群的研究較少,故分層分析的結果尚待進一步證實。盡管中國大陸地區有龐大的帕金森病和腦腫瘤患者,但仍缺乏對帕金森病與腦腫瘤發病風險的研究,故本Meta分析結果缺乏中國大陸地區人群的研究數據。
綜上所述,本Meta分析證實帕金森病患者腦腫瘤發病風險高于健康人群,提示在今后的臨床工作中,應認識到雖然一般情況下帕金森病患者罹患腫瘤的風險較正常人群降低,但不能忽視帕金森病患者發生腦腫瘤的可能。其具體作用機制尚待后續研究進一步探討。
[1]Huang P,Yang XD,Chen SD,Xiao Q.The association between Parkinson's disease and melanoma:a systematic review and meta-analysis.Transl Neurodegener,2015,4:21.
[2]Bajaj A,Driver JA,Schernhammer ES.Parkinson's disease and cancer risk:a systematic review and meta-analysis.Cancer Causes Control,2010,21:697-707.
[3]Jafari S,Etminan M,Aminzadeh F,Samii A.Head injury and risk of Parkinson disease:a systematic review and metaanalysis.Mov Disord,2013,28:1222-1229.
[4]Stang A.Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in metaanalyses.Eur J Epidemiol,2010,25:603-605.
[5]M?ller H,Mellemkjaer L,Mc Laughlin JK,Olsen JH. Occurrence of different cancers in patients with Parkinson's disease.BMJ,1995,310:1500-1501.
[6]D'Amelio M,Ragonese P,Morgante L,Epifanio A,Callari G, Salemi G,Savettieri G.Tumor diagnosis preceding Parkinson's disease:a case-control study.Mov Disord,2004,19:807-811.
[7]Olsen JH,Friis S,Frederiksen K,McLaughlin JK,Mellemkjaer L,M?ller H.Atypical cancer pattern in patients with Parkinson's disease.Br J Cancer,2005,92:201-205.
[8]Driver JA,Logroscino G,Buring JE,Gaziano JM,Kurth T.A prospective cohort study of cancer incidence following the diagnosis of Parkinson's disease.Cancer Epidemiol Biomarkers Prev,2007,16:1260-1265.
[9]Fois AF,Wotton CJ,Yeates D,Turner MR,Goldacre MJ. Cancer in patients with motor neuron disease,multiple sclerosis and Parkinson's disease:record linkage studies.J Neurol Neurosurg Psychiatry,2010,81:215-221.
[10]Rugbjerg K,Friis S,Lassen CF,Ritz B,Olsen JH.Malignant melanoma,breast cancer and other cancers in patients with Parkinson's disease.Int J Cancer,2012,131:1904-1911.
[11]Ong EL,Goldacre R,Goldacre M.Differential risks of cancer types in people with Parkinson's disease:a national recordlinkage study.Eur J Cancer,2014,50:2456-2462.
[12]Wirdefeldt K,Weibull CE,Chen H,Kamel F,Lundholm C, Fang F,Ye W.Parkinson's disease and cancer:a register-based family study.Am J Epidemiol,2014,179:85-94.
[13]Tang CF,Lu MK,Muo CH,Tsai CH,Kao CH.Increased risk of brain tumor in patients with Parkinson's disease:a nationwide cohort study in Taiwan.Acta Neurol Scand,2016,134:148-153.
[14]Lin PY,Chang SN,Hsiao TH,Huang BT,Lin CH,Yang PC. Association between Parkinson disease and risk of cancer in Taiwan.JAMA Oncol,2015,1:633-640.
[15]Olsen JH,Friis S,Frederiksen K.Malignant melanoma and other types of cancer preceding Parkinson disease. Epidemiology,2006,17:582-587.
[16]Wang XJ,Zhang Y,Chen SD.Ten-year advance in the study on pathologic mechanism and treatment of Parkinson's disease. Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2010,10:36-42.[汪錫金,張煜,陳生弟.帕金森病發病機制與治療研究十年進展.中國現代神經疾病雜志,2010,10:36-42.]
[17]Doshay LJ.Problem situations in the treatment of paralysis agitans.J Am Med Assoc,1954,156:680-684.
[18]Kenborg L,Rugbjerg K,Lee PC,Ravnskj?r L,Christensen J, Ritz B,Lassen CF.Head injury and risk for Parkinson disease:results from a Danish case-control study.Neurology,2015,84:1098-1103.
[19]Benincasa D,Romano A,Mastronardi L,Pellicano C,Bozzao A, Pontieri FE.Hemiparkinsonism due to frontal meningioma.Acta Neurol Belg,2008,108:29-32.
[20]Bostantjopoulou S,Katsarou Z,Petridis A.Relapsing hemiparkinsonism due to recurrent meningioma.Parkinsonism Relat Disord,2007,13:372-374.
[21]D'Amelio M,Ragonese P,Sconzo G,Aridon P,Savettieri G. Parkinson's disease and cancer:insights for pathogenesis from epidemiology.Ann NY Acad Sci,2009,1155:324-334.
[22]Fujita M,Sugama S,Nakai M,Takenouchi T,Wei J,Urano T, Inoue S,Hashimoto M.alpha-Synuclein stimulates differentiation of osteosarcoma cells:relevance to downregulation of proteasome activity.J Biol Chem,2007,282:5736-5748.
[23]Skibba JL,Pinckley J,Gilbert EF,Johnson RO.Multiple primary melanoma following administration of levodopa.Arch Pathol,1972,93:556-561.
[24]Constantinescu R,Romer M,Kieburtz K;DATATOP Investigators of the Parkinson Study Group.Malignant melanoma in early Parkinson's disease:the DATATOP trial. Mov Disord,2007,22:720-722.
[25]Fang F,Ding JQ.The role of abnormally activated microglia in the pathogenesis of Parkinson's disease and its potential clinical application.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2013,13:153-156[.方芳,丁健青.小膠質細胞異常激活在帕金森病發病中的作用及潛在臨床應用.中國現代神經疾病雜志,2013,13:153-156.]
[26]Mantovani A,Allavena P,Sica A,Balkwill F.Cancer-related inflammation.Nature,2008,454:436-444.
[27]Veeriah S,Taylor BS,Meng S,Fang F,Yilmaz E,Vivanco I, Janakiraman M,Schultz N,Hanrahan AJ,Pao W,Ladanyi M, Sander C,Heguy A,Holland EC,Paty PB,Mischel PS,Liau L, Cloughesy TF,Mellinghoff IK,Solit DB,Chan TA.Somatic mutations of the Parkinson's disease-associated gene PARK2 in glioblastoma and other human malignancies.Nat Genet,2010, 42:77-82.
[28]Liu S,Yang Z,Wei H,Shen W,Liu J,Yin Q,Li X,Yi J. Increased DJ-1 and its prognostic significance in hepatocellular carcinoma.Hepatogastroenterology,2010,57:1247-1256.
[29]Miyajima Y,Sato Y,Oka H,Utsuki S,Kondo K,Tanizaki Y, Nagashio R,Tsuchiya B,Okayasu I,Fujii K.Prognostic significance of nuclear DJ-1 expression in astrocytoma. Anticancer Res,2010,30:265-269.
[30]Vasseur S,Afzal S,Tomasini R,Guillaumond F,Tardivel-Lacombe J,Mak TW,Iovanna JL.Consequences of DJ-1 upregulation following p53 loss and cell transformation. Oncogene,2012,31:664-670.
[31]Hinkle DA,Mullett SJ,Gabris BE,Hamilton RL.DJ-1 expression in glioblastomas shows positive correlation with p53 expression and negative correlation with epidermal growth factor receptor amplification.Neuropathology,2011,31:29-37.
[32]Inzelberg R,Cohen OS,Aharon-Peretz J,Schlesinger I, Gershoni-Baruch R,Djaldetti R,Nitsan Z,Ephraty L, Tunkel O,Kozlova E,Inzelberg L,Kaplan N,Fixler Mehr T,Mory A,Dagan E,Schechtman E,Friedman E,Hassin-Baer S.The LRRK2 G2019S mutation is associated with Parkinson disease and concomitant non-skin cancers. Neurology,2012,78:781-786.
[33]Ruiz-Martínez J,de la Riva P,Rodríguez-Oroz MC,Mondragón Rezola E,Bergareche A,Gorostidi A,Gago B,Estanga A, Larra?aga N,Sarasqueta C,López de Munain A,Martí Massó JF.Prevalence of cancer in Parkinson's disease related to R1441G and G2019S mutations in LRRK2.Mov Disord,2014, 29:750-755.
Parkinson's disease and risk of brain tumor:a Meta-analysis
YANG Xiao-dong,XU Shao-qing,QIAN Yi-wei,XIAO Qin
Department of Neurology and Institute of Neurology,Ruijin Hospital,School of Medicine,Shanghai Jiaotong University,Shanghai 200025,China
< class="emphasis_italic">Corresponding author:XIAO Qin(Email:xiaoqin67@medmail.com.cn)
XIAO Qin(Email:xiaoqin67@medmail.com.cn)
ObjectiveTo assess the correlation between Parkinson's disease(PD)and brain tumor.MethodsTaking Parkinson's disease,tumor,cancer in Chinese,and PD,Parkinson's disease,tumor, cancer,neoplasm in English as the key words,prospective cohort studies and case-control studies on relation between PD and brain tumor were searched by using PubMed,Web of Science,EMBASE/SCOPUS, Cochrane Library,China National Knowledge Infrastructure(CNKI),Wanfang Data,and VIP database from January 1965 to July 2016,assisted by manual searching.Quality assessment and Meta-analysis were made by using Newcastle-Ottawa Scale(NOS)and Stata 12.1 software.ResultsA total of 11 studies with a total number of 350 632 PD patients were included in the overall analysis after excluding duplicate ones and those which did not meet the inclusion criteria from 1832 articles.Meta-analysis showed that compared with healthy people,PD patients had an increased risk of brain tumor(OR=1.370,95%CI:1.120-1.690;P=0.003),and the result was consistent after excluding 2 low-quality articles(OR=1.360,95%CI:1.080-1.720;P=0.008).Further stratified analyses according to disease onset time and regional difference showed that brain tumor occurrence in PD patients was significantly higher than healthy people only after the diagnosis of PD(OR=1.430,95%CI:1.120-1.830;P=0.004).The geographical subgroup analyses showed a higher risk of brain tumor among PD patients in Europe(OR=1.420,95%CI:1.290-1.560;P= 0.000)and Taiwan area of China in Asia(OR=2.590,95%CI:1.730-3.880;P=0.000)compared with healthy people.Funnel plot,Begg test(P=0.583)and Egger test(P=0.985)showed there was no bias.ConclusionsPD patients have a higher risk of brain tumor.
Parkinson disease;Brain neoplasms;Meta-analysis
2016-12-02)
10.3969/j.issn.1672-6731.2017.01.006
上海市科學技術委員會科研計劃項目(項目編號:14ZR1425700)
200025上海交通大學醫學院附屬瑞金醫院神經科上海交通大學醫學院神經病學研究所
肖勤(Email:xiaoqin67@medmail.com.cn)

