低溫耐鹽芘降解菌的篩選鑒定及降解特性研究
刁 碩,王紅旗,許 潔,趙一村
(北京師范大學水科學研究院,北京 100875)
低溫耐鹽芘降解菌的篩選鑒定及降解特性研究
刁 碩,王紅旗*,許 潔,趙一村
(北京師范大學水科學研究院,北京 100875)
低溫條件(10℃)下,采用定時定量轉接、間歇式逐步提高PAHs濃度的方法,從天津濱海濕地石油污染土壤中獲得能以多環芳烴芘為唯一碳源和能源生長的菌群H和純化菌株DYC-1,經生理生化和16S rDNA基因序列BLAST對比結果分析,菌株DYC-1屬于紅球菌屬(Rhodococcus).降解特性分析結果表明,10℃低溫條件下,紅球菌DYC-1與菌群H降解能力相似,對20mg/L芘的15d降解率達到35%以上;紅球菌DYC-1具有較好的耐鹽能力和較廣的降解底物譜,菌株DYC-1的最優降解條件為:低溫10 ℃,鹽度2%的條件下,在pH8,搖床轉速為110r/min,接菌量為5%時,對于初始濃度為20mg/L的芘能達到35%以上的降解率.
低溫;耐鹽;芘;降解;紅球菌DYC-1
多環芳烴(PAHs)作為典型的持久性有機污染物[1],不僅存在大氣中,由于其自身的穩定性,進入土壤后便長期殘留其中,在土壤中的半衰期為2~24個月[2],隨著地表水及降水的沖刷,不斷向地下水釋放,對地下水環境造成了嚴重的污染和破壞[3].有研究表明,在PAHs污染土壤中,土著微生物對PAHs的轉化能力顯著高于外源微生物,轉化率相差3000倍以上.同時,土著菌及混合菌對污染物具有更好的降解能力,對外界環境的變化(如溫度、pH等)也有更好的適應性,易于在環境中保持競爭優勢[4].因此,從長期受PAHs污染的土壤中分離篩選出高效PAHs降解菌,是生物修復PAHs污染土壤的第一步,也是關鍵的一步.
天津濱海濕地處于我國北方濱海地區,年平均溫度多在15℃或以下.近年來濱海濕地由于油田開發等生產活動的進行,在經濟快速增長的同時也造成了石油污染.PAHs是濱海濕地石油污染土壤中的主要污染物,其中含四個苯環的芘(Pyrene)是主要污染物之一.石油的生產多伴隨著高鹽環境的產生,降解芘的微生物在低溫高鹽條件下的生長和代謝都要受到一定程度的限制.Whyte等[5]指出,耐冷型假單胞菌在低溫下(5~10℃)可降解萘,Deppe等[6]發現,北極的細菌共生體也可以在4℃降解萘.宋立超等[7]分離出一組菌群,在鹽質量分數0~2%,15d后對菲、芘的降解率可達到92.1%和65.8%.張巧巧[8]研究發現,菌株SE12在液體培養條件下對芘的降解效果十分顯著,在芘初始濃度為50,100,200mg/L的無機鹽培養基中培養15d,降解率分別達到86.4%, 96.4%與79.6%.SE12能將初始濃度100mg/L的芘在15d幾乎完全降解,但是當初始濃度低于或者高于100mg/L時降解率都有所降低.但目前針對低溫高鹽復合環境下PAHs芘降解菌的研究較少,其在低溫高鹽環境下的生長特性及對PAHs芘的降解特性尚不明確.本文可科學指導濱海濕地PAHs污染土壤的生物修復工作,也可為PAHs污染治理提供適宜菌株及理論依據.
1 實驗材料與方法
1.1 樣品來源
本研究所用土壤樣品均采自天津濱海濕地石油污染地區(采樣坐標N38°44′57.1″E117°29′51.1″)土壤表層10~15cm處,采取占地面積最大的鹽漬化污染區域土壤樣品后放于塑料自封袋中,封口,帶回實驗室后過2mm篩,放在4℃冰箱進行保存.理化性質如表1所示.
1.2 藥品與試劑
本文所使用的主要藥品及來源:芘、菲、苯并b熒蒽、苯并a蒽(分析純,日本TCL公司);熒蒽、芴(分析純,美國Sigma公司);Na2HPO4、KH2PO4、NH4Cl、MgSO4·7H2O、CaCl2、NaCl、NaNO3、FeSO4·7H2O、K2HPO4等、水楊酸、葡萄糖、牛肉膏、瓊脂粉(分析純,國藥集團化學試劑北京有限公司);蛋白胨(分析純,北京鼎國生物試劑公司);酵母粉(分析純,OXOID公司);瓊脂糖(分析純,Spain公司);正己烷、乙腈、丙酮(分析純,美國J.T.Baker公司).
試劑及來源:磷酸鹽緩沖液(PBS)(pH7.4),醋酸鉛濾膜,安捷倫小瓶.
1.3 培養基
無機鹽培養基(MSM):K2HPO41.0g, NH4H2PO41.0g,(NH4)2SO41.0g,MgSO4·7H2O 0.2g,KNO33.0g,微量元素1.0mL(MnSO439.9mg,ZnSO4·H2O 42.8mg, (NH4)2MoO4·4H2O 34.7mg,蒸餾水1000mL),NaCl 20.0g(鹽度為2%),瓊脂15.0g(固體培養基)去離子水定容到1000mL,pH調為8.0,121℃高壓蒸汽滅菌20min;
LB培養基:蛋白胨10.0g,酵母提取物5.0g,NaCl 20.0g(鹽度為2%),瓊脂15.0g(固體培養基),去離子水定容到1000mL,pH值調為8.0, 121℃高壓蒸汽滅菌20min;
選擇性無機鹽液體培養基:無菌條件下,在已滅菌的無機鹽培養基中加入一定量芘的丙酮溶液,使其達到預定濃度,置于恒溫振蕩器上以120r/min的振蕩頻率振蕩24h,待丙酮完全揮發后使用;
選擇性無機鹽固體培養基:無機鹽固體培養基121℃下高壓滅菌20min,倒入平板,在其表面涂布芘的丙酮溶液,于超凈臺上待丙酮完全揮發后使用.
1.4 實驗方法
1.4.1 篩選方法 在低于正常室溫的10℃低溫條件下,采用土壤菌懸液制備——初篩——保存混合菌及分離純化——復篩——保藏菌株的方法獲得芘降解菌群H和單菌DYC-1.
1.4.2 菌株鑒定 表型特征鑒定:參照伯杰氏手冊第八版[9]細菌分類學進行相關實驗.
分子生物學鑒定:利用16S rDNA 技術對其進行鑒定.采用北京博邁德生物技術有限公司合成的引物,以該菌株基因組DNA為模板,擴增出該菌株16S rDNA序列.PCR擴增反應體系為25μL:2×TaqPCR MasterMix 12.5μL (0.1U Taq Polymerase/μL;500μmol/L dNTP;20mmol/L Tris-H Cl (pH8.3);100mmol/L KCl;3mmol/L MgCl2),引物27F (10μmol/L)1μL,引物1492R (10μmol/ L)1μL,菌液模板1μL,ddH2O 9.5μL,總體積25μL. PCR擴增條件為: 94℃預變性2min;94℃變性30s,55℃復性430s, 72℃延伸1.5min,進行40個循環;最后72℃延伸10min,在4℃下保存.將PCR擴增產物送至測序公司進行純化測序,測序結束后,將所測基因序列輸入到NCBI網站的GenBank數據庫中,用BLAST(Basic Local Alignment Search Tool)工具與已登錄的16S rDNA序列進行同源性比對,從而確定微生物的種屬.使用軟件MEGA6.0進行序列同源性分析,構建菌株的系統發育樹.
1.4.3 菌株生長曲線的測定 菌懸液的制備:從-20℃冰箱取出保存單菌及菌群的甘油管,分別移出200μL至2瓶滅菌的100mL LB培養基中,在10℃、110r/min的搖床振蕩培養48h, 8000r/ min離心10min,棄去LB培養基,用無機鹽培養基液洗滌3次,制成OD600=0.8的菌懸液,備用.
本研究采用光密度法測定菌群及單菌的生長曲線.在裝有已滅菌的50mL無機鹽液體培養基的150mL三角瓶中加入芘的丙酮溶液,使培養基中芘濃度為20mg/L,待丙酮揮發后,準確加入制備好的單菌及菌群的菌懸液2.5mL(接菌量5%),調節pH值為8.0,在溫度設置為10℃的恒溫振蕩器上以110r/min的振蕩頻率振蕩培養.每隔24h取發酵液進行分析,以無機鹽培養基作為空白對照,用紫外分光光度計測定其OD600值來表征菌體的生長情況.以發酵液的培養時間為橫坐標,以OD600值為縱坐標,繪制菌群及單菌的生長曲線.
1.4.4 芘降解能力的測定 在裝有已滅菌的50mL無機鹽液體培養基中加入一定量芘的丙酮溶液,使培養基中芘濃度為20mg/L,待丙酮揮發后,準確加入制備好的單菌及菌群的菌懸液2.5mL,設置不加菌作為對照組,調節pH值為8.0,在溫度設置為10℃的恒溫振蕩器上以110r/min的振蕩頻率振蕩培養,以考察菌株對芘的耐受性及降解能力.培養一段時間后,用高效液相色譜法(HPLC)測定芘的降解率,考察菌株降解能力.
1.4.5 高效液相(HPLC)分析水相中殘留的芘 樣品的前處理:采用高效液相法來分析水相中殘留的芘.首先對錐形瓶中的樣品進行殘留芘的提取(總量50mL,整瓶萃取),加入等體積(50mL)的正己烷,在40Hz下超聲萃取30min,靜置20min后對有機相進行分離,重復萃取兩次,合并有機相.用針管取2mL合并后的有機相,過0.2μm的醋酸鉛濾膜后置于安捷倫小瓶中,待HPLC分析.
HPLC測定條件:采用高效液相對安捷倫小瓶中萃取液進行分析,分析儀器為配有自動進樣器的德國戴安公司U3000液相色譜儀,色譜柱為PAHs專用高效液相分析柱(安捷倫, 250mm×4.6mm,5μm),流動相為乙腈/水(65:35),流速為1.2mL/min,檢測波長為254nm,柱溫25℃,進樣體積為20μL.
1.4.6 菌株對不同底物的利用能力 準備裝有無機鹽培養基的三角瓶,分別加入濃度為100mg/L的碳源物質:鄰苯二甲酸、菲、芴、苯酚、熒蒽、鄰苯二酚、苯并[b]熒蒽、苯并[a]蒽、水楊酸,再分別加入5%菌懸液,在10℃,110r/min的搖床中振蕩培養.依據相關研究選擇的9種碳源物質(見3.5),每種做3個平行,共27瓶培養基.培養10d,考察紅球菌DYC-1對不同底物的利用情況.
1.4.7 降解菌的耐鹽特性研究 本研究立足濱海濕地現狀,選擇2%鹽度為篩選菌株條件,并探索篩選出的單菌DYC-1的耐鹽特性.
不同NaCl濃度對降解菌生長狀況的影響:將DYC-1接種到LB液體培養基中,調整NaCl濃度分別為0%、0.5%、1%、2%、3%、5%、8%、10%、15%、20%,檢測菌株是否生長.
降解菌分別在5%、10%、15%鹽度條件下的降解效果:將篩選出的單菌DYC-1接種在NaCl濃度分別為5%、10%、15%,芘濃度為20mg/L的無機鹽培養基中,觀察菌株的生長特性,測定菌株對四環PAHs芘的降解率,考察其對鹽的耐受性及對高分子量PAHs的降解能力.
1.4.8 搖瓶降解實驗設計 不同初始濃度對芘降解效能的影響:準備150mL的三角瓶,滅菌后在無菌操作臺上每瓶加入已滅菌的50mL無機鹽培養基,分別加入不同量芘的丙酮溶液,使芘的濃度分別為20,50,80,100,150,200,300,500mg/L,待丙酮揮發后,各加入制備好的菌液2.5mL(接種量為5%),調節pH值為8.0,在溫度設置為10℃的恒溫振蕩器上以110r/min的振蕩頻率培養,定期取樣,測定芘降解率.
pH值變化對降解效果的影響:準備150mL的三角瓶,滅菌后在無菌操作臺上每瓶加入已滅菌的50mL無機鹽培養基,加入芘的丙酮溶液,使芘的初始濃度為20mg/L,待丙酮揮發后,加入制備好的菌液2.5mL(接種量為5%),調節pH值分別為5.0,6.0,7.0,8.0,9.0,10.0.在溫度設置為10℃的恒溫振蕩器上以110r/min的振蕩頻率培養,考察菌株DYC-1對芘的降解率.
轉速變化對降解效果的影響:由于搖床轉速直接反應水中溶解氧的含量,因此在其他條件不變的情況下,以搖床轉速來控制溶解氧的含量,設搖床轉速分別為80,110,140,170,200r/min,考察紅球菌DYC-1對芘的降解能力.
不同接種量對降解效果的影響:在其他條件不變的情況下,將菌懸液按照0.5%、1%、3%、5%、8%、10%、15%的接種量接入到含芘的無機鹽培養基中,考察紅球菌DYC-1對芘的降解能力.
2 結果與討論
2.1 篩選馴化菌株過程中反應體系變化情況
錐形瓶中加入PAHs芘作為唯一碳源和能源進行富集培養,15d內培養液顏色出現如下變化:乳白色(透明無色的無機鹽培養基加入一定濃度芘后變為乳白色),出現白色混濁,變成淡黃色-最后穩定不變.可能是因為芘的生物降解過程中會產生某種中間產物,而在隨后各階段的富集培養中,變化過程會再次出現且所需時間逐漸縮短,表明微生物的酶體系適應了芘存在的環境,可將其作為生長基質.
2.2 菌株DYC-1的鑒定結果
2.2.1 菌株DYC-1的生理生化實驗結果 菌株DYC-1的菌落呈淡黃色,圓形,直徑約3mm,表面濕潤,不透光,邊緣光滑,未向四周擴散.相關實驗結果見表2.

表2 紅球菌DYC-1生理生化特性Table 2 Physical and biochemical characteristics of Rhodococcus sp. DYC-1
由表2的細菌生理生化反應總特征,相關的文獻以及伯杰氏手冊[9],初步鑒定篩選出的芘降解單菌為紅球菌屬.
2.2.2 序列分析與系統發育樹構建 采用較易操作的16S rDNA分析方法對菌株進行同源性序列分析.BLAST工具的對比結果表明,實驗所用菌種為紅球菌(Rhodococcussp.),在GenBank中挑選與DYC-1同源性達99%的菌種,利用MEGA6.0做紅球菌DYC-1的基因發育進化樹(圖1),結果表明DYC-1與紅球菌最為接近,說明實驗所用的菌種的確為紅球菌,課題組將其命名為紅球菌DYC-1(Rhodococcussp. DYC-1, GenBank Entry:KR029576;保藏編號:CGMCC 10289).
紅球菌屬目前被認為是可參與共代謝降解,且能降解芘效果較好的菌屬.
2.3 菌株DYC-1及菌群的生長曲線
在10℃,2%鹽度條件下篩選出的菌群記為H,菌株DYC-1及菌群H的生長曲線如圖2所示.
單菌DYC-1與菌群H的生長曲線趨勢大致相同,0~2d為停滯期.單菌DYC-1在3~8d期間處于對數生長期,而菌群H在3~11d期間處于對數生長期.菌群相對于單菌對數期較長,進入穩定期較慢,可能由于不同菌株之間競爭營養元素,拮抗作用所致.也可能由于不同菌株之間的促進作用減緩了衰亡進程,菌群在15d之后進入衰亡期,而單菌DYC-1則衰亡得比較快,在12d之后已經進入衰亡期.
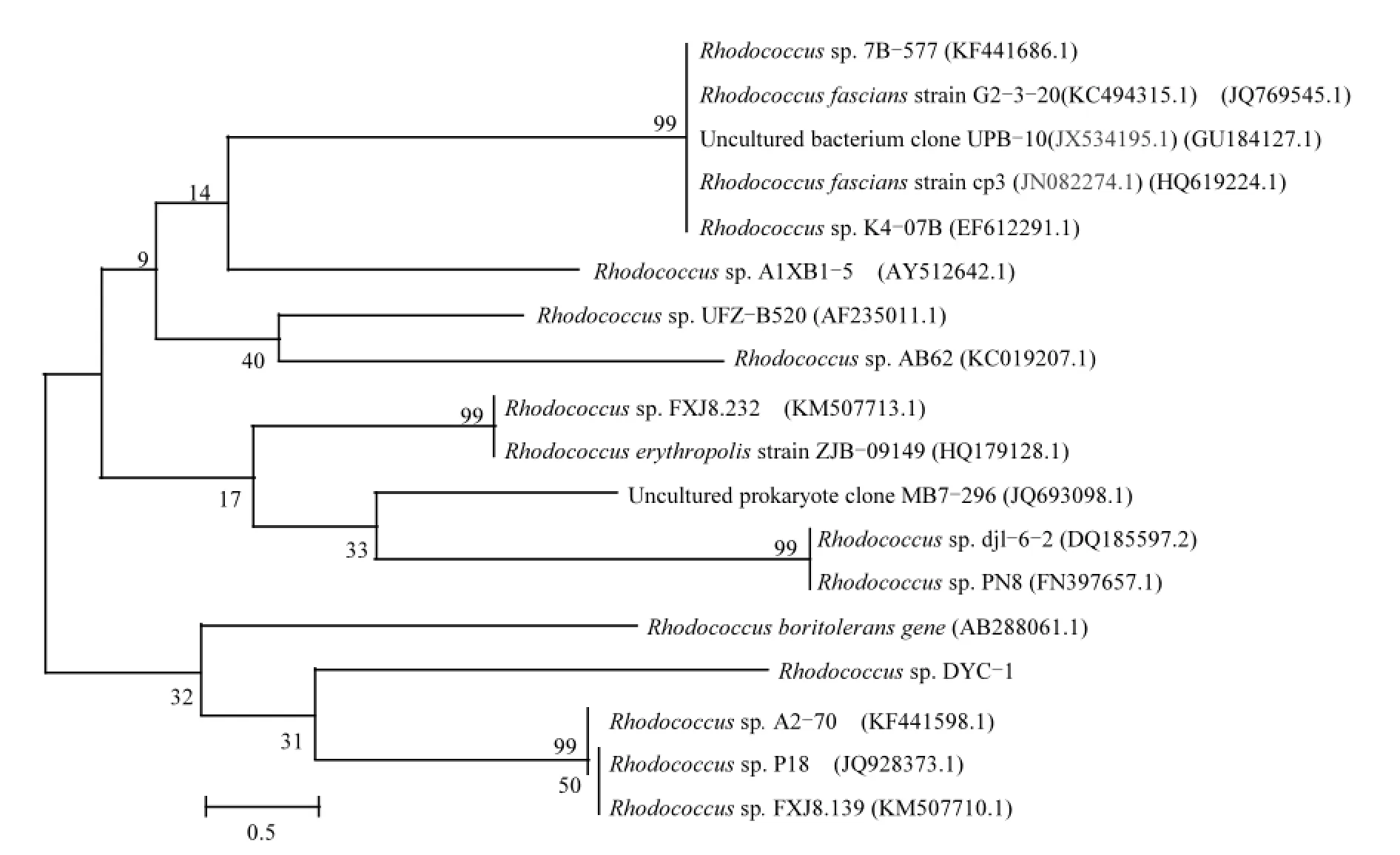
圖1 菌株DYC-1系統發育樹Fig.1 Phylogenetic tree of Rhodococcus sp. DYC-1
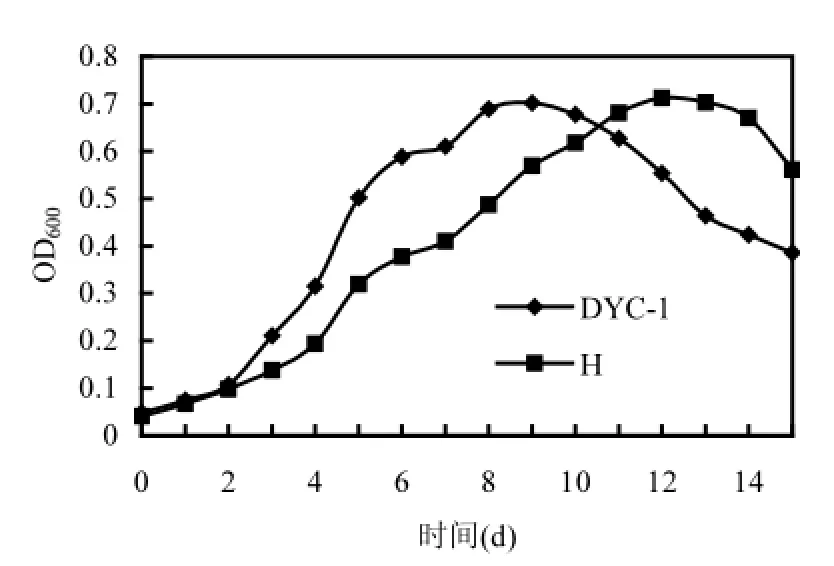
圖2 菌株DYC-1及菌群H的生長曲線Fig.2 Growth curve of Rhodococcus sp. DYC-1and mixed culture H
綜上所述,如果把菌株用于以后的降解試驗時,菌液的發酵時間定為8~11d之間比較合適.
2.4 單菌及菌群對芘的降解能力分析
菌群H由于含多種菌株理論上降解能力會高于單菌,但從圖3可以看出,菌群的降解能力與單菌DYC-1的降解能力相當,只是略高于單菌.這可能是由于不同菌株之間拮抗作用所致.因此后續實驗中只考察單菌DYC-1對芘的降解情況.
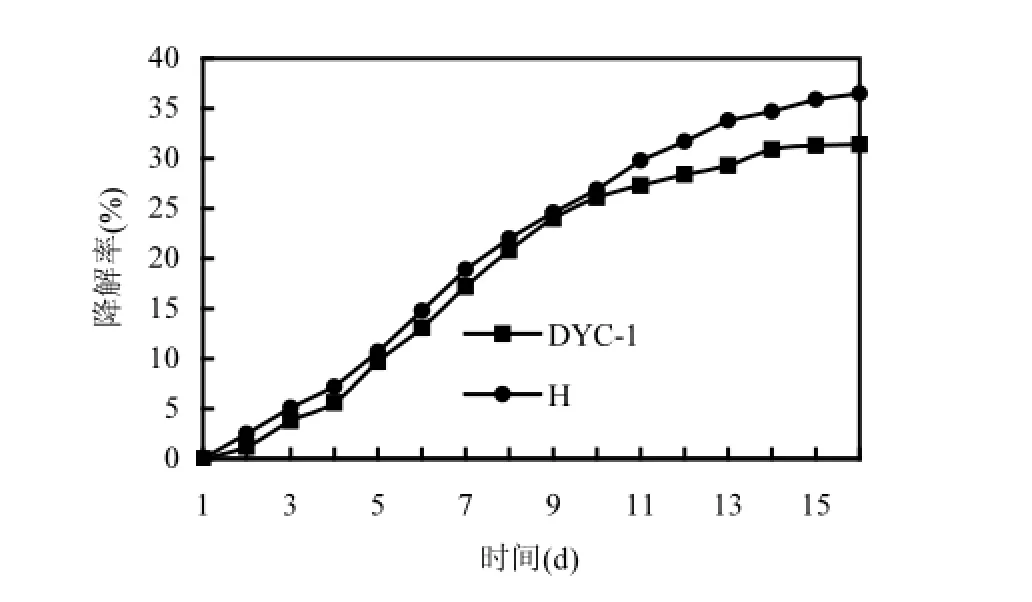
圖3 菌株DYC-1及菌群H的降解曲線Fig.3 Degradation curve of Rhodococcus sp. DYC-1and mixed culture H
2.5 菌株對不同底物的利用
考查菌株DYC-1對不同底物利用情況時,因其對四環芳烴芘具有一定降解能力,故分別選定低環芳烴菲、芴,高環芳烴熒蒽、苯并[b]熒蒽、苯并[a]蒽,苯系物苯酚作為底物,而鄰苯二甲酸、鄰苯二酚、水楊酸均為芘的中間代謝產物[10-12],因而也選定為底物.菌株對不同底物的利用情況見表3.可知,菌株DYC-1對鄰苯二甲酸、水楊酸、鄰苯二酚都可以降解,可能是由于它們是PAHs代謝中間產物,對菲、芴低環PAHs可以降解,對五環熒蒽也可以降解,但卻難以降解苯并[b]熒蒽和苯并[a]蒽.

表3 菌株DYC-1對不同底物的利用情況Table 3 The utilization of different substrates
2.6 不同NaCl濃度對降解菌生長效果的影響
本研究實驗樣品采自天津濱海濕地石油污染區土壤,濱海鹽土的特點是鹽分組成單一,以氯化物占絕對優勢;土壤表層含鹽量多為0.6%~1.0% 部分區域高達2%~3%,除南方濱海地區“咸酸田”呈強酸性反應外,一般pH值為8.0-8.5.天津濱海新區濱海鹽土(0~30cm)土壤含鹽量大于0.6%的土壤面積占總面積的43.9%[13].因此改變LB培養基的鹽度,測試所篩選出的降解菌DYC-1耐鹽特性.結果表明,芘降解菌DYC-1在0%~10%的鹽度范圍內都可以生長,鹽度升高至15%時,因OD600數值低于0.02,認定為不能生長,鹽度耐受范圍相對較寬.
紅球菌DYC-1具有較強的耐鹽特性,證明它在高鹽條件下能夠保持酶活,可為其在高鹽條件下去除環境中PAHs提供基礎生境條件.

表4 菌株DYC-1耐鹽特性Table 4 The salt resistance of Rhodococcus sp. DYC-1
2.7 不同鹽度條件下菌株DYC-1對芘的降解效果
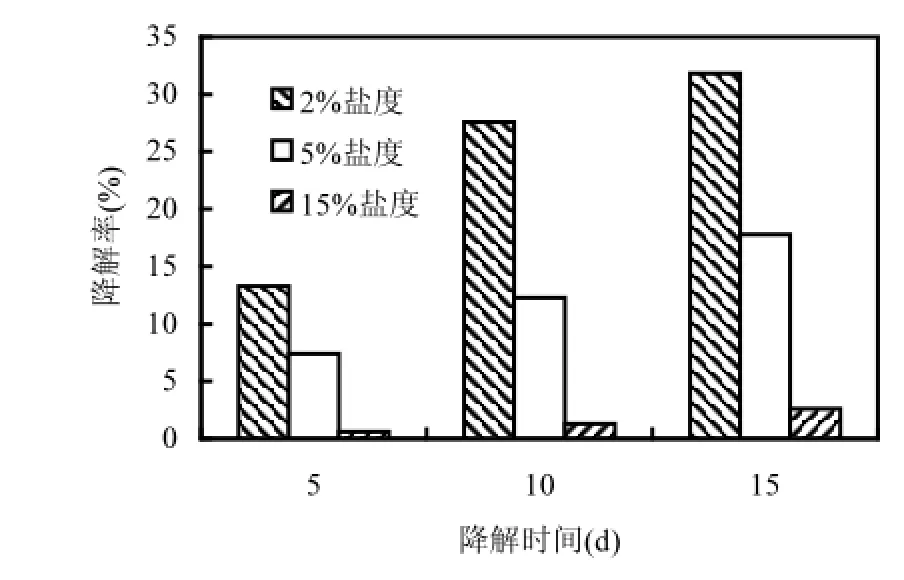
圖4 不同鹽度條件下菌株對芘的降解Fig.4 The degradation of pyrene in the condition of different salinity
研究表明,菌株對鹽分有一定的適應范圍,尤其是生長在鹽堿土壤中的土著菌[14]. Kushner[15]認為中度嗜鹽菌其生長最適NaCl濃度約為3%~15%,韓言柱等[16]分離出一株降解菲的中度嗜鹽菌,其在pH中性條件下對菲的降解耐鹽性達到15%.有學者發現,當鹽度超過3%時,非嗜鹽微生物因其代謝受到一定程度的抑制,使得生物修復效率明顯降低,甚至喪失修復能力[17].而菌株DYC-1在5%鹽度條件下仍表現出不錯的降解能力,從而證明菌株DYC-1是一株能高效降解芘的耐鹽菌.而當鹽度達到15%時,菌株雖能降解芘,但降解能力非常微弱.總體來說,菌株DYC-1具有較好的耐鹽性,這可能與其土壤來源有關,土壤取自天津濱海濕地,屬于鹽漬化土地,對天津濱海鹽堿土壤14個樣點的土壤鹽分測定結果顯示,土壤含鹽量分布在0.049% ~1.85%之間.
2.8 不同初始濃度對芘降解效果的影響
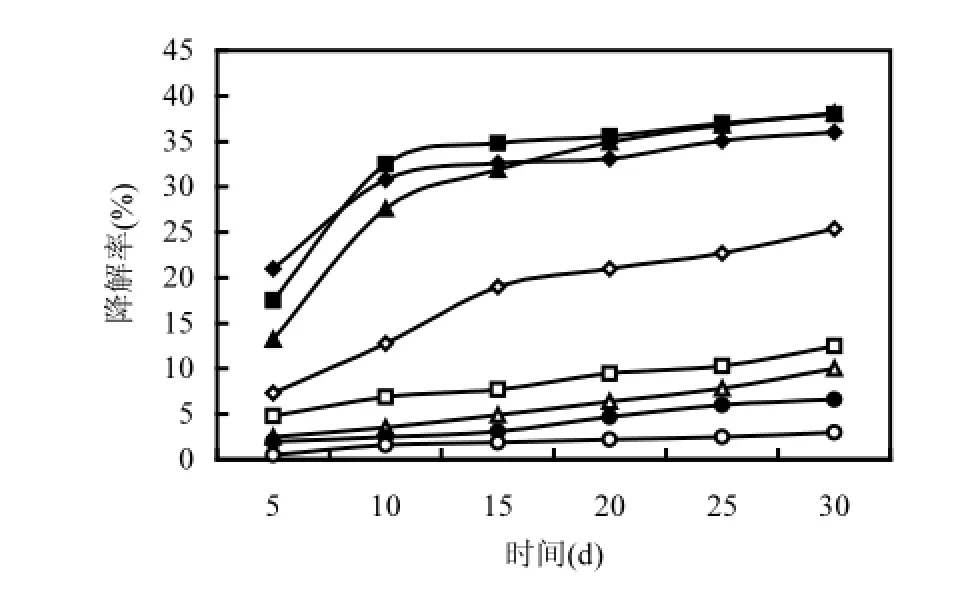
圖5 不同初始濃度菌株芘的降解Fig.5 The degradation of pyrene in the condition of different initial concentration
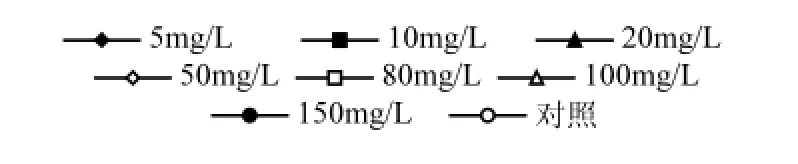
如果菌株能夠降解高濃度的污染物,則說明該菌株具有很強的生物降解能力[18].本實驗設計了5,10,20,50,80,100,150mg/L共7種濃度的液相好氧降解體系,如圖5所示,芘的初始濃度在5,10, 20mg/L時,30d后總降解率雖相差不多,但降解速率卻在明顯增加,芘濃度為20mg/L時降解率可達到最高38.42%,說明在5~20mg/L的實驗范圍內,并未出現底物抑制現象,即芘作為唯一碳源和能源還不能完全滿足微生物新陳代謝的需要.而當芘的初始濃度達到50mg/L時,降解率隨著時間延長而增大,但并沒有隨著芘濃度的增大而升高,這可能是由于菌株DYC-1是在10℃、鹽度為2%、芘的濃度為20mg/L的條件下篩選出來的,低溫高鹽的條件本就不適于微生物的生長,當芘的濃度升高至50mg/L,微生物降解PAHs的能力受到一定程度的限制.如果繼續增大芘的初始濃度,降解率則幾乎不增長,隨著芘濃度的升高,降解率增更慢,這時的降解率與空白對照(不加微生物的芘無機鹽培養基)相差不大,因此降解率多是由于芘的自然揮發所致,則芘的初始濃度高于100mg/L時,微生物無法對芘的降解發揮作用,可能是由于過高濃度的芘對菌株DYC-1產生毒害作用.由于低溫耐鹽等嚴苛的篩選條件及實驗條件,本研究選定的芘濃度低于馬姍姍[18]選定的80mg/L,定為20mg/L.
2.9 不同pH值對降解效果的影響
研究表明,細菌對PAHs降解的最適pH值為中性[14,19]. pH值變化對微生物降解PAHs的影響非常復雜,可以通過影響降解酶的活性還可通過影響氧化還原電位來影響降解率.另外微生物的新陳代謝活動與環境介質的pH值密切相關,在不同的pH值條件下,微生物對營養物質的利用及吸附作用、胞外酶的產生及分泌等均不相同.在其他條件相同的情況下,將無機鹽培養基中的初始pH值分別調為5.0、6.0、7.0、8.0、9.0、10.0,分別接入紅球菌DYC-1,10℃,110r/min振蕩培養15d后測定剩余PAHs含量,計算降解率,結果如圖6所示.
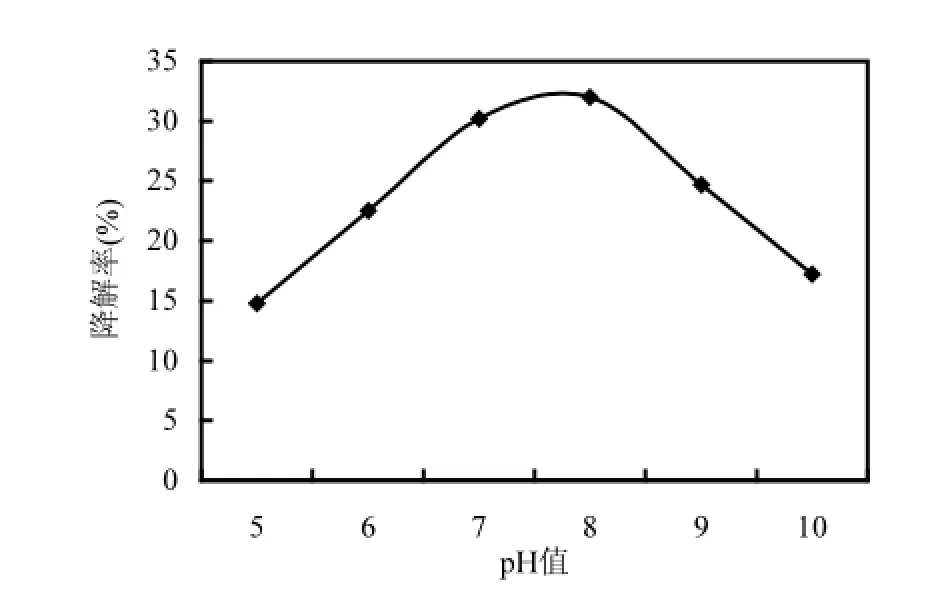
圖6 不同pH值條件下菌株對芘的降解Fig.6 The degradation of pyrene in the condition of different pH
從圖6可以看出,菌株DYC-1在pH值為7~9的范圍內降解PAHs的能力較強,當pH值小于7或者大于9降解能力都明顯減弱,這可能是由于每種微生物都有其生長的最適pH值,pH值過高或過低都會影響微生物酶的分泌及活性,從而抑制微生物對PAHs的降解.因此中性或弱堿性條件下最有利于菌株DYC-1發揮對芘的降解作用,本研究中選取pH值為8.
2.10 不同轉速對降解效果的影響
由圖7所示,隨著搖床轉速的升高,15d后菌株DYC-1對PAHs的降解率逐漸增高.但從80r/min升高至110r/min時,降解率顯著增加,而從110r/min升高至200r/min的過程中降解率變化不大,這可能是由于溶解氧對于微生物降解污染物的促進作用是有一定范圍的,當超過了這個范圍,即使供氧量繼續增加,對降解率的促進作用也是有限的,因此本研究將搖床轉速控制為110r/min,既能促進菌株對PAHs的降解,又節省了能源.
圖7 轉速不同對菌株降解芘的影響Fig.7 The degradation of pyrene in the condition of different oxygen gas content
2.11 不同接種量對降解效果的影響
接種量的大小對縮短菌株在新環境中延滯期有一定作用,降解菌的生物量是影響污染物生物降解效率的重要因素之一[17,20].將菌懸液以不用的接種量接入到含芘的無機鹽培養基中,15d后測定芘的降解速率(10℃,110r/min),考察初始不同接種量對菌株DYC-1降解芘的影響,結果見圖8.總的來說,接種量與芘的降解率呈正相關:接種量在0.5%~5%之間,芘的降解率隨著接種量的增加而增大,但隨著接種量的進一步增加,降解率維持在32%左右,變化相差不大.由此可見,生物量的增加與降解率的提高并非呈線性關系,超出一定范圍后,接種量的增加反而不利于菌體的新陳代謝及分泌表面活性劑[21].因此本研究選取5%的接種量.
芘作為一種穩定的四環高分子量PAHs,在室溫低鹽條件下仍然不易降解.段燕青等[22]通過實驗證明了米曲霉以芘為單基質代謝時,降解率為33%;一些學者對菌株的選擇更地域化,Patel等[23]驗證了海洋微藻集胞藻對芘的降解率可達36%,陸泗進等[24]在實驗中測定芽孢桿菌B6和假單孢菌B17對芘的降解效果,發現降解率為24.45%和18.77%.而本研究中,在相對低溫高鹽的環境下,紅球菌DYC-1降解高濃度芘仍可達35%以上的降解率.
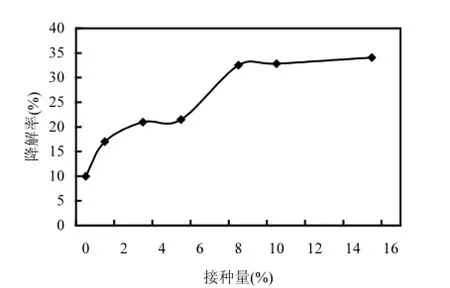
圖8 不同接種量對菌株降解芘的影響Fig.8 The degradation of pyrene in the condition of different capacity of bacteria
后續將在改變降解溫度或提供并改善共代謝降解環境方面進一步探索,還可對芘的降解途徑、產物及芘污染土壤的實際修復效果方面深入開展研究,以期為石油烴污染土壤的生物修復技術提供優勢菌株和理論支持.
3 結論
3.1 采用定時定量轉接、間歇式逐步提高PAHs濃度的方法,從天津濱海濕地石油污染土壤中獲得能以PAHs芘為唯一碳源和能源生長的菌株DYC-1,經生理生化和16S rDNA分析鑒定為紅球菌(Rhodococcus sp. DYC-1).
3.2 紅球菌DYC-1與菌群H降解能力相似,可能是各菌株之間的拮抗作用導致或者紅球菌DYC-1是該菌群中的優勢菌株.
3.3 紅球菌DYC-1具有較好的耐鹽能力,在10%鹽度條件下仍可以生長,同時在5%鹽度條件下仍可到達20%的芘降解率.
3.4 紅球菌DYC-1具有較廣的降解底物譜,可以降解低環PAHs菲、芴,可以降解代謝中間產物鄰苯二甲酸、水楊酸、鄰苯二酚,還可降解五環PAHs熒蒽,具有廣泛的降解潛力.
3.5 通過單因素搖瓶實驗,得到了菌株DYC-1的最優降解條件:菌株在低溫10℃,鹽度為2%的條件下,在pH值為8,初始濃度為20mg/L,搖床轉速為110r/min,接菌量為5%時,能達到35%以上的降解率.
[1] Hua F, Wang H. Uptake modes of octadecane by Pseudomonas, sp. DG 17and synthesis of biosurfactant [J]. Journal of Applied Microbiology, 2012,112(1):25—37.
[2] Mackay D, Shiu W Y, Ma K C. Illustrated handbook of physical-chemical properties and environmental fate for organic chemicals. Volume 5: pesticide chemicals.[M]// Illustrated handbook of physical-chemical properties and environmental fate for organic chemicals /. Lewis Publishers, 1992:551-552.
[3] 張 旭,李廣賀,黃 巍.包氣帶土層中石油污染物生物降解的溫度效應 [J]. 環境科學, 2001,22(4):108-110.
[4] 溫桂照,陳 敏.高效優勢混合菌降解廢水中的氯代芳香族化合物 [J]. 上海環境科學, 2000,(8):379-381.
[5] Whyte L G, Greer C W, Inniss W E. Assessment of the biodegradation potential of psychrotrophic microorganisms. [J]. Canadian Journal of Microbiology, 1996,42(2):99-106.
[6] Deppe U, RichnowH H, Michaelis W, et al. Degradation of crude oil by an arctic microbial consortium[J]. Extremophiles, 2005, 9(6):461-70.
[7] 宋立超,李培軍,劉 宛,等.鹽堿土壤PAHs降解菌的篩選鑒定及其降解特性 [J]. 微生物學通報, 2011,38(2):282-287.
[8] 張巧巧.芘降解菌株SE12的分離和鑒定及其降解效果研究[D]. 南京:南京農業大學, 2010.
[9] 布瑞德.伯杰氏系統細菌學手冊 [M]. 8版.中國:科學出版社(譯), 1984.
[10] 鐘 鳴,張佳慶,吳小霞,等.芘高效降解菌的分離鑒定及其降解特性 [J]. 應用生態學報, 2010,21:1334-1338.
[11] 鞏宗強,李培軍,王 新,等.芘在土壤中的共代謝降解研究 [J].應用生態學報, 2001,(3):447-450.
[12] 周 樂,盛下放.芘降解菌株的篩選及降解條件的研究 [J]. 農業環境科學學報, 2006,25(6):1504-1507.
[13] 溫 靜.天津濱海新區鹽堿地景觀生態化設計研究 [D]. 保定:河北農業大學, 2008.
[14] 王震宇,趙 建,李鋒民,等.鹽漬化土壤中土著菌的石油烴降解潛力研究 [J]. 農業環境科學學報, 2009,(7):1416-1421.
[15] D J Kushner. Life in high salt and solute concentrations: halophilic bacteria [J]. Microbial life in extreme environments, 1978:317-368.
[16] 韓言柱,王立成,許學工,等.黃河三角洲土壤(潮土)石油類含量對小麥的影響研究 [J]. 環境科學與技術, 2000,(4):1-4.
[17] 馬 靜.多環芳烴降解菌的篩選、降解機理及降解性能研究[D]. 大連:大連理工大學, 2013:144.
[18] 馬姍姍.一株芘高效降解菌的選育及降解特性、固定化研究[D]. 鎮江:江蘇科技大學, 2010,52.
[19] 姚治華,王紅旗,劉敬奇,等.石油污染土壤中苯降解菌的篩選及降解特性研究 [J]. 農業環境科學學報, 2006,(6):1498-1503.
[20] 楊 樂.石油降解菌群的構建及其生物修復研究 [D]. 石河子:石河子大學, 2008:77.
[21] 謝丹平,尹 華,彭 輝.石油降解菌株的分離及其降解特性研究 [J]. 上海環境科學, 2003,(12):951-954.
[22] 段燕青,岳秀萍,白凡玉,等.耐受重金屬的芘降解真菌的篩選及芘降解動力學研究 [J]. 環境工程學報, 2015,9(2):977-982.
[23] Patel J G, Kumar J I N, Kumar R N, et al. Enhancement of pyrene degradation efficacy of Synechocystis sp. by construction of an artificial microalgal-bacterial consortium[J]. Cogent Chemistry, 2015,1(1).
[24] 陸泗進,何立環,孫 聰.兩株高效芘降解菌對土壤中芘的降解研究 [J]. 環境科學與管理, 2013,38(5):47-51.
Isolation, identification and analysis of degradation ability of a cold-resistant haloduric pyrene-degrading strains.
DIAO Shuo, WANG Hong-qi*, XU Jie, ZHAO Yi-cun
(College of Water Sciences, Beijing Normal University, Beijing 100875, China). China Environmental Science, 2017,37(2):667~685
The community H and single-strain DYC-1 was isolated by timing quantitative culture and domestication method of adding the concentration of PAHs gradatimfromTianjin coastal wetland petroleumcontaminated soil under the lowtemperature condition. The community H and single-strain DYC-1used pyrene as solo carbon source for growth. The bacteria were identified as Rhodococcus sp. based on the BLAST sequence analysis of 16s rDNA and its morphological and physio-biochemcial characteristics. Analysis results showed that the degrading ability of single-strain DYC-1 was similar to community H under the lowtemperature condition. The degradation rate of themwas above 35% at high concentrations of pyrene. The single-strain DYC-1 had more salt-resisting ability and wide substrate degradation ability. The optimal degradation conditions of single-strain DYC-1 was 2% salinity, pH8, 10℃, 110r/min rotate speed and 5% capacity of bacteria. The degradation rate of pyrene was high with 20mg/L initial concentration in the optimal degradation conditions.
cold-resistant;haloduric;pyrene;degradation;bioremediation
X172
A
1000-6923(2016)02-0677-09
刁 碩(1992-),女,山東荷澤人,北京師范大學碩士研究生,從事污染土壤修復與治理研究.
2016-04-10
國家自然科學基金面上項目(41372232);國家高技術研究發展計劃(863)重大課題(2013AA 06A205);中國博士后科學基金第54批面上資助項目
* 責任作者, 教授, whongqi310@sohu.com

