一種適于本科實驗教學的雙向電泳技術體系
趙玉紅, 李 欣, 崔建林, 周 浩, 李登文,李小菊, 張金紅, 趙立青
(南開大學 a. 生物實驗教學中心; b. 醫學院, 天津 300071)
一種適于本科實驗教學的雙向電泳技術體系
趙玉紅a, 李 欣a, 崔建林b, 周 浩a, 李登文a,李小菊a, 張金紅a, 趙立青a
(南開大學 a. 生物實驗教學中心; b. 醫學院, 天津 300071)

雙向電泳技術是當前蛋白質組學研究中的重要技術。設計“雙向電泳檢測熱休克處理對細菌蛋白表達譜的影響”的實驗,以PGEX-4T-2大腸桿菌中可溶性總蛋白為研究對象, 采用雙向電泳技術篩選熱休克處理后有差異表達的蛋白。實驗獲得了穩定性較高、分辨率和重復性較好的電泳圖譜,建立了一種適于本科實驗教學的雙向電泳技術體系。通過該實驗,學生可以掌握雙向電泳技術的基本原理、實驗方法以及蛋白提取的一般思路與方法。
雙向電泳; 實驗教學; 熱休克; 細菌蛋白表達譜
0 引 言
20世紀90年代中期,蛋白質組學作為功能基因組學的重要支柱應運而生[1],特別在醫藥學領域,蛋白質組學是尋找人類疾病新的生物標志物和發現藥物治療新靶點的一種主要工具[2]。雙向電泳(Two-Dimensional Electrophoresis, 2-DE)作為蛋白質組學的核心技術之一,是目前唯一一種可以將數千種蛋白質同時分離的方法,可用于研究樣品中總蛋白、不同樣品蛋白質表達差異、蛋白質間相互作用、以及蛋白修飾等[3]。在目前發表的與蛋白組學研究相關的論文中, 有80% 以上的論文中涉及雙向電泳技術[4],因此,有必要在本科實驗教學中引入該項技術。
常規雙向電泳存在電泳時間長、系統產熱多、微量的蛋白質樣品極易擴散、不利于實驗結果的觀察等弊端。因此,建立實驗檢出的靈敏度高、電泳時間短、適合學生操作的雙向電泳條件非常必要[5]。
結合現代生物科學發展的需要,根據本科生實驗教學特點,設計“雙向電泳檢測熱休克處理對細菌蛋白表達譜的影響”的實驗,建立了一種適于本科實驗教學的雙向電泳技術體系。以PGEX-4T-2大腸桿菌總蛋白為研究對象,以37 ℃培養的大腸桿菌作為對照組,42 ℃熱休克處理的大腸桿菌作為實驗組,選擇7 cm、pH 3~10 IPG膠條,采用丙酮沉淀大腸桿菌中的總蛋白,上樣量為175 μg,進行雙向電泳。經電泳結果圖像掃描、PDQuest分析軟件分析,篩選差異表達蛋白。
1 主要實驗儀器
超聲破碎儀,酶標儀,Bio Rad雙向電泳系統(包括等點聚焦儀、GS-800光密度儀以及PDQuest分析軟件等),垂直板電泳設備(電源、電泳槽、制膠架等),高速冷凍離心機,搖床等。
2 實驗材料與試劑
(1) 實驗材料:大腸桿菌(E.coli,pGEX-4T-2)。
(2) 試劑:pH 3~10兩性電解質載體購自Bio Rad,BCA蛋白濃度測定試劑盒購自Solarbio,AP,TEMED,SDS,甘油,Tris,溴酚藍,甘氨酸購自sigma,尿素,CHAPS,DTT,碘乙酰胺,低熔點瓊脂糖等購自楠梓商貿有限公司,MilliQ水,其余試劑為國內分析純。
(3) 耗材:7cm,pH 3~10 IPG預制膠條購自GE、96孔酶標板。
3 實驗方法
3.1 大腸桿菌中可溶性總蛋白的提取與定量
(1) 熱休克處理:將活化的大腸桿菌接種至2瓶250 mL LB(Amp)培養基中,37 ℃培養過夜,2瓶細菌分別繼續培養37 ℃ 40 min、42 ℃ 40 min;
(2) 菌體蛋白提取及含量檢測:4 ℃,8 000 r/min離心5 min收集菌體,以預冷的50 mM pH 8.0 Tris-HCl重懸菌體至20 mL;低溫下超聲波裂解菌體,至懸浮液清亮(200 W,破5 s,停6 s,26個循環);4 ℃,12 000 r離心20 min,收集含可溶性蛋白的上清,分裝入2 mL離心管中,每管0.5 mL;加入3倍體積-20 ℃預冷丙酮(0.5 mL菌體+1.5 mL丙酮),-20 ℃沉淀蛋白2 h(沉淀等體積的兩管蛋白,其中一管用于測定蛋白質濃度);12 000 r/min,4℃,30 min收集蛋白,棄上清。冷丙酮洗沉淀2次,-20 ℃保存備用。按照試劑盒使用說明書,測定樣品蛋白含量。
3.2 雙向電泳
(1) 第一向等電聚焦電泳(IEF)。蛋白沉淀溶于水化上樣緩沖液(8 M尿素、4 % CHAPS、65 mM DTT、0.2 % Bio-Lyte、0.001 %溴酚藍),終濃度為1.4 mg/ml,上樣量175 μg。膠條加1.5 mL礦物油覆蓋。設置等電聚焦程序:18 ℃被動水化12 h;250 V(線性)30 min;500 V(快速)30 min;4 000 V(線性)3 h;4 000 V(快速)20 000 h;500 V(快速),任意時間。
(2) 膠條平衡。聚焦好的膠條先后加入2.5 mL平衡緩沖液I(6 M尿素、0.2 % SDS、0.375 M pH 8.8 Tris-HCl、20 %甘油、2 % DTT)和2.5 mL平衡緩沖液II(6 M尿素、0.2 % SDS、0.375 M pH 8.8 Tris-HCl、20 %甘油、2.5 % DTT),分別平衡15 min。平衡后的膠條浸沒在1×TAE電泳緩沖液中。
(3) 第二向SDS-PAGE電泳。配制12 %的分離膠,膠厚1 mm。將平衡好的膠條轉移至SDS—PAGE膠,用0.5 %低熔點瓊脂糖封膠液(0.5 %低熔點瓊脂糖、25 mM Tris、 192 mM甘氨酸、0.1% SDS、 0.001 %溴酚藍)封閉。將凝膠轉移至電泳槽中,加入電泳緩沖液(25 mM Tris,200 mM Gly,0.1 % SDS),接通電源,初始設置低電流(5mA/gel/17cm)或低電壓,待樣品在完全走出IPG膠條,濃縮成一條線后,加大電流(或電壓)(20~30 mA/gel/17cm),待溴酚藍指示劑達到底部邊緣時停止電泳。電泳結束后,取出凝膠,切角以標記正負極;0.25%考馬斯亮蘭R250染液(考馬斯亮藍R250 2.5 g,無水乙醇250 mL,冰乙酸80 mL,水670 mL)室溫染色20 min;用水漂洗凝膠,微波爐水煮15 min,2~3次。加入脫色液(7.5 %冰乙酸,5%甲醇)脫色過夜,至獲得清晰蛋白點。
3.3 電泳結果掃描、PDQuest8.0 軟件分析電泳結果
電泳結束后,用GS-800圖像掃描儀對凝膠進行掃描,掃描方式為透射。PDQuest8.0分析軟件進行圖譜分析。
4 結果與討論
4.1 實驗結果
采用超聲破碎法進行細胞破壁,利用丙酮沉淀大腸桿菌中總蛋白,選擇7 cm、 pH 3-10 IPG預制膠條,上樣量為175 μg,進行雙向電泳,結果如圖1、2所示。從圖1、2中可以看出,通過該雙向電泳體系能夠獲得穩定性較高、分辨率和重復性較好的電泳圖譜。經PDQuest8.0分析軟件初步分析,37℃培養的大腸桿菌對照組和42℃熱休克處理的大腸桿菌實驗組分別檢測到500多個清晰的蛋白點,未篩選出有明顯表達差異的蛋白點。
4.2 注意事項
(1) 超聲破碎過程中會產生大量的熱,因此整個過程必須冰上操作且間歇處理;
(2) 本實驗采用BCA法對蛋白進行定量。蛋白用丙酮沉淀吹干后,往往難以完全溶解在PBS中,定量前離心處理會有效降低實驗誤差;

圖1 對照組(37℃培養的大腸桿菌)總蛋白雙向電泳圖譜
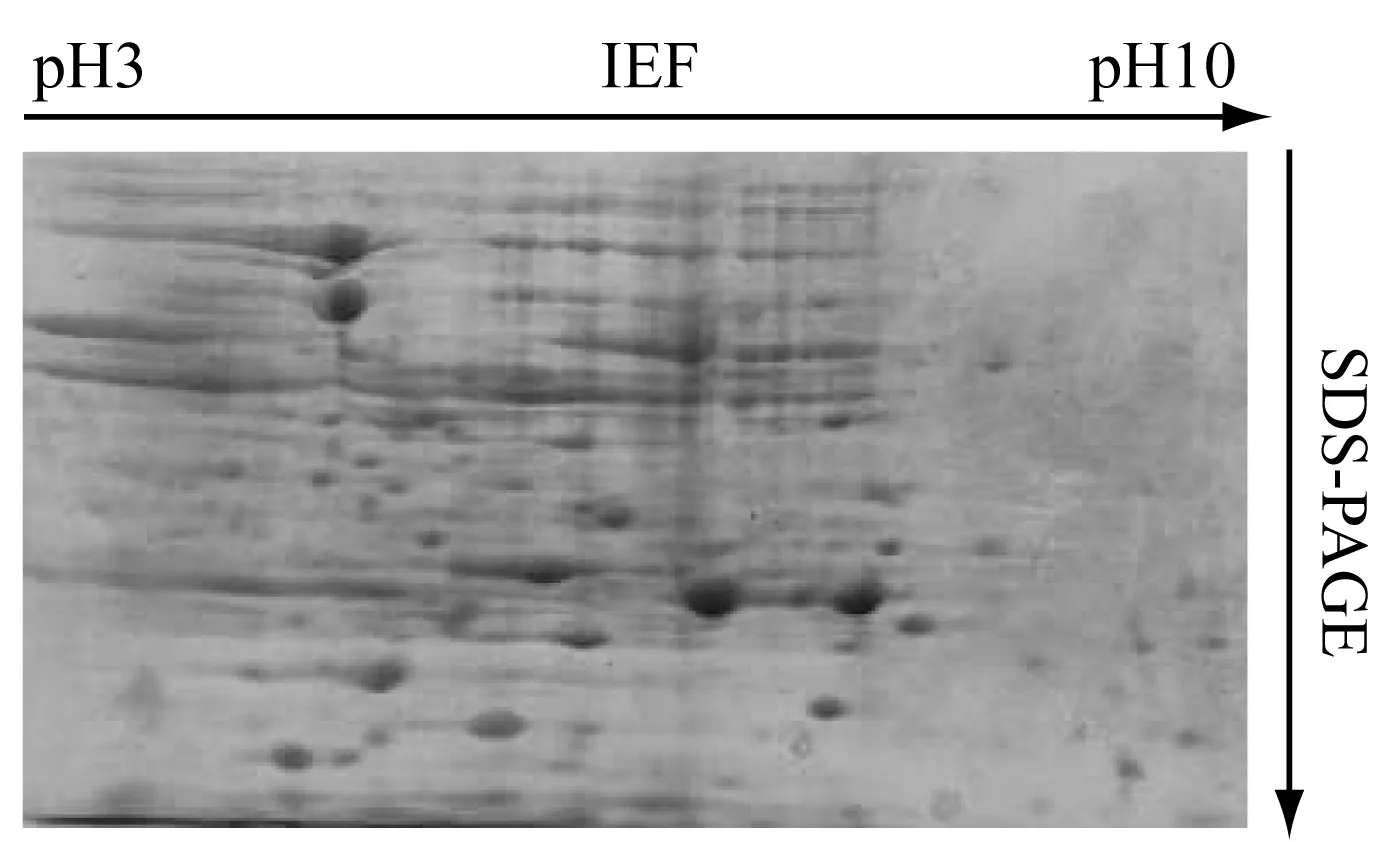
圖2 實驗組(42℃熱休克處理的大腸桿菌)總蛋白雙向電泳圖譜
(3)蛋白樣品易溶于水化上樣緩沖液,但為防止少量未溶蛋白對等點聚焦及SDS-PAGE電泳的影響,離心后再上樣;加樣時注意不要產生氣泡,否則影響到膠條中蛋白質的分布。
(4) 兩性電解質載體所形成的pH梯度的穩定性對電泳結果的穩定性和可重復性有非常重要的影響[6],本實驗所使用的兩性電解質載體購自Bio Rad,效果優于國產試劑;
(5) 灌制SDS-PAGE膠時,膠面一定要平,否則第一向的膠條不能很好的和膠面接觸,影響電泳效果[7]。經驗做法:TEMED量不要太多,以30min左右能凝最好;灌膠以水封膠面后,稍微水平搖晃一下,置于水平桌面待其自然凝固。
4.3 討論
(1) 課程組織。本實驗適于以綜合實驗的形式開設,進度宜安排24學時,小班授課。第一天進行蛋白樣品的制備與定量以及第一向等點聚焦電泳;第二天配制分離膠,進行第二向電泳,染色、脫色;第三天電泳結果掃描及圖像分析。實驗以單人操作的形式為主,每人一根膠條。按照人數,將學生劃分為對照組和實驗組,組間的結果作為平行實驗結果參考。
(2) 染色。不同的凝膠染色方法對雙向電泳成像效果以及蛋白質點的檢測有很大影響[8]。實驗室常用的染色方法主要有考馬斯亮藍染色和銀染。考馬斯亮藍染色靈敏度雖然遠低于銀染,但考馬斯亮藍染色過程簡單, 操作簡便,染色后的背景及對比度好[9-11]。故本實驗采用考馬斯亮藍R-250染色,結果表明獲得的可辨別的蛋白點也很多,可以滿足一般的實驗教學。
(3) 圖像分析。圖像分析是2-DE中十分重要的一步,其作用是評價和量化電泳結果。只有較為精確地對蛋白點進行識別、對比、定量,才可能有效地分析各組凝膠上的蛋白數據,從而得到有意義的生物學信息[12]。為了使學生更好地掌握分析軟件的使用,通常以Bio Rad廠家提供的2-DE圖譜作為范例講解,包括圖像優化、點檢測、點匹配、手動校正、結果報告等,然后由學生對自己的實驗結果做出分析。通常選取對照組和實驗組中蛋白點最清晰、橫豎紋及拖尾相對少的圖譜進行分析和比較。
5 結 語
本文建立了一種適于本科實驗教學的雙向電泳技術體系,優點如下:① 蛋白樣品取材方便。本實驗選取的材料是大腸桿菌,很容易獲得且生長速度快,易于根據實驗目的擴大培養。② 制備方法簡單有效。在雙向電泳技術中,樣品制備是整個分離過程中的關鍵一步,對實驗結果將起到決定性作用,如果樣品制備過程出現問題將直接影響2-DE的結果與分析[13-16]。對于不同的實驗材料、實驗室條件以及實驗目的,采用不同的樣品處理方法。本實驗的研究對象是大腸桿菌中的全部水溶性蛋白,菌體超聲破碎離心后,上清直接用丙酮沉淀,實驗方法簡單,蛋白丟失相對較少。③ 可獲得穩定性較高、分辨率和重復性較好的2-DE圖譜。雙向電泳實驗中很多因素都可能影響到最終的實驗結果,本實驗一方面對學生的動手操作提出了很高的要求,另一方面需要學生綜合運用所學知識來分析解釋復雜的實驗結果,有助于提高學生的實驗技能和綜合素質。④ 利用簡單的熱休克處理手段,加深學生理解雙向電泳技術在蛋白質組學研究中的應用。
[1] 蔡 侖.植物生物信息學:從基因組到表型組[J].生物技術世界,2005(4):44-47.
[2] Omenn G S.Strategies for plasma ptotemic profiling of cancers[J].Proteomics,2006(6):5662-5673.
[3] 李 倩,于 振,江 帆,等.雙向電泳技術在蛋白質組學中的應用[J].實驗室科學,2009(2):81-84.
[4] 阮松林,童建新,趙杭蘋.雙向電泳技術研究進展[J].杭州農業科技,2006(5):2-5.
[5] 侯 元,霍德勝,劉永茂. 雙向電泳實驗方法的改良[J].實驗室研究與探索,2010,29(12):31-33.
[6] 王經源,陳舒奕,梁義元,等.ISO-DALT雙向電泳方法的優化與改進[J].福建農林大學學報(自然科學版),2006,35(2):187-190.
[7] 王鳳茹.雙向電泳應注意的幾個關鍵問題[J].生物技術通報,2005(6):62-64.
[8] 秦 慧,劉 霆,柳 斌,等.幾種雙向凝膠電泳蛋白質檢測方法的比較[J].中國實驗血液學雜志,2006,14(1):168-172.
[9] 趙紹輝,周景文,堵國成,等.釀酒酵母蛋白質雙向電泳條件優化及圖譜建立[J].食品與生物技術學報,2014,33(3):235-239.
[10] 王英超,黨 源,李曉艷,等.蛋白質組學及其技術進展[J].生物技術通訊,2010,21(1):139-143.
[11] 劉 佳,歐陽津.雙向電泳檢測技術綜述[J].首都師范大學學報(自然科學版),2007,28(6):42-44.
[12] 李 赫,鄒黎明.雙向電泳圖譜的圖像分析技術進展[J].沈陽醫學院學報,2006,8(1):74-76.
[13] 談旭翡,陳 智.蛋白質組學研究中雙向電泳的樣品制備[J].醫學分子生物學雜志,2008(5):462-465.
[14] 尹燕霞,趙長云,劉照蓬,等.大腸桿菌可溶性蛋白質雙向電泳條件的建立[J].中國現代教育裝備,2010(5):97-99.
[15] 張 潔,孫一凡,張 荻,等. 百子蓮莖尖分生組織蛋白雙向電泳體系的建立[J]. 上海交通大學學報(農業科學版),2015,33(3):43-51.
[16] 郭佳林,李 政,張改生,等. 多子房小麥蛋白質雙向電泳體系的建立及優化[J].中國生物化學與分子生物學學報,2015,31(9):999-1007.
Establishment of a Convenient Two-Dimensional Electrophoresis Technique in Undergraduate Experimental Teaching
ZHAOYu-honga,LIXina,CUIJian-linb,ZHOUHaoa,LIDeng-wena,LIXiao-jua,ZHANGJin-honga,ZHAOLi-qinga
(a. Biological Experimental Center; b. College of Medicine, Nankai University, Tianjin 300071, China)
Two-dimensional electrophoresis (2-DE) is an important technology in proteomics research. The experiment of the effect of heat shock treatment on the expression profile of bacterial protein was designed to provide undergraduate an experiment for 2-DE technique. The soluble proteins from Escherichia coli was studied by 2-DE. The higher stability and resolution repeatability 2-DE maps were obtained. Through this experiment, students can master the basic principle, experiment method of 2-DE and the general idea of protein extraction.
two-dimensional electrophoresis; experimental teaching; heat shock; expression profile of bacterial protein
2016-01-28
國家基礎學科人才培養基金“條件建設項目”(J1310003);南開大學2014年教學改革項目
趙玉紅(1981-),女,山東青島人,碩士,實驗師,從事生物化學和分子生物學實驗教學工作。
Tel.:13920242524; E-mail:zyh@mail.nankai.edu.cn
趙立青(1962-),女,云南洱源人,博士,教授,從事蛋白質結構與功能研究以及基于蛋白質結構的工程應用。
E-mail:lqzhao@nankai.edu.cn
G 642.0; Q 503
A
1006-7167(2017)01-0177-03

