微波輔助提取沙田柚囊衣中柚皮苷及其對抗氧化性的影響
李楠楠,馬亞琴,李申,張震
(西南大學 柑桔研究所,重慶,400712)
微波輔助提取沙田柚囊衣中柚皮苷及其對抗氧化性的影響
李楠楠,馬亞琴*,李申,張震
(西南大學 柑桔研究所,重慶,400712)
采用微波提取技術對沙田柚囊衣中柚皮苷的提取工藝進行優化,并對提取液的抗氧化活性進行分析。以單因素試驗為基礎,選取溶劑體積分數、微波功率和料液比3個因素,根據Box-Behnken Design中心組合設計原理進行響應面分析,建立柚皮苷得率的二次多項數學模型。得到提取柚皮苷的最佳工藝條件:提取溶劑為體積分數52%乙醇,微波功率587 W,料液比1∶20 (g∶mL),柚皮苷的提取量為15.581 0 mg/g。此外,根據DPPH法、FRAP法及ABTS法3種方法測定的提取液的抗氧化性表明,有效的微波處理能顯著影響提取物的抗氧化性。
沙田柚囊衣;柚皮苷;微波提取;抗氧化性
柚子是蕓香科植物柚的成熟果實,常見的有沙田柚、葡萄柚、蜜柚等多個品種[1]。目前,柚皮除少量加工成蜜餞類產品及藥用外,絕大多數沒有得到合理利用,一般直接作為垃圾處理,這不僅造成資源的浪費,還造成嚴重的環境污染[2]。國內外研究表明,柚皮中不僅含有豐富的營養成分如氨基酸、抗壞血酸、β-胡蘿卜素等[3-4],還含有多種生物活性成分,其中黃酮類、類檸檬苦素等含量甚至高于果實中的含量,因此具有極高的開發價值[5]。
研究顯示,柚皮中的主要活性成分為黃酮類物質[6],如柚皮苷、新橙皮素等,其中柚皮苷含量最高[7-8]。柚皮苷具有抗菌[9]、抗腫瘤[10-11]、改善局部微循環和營養供給等功效,還可用于防治心腦血管疾病[12-13]。但由于柚皮苷在人體內不能合成,因此天然柚皮苷的研究與開發受到研究人員的高度關注[14-15]。
目前,天然活性物質的高效綠色提取已成為提取技術的研究熱點和發展趨勢,最大限度地降低提取時間和節約能耗的同時,還應有效提高提取率。文獻資料顯示,柚皮苷的主要提取方法包括:溶劑提取法[15-17]、熱水提取法、堿提酸沉法[18]、微波輔助提取法[19]、超聲波輔助提取法[20]、超濾法等。微波提取技術具有快速、高效、綠色的工藝條件等優勢[21-22],已被廣泛應用于提取各種生物活性物質[23-26]。微波高效提取活性物質的機理在于微波能對植物組織細胞產生生物效應,其高能量使細胞內溫度升高,根據摩爾方程,溫度升高,細胞內壓力增大,當壓力大于細胞膜的承受力時,細胞立即破裂,釋放出內含物[27]。因此,加快了細胞內含物流出,大大降低提取時間,增強活性物質的抗氧化能力[28-29]。
因此,本文以重慶地區廣泛種植的成熟沙田柚(Shatian pomelo)為原料,微波輔助提取柚皮囊衣中的柚皮苷,并采用響應面設計優化柚皮囊衣中油皮苷的工藝條件,通過分析柚皮苷提取液抗氧化性的變化,綜合得到油皮苷的最佳提取工藝條件,以期為柚類副產物綜合利用的開發尋找有效途徑。
1 材料與方法
1.1 材料與試劑
沙田柚,采摘于西南大學柑桔研究所資源室;甲醇,乙醇,冰乙酸,均為分析純,均購于成都市科龍化工試劑廠;柚皮苷標準品,純度均為≥95.5%,購于Sigma公司。
1.2 試驗儀器與設備
HWC-3LA型微波提取設備,天水華圓制藥設備科技有限責任公司;高效液相色譜儀 Ultimate3000,戴安中國有限公司;電子分析天平FAZ004B,上海精密儀器有限公司;氮吹儀TTL-DCI,北京同泰聯科技發展有限公司;TU-1901 紫外可見分光光度計,北京普析通用儀器有限責任公司。
1.3 實驗方法
1.3.1 樣品制備
新鮮沙田柚去除柚子果皮表面的油胞層,取白囊衣,切成1 cm2大小的碎片,60 ℃恒溫箱烘干,粉碎機制得粉末(粒徑60目)備用。
1.3.2 柚皮苷含量的測定
采用高效液相色譜測定柚皮苷的含量。檢測條件[30]:Thermo Fisher色譜柱(5 μm,100 A,4.6 mm×250 mm),柱溫30 ℃,V(1%冰乙酸)∶V(甲醇)=68∶32,流速1.0 mL/min,進樣量20.0 μL,紫外檢測線283 nm下測定柚皮苷的峰面積,外標法定量測定。
標準曲線的繪制:標品用純甲醇定容進樣,將以上母液分別稀釋成不同的濃度,繪制標準曲線。標準曲線方程為:y=23.73x+9.017 2(式中y為柚皮苷標品的峰面積,x為柚皮苷標品的含量,R2=0.997 7)。
1.3.3 總酚含量的測定
以沒食子酸(GA)為對照品,參考HE等[31]采用的Folin-酚法對總酚含量進行測定,以GA當量表示樣品的總酚含量。GA標準曲線:y=0.103 9x+0.002 9(式中y為波長760 nm 處的吸光度,x為每克干樣所含微克當量沒食子酸,R2=0.999 5)。
1.3.4 不同微波參數對柚皮苷及總酚提取量的影響
1.3.4.1 單因素試驗
稱取1g囊衣粉末作為樣品,分別研究乙醇體積分數(0、20%、40%、60%、80、100%)、微波功率(200、300、400、500、600、700 W)、微波時間(1、2、4、6、8 min)和料液比(1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL),確定各因素的最佳條件。每組對照處理,將1 g樣品浸泡在蒸餾水中30 min,料液比為1∶30(g∶mL)。
1.3.4.2 響應面試驗
基于單因素試驗結果,選擇乙醇體積分數、微波功率、料液比為影響因素,并以A、B、C分別表示3個因素,以-1、0、1分別表示各因素的3個水平。采用Design Expert3因素3水平的Box-Behnken Design(BBD)試驗設計原理,研究響應值以及最佳變量的優化組合。試驗因素水平見表1。
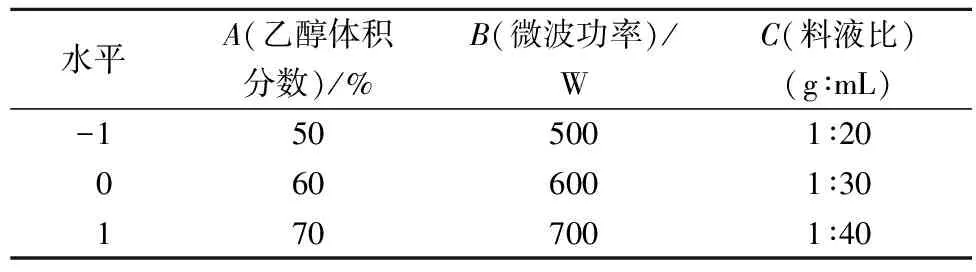
表1 微波輔助提取沙田柚囊衣中柚皮苷的工藝優化響應面分析因素水平表
1.3.5 不同微波參數對提取液抗氧化性的影響
1.3.5.1 FRAP法[32]
標準曲線:準確稱取0.05 g Trolox,用甲醇容易定容于25 mL的容量瓶。稀釋標準品濃度至0.1 mg/mL,用移液槍分別準確移取0、50、80、100、150、200 μL Trolox標準溶液于試管中,并加入4.9 mL FRAP試劑在暗室反應10 min,在593 nm處測定其最大吸收光值。
標準曲線方程為:y=0.023 5x+0.004(式中y為波長 593 nm 處的吸光度,x為每克干樣所含毫克當量Trolox,R2=0.998 6)。
樣品測定:0.1 mL的提取液與4.9 mL的FRAP工作液在暗室中充分反應10 min后,采用紫外分光光度計在593 nm處測定其最大吸收值,結果以每克干樣所含毫克當量Trolox來表示。
1.3.5.2 DPPH法[33]
標準曲線:配制不同濃度的Trolox溶液,加4 mL DPPH溶液,于517 nm下測吸光值,以吸光值的減少值與Trolox含量作標準曲線。標準曲線方程為:y=2.934x-0.367(式中y為DPPH自由基清除率,x為每克干樣所含微克當量Trolox,R2= 0.999 1)。
樣品測定:100 μL的提取液加入4 mL DPPH溶液,在暗室中靜置10 min,接著在517 nm測定其吸收值,結果以每克干樣所含毫克當量Trolox來表示。
1.3.5.3 ABTS法[34]
標準曲線:先配制140 mmol/L過硫酸鉀儲備液和7 mmol/L的ABTS儲備液,然后取過硫酸鉀溶液440 μL與ABTS溶液25 mL混合避光反應12~16 h,然后用乙醇稀釋ABTS溶液至吸光值為(0.7±0.002),準確稱取0.05 g Trolox,用甲醇容易定容于25mL的容量瓶。配制不同濃度梯度的Trolox溶液于試管中,加3.9 mL ABTS+溶液,于734 nm下測吸光值。標準曲線方程為:y=0.038 5x+0.002 3(式中y為ABTS+·清除率,x為每克干樣所含毫克當量Trolox,R2=0.999 1)。
樣品測定:取3.95 mL ABTS+溶液與50 μL提取液,混合均勻后反應10 min,于734 nm下測吸光值,結果以每克干樣所含毫克當量Trolox來表示。
1.4 統計分析
所有測得的實驗數據都以3個重復的“平均值±標準差”表示。數據處理采用Design-Expert 8.0,方差分析(ANOVA)通過SPSS 20.0.0完成,采用Duncan多元回歸方法分析了在0.05的水平上均值的顯著性差。
2 結果與分析
2.1 單因素試驗
2.1.1 乙醇體積分數對提取液中柚皮苷及總酚的影響
由圖1可知,在微波功率600 W、微波時間6 min,料液比1∶30(g∶mL)條件下,隨乙醇體積分數的增大,柚皮苷提取量增加,隨后增幅變緩,當乙醇體積分數為60%時,柚皮苷提取量達到14.28 mg/g,之后隨著乙醇體積分數的增大,柚皮苷提取量反而降低。提取液中總酚的提取量與柚皮苷提取量具有相同的趨勢,隨著乙醇體積分數的上升而增大,總酚溶解越徹底,當乙醇體積分數為60%時,總酚提取量達到392 μg/g,當乙醇體積分數大于80%時,總酚提取量呈顯著下降趨勢。與本實驗研究結果一樣,蔣志國等[35]在利用超聲-微波協同提取菠蘿蜜果皮中多酚類物質,乙醇體積分數對其得率的影響同樣呈先增大后減小的趨勢;XIAO等[36]利用微波輔助提取黃芪中黃酮,研究表明黃酮得率隨著乙醇體積分數顯著增加,當乙醇體積分數超過90%時迅速下降。柚皮苷溶于乙醇,乙醇體積分數越大,溶解越徹底,當乙醇體積分數達到80%,不再增加柚皮苷溶解度,乙醇體積分數增大則產生較大的滲透壓,影響柚皮苷的提取速度,同時高濃度的乙醇與液相中的柚皮苷發生反應,影響柚皮苷提取量,不利于柚皮苷的提取[36-38]。綜合分析選取提取溶劑為體積分數60%的乙醇。
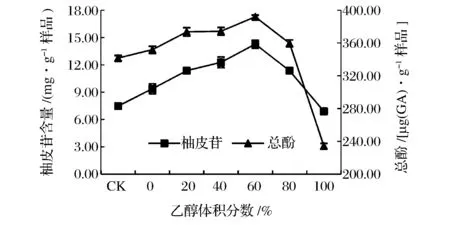
圖1 乙醇體積分數對沙田柚囊衣中柚皮苷及總酚提取量的影響Fig.1 Effect of ethanol concentration on the yield of naringin and total phenolics from Shatian pomelo white white layer.
2.1.2 微波功率對提取液中柚皮苷及總酚的影響
由圖2可知,因微波的破壁效應和熱效應,當微波功率增大時,柚皮苷提取量顯著增加(P<0.05)。在乙醇體積分數60%、微波時間6 min,料液比1∶30 (g∶mL)條件下,當微波功率達到600 W時,柚皮苷提取量達到17.79 mg/g,當微波功率的增大到700 W時,柚皮苷提取量迅速降低。提取液中總酚提取量隨著微波功率增大而增加,在超過600 W之后,微波功率過大造成內部溫度過高,導致酚類物質分解,總酚提取量下降。與CK相比較,在微波功率為600 W時的總酚提取量增加了14.73%。項昭保等[39]分別利用超聲波、微波在提取橄欖多酚的研究中,其功率的影響與本結果相似。由于微波功率的增加,物料吸收微波能導致內部升溫加劇,提取溶劑溫度升高引發內部壓力增大而導致細胞快速破裂[40],同時,微波所產生的電磁場加快了被提取組分由物料內部趨向提取溶劑界面的擴散速度,增強了柚皮苷溶解到提取溶劑的速率。隨微波功率的繼續增加,或會導致柚皮苷的分解。因此,在本研究中,選擇提取柚皮苷的最佳微波功率為600 W。
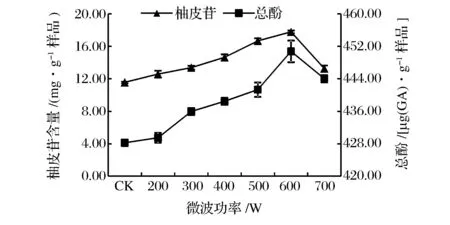
圖2 微波功率對沙田柚囊衣中柚皮苷及總酚提取量的影響Fig.2 Effect of microvave power on the yield of naringin and total phenolics from Shatian pomelo white white layer.
2.1.3 微波時間對提取液中柚皮苷及總酚的影響
由圖3可知,在乙醇體積分數60%,微波功率600 W,料液比1∶30(g∶mL)條件下,柚皮苷提取量隨著微波時間的延長而增加,當處理時間2 min時,柚皮苷提取量達到13.03 mg/g,繼續延長時間柚皮苷提取量反而下降。在微波電磁場,物質吸收微波能,細胞內部溫度迅速上升,高溫使其內部壓力超出細胞空間膨脹力,導致細胞破裂,細胞內有效成分快速溶解到介質中,從而提高了提取量。當提取量達到最大值之后,隨微波處理時間的延長,熱能急劇增加,高溫導致柚皮苷分子降解,最終造成柚皮苷含量下降[41]。綜合經濟效益和柚皮苷產量等因素,微波時間為2 min對柚皮苷的提取效果最好。
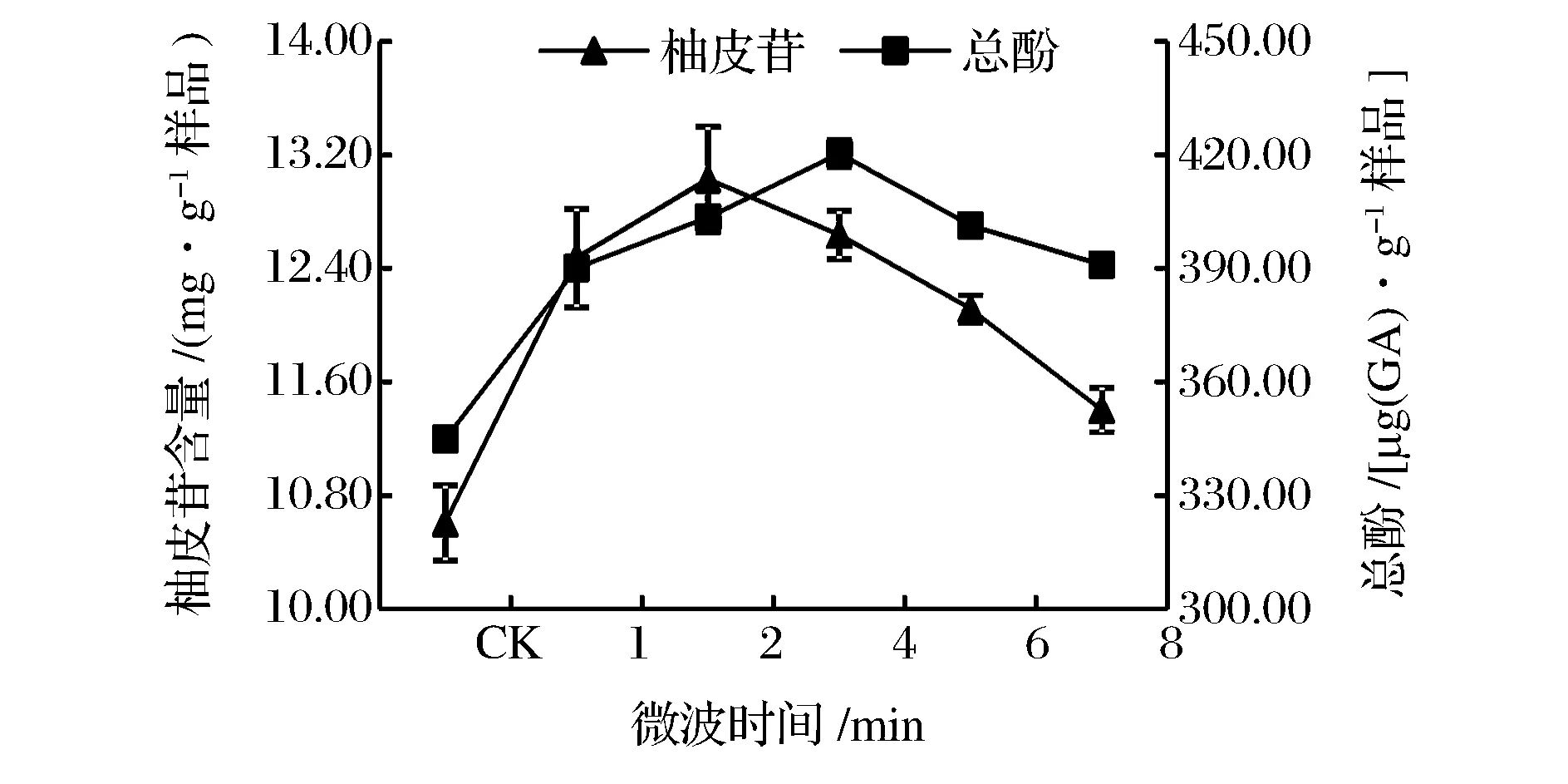
圖3 微波時間對沙田柚囊衣中柚皮苷及總酚提取量的影響Fig.3 Effect of microvave treatment time on the yield of naringin and total phenolics from Shatian pomelo white layer.
由圖3可知,隨著微波時間的延長,總酚提取量增加,在微波時間延長到4 min時,與CK相比較總酚含量增加了22%,總酚提取量達到420 μg/g,當微波時間超過6 min,總酚含量反而有所下降,可能是處理時間過長,溫度上升過高,對總酚成分有所破壞。
2.1.4 料液比對提取液中柚皮苷及總酚的影響
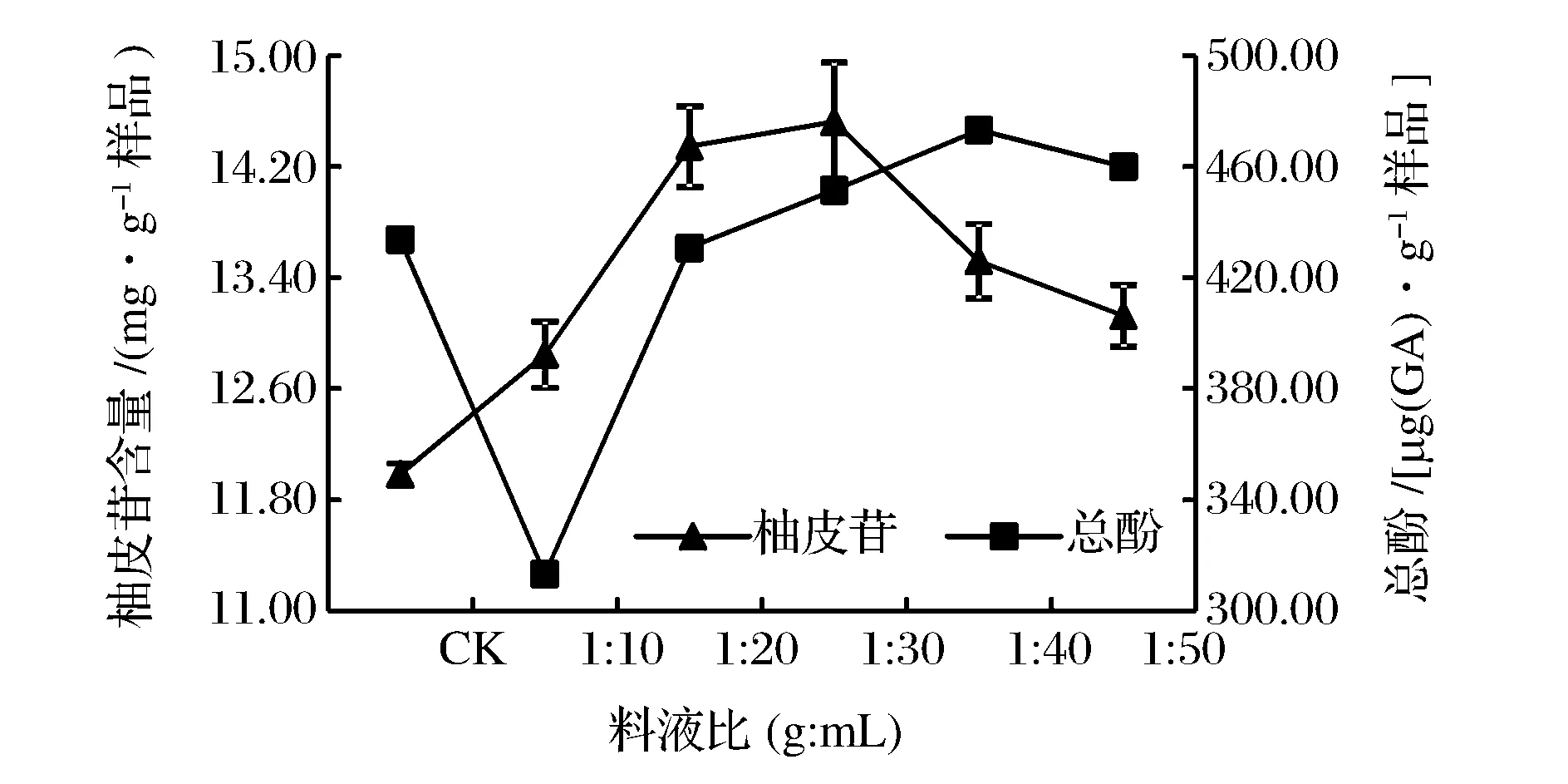
圖4 料液比對沙田柚囊衣中柚皮苷及總酚提取量的影響Fig.4 Effect of solid-to-solvent ratio on the yield of naringin and total phenolics from Shatian pomelo white layer.
由圖4可知,在乙醇體積分數60%,微波功率600 W,微波時間2 min條件下,隨著溶劑量的增加,樣品與溶劑接觸面增大,溶劑中溶質的濃度差和溶劑能夠溶解的物質的量不斷增大,使得柚皮苷提取量逐漸增大[42],當料液比超過1∶40(g∶mL)時,柚皮苷提取量呈下降趨勢。總酚物質在低料液比中因沒有全部溶解到提取溶劑中,造成提取溶劑中總酚提取量較低,之后隨著料液比增大,酚類物質溶于乙醇中直到飽和,乙醇過量造成酚類物質的濃度被稀釋,總酚提取量降低。焦士蓉等[43]利用微波提取柚皮黃酮類物質的研究與本實驗的結果相似;XIAO等[36]提取黃酮類化合物研究料液比對提取量的影響得出最佳料液比也是1∶30(g∶mL)。物料比較小不利于提取物的溶出,表現為低提取量;而物料比過大相對稀釋了提取物的濃度,提取量呈現下降趨勢。此外,料液比的增加同樣會加速物料中的其他成分溶解,進而影響柚皮苷的提取量[44]。因此,本研究選擇提取果膠的最佳料液比為1∶30(g∶mL)。
2.2 響應面試驗
綜合以上單因素試驗結果,選擇乙醇體積分數(A)、微波功率(B)、料液比(C)3個較優水平。以2分鐘為微波時間,確定3因素3水平的響應面分析法,柚皮苷提取量的提取結果見表2。表2所得的試驗數據進行二次回歸分析,得到以柚皮苷提取量為目標函數的二次回歸方程:
Y=15.19-0.59A-0.44B-0.59C+0.31AB-0.21AC-0.3BC-0.29A2-1.52B2-0.22C2
對該模型進行回歸方差分析,結果見表3。P<0.01,表明響應回歸模型達到極顯著水平。此外,R2=0.928 1,表明響應值柚皮苷提取量實際值與預測值之間具有較好的擬合度,該實驗方案是可行的。該模型的失擬項P>0.05,表明該模型合理。
表4表明回歸系數顯著性檢驗結果,該模型中的A、C均達到極顯著水平,B達到顯著水平;交互項均不顯著,二次項B2表現為極顯著。表明各因素對柚皮苷含量的影響不是簡單的線性關系。從各個因素的顯著性水平差異可知,對提取液中柚皮苷含量的影響次序為:乙醇體積分數=料液比>微波功率。
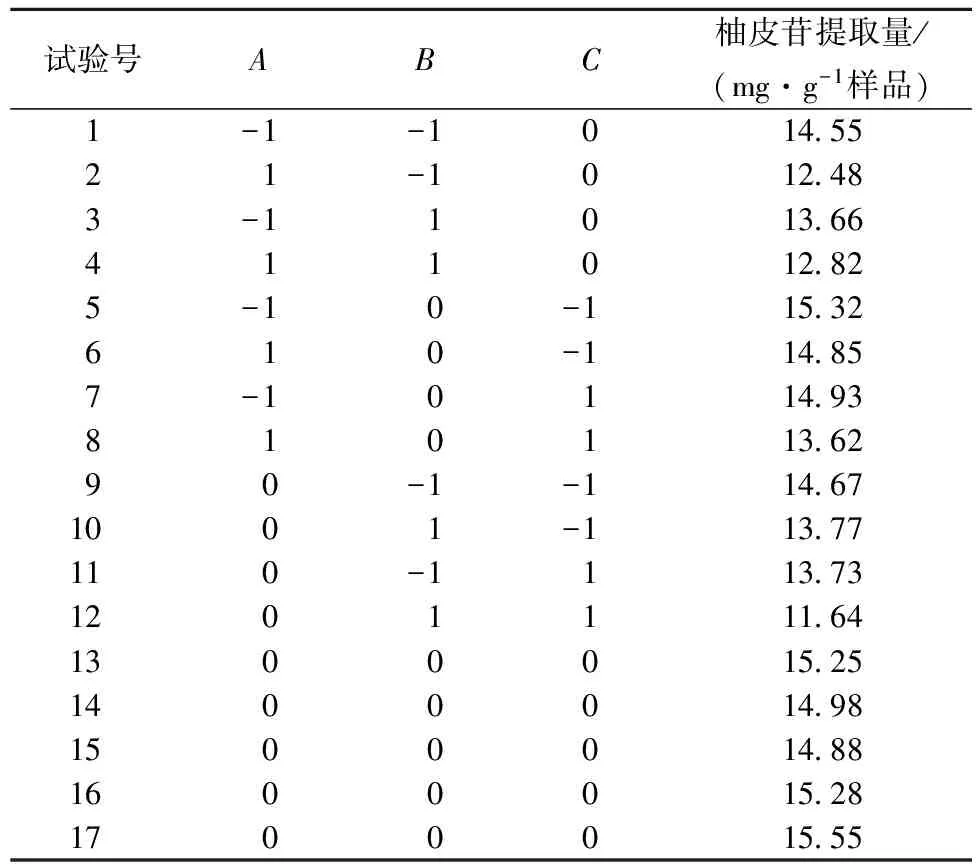
表2 微波輔助提取沙田柚囊衣中柚皮苷的工藝優化響應面試驗設計及結果
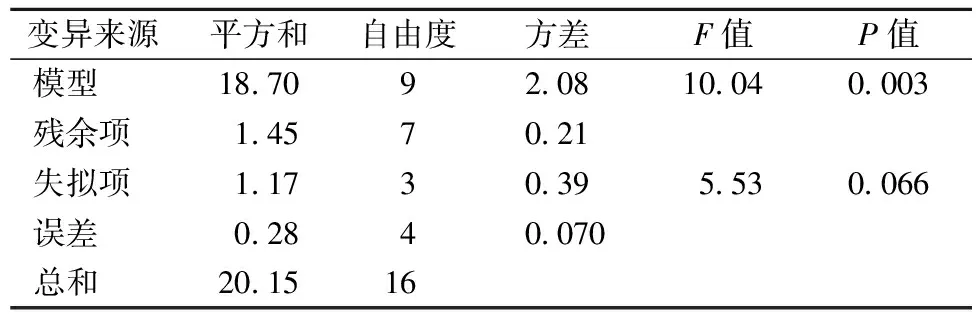
表3 回歸模型方差分析

表4 回歸系數及顯著性檢驗
注: *.顯著(P<0.05); **.極顯著(P<0.01)。
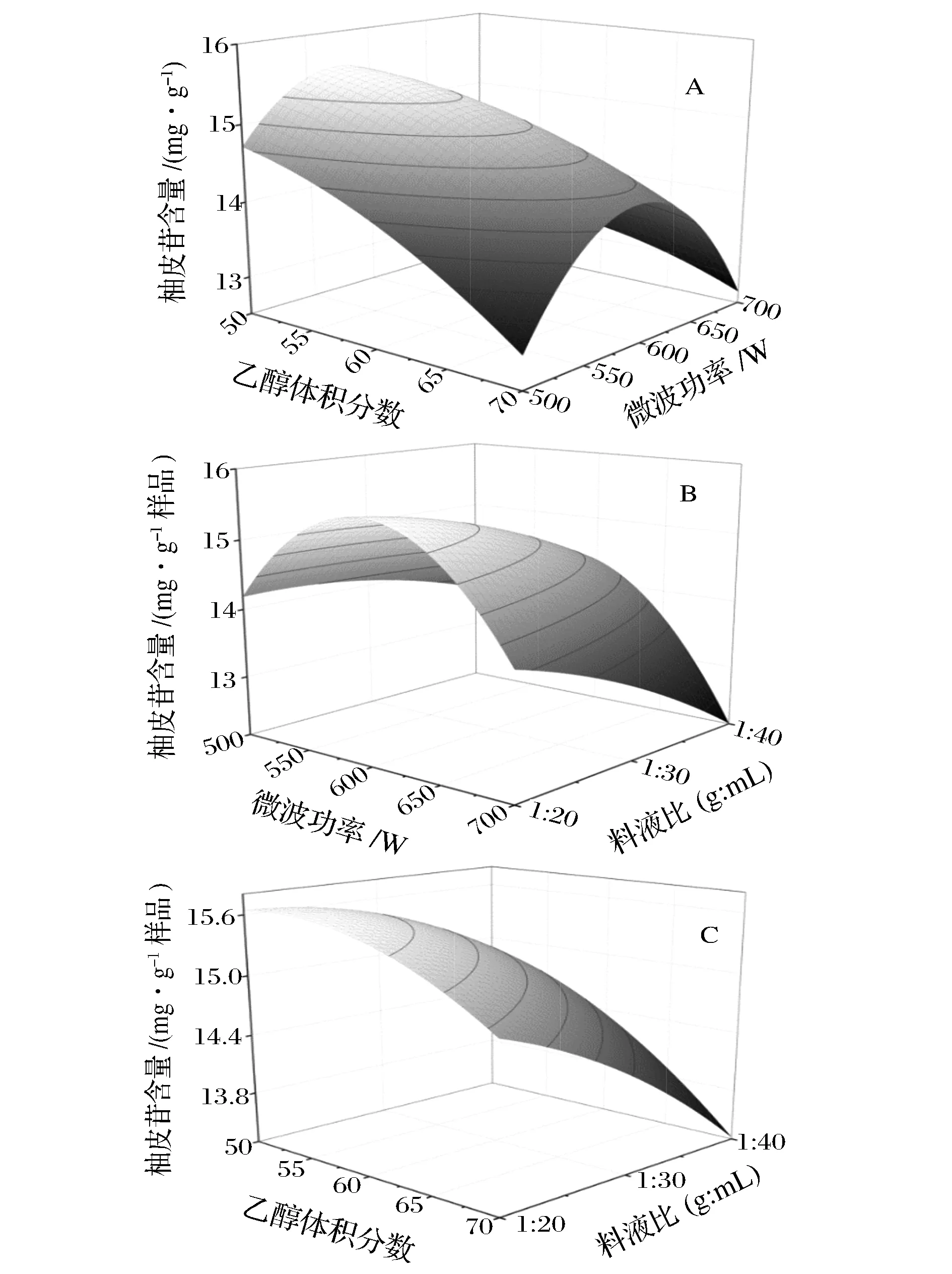
圖5 乙醇體積分數、微波功率和料液比對沙田柚囊衣中柚皮苷提取量影響的響應面圖Fig.5 Effect of response surface on: (A) microwave power level and ethanol concentration; (B) microwave power level and solid-to-solvent ratio; (C) ethanol concentration and solid-to-solvent ratioon naringin yield from Shatian pomelo white layer(注:固定水平:料液比1∶30(g∶mL);乙醇體積分數60%;微波功率600 W)
當響應曲面坡度比較平滑,說明響應值受各個變量變化的影響較小;相反,當響應曲面坡度較陡峭,則說明響應值受變量交互作用較為明顯。由圖5A可知,乙醇體積分數和微波功率對提取液中柚皮苷提取量均有顯著影響(P<0.05),隨著乙醇體積分數的變化,響應面曲面比較陡峭,但微波功率的變化引起響應面曲面的變化比較平坦。兩者的交互作用沒有達到顯著水平;由圖5B可知,微波功率的增大可能導致柚皮苷分子結構的破壞,使得提取液中柚皮苷提取量下降,從響應面曲線圖來看,料液比對柚皮苷提取量的影響較微波功率的影響顯著;由圖5C可知,乙醇體積分數對柚皮苷提取量的影響相對較弱,表現為曲線較為平滑,隨著料液比的變化,響應面曲線急劇陡峭,說明料液比對提取液中柚皮苷提取量的影響是顯著的。利用Design-Expert 8.0軟件分析,得出最佳微波提取柚皮苷的工藝條件為乙醇體積分數51.91%、微波功率586.75 W、料液比1∶20(g∶mL),提取3次,模型預測柚皮苷提取量15.685 7 mg/g。采用優化條件進行驗證實驗,為了便于在實驗中實際操作,將實驗條件修改為乙醇體積分數52% e、微波功率587 W、料液比1∶20(g∶mL),在最佳微波條件下進行3次重復實驗,柚皮苷提取量為15.581 6 mg/g。柚皮苷含量回歸模型的預測值和實驗所得到的實際值基本一致,說明本實驗采用響應面法對柚皮囊衣中柚皮苷的提取條件優化合理可行。
2.3 提取液抗氧化性分析
2.3.1 乙醇體積分數對提取液抗氧化性的影響
由圖6可知,隨著乙醇體積分數的增加,提取液的抗氧化能力增強,在乙醇體積分數為40%與60%之間時,提取液的抗氧化能力達到最強,之后隨著乙醇體積分數的增加抗氧化性減弱。
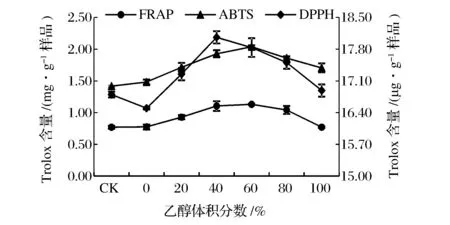
圖6 乙醇體積分數對提取液抗氧化性的影響Fig.6 Effect of ethanol concentration on antioxidant activities of extracts.(注:FRAP法和ABTS法在主坐標軸,DPPH法在次坐標軸)
2.3.2 微波功率對提取液抗氧化性的影響
由圖7可知,微波功率對提取液的抗氧化性的影響隨微波功率的增大,抗氧化性能逐漸增強,微波功率超過600 W時,抗氧化性能力呈現下降趨勢。
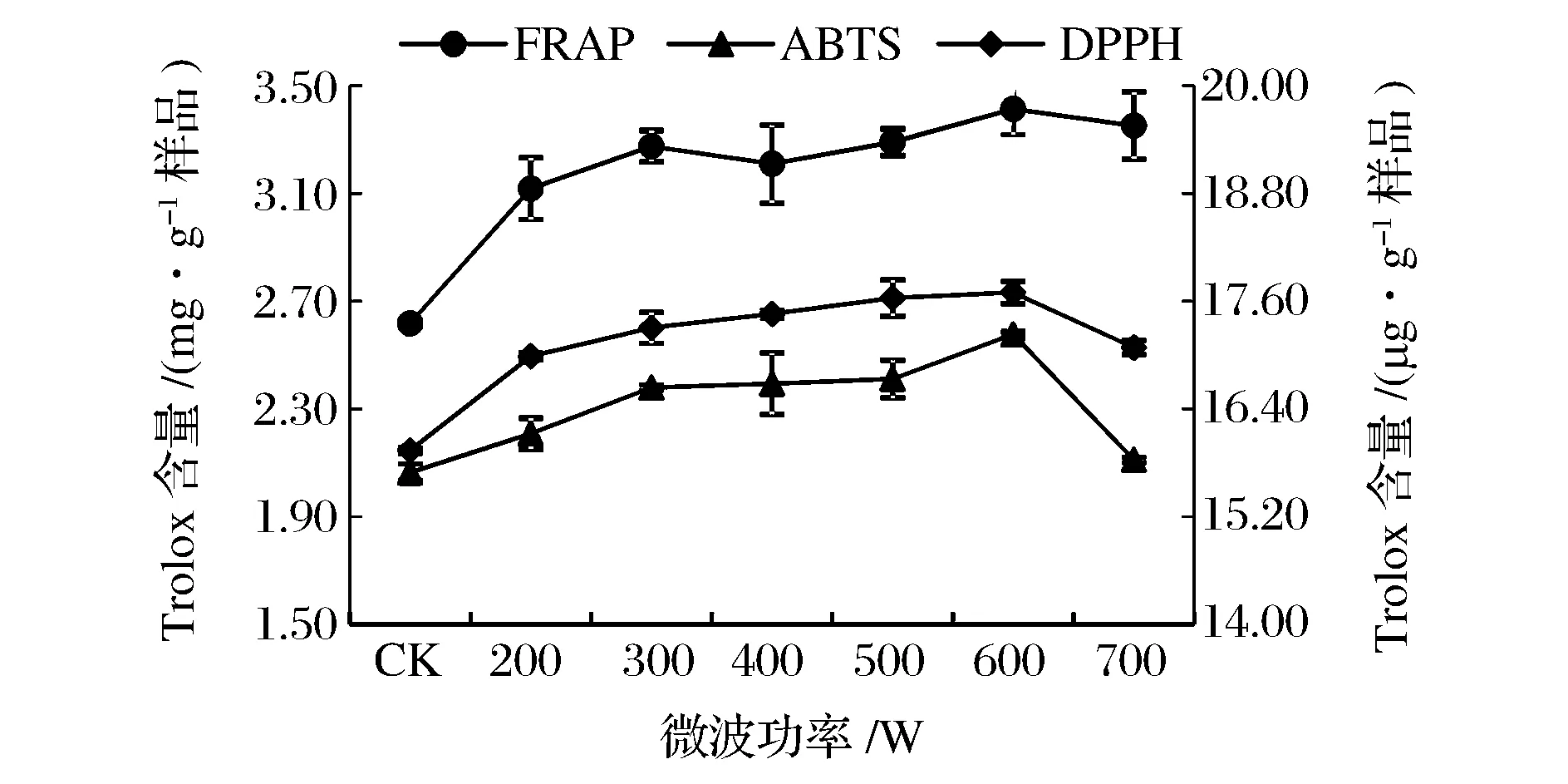
圖7 微波功率對提取液抗氧化性的影響Fig.7 Effect of microwave power on antioxidant activities of extracts.(注:FRAP法和ABTS法在主坐標軸,DPPH法在次坐標軸)
2.3.3 微波時間對提取液抗氧化性的影響
由圖8可知,微波處理組與對照組在抗氧化性上具有顯著性差異,但是不同時間的微波處理之間沒有顯著性差異,微波處理6 min后,FRAP法、DPPH法和ABTS法測定的抗氧化能力均有所下降。
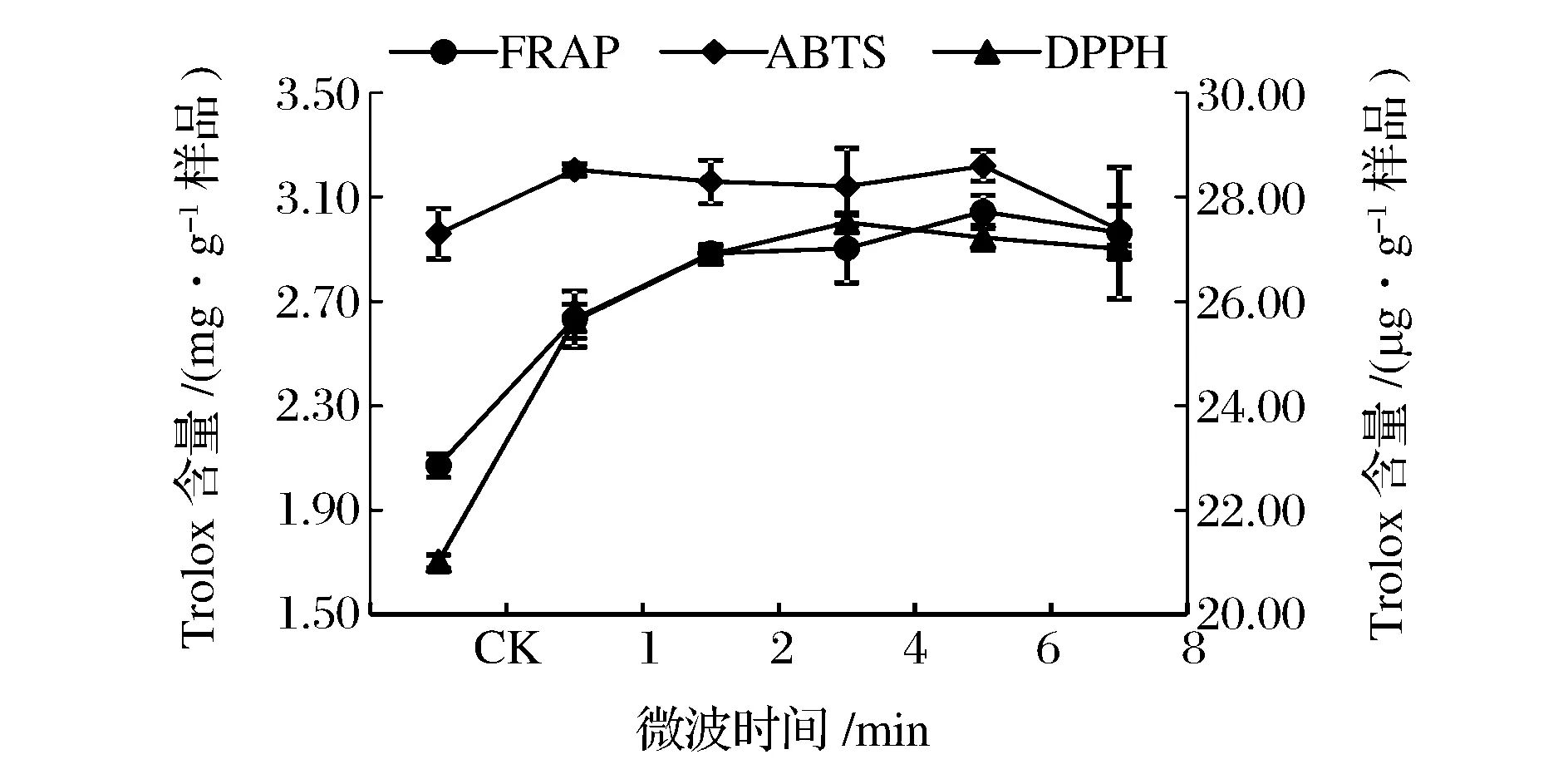
圖8 微波時間對提取液抗氧化性的影響Fig.8 Effect of microwave treatment time on antioxidant activities of extracts.(注:FRAP法和ABTS法在主坐標軸,DPPH法在次坐標軸)
2.3.4 料液比對提取液抗氧化性的影響
由圖9可得,因其測量抗氧化性的機理不同,導致在FRAP法、ABTS法、DPPH法的最大值在不同料液比上,并且FRAP法和ABTS法測出的Trolox提取量明顯高于DPPH法的。
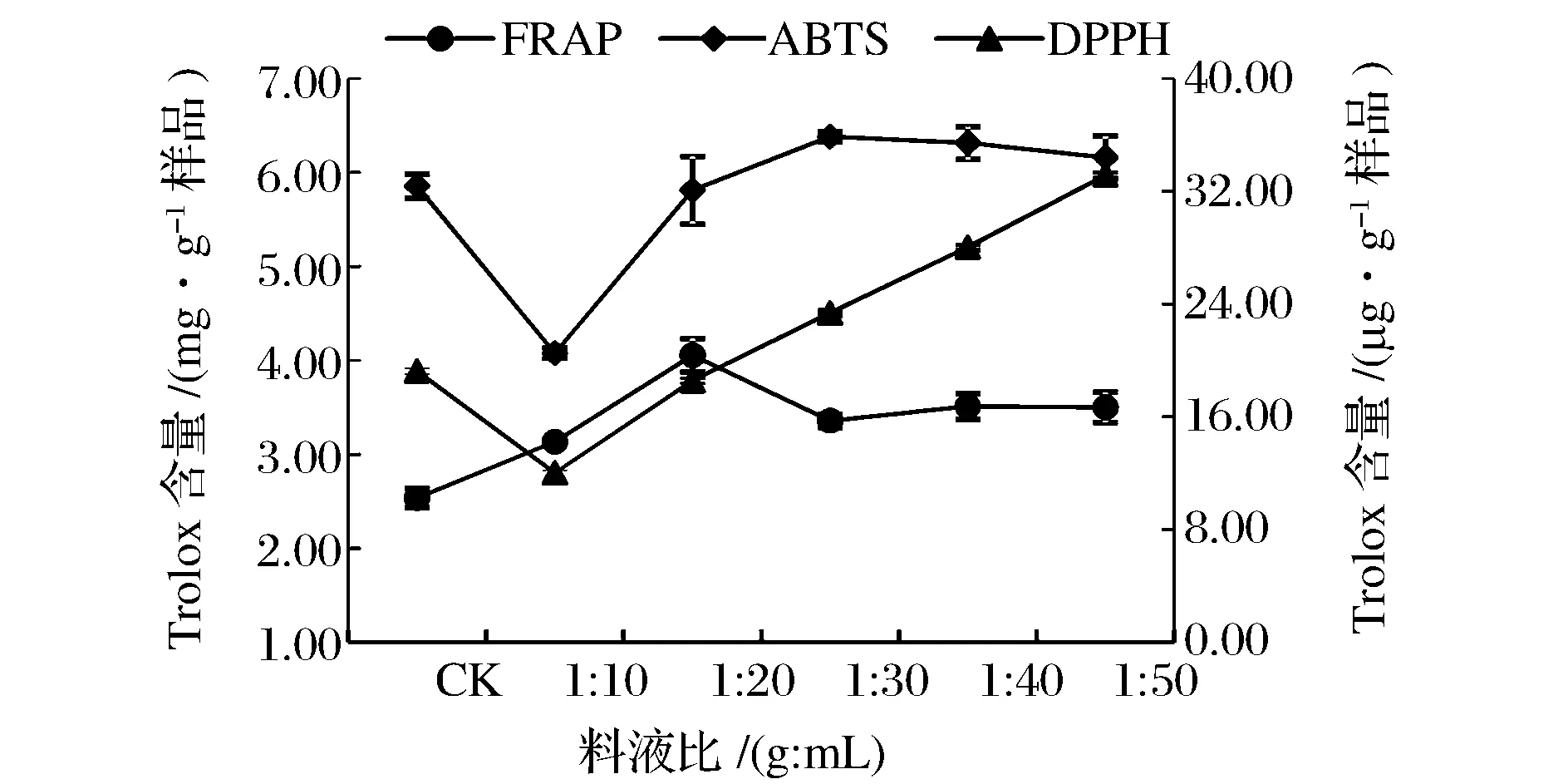
圖9 料液比對提取液抗氧化性的影響Fig.9 Effect of solid-to-solvent ratio on antioxidant activities of extracts.(注:FRAP法和ABTS法在主坐標軸,DPPH法在次坐標軸)
2.4 相關性分析
2.4.1 總酚提取量與抗氧化能力之間的相關性
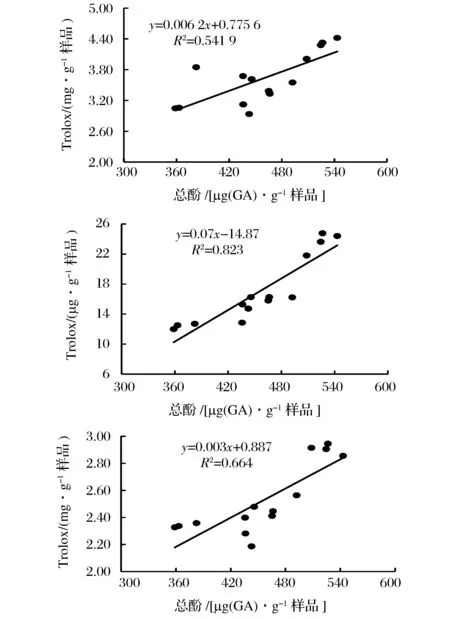
A:鐵離子還原力;B:DPPH自由基消除能力;C:ABTS自由基消除能力圖10 抗氧化活性與其總酚提取量的相關性Fig.10 Correlation between the antioxidant activities and phenolic content
從圖10可知,總酚提取量與Fe3+還原能力(R2=0.541 9,P<0.01)、DPPH·清除能力(R2=0.823 9,P<0.01)、ABTS+·清除能力(R2=0.664 4,P<0.01)存在著一定的線性關系,與總酚的相關性強弱分別是:DPPH法>ABTS法>FRAP法,這與以往的研究結論是一致的[45-46]。但是,孫丹[47]等研究苦蕎中總酚與DPPH·的清除能力、ABTS+·清除能力和鐵離子還原能力之間具有較強的相關性(r>0.95,P<0.01)。原料以及處理條件的不同,從而影響總酚的提取效果或是抗氧化能力結果,導致相關性的差異[48]。
2.4.2 各方法測定抗氧化能力之間的相關性
從圖11可知,各種方法測得的抗氧化活性之間存在著較強的線性關系,其中ABTS法與DPPH法之間存在著很強的線性相關關系,顯示酚類有較強的ABTS+·清除能力和Fe3+還原能力,這與以往的研究是一致的[49]。FRAP法與ABTS法之間也存在著較強的線性關系,但FRAP法與DPPH法之間的相關性較弱,其原因值得進一步研究,這與陳冠林等[50]的研究相一致。

圖11 FRAP、DPPH以及ABTS法測定的抗氧化能力之間的相關性Fig.11 Correlation between the antioxidant activities of FRAP, DPPH and ABTS assay
3 結論
本研究利用微波輔助提取沙田柚白囊衣中的柚皮苷,并對提取液的抗氧化性進行分析。在單因素的基礎之上,應用響應面法優化了白囊衣中柚皮苷提取的工藝參數,考慮到實驗的可行性以及效益等綜合因素,確定最佳工藝條件為乙醇體積分數52%、微波功率587 W、料液比1∶20(g∶mL),柚皮苷提取量為15.581 6 mg/g,在此微波條件下進行3次重復實驗,柚皮苷平均提取量為15.581 0 mg/g,與預測值基本吻合。各因素對響應值結果影響的主次關系依次為:乙醇體積分數=料液比>微波功率,且3因素對柚皮苷提取量的影響均到達顯著水平。應用微波輔助技術能有效地縮短提取時間、提高提取率。與此同時,將單因素方法得到的粗提取液進行抗氧化研究,結果表明,微波醇提取液總酚含量顯著增加,且抗氧化能力增強。說明采用微波技術提取天然產物,有利于提高天然產物的活性功能,為沙田柚及其柚類黃酮類物質的進一步開發利用提供了基礎參數。
[1] 鄧桂蘭, 魏強華, 劉冬梅. 柚子皮的綜合利用研究[J]. 食品工業, 2013,34(9):180-184.
[2] 周暉, 韓香云. 柚子皮吸附廢水中重金屬的研究[J]. 污染防治技術, 2013,26(2):11-15.
[3] 許鷺.柚皮中柚皮苷的提取、分離純化及其固體分散體與卵磷脂復合物的制備及表征[D]. 廣州:華南理工大學, 2015.
[4] LARSEN A K R, MOLLER M T N, Blankson H, et al. Naringin-sensitive phosphorylation of plectin, a cytoskeletal cross-linking protein, in isolated rat hepatocytes[J]. Journal of Biological Chemistry, 2002,277(38):34 826-34 835.
[5] 蔡文, 譚興和, 張喻, 等. 超聲波輔助提取柚子皮果膠的工藝優化[J]. 農產品加工(學刊), 2013,314(4):17-21.
[6] WANG Y, CHUANG Y, HSU H. The flavonoid, carotenoid and pectin content in peels of citrus cultivated in Taiwan[J]. Food Chemistry, 2008,106(1):277-284.
[7] 陽梅芳.柚子黃酮類物質提取、分離及生物特性研究[D]. 廣州:華南理工大學, 2013.
[8] WU T, GUAN Y, YE J. Determination of flavonoids and ascorbic acid in grapefruit peel and juice by capillary electrophoresis with electrochemical detection[J]. Food Chemistry, 2007,100(4):1 573-1 579.
[10] KANNO S, SHOUJI A, HIRATA R, et al. Effects of naringin on cytosine arabinoside (Ara-C)-induced cytotoxicity and apoptosis in P388 cells[J]. Life Sciences, 2004,75(3):353-365.
[11] DING X.Extracts of pomelo peels prevent high-fat diet-induced metabolic disorders in c57b1/6 mice through activating the PPARα and GLUT4pathway[BE/OL].[2013-11-16].http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0077915.
[12] HONG H J,JIN J Y,YANG H,et al. Dangyuja (Citrus grandis Osbeck) peel improves lipid profiles and alleviates hypertension in rats fed a high-fat diet[J]. Laboratory Animal Research,2010,26(4):361-367.
[13] TANG D M, ZHU C F, ZHONG S A, et al. Extraction of naringin from pomelo peels as dihydrochalcone's precursor[J]. Journal of Separation Science, 2011,34(1):113-117.
[14] 吳瓊英, 賈俊強. 柚皮黃酮的超聲輔助提取及其抗氧化性研究[J]. 食品科學, 2009,30(2):29-33.
[15] 周石磊, 王鴻飛, 杜潔雄. 柚皮中柚皮苷乙醇提取工藝研究[J]. 農業工程學報, 2006,22(7):184-187.
[16] 賈冬英, 姚開, 譚敏, 等. 柚皮中柚皮苷的乙醇提取工藝研究[J]. 中草藥, 2002,33(9):36-37.
[17] 許方馳, 潘思軼. 響應面分析琯溪蜜柚果皮中柚皮苷的醇提取工藝[J]. 食品工業科技, 2016,37(11):238-248.
[18] 游見明, 蘭江濤. 柑橘類柚皮苷提取工藝研究[J]. 現代食品科技, 2006,22(2):160-161.
[19] 蘇東林.柑桔皮中黃酮類物質的提取、分離及純化研究[D]. 長沙:湖南農業大學, 2007.
[20] 劉英, 但俊峰, 吳丹, 等. 柚皮中柚皮苷的超聲波輔助提取條件研究[J]. 西北農林科技大學學報(自然科學版), 2008(4):218-222.
[21] LI Y, SKOUROUMOUNIS G K, ELSEY G M, et al. Microwave-assistance provides very rapid and efficient extraction of grape seed polyphenols[J]. Food Chemistry, 2011,129(2):570-576.
[22] ZIGONEANU I G, WILLIAMS L, XU Z, et al. Determination of antioxidant components in rice bran oil extracted by microwave-assisted method[J]. Bioresource Technology, 2008,99(11):4 910-4 918.
[23] LI Y, SKOUROUMOUNIS G K, ELSEY G M, et al. Microwave-assistance provides very rapid and efficient extraction of grape seed polyphenols[J]. Food Chemistry, 2011,129(2):570-576.
[24] ZHANG H, ZHANG X, YANG X, et al. Microwave assisted extraction of flavonoids from cultivated Epimedium sagittatum: Extraction yield and mechanism, antioxidant activity and chemical composition[J]. Industrial Crops and Products, 2013,50(10):857-865.
[25] 劉學仁, 蔡品品, 姜濤, 等. 微波輔助提取枳殼中柚皮苷、新橙皮苷的工藝研究[J]. 中成藥, 2013(2):420-423.
[26] 王桂花, 周峰, 趙常青, 等. 微波輔助萃取枳殼中有效成分柚皮苷的研究[J]. 時珍國醫國藥, 2009(11):2 712-2 713.
[27] AHMAD J, LANGRISH T A G. Optimisation of total phenolic acids extraction from mandarin peels using microwave energy: The importance of the Maillard reaction[J]. Journal of Food Engineering, 2012,109(1):162-174.
[28] LIAZID A, SCHWARZ M, VARELA R M, et al. Evaluation of various extraction techniques for obtaining bioactive extracts from pine seeds[J]. Food and Bioproducts Processing, 2010,88(2):247-252.
[29] HAYAT K, HUSSAIN S, ABBAS S, et al. Optimized microwave-assisted extraction of phenolic acids from citrus mandarin peels and evaluation of antioxidant activity in vitro[J]. Separation And Purification Technology, 2009,70(1):63-70.
[30] 白小鳴, 曾小峰, 王華, 等. 響應面法優化超聲波輔助提取梁平柚果皮中柚皮苷工藝研究[J]. 西南師范大學學報(自然科學版), 2016,41(2):58-65.
[31] HE B, ZHANG L, YUE X, et al. Optimization of ultrasound-assisted extraction of phenolic compounds and anthocyanins from blueberry (Vacciniumashei) wine pomace[J]. Food Chemistry, 2016,204:70-76.
[32] 張文娟.柑橘幼果功能成分提取分析及抗氧化活性研究[D]. 杭州:浙江大學, 2015.
[33] SONG F, GAN R, ZHANG Y, et al. Total Phenolic Contents and Antioxidant Capacities of Selected Chinese Medicinal Plants[J]. International Journal of Molecular Sciences, 2010,11(6):2 362-2 372.
[34] ALMEIDA M M B, DE SOUSA P H M, ARRIAGAM C, et al. Bioactive compounds and antioxidant activity of fresh exotic fruits from northeastern Brazil[J]. Food Research International, 2011,44(7):2 155-2 159.
[35] 蔣志國, 李斌, 王燕華, 等. 菠蘿蜜果皮多酚超聲微波協同提取工藝優化及抗氧化活性研究[J]. 食品工業科技, 2016,37(2):270-275.
[36] XIAO W, HAN L, SHI B. Microwave-assisted extraction of flavonoids from Radix Astragali[J]. Separation & Purification Technology, 2008,62(3):614-618.
[37] HEMWIMON S, PAVASANT P, SHOTIPRUK A. Microwave-assisted extraction of antioxidative anthraquinones from roots of Morinda citrifolia[J]. Separation and Purification Technology, 2007,54(1):44-50.
[38] 楊秋明,李靖雅,肖安風,等.柚皮中柚皮苷和類檸檬苦素的提取及分離純化[J]. 集美大學學報(自然版),2015,20(6):414-420.
[39] 項昭保, 劉星宇. 響應面法優化超聲-微波協同輔助提取橄欖多酚工藝研究[J]. 食品工業科技, 2016,37(1):195-200.
[40] 馬亞琴, 吳厚玖, 周志欽, 等. 微波輔助提取柑橘鮮皮渣中果膠的工藝優化[J]. 食品科學, 2012,33(24):31-35.
[41] FRANCO-VEGA A, RAMREZ-CORONA N, PALOU E, et al. Estimation of mass transfer coefficients of the extraction process of essential oil from orange peel using microwave assisted extraction[J]. Journal of Food Engineering, 2016,170:136-143.
[42] 鄭玲利, 李燕, 黃玲, 等. 枸杞多糖的微波提取及抗氧化性分析[J]. 解放軍藥學學報, 2016,32(1):1-4.
[43] 焦士蓉, 鄭貴菊. 柚皮黃酮類物質的微波輔助提取及其抗氧化活性研究[J]. 食品與機械, 2007,23(1):73-75.
[44] 朱攀攀, 馬亞琴, 竇華亭, 等. 超聲處理條件對血橙皮渣中黃酮類物質的影響[J]. 食品與發酵工業, 2015,42(1):126-130.
[45] WAONG C, LI H, CHENG K, et al. A systematic survey of antioxidant activity of 30 Chinese medicinal plants using the ferric reducing antioxidant power assay[J]. Food Chemistry, 2006,97(4):705-711.
[46] ERSUS S, CAM M. Determination of organic acids, total phenolic content, and antioxidant capacity of sour Citrus aurantium fruits[J]. Chemistry of Natural Compounds, 2007,43(5):607-609.
[47] 孫丹, 黃士淇, 蔡圣寶. 不同加工方式對苦蕎中總酚、總黃酮及抗氧化性的影響[J]. 食品與發酵工業, 2016,42(1):141-147.
[48] 徐穎, 樊明濤, 冉軍艦, 等. 不同品種蘋果籽總酚含量與抗氧化相關性研究[J]. 食品科學, 2015,36(1):79-83.
[49] SONG F, GAN R, ZHANG Y, et al. Total phenolic contents and antioxidant capacities of selected chinese medicinal plants[J]. International Journal of Molecular Sciences, 2010,11(6):2 362-2 372.
[50] 陳冠林, 陳松根, 趙穎瑩, 等. 33種水果的總酚含量及其抗氧化能力研究[J]. 食品工業, 2014,35(9):264-268.
Effect of microwave-assisted extraction on the yield of naringin and antioxidant activities of extracts from Shatian pomelo white layer
LI Nan-nan, MA Ya-qin*, LI Shen, ZHANG Zhen
(Citrus Research Institute,Southwest University,Chongqing 400712,China)
Microwave-assisted extraction of naringin from Shatian pomelo white layer using was optimized by response surface methodology(RSM. The antioxidant activity of extracts were analyzed in vitro. On the basis of the single-factor experiment results, use extracting volume ratio, microwave power and solid-to-solvent ratio as the indexes, based on central composite experimental design of the Box-Behnken, a second order quadratic equation for extraction of naringin was established. The optimal extraction conditions for naringiin from Shatian pomelo white layer were: extraction solvent 52% aqueous ethanol; microwave power 587 W; solid-liquid ratio 1∶20 (g∶mL). Furthermore, the result indicated that appropriate microwave treatment can significantly influence antioxidant activities of extracts according to the results from DPPH, FRAP and ABTS.
Shatian pomelo white layer; naringin; microwave extraction; antioxidant activities
10.13995/j.cnki.11-1802/ts.201703046
碩士研究生(馬亞琴副研究員為通訊作者,E-mail:myaya211@163.com)。
國家現代農業柑橘產業技術體系(CARS-27-05B);中央高校基本科研業務費專項(XDJK2015B004)
2016-07-22,改回日期:2016-09-07

