Wnt 信號通路阻滯劑DKK-1對人結腸癌細胞HCT116侵襲能力的影響
張延新,張印坡,趙琰 ,王記紅 ,張艷, 崔東濤
(1漯河醫學高等專科學校,河南漯河462002;2漯河醫學高等專科學校第一附屬醫院)
Wnt 信號通路阻滯劑DKK-1對人結腸癌細胞HCT116侵襲能力的影響
張延新1,張印坡1,趙琰2,王記紅1,張艷1, 崔東濤1
(1漯河醫學高等專科學校,河南漯河462002;2漯河醫學高等專科學校第一附屬醫院)
目的 探討Wnt 信號通路阻滯劑DKK-1對人結腸癌細胞HCT116侵襲能力的影響及其分子機制。方法 將HCT116細胞隨機分為觀察組和對照組,分別給予DKK-1 100 ng/mL及等量細胞培養液繼續培養48 h。采用Transwell侵襲實驗觀測腫瘤細胞侵襲能力的變化,分別采用Western blot法、RT-PCR法檢測腫瘤細胞中Wnt 信號通路關鍵基因β-catenin、EMT調控因子Snail及上皮細胞標記物E-cadherin、間質細胞標記物Vimentin的蛋白及mRNA表達,結果 觀察組穿膜細胞數為(45.29±6.25)個/HP,低于對照組的(76.36±8.32) 個/HP,差異有統計學意義(P<0.05)。與對照組比較,觀察組HCT116細胞中β-catenin、Snail、Vimentin蛋白及mRNA表達水平均降低,E-cadherin蛋白及mRNA表達水平增高(P均<0.05)。結論 Wnt 信號通路阻滯劑DKK-1可能通過抑制腫瘤細胞上皮-間充質轉化過程,進而降低人結腸癌細胞HCT116的侵襲能力。
結腸癌;Wnt 信號通路;通路阻滯劑;上皮-間充質轉化;細胞侵襲
研究表明,上皮-間質轉化(EMT)是許多惡性腫瘤細胞獲得侵襲、轉移能力的重要機制[1~3],而Wnt信號通路在腫瘤細胞的EMT過程中發揮著重要作用[4]。本實驗將外源性Wnt 信號通路阻滯劑DKK-1作用于人結腸癌細胞HCT116,檢測細胞中Wnt 信號通路關鍵基因β-catenin、EMT調控因子Snail及上皮細胞標記物E-cadherin、間質細胞標記物Vimentin的蛋白及mRNA表達;采用Transwell法檢測細胞侵襲能力的改變,分析上述基因表達與腫瘤細胞侵襲能力變化間的關系,旨在為臨床進一步探討如何抑制結腸癌侵襲與轉移提供理論依據。
1 材料與方法
1.1 材料 人結腸癌細胞HCT116購自中科院上海細胞所,DKK-1購自Pepro Tech公司;兔抗人β-catenin抗體、Snail抗體、Vimentin抗體、E-cadherin抗體均購自Abcam公司,PCR擴增試劑盒購自北京全式金生物技術有限公司,RT-PCR引物由北京博大泰克生物技術有限公司完成設計、合成,Transwell小室購自Costar公司。
1.2 實驗方法
1.2.1 HCT116細胞培養與分組處理 將腫瘤細胞培養于DMEM培養基中,于37 ℃、50 mL/L CO2培養箱中培養;以2.5 g/L胰酶消化后繼續培養,收集對數生長期細胞用于實驗[5]。將細胞隨機分為觀察組和對照組,分別給予DKK-1 100 ng/mL及等量細胞培養液繼續培養48 h。
1.2.2 HCT116細胞侵襲能力觀察 采用Transwell 侵襲實驗。將Transwell小室放 24 孔板中,上室內加入以0.2% BSA 的無血清培養基 1∶5稀釋后的基質膠50 μL/孔,37 ℃溫箱過夜使膠凝固。使用前在上室加入 100 μL 含0.2% BSA 的無血清培養基,在下室加入 600 μL小鼠成纖維細胞NIH3T3的條件培養基[5],水化 30 min。將兩組腫瘤細胞在0.2%BSA無血清培養基孵育過夜,制成5×105/mL 細胞懸液。吸出小室的上層培養基,取細胞懸液 100 μL 加入上室,5% CO2、37 ℃的細胞培養箱內培養 24 h;常規蘇木素染色,400倍鏡下觀察。在每個濾膜上均隨機選取5個視野,計數全部視野穿膜細胞平均數,作為一個濾膜每視野下侵襲細胞數,實驗重復3次。
1.2.3 HCT116細胞中β-catenin、Snail、Vimentin、E-cadherin蛋白檢測 采用Western blot法。 吸去培養皿中的培養液,PBS漂洗后將腫瘤細胞刮下加到1.5 mL EP管中,以4 000 r/min離心3 min后收集細胞。加入200 μL裂解液冰上裂解60 min,4 ℃下以12 000 r/min離心30 min,取上清并測定蛋白濃度。將蛋白樣品變性后按60 μg/道上樣于10 % SDS-PAGE 凝膠,加入電泳緩沖液,120 mV電泳2.5 h,按常規電轉移步驟將蛋白轉至PVDF膜;經5 %的脫脂牛奶封閉1 h后,加入5% BSA/PBST緩沖液1∶1 000稀釋的兔抗人β-catenin、Snail抗體、Vimentin抗體、E-cadherin抗體,4 ℃孵育過夜;PBST漂洗3 次,每次5 min;加入5%的脫脂牛奶/PBST緩沖液稀釋的二抗(濃度為1∶10 000),室溫孵育1 h;PBST漂洗3次,每次5 min;ECL避光孵育2~3 min后,LAS-3000顯影曝光。采用凝膠圖像分析系統對各目標條帶進行掃描后并記錄其分子量及灰度值,計算各目標條帶與內參蛋白β-actin的灰度值之比,以此作為待測蛋白的相對表達量[6,7]。
1.2.4 HCT116細胞中β-catenin、Snail、Vimentin、E-cadherin mRNA檢測 采用RT-PCR法。根據Gene Bank收錄的基因序列,根據引物設計原則用Primer 6.0軟件設計,經BLAST比對,經過微機檢索與人類基因無同源性。由北京博大泰克生物技術有限公司合成,均進行硫代磷酸化修飾。引物序列見表1。

表1 RT-PCR引物序列
取兩組細胞,棄去培養板中培養基,PBS液洗滌,用TRIzol提取細胞總RNA,檢測總RNA純度、濃度和完整性,檢測合格后將 mRNA 逆轉錄為 cDNA。逆轉錄反應體系:總RNA 1.0 μg,Oligo(dT)18 μg(0.5 μg/μL),2×ES Reaction Mix 10 μL,EasyScript RT 1 μL,補DEPC水至30 μL。42 ℃反應30 min,99 ℃滅活5 min,4 ℃ 5 min,置于-20 ℃備用。取2 μL用于PCR擴增反應,反應體系:CDNA 2 μL,上下游引物(10 μmol/L)各1 μL,10×Easy Tag Buffer(Mg2+) 5 μL,2.5 mmol/L dNTPs 4 μL,Easy Tag DNA Polymerase 0.5 μL,補雙蒸水至20 μL。反應條件:95 ℃預變性10 min,1個循環;94 ℃變性30 s,55 ℃退火30s(引物不同退火溫度不同),72 ℃延伸2 min,共40個循環;72 ℃總延伸6 min。陰性對照用無RNA酶的水代替cDNA進行反應。取5 μL擴增產物與緩沖液混合后,加入含2%瓊脂糖凝膠(0.5 μg/mL EB)的加樣孔中,電壓4~10 V/cm條件下進行電泳。采用D-140圖像分析系統進行記錄及分析,Quantity One軟件分析,目的基因表達量以目的基因的DNA條帶和β-actin 的DNA條帶灰度值比值表示[8]。
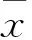
2 結果
2.1 兩組HCT116細胞侵襲能力比較 觀察組穿膜細胞數為(45.29±6.25)個/HP,明顯低于對照組的(76.36±8.32) 個/HP(P<0.05)。
2.2 兩組HCT116細胞β-catenin、Snail、Vimentin、E-cadherin蛋白表達比較 見表1。

表1 兩組HCT116細胞中β-catenin、Snail、Vimentin、E-cadherin蛋白表達比較
注:與對照組比較,*P<0.05。
2.3 兩組HCT116細胞β-catenin、Snail、Vimentin、E-cadherin mRNA表達比較 見表2。

表2 兩組HCT116細胞中β-catenin、Snail、Vimentin、E-cadherin mRNA表達比較
注:與對照組比較,*P<0.05。
3 討論
結腸癌是常見的惡性腫瘤之一,多數患者就診時已發生腫瘤細胞的侵襲和轉移,這也是影響患者臨床治療效果、生存率及生活質量的重要因素,因而研究結腸癌的侵襲和轉移有重要的臨床應用價值。
EMT被認為是許多惡性腫瘤細胞獲得侵襲與轉移能力的重要機制[1~3],而β-catenin依賴的經典Wnt信號通路在腫瘤細胞的EMT過程中發揮著重要的作用[4]。Wnt 蛋白分子與胞膜相應受體結合后,β-catenin磷酸化降解受抑,在胞質內逐漸堆積[9,10],并影響相關基因的轉錄;導致上皮源性細胞逐漸失去上皮樣表型,細胞極性消失,細胞間的緊密連接減少,而間質樣表型逐漸增強,遷移、游走能力增強,即發生EMT[11]。這對惡性腫瘤細胞而言,侵襲能力增強。研究表明作為EMT調控因子,Snail參與了多種惡性腫瘤的侵襲與轉移。
本實驗將外源性Wnt 信號通路阻滯劑DKK-1作用于人結腸癌細胞HCT116,采用Transwell侵襲實驗觀察腫瘤細胞侵襲能力變化。結果顯示,觀察組腫瘤細胞穿膜細胞數低于對照組,組間比較差異有統計學意義;提示阻斷Wnt 信號通路能明顯降低人結腸癌細胞的侵襲能力。另外,本研究顯示,觀察組腫瘤細胞中Wnt信號通路關鍵基因β-catenin、EMT調控因子Snail、間質細胞標記物Vimentin蛋白及mRNA表達均較對照組降低,上皮細胞標記物E-cadherin蛋白及mRNA表達均較對照組增高,組間比較差異有統計學意義。提示DKK-1可能通過阻斷經典 Wnt 信號通路,降低 β-catenin 在胞質內聚積[12,13],進而抑制EMT調控因子Snail表達;Snail表達降低,對上皮細胞標記物E-cadherin的抑制作用減弱,也不能上調間質細胞標記物Vimentin的表達[14],最終導致腫瘤細胞EMT減弱、侵襲能力降低。
綜上所述,將外源性Wnt 信號通路阻滯劑DKK-1作用于人結腸癌細胞HCCT116,其可通過抑制腫瘤細胞EMT降低腫瘤細胞的侵襲能力,為進一步探索抑制結腸癌侵襲與轉移有效途徑提供了一定的理論依據。
[1] Greenburg G, Hay ED. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells[J]. J Cell Biol, 1982,95(1):333-339.
[2] Clevers H. Wnt/beta-catenin signaling in development and disease[J]. Cell, 2006,127(3):469-80.
[3] Kaufhold S, Bonavida B. Central role of Snail1 in the regulation of EMT and resistance in cancer:a target for therapeutic intervention[J]. J Exp Clin Cancer Res, 2014,33:62.
[4] Jiang YG, Luo Y, He DL, et al. Role of Wnt/beta-eatenin signaling pathway in epithelial-mesenchymal transition of human prostate cancer induced by hypoxia-inducible factor-l alpha[J]. Int J Ural, 2007,14(11):1034-1039.
[5] 張延新,趙紅軍,宋文剛,等.TWEAK 反義寡核苷酸對人結腸癌細胞系SW480增殖及侵襲能力的影響[J].解剖學報,2014,45 (1):74-79.
[6] 張娜,梁瑩,楊興升,等.GBP1基因沉默對宮頸癌CaSki細胞增殖和遷移的影響[J].現代婦產科進展,2015,24(12):907-910.
[7] 李艷芹,張苗苗,閔鶴鳴,等.ZHX1基因沉默對BMSCS中BMP2/smad通路的影響[J].重慶醫科大學學報,2016,40(10):38-43.
[8] 馬松林,張姮,廖宇圣,等.Wnt3a 對結腸癌 SW480 細胞增殖的影響及作用機制[J].山東醫藥,2016,56(37):18-20.
[9] 姜俊,王曉蕾.Wnt信號通路在結腸鋸齒狀息肉癌變過程中作用的研究進展[J].國際消化病雜志,2015,32(2): 99-101.
[10] 鄒慧娟,鄭航,李明君,等.Wnt信號通路在結腸癌中的表達及其作用機制[J].中國老年學雜志,2016,36(14):3373-3374.
[11] Lee JM, dedhar S, Kalluri R, et al. The epithelial-mesenchymal transition: new insights in signaling, development, and disease[J]. J Cell Biol, 2006,172(7):973-981.
[12] 邊立忠, 高松.DKK1 基因干擾對原發性肝細胞癌細胞增殖的影響及其機制探討[J].山東醫藥,2014,54 (28):31-33.
[13] 紀曉花,王玲,高占海,等.β-catenin 與食管鱗癌發生發展的關系[J].山東醫藥,2016,56(19):103-105.
[14] 鄭麗芳,梅元武,張小喬,等.Snail 基因沉默對轉化生長因子-β1 促進骨髓間充質干細胞遷移的抑制作用[J]. 解剖學報,2008,39 (5):717-722.
Effects of Wnt signaling pathway antagonist DKK-1 on invasion ability of colon cancer cell line HCT116
ZHANGYanxin1,ZHANGYinpo,ZHAOYan,WANGJihong,ZHANGYan,CUIDongtao
(1LuoheMedicalCollege,Luohe462002,China)
Objective To investigate the effects and molecular mechanism of Wnt signal pathway antagonist DKK-1 on invasion ability of colon cancer cell line HCT116. Methods Conlon cancer HCT116 cells were divided into the experimental group and control group, which were cultured with exogenous DKK-1 (100 ng/mL) and the same amount of cell culture medium for 48 h, respectively. Transwell was used to observe the change of invasion ability. The protein and mRNA expression of β-catenin, Snail, E-cadherin and Vinentin in the HCT116 cells was observed by Western blotting and RT-PCR. Results The number of transmembrane cells in the experimental group was (45.29±6.25)/HP which was obviously lower than that in control group〔(76.36±8.32)/HP〕, and the difference was statistically significant (P<0.05). The protein and mRNA expression of β-catenin, Snail and Vinentin was lower and the expression of E-cadherin protein and mRNA was higher in the experimental group than that of the control group, and the differences were statistically significant (allP<0.05). Conclusion Wnt signal pathway antagonist DKK-1 can decrease the invasion ability of conlon cancer cell line HCT116 by inhibiting the process of epithelial-mesenchymal transition in tumor cells.
colon carcinoma; Wnt signaling pathway; pathway antagonist; epithelial-mesenchymal transition; cell invasion
河南省教育廳青年教師資助項目(2012GGJS-269)。
張延新(1974-),男,副教授,主要研究方向為消化系腫瘤病理。E-mail: zhangyx448@126.com
10.3969/j.issn.1002-266X.2017.10.003
R735.3
A
1002-266X(2017)10-0008-03
2016-11-21)

