紅松不同種源的遺傳多樣性分析
張巍,王清君,郭興
(伊春林業科學院,黑龍江 伊春 153000)
紅松不同種源的遺傳多樣性分析
張巍,王清君,郭興
(伊春林業科學院,黑龍江 伊春 153000)
紅松是小興安嶺林區的主要建群樹種,在小興安嶺總體生態系統中具有重要的生態地位。為了保證小興安嶺林區紅松的遺傳豐富度,為小興安嶺林區提供優質的紅松造林苗木。研究運用10個經過篩選后的引物,用ISSR分析方法對10個不同紅松天然林種源進行了分子標記分析。結果顯示:①10個ISSR引物共檢測到的位點數在2~13之間,各位點的 DNA 片段長度介于 150~2 000 bp 之間。②共檢測到79個位點,平均每個 ISSR 引物檢測到9.9個位點。③多態性條帶為65條,多態性位點百分率為42.63%。④各種源在分子層面存在明顯差異,而這一差異與地理分布呈正相關。⑤小興安嶺林區紅松群落的遺傳豐富度較高,這也有效的保證了小興安嶺紅松群落的林分質量。
紅松;遺傳豐富度;ISSR
0 引言
紅松(Pinuskoraiensis)是我國珍貴的用材樹種[1-2],而天然闊葉紅松林是經過長期自然選擇形成的原始群落[3],同時也是小興安嶺林區的地帶性頂級群落[4]。小興安嶺伊春林區是我國紅松的主分布區之一,曾經分布著大面積的紅松原始林,但20世紀60、70年代經受了嚴重破壞。雖然現在每年都有大面積的造林計劃進行,但伊春林區的紅松原始林目前仍然處于恢復階段。而隨著造林任務的深入,不同種源的遺傳豐富度表現出一定差異,造林質量也存在差異。近年來,如何有效的保存現有紅松原始林的遺傳多樣性,提高闊葉紅松林的遺傳豐富度,一直是林業工作者共同努力的方向。為了揭示紅松不同種源間遺傳多樣性的差異,本研究收集了包括小興安嶺、長白山等紅松主分布區在內的天然紅松母樹林優樹子代,用ISSR-PCR分子標記分析方法對各種源及種源內家系進行了分子標記分析,希望可以為紅松不同種源的綜合評價及利用提供參考和理論依據。
1 材料與方法
1.1 試驗材料選擇
試驗共選定10個地區的紅松原始林為種源選擇區,各種源區具體情況見表1。
依據種源區域,選擇鐵力林業局種源家系8株,五營林業局種源家系10株,湯旺河林業局種源家系12株,帶嶺林業局種源家系9株,新青林業局種源家系10株,吉林省長白山1號種源家系10株(吉林,安圖),吉林省長白山2號種源家系10株(吉林,蛟河),雙鴨山市種源家系10株,友好林業局種源家系10株,牡丹江市種源家系10株,共99株單株樣本。
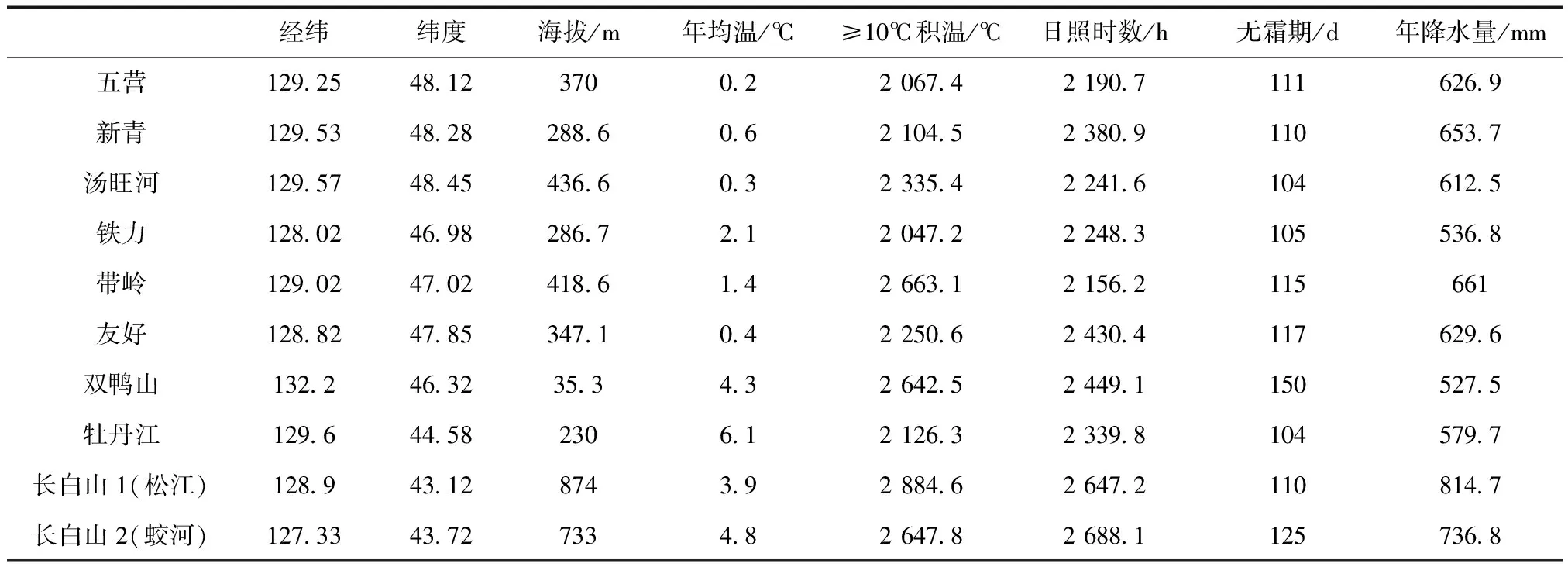
表1 種源區立地條件統計
1.2 反應體系建立
1.2.1 紅松總DNA提取
試驗參考馮富娟等的試驗方法[4-9]。采用CTAB提取紅松針葉總DNA,從上清液中獲取的DNA得率高,DNA電泳條帶清晰。
1.2.2 ISSR-PCR
反應體系為20 μL,包括1×Buffer,1.5 mmol/L MgCl2,引物1.5 ng/(μL),dNTP的濃度為0.2 mmol/L,TaqDNA聚合酶的用量為0.5U,模板DNA的用量為20~40 ng,TaqDNA聚合酶、引物、dNTP由上海生工生物工程公司提供。見表2。
PCR反應程序為:94℃ 預擴增7 min;94℃變性 30s,52℃退火 45s,72℃延伸 2 min,40個循環;72℃ 7 min;4℃保存。
1.2.3 電泳檢測及數據處理
PCR產物用1.5%瓊脂糖凝膠,在不超過5 V/cm的電壓下電泳,電極緩沖液為1×TAE,凝膠成像系統拍照記錄。
1.2.4 DNA指紋圖譜建立
將瓊脂糖凝膠上出現DNA片段的記為1,不出現的為0,統計后輸入電腦,用NTSYS聚類分析軟件進行UPGMA法聚類分析,用POPGENE32軟件進行數據處理。

表2 ISSR引物編號及序列
2 結果與分析
2.1 種源間ISSR的多態性
對10個種源進行PCR擴增。擴增片段分子量主要集中在200~1 500 bp之間。共擴增片段條帶501條,其中多態性條帶289條。各引物擴增出的條帶數目從20至84不等。引物p13擴增出的條帶數最多,為49條。引物P807擴增出891個遺傳位點,為10個引物中最多(圖1~圖4)。以上數據表明紅松種間在分子水平上的多態性是豐富的,利用ISSR分子標記能夠檢測紅松多種源間的親緣關系[10-13](表3)。

圖1 天然紅松ISSR電泳圖譜,引物p5Fig.1 Pine ISSR gel electrophoresis primer P5

圖2 天然紅松ISSR電泳圖譜,引物p11Fig.2 Pine ISSR gel electrophoresis primer P11

圖3 天然紅松ISSR電泳圖譜,引物p13Fig.3 Pine ISSR gel electrophoresis primer P13

圖4 天然紅松ISSR電泳圖譜,引物p807Fig.4 Pine ISSR gel electrophoresis primer P807

引物名稱P3P5P8P10P11P13P815P807P817P818擴增條帶數59428449436120594638多態條帶4138463117490312412多態條帶比率/%41475418238752833445503444342924
2.2 遺傳多態位點分析
遺傳多樣性是生物多樣性的基礎,也是生物多樣性最重要的部分[13-15]。通過對10個種源的遺傳多樣性進行統計分析表明,湯旺河種源區遺傳性最為豐富,其總條帶數為34條,多態性條帶數42條,多態性條帶百分比53.16%,該種區為各種源最高,其次為帶嶺種源區,總條帶數為44條,多態性條帶35條,多態性條帶百分比為44.30%。五營種源區總條帶數46,其中多態性條帶數33,多態性條帶比率為41.77%,相對較高(表4)。
從表4可知,不同種群的多態位點比率在25.32%~53.16%。其中,在10個種源區劃中,湯旺河種源區和帶嶺種源區的遺傳多樣性最為豐富。五營種源區遺傳多態位點比率也達到了41.77%,在本次所收集的種源中多態位點比率較高。長白山2號種源區、新青種源區和雙鴨山種源區的多態位點比率最少,分別為25.32%、27.85%、29.11%,證明其遺傳豐富度較差。
比較中,小興安嶺種群區域和長白山種群區域的多態位點比率都高于做為兩個紅松主分布區中間帶的雙鴨山和牡丹江種群區,證明做為我國國內的紅松主分布區,兩種群都在長期的進化中保證了種群自身的遺傳豐富度。丁慶祝等[16]以5年生紅松種源為實驗材料,證明了紅松不同地理種源間遺傳差異是極顯著的。
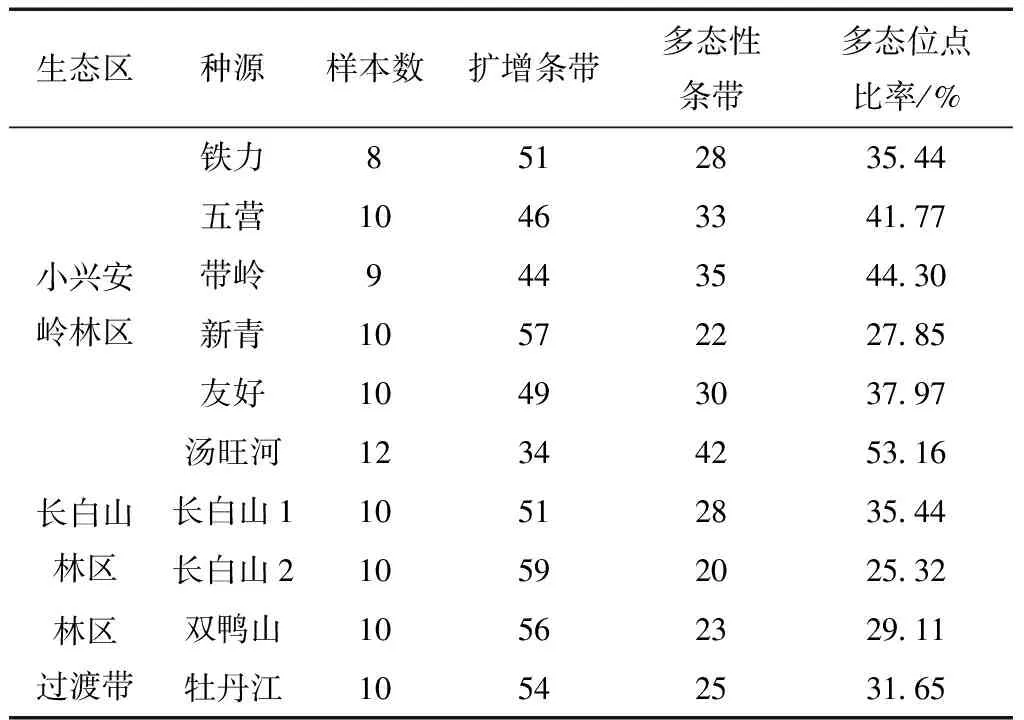
表4 各生態區和種群多態位點統計
2.3 遺傳變異分析
Nei指數(H)、Shannon指數(I)和有效等位基因數(Ne)是衡量種源遺傳多樣性的重要參數。為了分析紅松各種群內和種群間的遺傳變異,對紅松10個種源進行了遺傳多樣性分析(表5)。
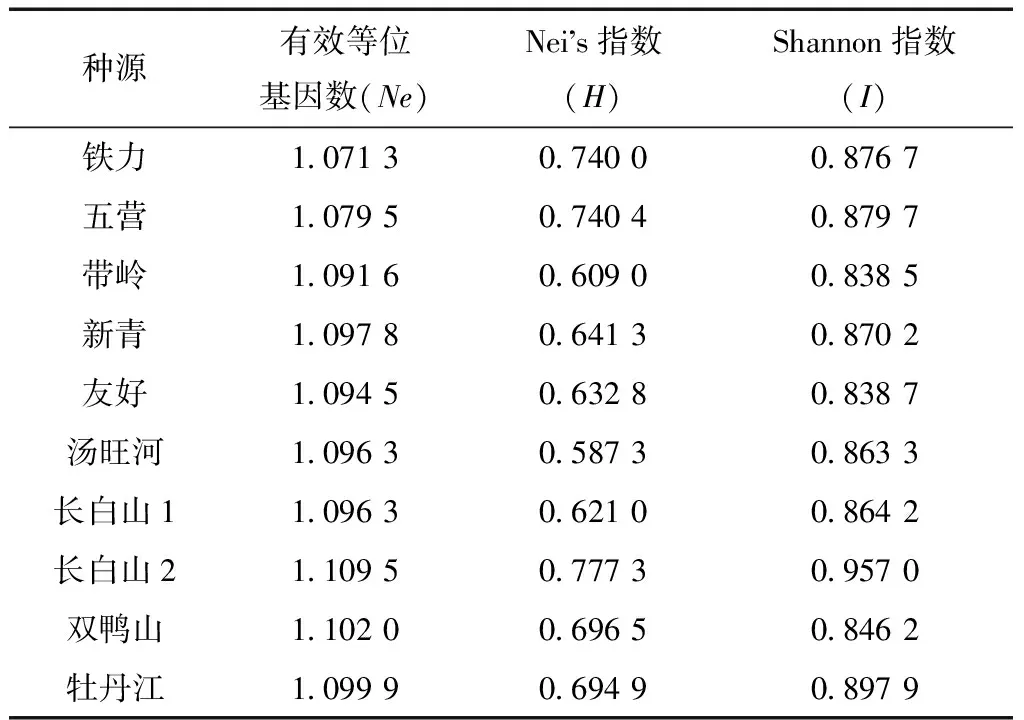
表5 紅松各種源遺傳多樣性
從表5來看,除Shannon指數I比Nei指數H稍高一點外,各種源遺傳多樣性指數基本一致。其中,帶嶺種源的Shannon指數I最低,為0.838 5,其次為友好種源。Shannon指數I最高的種源為長白山2號種源和新青種源。結果表明,紅松種源Nei遺傳多樣性指數總體區間在0.403 3~0.874 4。Shannon遺傳多樣性指數總體區間在0.514 2~1.025 3。各種源總的Nei遺傳多樣性指數為0.631,總Shannon多樣性指數I為0.839 1。
2.4 各種源間的遺傳距離和親緣關系
對紅松10個種源的99株單株個體進行聚類分析表明,10個種源基本可以分為兩大類群,即包括鐵力、帶嶺、友好、新青、五營、湯旺河等在內的小興安嶺紅松群落和包括長白山1號種源、長白山2號種源、牡丹江、雙鴨山等在內的長白山紅松群落。鐵力,友好,新青,五營,帶嶺、湯旺河等6個種源組內的單株個體在遺傳距離上并沒有明顯的集群分類。
3 結論
(1)對10個種源99株單株優樹進行遺傳多樣性及遺傳分化的分析,共檢測出有效位點7 821個,其中多態性位點數3 334個。分析結果證明,10個種源基本可以劃分為小興安嶺林區、長白山林區和林區過渡帶三個大的種源區劃。而以雙鴨山種源區、牡丹江種源區為代表的過渡帶,遺傳距離更接近于長白山林區。
(2)試驗分析證明,小興安嶺紅松區組總擴增位點數為4 661個,多態位點數2 135個。總的多態位點比率為45.81%。長白山紅松區組總擴增位點數為1 580個,總多態位點率39.30%。雙鴨山和牡丹江種源區組總擴增位點數為1 580個,總多態位點數為576個,總多態位點比率為36.48%。由此看出,無論是各種源組間比較或組內比較,小興安嶺林區總的多態位點比率都相對較高,證明具有更高的遺傳豐富度,組內存在更好的基因流動性,可以更為有效的保證種源間基因雜合的豐富度,從而近一步保證林分質量。
(3)對所收集的10個紅松種源進行分子標記分析證明,紅松各種源的遺傳差異在分子層面是顯著的。而這種差異的顯著性在一定程度上與地理分布關系密切。由此也證明,與其它植物相比,紅松種源間的遺傳距離受空間限制機率更小,其自身具有較高水平的基因流動。這也是紅松在長時間的進化過程中為有效防止基因空間異質性而產生的生理對策。
4 討論
紅松自然分布地域狹長,從小興安嶺到長白山,幾千公里,地理及氣候條件差異很大,不同亞區的優樹子代具有不同的生態適應性[16]。馮富娟等對露水河紅松種子園內7個無性系種源進行聚類分析,表明黑龍江的4個種源遺傳關系較近,而長白山的3個種源遺傳關系同樣較近[9],這與本文研究基本相同。但本次研究得到的多態位點比率較高,最終確定的種源區劃也稍有差異,這可能是由于試驗條件及選擇樣本方法不同產生的。本次種源選擇完全是在紅松天然母樹林完成,樣本樹齡從128~444 a不等,共分4個層級進行采集,樹齡跨度較大。這一齡級跨度的紅松原始林基本未受人為干擾,物種豐富度可以被更好的保留。其次,本次研究選擇種源區較多,且每個種源區在采集的過程中都對不同樹齡層級的樣本進行了采集,樣本數的增加增大了位點被檢測到的幾率。
小興安嶺和長白山紅松林地理距離較遠,而紅松林的群落組成及垂直植被層各有特點,差異較大[17]。張恒慶等在對天然紅松林時間尺度遺傳多樣性變化和遺傳分化進行分析后,證明紅松在時間尺度具有一定波動[17]。丁慶祝等[18]以5 a生紅松種源為實驗材料,證明紅松不同地理種源間遺傳差異是顯著的。而做為主分布區之一的小興安嶺紅松林群落,由于包括土壤、氣候等自然因子和種群內基因流動及雜合程度的復雜性,而形成了自身的群落穩定性。
[1]馬建路,莊麗文,陳動,等.紅松的地理分布[J].東北林業大學學報,1992,30(9):40-48.
[2]周以良,董世林,聶紹荃.黑龍江樹木志[M].哈爾濱:黑龍江科學技術出版社,1986:29-65.
[3]安慧君.闊葉紅松林空間結構研究[D].北京:北京林業大學,2003.
[4]郭興,張 巍,任廣明.小興安嶺紅松原始林的遺傳多樣性研究[J].森林工程,2012,28(1):14-16.
[5]張振,張含國,莫遲,等.紅松轉錄組SSR分析及EST-SSR標記開發[J].林業科學,2015,51(8):114-120.
[6]Ge X J,Sun M.Reproductive biology and genetic diversity of a cryptoviviparous mangrove aegiceras corniculatum (Myrsinaceae) using allozyme and intersimple sequence repeat (ISSR) analysis[J].Molecular Ecology,1999,8(12):2061-9.
[7]Prevost A,Wilkinson M J.A new system of comparing PCR primers applied to ISSR fingerprinting of potato cultivars[J].Theoretical and Applied Genetics,1999,98(1):107-112.
[8]馮富娟,隋心,張冬東.不同種源紅松遺傳多樣性的研究[J].林業科技,2008,38(1):11-4.
[9]馮富娟,王鳳友,劉彤.紅松ISSR-PCR實驗系統影響因素[J].植物學通報,2004,21(3):326-331.
[10]Lester D T.Variation in cone morphology of balsam fir,abies balsamea[J].Rhodorad,1968,70(781):83-94.
[11]Khalil M A K.Genetics of cone morphology in white spruce (Picea glauca)[J].Canadian Journal of Botany,1974,52(1):15-21.
[12]Maley M L,Parker W H.Phenotypic variation in cone and needle characters of Pinus banksiana[J].Canadian Journal of Botany,1993,71(1):43-51.
[13]Parker M H,Maze J.Intraspecific variation in Aies lasioearpa from British Columbia and Washington.Am.J.Bot.[J].Oires,1984,71:1051~1059.
[14]張東冬.SRAP對不同地理種源紅松遺傳結構的研究[D].哈爾濱:東北林業大學,2008.
[15]馬順興.日本落葉松無性系遺傳變異及早期選擇研究[D].鄭州:河南農業大學 2006.
[16]徐化成.中國紅松天然林[M].北京:中國林業出版社,2000:39-41.
[17]劉得利.天然紅松遺傳多樣性在時間尺度上變化的RAPD和ISSR分析[D].沈陽:遼寧師范大學,2004.
[18]丁慶祝,張彩霞,江淑敏,等.紅松不同種源的遺傳差異與地理變異趨勢[J].林業科技,1994,23(5):1-4
Study on the Genetic Diversity ofPinusKoraiensisin Different Provenances
Zhang Wei,Wang Qingjun,Guo Xing
(Yichun Academy of Forestry sciences,Yichun,153000)
Pinus koraiensis is the main tree species in Xiaoxing'anling forest,and of important ecological status in the overall ecological system of Xiaoxing'anling area.In order to ensure the genetic richness of Pinus koraiensis in Xiaoxing'anling forest region,and provide high quality Pinus koraiensis afforestation seedlings for Xiaoxing’anling forest area,10 primers were screened and 10 different Korean pine natural provenances were analyzed by ISSR in this study.The results showed that the points were detected by 10 ISSR primers were between 2~13loci,DNA fragment length of each point was between 150~2000 bp.79 loci were detected,and 9.9 loci was detected by ISSR primers on the average.Polymorphic bands for the 65 polymorphic loci was 42.63%.There was a significant difference in the molecular level of the various sources,and this difference was positively correlated to the geographical distribution.The genetic richness of Pinus koraiensis community was higher in Xiaoxing'anling forest area,which effectively ensured the quality of Pinus koraiensis community in Xiaoxing'anling.
korean pine;genetic richness;ISSR
2016-10-24
黑龍江省森林工業總局科技攻關項目(sgzjy2010005)
張巍,碩士,工程師。研究方向:森林特產和森林經營。E-mail:zw81025259@163.com
張巍,王清君,郭興.紅松不同種源的遺傳多樣性分析[J].森林工程,2017,33(2):17-21.
S 791
A
1001-005X(2017)02-0017-05

