4甲基傘形內酯衍生物的合成與生物活性研究
汪秋安?で茄扌廓っ?炎?ち醵?

摘 要:4甲基傘形內酯(4甲基7羥基香豆素, 1)是一種具有重要生物活性的香豆素類天然產物. 本文以間苯二酚和乙酰乙酸乙酯為原料, 經Pechmann反應合成4甲基傘形內酯(1). 然后以4甲基傘形內酯(1)為底物, 分別經Mannich反應、乙酰化、Fries重排、O甲基化、BaeyerVilliger氧化、O異戊烯基化和Claisen重排等反應步驟, 合成了一系列4甲基傘形內酯衍生物2~10.并對所合成的化合物進行了人宮頸癌Hela細胞的抑制活性測試, 結果發現新化合物4甲基5異戊烯基8羥基7甲氧基香豆素(10)對Hela細胞的抑制活性(IC50 = 28.58 μmol/L), 高于陽性對照藥物順鉑(IC50 = 41.25 μmol/L), 具有進一步研究開發的價值.
關鍵詞:4甲基傘形內酯; 香豆素衍生物; 合成; 生物活性
中圖分類號:O625.12 文獻標識碼:A
Abstract:4Methylumbelliferone (4methyl7hydroxycoumarin, 1) is a coumarins natural product with important biological activity. Firstly, 4methylumbelliferone (1) was synthesized from resorcinol and ethyl acetoacetate by Pechmann reaction. Nine coumarin derivatives (2~10) were then synthesized through Mannich reaction, acetylation, Fries rearrangement, Omethylation, BaeyerVilliger oxidation, Oprenylation and Claisen rearrangement from 4methylumbelliferone (1). Their inhibitory activities on human cervical carcinoma Hela cells were evaluated in vitro. The biological testing results showed that 4methyl5prenyl8hydroxy7methoxycoumarin (10, IC50 = 28.58 μmol/L) displayed stronger activity than the positive control drug cisPlatin (IC50 = 41.25 μmol/L), which is worthy of further study.
Key words:4methylumbelliferone; coumarin derivatives; synthesis; biological activity
香豆素是一類具有抗腫瘤、抗病毒、抗菌和抗凝血作用等重要生物活性的天然產物. 例如,Kashman等從馬來西亞熱帶雨林樹木藤黃科胡桐樹(Calophyllum lanigerum)中分離出來的Calandide具有很強的抗艾滋病毒活性[1]. 2003年Lee等從緬甸的Kayea Ossamica 樹皮中分離得到的新香豆素TheraphinsA, B和C顯示出很好的抗Co12, KB和LNCaP人腫瘤細胞活性[2]. 張慶林等從蛇床子(Cnidiummonnier)中分離出的3種香豆素對耐藥的腫瘤細胞KBV200具有明顯的逆轉作用[3]. Itoigawa等從C. inophllum中分離出的10種4苯基香豆素對腫瘤細胞EpsteinBarr Virus(EBV)具有顯著抑制活性[4].
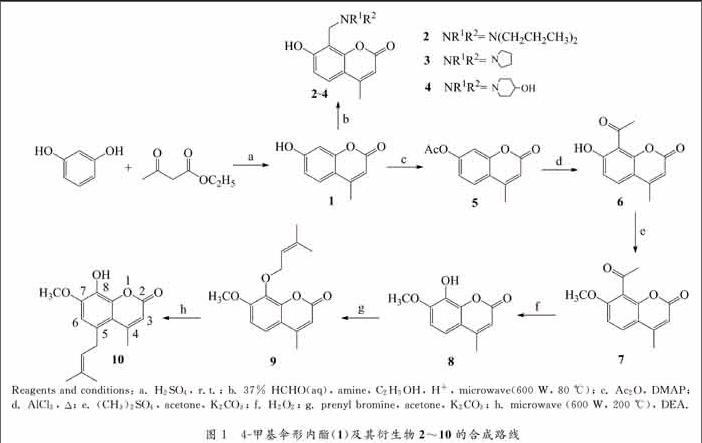
4甲基傘形內酯(1)是一種簡單的天然香豆素, 它對各種腫瘤細胞具有抑制活性, 同時也是一種新型利膽藥物[5-6]. 由于它的分子量小、合成簡便且生物利用度高, 由4甲基傘形內酯所衍生出來的香豆素衍生物顯示出良好的生物活性和藥理作用, 已引起人們的廣泛關注[7-10]. 現有的研究表明, 異戊烯基、甲氧基和含氮堿基對香豆素類化合物的生物活性具有增強效果, 例如, 蛇床子素(osthol, 7甲氧基8異戊烯基香豆素)是近年來發現的一種很有潛力的高效抗腫瘤的異戊烯基香豆素[11]. 為了進一步研究4甲基傘形內酯衍生物的生物活性及適應新藥開發的需要, 我們首先以間苯二酚和乙酰乙酸乙酯為原料, 經Pechmann反應合成了4甲基傘形內酯(1), 然后對4甲基傘形內酯進行結構修飾, 分別經Mannich 反應、乙酰化、Fries重排、O甲基化、BaeyerVilliger氧化、O異戊烯基化和Claisen重排等反應, 合成了一系列4甲基傘形內酯衍生物2~10.并對所合成的4甲基傘形內酯衍生物進行了人宮頸癌Hela細胞的抑制活性測試. 4甲基傘形內酯(1)及其衍生物2~10的合成路線如圖1所示.
4methylumbelliferone (1) and its derivatives 2~10
1 實驗部分
1.1 儀器與試劑
熔點在 XRC1 型顯微熔點儀上測定(溫度計未校正);NMR 用 Bruker Am400 型核磁共振儀測定(溶劑 CDCl3 或 DMSOd6, TMS 為內標);MS 用 Agilent 1100 液質聯用儀或 ZABHS 型儀測定記錄(EI模式);IR用 FD5DX 儀 (KBr 壓片法)測定;微波加熱用XHMC1實驗室微波合成儀(北京祥鵠科技發展有限公司);薄層和柱層析用硅膠均為青島海洋化工廠產品;所用試劑和溶劑為化學純和分析純, 要求無水的溶劑都經過干燥劑或分子篩除水和重蒸處理.
4甲基7羥基香豆素(1)按文獻以間苯二酚和乙酰乙酸乙酯為原料合成[12].
1.2 4甲基7羥基8亞甲基(1二正丙胺)香豆素(2)合成
首先將0.8 mL甲醛、0.8 mL二正丙胺、5滴濃鹽酸溶于5 mL乙醇中, 室溫下攪拌10 min, 再稱取化合物1 (200 mg, 1.14 mmol) 于100 mL加有磁子的圓底燒瓶中, 將20 mL無水乙醇加入其中, 微波條件(600 W, 80 ℃)下溶解原料, 回流30 min左右, 反應完畢, 旋干反應液, 加水, 用乙酸乙酯萃取3次, 無水硫酸鈉干燥, 過濾, 旋蒸除溶劑,用乙酸乙酯石油醚重結晶, 得到黃色固體165 mg, 產率50%, m.p. 125~127 ℃, 1H NMR (400 MHz, CDCl3) δ 7.24 (d, J = 8.5 Hz, 1H, 5H), 6.57 (d, J = 8.5 Hz, 1H, 6H), 5.88 (s, 1H, 3H), 3.91 (s, 2H, NCH2), 2.41 (t, J = 6.9 Hz, 4H, NCH2), 2.25 (s, 3H, 4CH3), 1.46~1.49 (m, 4H, CH2), 0.78 (t, J = 6.7 Hz, 6H, CH3). 13C NMR (100 MHz, CDCl3)δ 163.09, 160.84, 153.22, 152.20, 124.28, 113.16, 111.59, 109.98, 108.08, 55.47, 50.79, 19.18, 18.55, 11.55. MS (EI), m/z: 289 [M]+. Anal. calcd for C17H23O3N: C 70.56, H 8.01, N 4.84;found C 70.48, H 7.98, N 4.81.
1.3 4甲基7羥基8亞甲基(1吡咯烷)香豆素(3)的合成
合成方法同(2)得到黃色固體201 mg, 產率68%, m.p. 223~225 ℃, 1H NMR (400 MHz, CDCl3) δ 13.08 (s, 1H, OH), 7.32 (d, J = 8.7 Hz, 1H, 5H), 6.67 (d, J = 8.7 Hz, 1H, 6H), 5.97 (s, 1H, 3H), 4.10 (s, 2H, NCH2), 2.65 (s, 4H, NCH2), 2.30 (s, 3H, 4CH3), 1.81 (s, 4H, CH2). 13C NMR (100 MHz, CDCl3) δ 163.13, 161.37, 153.46, 152.02, 124.49, 113.37, 111.91, 110.34, 108.60, 77.46, 77.14, 76.82, 53.60, 51.43, 23.70, 18.83. MS (EI), m/z: 259 [M]+ . Anal. calcd for C15H17O3N: C 69.48, H 9.51, N 7.77;found C 69.57, H 9.38, N 7.83.
1.4 4甲基7羥基8亞甲基(4羥基哌啶)香豆素(4)的合成
合成方法同(2)得到黃色固體214 mg,產率65%, m.p. 150~152 ℃, 1H NMR (400 MHz, CDCl3) δ 7.39 (d, J = 8.7 Hz, 1H, 5H), 6.75 (d, J = 8.7 Hz, 1H, 6H), 6.05 (s, 1H, 3H), 4.04 (s, 2H, NCH2), 3.84 (s, 1H, CH(OH)), 2.92 (s, 2H, NCH2), 2.37 (s, 5H, NCH2 and 4CH3), 1.95 (s, 2H, CH2), 1.68 (s, 2H, CH2). 13C NMR (100 MHz, CDCl3)δ 162.71, 161.36, 153.48, 152.40, 124.60, 113.44, 112.16, 110.49, 107.72, 53.81, 33.84, 29.92, 18.79. MS (EI), m/z: 289 [M]+. Anal. calcd for C16H19O4N: C 66.42, H 6.62, N 4.84;found C 66.36, H 6.70, N 4.75.
1.5 4甲基7乙酰氧基香豆素(5)的合成
稱取化合物1 (500 mg, 2.85 mmol), 催化量的4二甲氨基吡啶于100 mL圓底燒瓶中, 加入15 mL乙酸酐,50 ℃反應2 h, 原料點幾乎消失, 停止反應,旋干反應液, 用乙酸乙酯萃取3次, 飽和食鹽水洗滌, 干燥, 旋干溶劑, 最后用二氯甲烷石油醚重結晶, 得到白色固體497 mg, 產率80%, m.p. 142~144 ℃, 1H NMR (400 MHz, CDCl3) δ 7.54 (d, J = 8.4 Hz, 1H, 5H), 7.07~6.98 (m, 2H, 6H and 8H), 6.20 (s, 1H, 3H), 2.36 (s, 3H, 4CH3), 2.28 (s, 3H,COCH3). 13C NMR (100 MHz, CDCl3) δ 167.80, 159.51, 153.09, 151.97, 150.96, 124.40, 117.10, 116.82, 113.47, 109.44, 20.12, 17.74. MS (EI), m/z: 218 [M]+. Anal. calcd for C12H10O4: C 66.05, H 4.62;found C 65.96, H 4.63.
1.6 4甲基8乙酰基7羥基香豆素(6)的合成
稱取化合物5 (500 mg, 2.29 mmol), AlCl3 (1 g, 7.49 mmol), 適量NaCl于100 mL圓底燒瓶中, 在140 ℃下反應24 h, 冷卻, 滴加 10% 稀鹽酸至酸性, 抽濾, 干燥, 用CH2Cl2溶解, 過濾, 最后重結晶, 得到黃色固體324 mg, 產率65%, m.p. 166~168 ℃, 1H NMR (400 MHz, CDCl3) δ 13.45 (s, 1H, OH), 7.57 (d, J = 8.9 Hz, 1H, 5H), 6.79 (d, J = 8.9 Hz, 1H, 6H), 6.05 (s, 1H, 3H), 2.82 (s, 3H, 4-CH3), 2.33 (s, 3H,COCH3).13C NMR (100 MHz, CDCl3) δ 204.32, 166.56, 159.31, 155.06, 153.07, 131.28, 115.06, 111.82, 110.98, 109.18, 33.91, 19.19. MS (EI), m/z: 218 [M]+. Anal. calcd for C12H10O4: C 66.05, H 4.62;found C 66.10, H 4.57.
1.7 4甲基8乙酰基7甲氧基香豆素(7)的合成
將化合物6(500 mg,2.29 mmol), 碳酸鉀(1.90 g, 13.74 mmol)放于圓底燒瓶中, 加入20 mL丙酮,40 ℃下加熱使原料溶解, 滴加2 mL硫酸二甲酯, 5 h后, 原料點幾乎沒有, 停止反應, 旋干濾液, 重結晶, 得白色固體425 mg, 產率80%, m.p. 95~97 ℃, 1H NMR (400 MHz, CDCl3) δ 7.57 (d, J = 8.9 Hz, 1H, 5H), 6.89 (d, J = 8.9 Hz, 1H, 6H), 6.11 (s, 1H, 3H), 3.89 (s, 3H, OCH3), 2.57 (s, 3H, 4CH3), 2.38 (s, 3H, COCH3). 13C NMR (100 MHz, CDCl3) δ 199.47, 159.95, 158.37, 152.24, 150.51, 126.50, 119.19, 113.87, 112.41, 107.47, 56.28, 32.42, 18.73. MS(EI), m/z: 232 [M]+. Anal. calcd for C13H12O4: C 67.23, H 5.21;found C 67.16, H 5.25.
1.8 4甲基8羥基7甲氧基香豆素(8)的合成
稱量化合物7 (200 mg, 0.86 mmol) 于100 mL圓底燒瓶中, 加入15 mL二氧六環, 12 mL 4%氫氧化鈉溶液, 40 ℃加熱, 使原料溶解, 冰浴條件下將10 mL 30% 的雙氧水溶液滴入其中, 反應3 h左右, 用冰的稀鹽酸進行酸化使pH=1, 原料點幾乎沒有, 停止反應, 加水, 用二氯甲烷萃取3~4次, 萃取后, 飽和食鹽水洗滌有機層, 干燥, 旋除溶劑, 最后重結晶, 得黃色固體89 mg, 產率50%, m.p. 80~82 ℃, 1H NMR (400 MHz, CDCl3) δ 7.12 (d, J = 8.8 Hz, 1H, 5H), 6.87 (d, J = 8.8 Hz, 1H, 6H), 6.14 (d, J = 0.9 Hz, 1H, 3H), 3.98 (s, 3H, OCH3), 2.39 (d, J = 1.1 Hz, 3H, 4CH3). 13C NMR (100 MHz, CDCl3) δ 160.17, 152.85, 149.30, 141.61, 132.75, 115.24, 114.38, 112.18, 107.30, 56.40, 18.61. MS(EI), m/z: 206 [M]+. Anal. calcd for C11H10O4: C 64.07, H 4.89;found C 64.11, H 4.78.
1.9 4甲基7甲氧基8異戊烯氧基香豆素(9)的
合成
稱量化合物8 (200 mg, 0.97 mmol), 無水碳酸鉀(800 mg, 5.80 mmol)于100 mL圓底燒瓶中, 加入15 mL丙酮,40 ℃加熱, 使原料溶解, 滴加0.2 mL異戊烯基溴, 反應4 h左右, 停止反應, 過濾, 旋轉蒸除溶劑, 用二氯甲烷石油醚重結晶, 得到黃色固體226 mg, 產率85%, m.p. 66~68 ℃,1H NMR (400 MHz, CDCl3) δ 7.29 (d, J = 8.9 Hz, 1H, 5H), 6.87 (d, J = 8.9 Hz, 1H, 6H), 6.13 (s, 1H, 3H), 5.59 (td, J = 7.3, 1.3 Hz, 1H, CH), 4.64 (d, J = 7.3 Hz, 2H, OCH2), 3.94 (s, 3H, OCH3), 2.38 (s, 3H, 4OCH3), 1.73 (s, 3H, CH3), 1.69 (s, 3H, CH3). 13C NMR (100 MHz, CDCl3)δ 159.68, 154.80, 151.55, 147.13, 138.23, 133.96, 119.02, 118.43, 113.70, 111.32, 106.94, 69.00, 55.30, 24.80, 17.75, 16.97. MS(EI), m/z: 274 [M]+. Anal. calcd for C16H18O4: C 70.06, H 6.61;found C 70.11, H 6.55.
1.10 4甲基5異戊烯基8羥基7甲氧基香豆素
(10)的合成
稱量化合物 9 (200 mg, 0.73 mmol)于100 mL圓底燒瓶中, 加入15 mL無水N, N二乙基苯胺, 微波條件(600 W, 200 ℃)下加熱, 反應2 h左右, 原料點消失, 停止反應, 冷卻至室溫, 加入4%稀鹽酸, 用二氯甲烷萃取3次, 萃取后用飽和NaCl溶液洗滌有機層, 無水硫酸鈉干燥, 過濾, 旋蒸除溶劑, 硅膠柱層析 (V石油醚∶V乙酸乙酯=6∶1), 得到黃色固體70 mg, 產率35%,m.p. 123~125 ℃, 1H NMR (400 MHz, CDCl3) δ 6.60 (s, 1H, 6H), 6.04 (s, 1H, 7H), 5.99 (s, 1H, CH), 5.06 (s, 1H, OH), 3.87 (s, 3H, OCH3), 3.56 (d, J = 5.5 Hz, 2H, CH2), 2.52 (s, 3H, 4CH3), 1.62 (s, 3H, CH3),1.75(s,3H,CH3). 13C NMR (100 MHz, CDCl3) δ 158.79, 153.83, 147.35, 142.27, 132.34, 130.81, 130.41, 122.29, 112.66, 111.83, 109.85, 55.21, 33.57, 24.54, 23.50, 17.13. MS(EI), m/z: 274 [M]+. Anal. calcd for C16H18O4: C 70.06, H 6.61;found C 69.95, H 6.59.
1.11 生物活性測試
采用CCK8法對合成化合物1~10進行體外抗腫瘤細胞Hela(宮頸癌細胞)的活性篩選. 以順鉑 (cisPlatin )作為陽性對照. 實驗流程如下:將每5 000個腫瘤細胞接種到96孔板中(每一孔板接種5 000個細胞), 待細胞貼壁之后(一般過夜或12 h)給藥, 起始給藥濃度100 μmol/L, 3倍或4倍濃度進行梯度稀釋, 一共稀釋8個濃度(如:稀釋4倍,分別是100 μmol/L, 25 μmol/L, 6.25 μmol/L, 1.56 μmol/L, 0.39 μmol/L, 0.097 6 μmol/L, 0.024 4 μmol/L, 0.006 1 μmol/L), 給藥后孵育培養48 h,棄去培養基, 加入含10% CCK8(檢測線號, 只與活細胞結合, 結合越多, 吸光度越大)的1640培養基(體外培養細胞所需的營養物質, 主要有糖、氨基酸和維生素三大類)100 μL, 孵育1~2 h, 檢測波長范圍450~490 nm, 酶聯免疫檢測儀(BioRad 680)讀取各孔光吸收值, 記錄結果, 以濃度為橫坐標, 細胞存活率為縱坐標繪制細胞生長曲線, 應用兩點法(Reed and Muench法)計算化合物的IC50值.
2 結果與討論
首先, 以間苯二酚和乙酰乙酸乙酯為原料, 經香豆素合成的經典反應Pechmann反應合成4甲基傘形內酯(1). 然后,4甲基傘形內酯(1)分別與二正丙胺、吡咯烷和4羥基哌啶等3種二級胺和水合甲醛的酸性醇溶液, 在微波加熱(600 W, 80 ℃)下進行Mannich反應, 因香豆素1環上8位上的電子云密度較大, 且處于酚羥基的鄰位, 易發生具有親電特征的Mannich反應, 生成8位胺甲基取代的香豆素衍生物2~4, 這3種產物的結構通過1HNMR譜確證, 其中8位上的氫峰消失, 出現了δ 2.41,4.10和4.04胺甲基氫的吸收峰. 微波促進的Mannich反應已見文獻報道[13], 該法可大大縮短反應時間, 且副產物少, 產率高.
4甲基傘形內酯(1)與乙酸酐在催化量二甲基吡啶(DMAP)作用下,發生乙酰化反應得到化合物5.化合物5在Lewis酸無水AlCl3催化作用下, 發生Fries重排, 可得鄰位、對位羥基芳香酮類化合物, 本文的化合物5中因對位被占據, 故得到鄰位重排產物6. 曾選用CS2或硝基苯作溶劑, 產率較低, 可能是溶劑中含有少量的水, 使部分無水AlCl3吸潮水解, 而使產率較低. 在無溶劑條件下, 于140 ℃反應24 h產率最高. 化合物6的7位經O甲基化作用得化合物7. 化合物7在雙氧水中經BaeyerVilliger氧化得8位有酚羥基的化合物8. 化合物8與異戊烯基溴在無水K2CO3丙酮體系中, 經親核取代反應得O異戊烯基化合物9. 化合物9溶于無水N, N二乙基苯胺(DEA)溶劑中, 在微波加熱(600 W, 200 ℃)條件下, 發生Claisen重排得4甲基5異戊烯基7甲氧基8羥基香豆素(10). 對所合成的4甲基傘形內酯及其衍生物進行了體外抗人子宮頸癌細胞Hela細胞株的活性篩選,采用CCK8法[14], 以順鉑(cisPlatin)為陽性對照物, 其結果見表1.從表1的生物活性結果可以看出, 化合物1, 5, 6, 7和10對Hela細胞增殖具有抑制作用, 其中化合物10(IC50=28.58 μmol/L)的活性高于陽性對照藥物順鉑(IC50=41.25 μmol/L), 也高于其母體香豆素4甲基傘形內酯(IC50 = 71.99 μmol/L).
3 結 論
天然香豆素4甲基傘形內酯經Mannich 反應、乙酰化、Fries重排、O甲基化、BaeyerVilliger氧化、O異戊烯基化和Claisen重排等反應, 合成了一系列4甲基傘形內酯衍生物2~10. 所合成的目標化合物經測試對人宮頸癌Hela細胞株的抑制活性, 發現異戊烯基香豆素10的活性(IC50=28.58 μmol/L)高于陽性對照物順鉑(IC50=41.25 μmol/L), 具有進一步研究開發的價值.
參考文獻
[1] KASHMAN Y, CUSTAFSON K R, FULLER R W, et al. The calandides, a novel HIVinhibitory class of coumarinn derivatives from the tropical rainforest tree, Calophyllum lanigerum [J]. Journal of Medicinal Chemistry, 1992, 35(15):2735-2738.
[2] LEE K H, CHAI H B, TAMEZ P A, et al. Biologically active alkylated coumarins from Kayea assamica[J]. Phytochemistry, 2003, 64(2):535-541.
[3] 張慶林, 趙靜華, 畢建進, 等. 蛇床子中3種逆轉腫瘤細胞多藥耐藥活性香豆素 [J]. 中草藥, 2003, 34(2):104-106.
ZHANG Qinglin, ZHAO Jinghua, BI Jianjin, et al. Three coumarins from seed of cnidium monnieri and their multidrug resistance reversal effects [J]. China Traditional and Herbal Drugs, 2003, 34(2):104-106. (In Chinese)
[4] ITOIGAWA M, ITO C, TAN H T, et al. Cancer chemopreventive agents, 4phenylcoumarins from Calophyllum inophyllum [J]. Cancer Letter, 2001, 169(1):15-19.
[5] MARESC A, SUPURAN C T. Coumarins incorporating hydroxyl and chloromoieties selectively inhibit the transmembrane, tumorassociated carbonic anhydrase isoforms IX and XII over cytosolic ones I and II [J]. Bioorganic Medicinal Chemistry Letters, 2010, 20(15):4511-4514.
[6] DOUGLAS M Y, TACOB J C W, KENNETH M D. Green synthesis of a fluorescent natural product[J].Journal of Chemistry Education, 2011, 88(3):319-321.
[7] MARIA J, ALYSSA B, JAMES M, et al. Synthesis and biological evaluation of isoprenylated coumarins as potential antipancreatic cancer agents [J]. Bioorganic Medicinal Chemistry Letters, 2014, 24:4654-4658.
[8] KONTOGIORGIS C A, HADJIPAVIOULITINA D T. Synthesis and antiinflammatory activity of coumarin derivatives [J]. Journal of Medicinal Chemistry, 2005, 48:6400-6408.
[9] MAZZEI M, NIEDDU E, MIELE M, et al. Activity of Mannich bases of 7hydroxycoumarin against Flaviviridae [J]. Bioorganic Medicinal Chemistry, 2008, 16(5):2591-2605.
[10] LIU D, CAI S L, WANG Q A, et al. Synthesis of long chain fatty acids acylated coumarin glycoside esters with lipase as catalyst [J]. Chemical Research in Chinese Universities, 2015, 31(4):534-538.
[11] YOU L S, AN R, WANG X H,et al. Discovery of novel osthole derivatives as potential antibreast cancer treatment[J]. Bioorganic Medicinal Chemistry Letters, 2010, 20:7426-7428.
[12] WU ZH, FU X L, WANG Q A, et al. Synthesis and fluorescence properties of coumarin glycosides and triazolylglycosides[J]. Chemical Research in Chinese Universities, 2013, 29 (3):460-465.
[13] PENG Y Q, DOU R L, SONG G H, et al. Dramatically accelerated synthesis of βaminoketones via aqueous mannich reaction under combined microwave and ultrasound irradiation [J]. ChemInform,2006,37(4):2245-2247.
[14] XUAN L N, WANG P, ZHANG K, et al. Synthesis and in vitro antiproliferative activity of novel benzioselenazolone derivatives[J]. Medicinal Chemistry Research, 2015, 24(2):543-552.

