慢性疼痛靜息態腦功能連接研究的Meta分析
程健,吳文
慢性疼痛靜息態腦功能連接研究的Meta分析
程健,吳文*
目的用Meta分析方法系統地描繪慢性疼痛患者靜息態腦功能連接的變化特點。材料與方法數據庫檢索Pubmed、EMBASE、Web Science、Science Direct、Springerlink、brainmap自建庫至2016年9月符合納入標準的所有fMRI研究。利用Icbm2tal軟件將Talairach坐標統一轉換為MNI坐標,依據ALE手冊中數據錄入方法將坐標數據分組錄入,使用Ginger-ALE 2.3軟件進行Meta分析并計算腦區ALE分布圖。結果納入20篇文獻,共389名慢性疼痛患者。Meta分析結果表明,慢性疼痛會導致默認網絡的功能連接出現異常。選取島葉作為種子點,研究發現:島葉和楔前葉;島葉和前扣帶回;島葉和后扣帶回;島葉和頂下小葉;島葉和內側前額葉的功能連接均出現異常。結論靜息態下慢性疼痛患者的島葉與默認網絡的功能連接異常,反映出疼痛腦加工與感知覺辨認、認知和情緒相關腦區活動有關,為慢性疼痛下的神經認知模型提供了實證基礎,有助于進一步探索疼痛與腦之間的聯系。
慢性疼痛;功能連接;磁共振成像;Meta分析
程健, 吳文. 慢性疼痛靜息態腦功能連接研究的Meta分析. 磁共振成像, 2017, 8(1): 26-32.
疼痛是一種不愉快的主觀感覺與情緒體驗,臨床上將疼痛分為急性疼痛和慢性疼痛[1-2]。慢性疼痛是指疼痛持續時間3個月以上,疼痛頻率至少每周1次且伴不愉快情緒的一種疼痛[3]。慢性疼痛多發遷延,不但給患者帶來軀體上的痛苦,也使其在精神上產生巨大壓力,嚴重影響患者的生活質量[4-6]。
研究人員發現,痛覺的形成與中樞神經元的編碼有關,這一過程涉及脊髓、腦干、大腦皮層等多個結構[7]。近年來, 靜 息 態 腦 功 能 磁 共 振 成像憑借其無創、無需試驗任務等獨特優勢,在臨床上已廣泛運用于各種疼痛的研究[8]。既往研究表明,人體的疼痛腦加工、感知覺辨認,都有島葉的參與[9-11];而靜息狀態下,慢性疼痛患者的默認網絡往往存在異常[12-14],為了明確二者之間的存在的關系,人們通常選擇島葉作為種子點,分析島葉與默認網絡之間的功能連接。但是由于功能磁共振高度敏感的特性以及研究方式的多種多樣,使得研究結果易受干擾,并且單一研究結果并不完全可靠,尚缺乏循證醫學的支持,因此,有必要對相關的fMRI研究進行Meta分析。
似然分析法(activation likelihood estimation,ALE)是 一 種由 Turkeltaub等[15]提 出 的 基于 體素坐標的腦區定位分析方法,通過對納入文獻的相關坐標進行三維高斯函數平滑和排列檢驗,達到定位腦區的目的。為了減少研究結果假陽性率,Eickhoff等[16]對統計 學 算 法 進 行了補充,引入一種基于錯誤發現率(false discovery rate,FDR)的檢驗方法,它是通過控制拒絕假設檢驗中出現誤判的比例來確定閾值,從而避免假陽性率發生;Eickhoff等[16]改 進 了 原 有 的統計學方法模型,把固定效應模型變為隨機效應模型,使得分析結果更加客觀、準確。與傳統圖表型Meta分析相比,ALE分析的最大優勢在于其客觀、量化的分析過程,通過計算各體素的ALE值,估計某特定體素被激活的可能性,從而定量整合分析fMRI研究結果,其結果可信度高,能夠避免傳統圖表類Meta分析主觀性強,容易產生偏倚和誤差的缺點。近年來ALE方法已廣泛運用于認知領域的腦功能研究中。本文基于似然分析法對慢性疼痛患者的腦區功能連接進行Meta分析,系統評估慢性疼痛患者靜息態腦區功能連接的變化特點。
1 材料與方法
1.1 納入與排除標準
1.1.1 研究設計
納入公開發表的慢性疼痛靜息態腦功能連接的fMRI研究,排除不能獲得全文的文獻,非靜息態的文獻以及急性疼痛的文獻,并且文獻中必須包含Talairach坐標或MNI坐標,語種設定為英文。
1.1.2 研究對象
(1)受試者必須是慢性疼痛患者且病情穩定;(2)國籍、性別和種族不限。
1.1.3 排除標準
(1)文獻信息不完整或數據有誤(如:缺少對照組);(2)重復文獻、文摘、綜述及講評類文獻;(3)組間基本資料(如:年齡、性別等)有統計學差異;(4)使用SPM、AFNI、FSL以外軟件進行數據分析的文獻。
1.1.4 干預措施
受試者保持靜息態(閉眼或睜眼),接受fMRI掃描。
1.1.5 結局指標
記錄島葉與默認網絡之間功能連接的Talairach坐標或MNI坐標。
1.2 方法
1.2.1 檢索策略
數據庫檢索Pubmed、EMBASE、Web Science、Science Direct、Springerlink、brainmap自建庫至2016年9月符合納入標準的所有靜息態fMRI研究,搜集所有關于慢性疼痛靜息態腦功能磁共振研究,語種限定為英文。檢索關鍵詞為:pain、chronic pain、resting-state、functional magnetic resonance imaging、fMRI、functional connectivity,并輔以人工檢索,以減少漏檢。
1.2.2 文獻篩選和數據提取
2名作者獨立評估入選數據,文章根據標題和摘要進行篩選,并解決有分歧的文章以達成共識。待確定文章后,2名作者分別獨立閱讀文章全文,必要時由第三方幫助完成。納入文獻中提取受試對象樣本量和激活區坐標。為了確定像素坐標的解剖位置,由2名研究者各自手工進行操作,參考Talairach and Tourneux的神經解剖立體定位圖譜進行校正,出現分歧通過兩位研究者討論解決。此外,手工進行細致分析,以防止有效數據丟失,對符合標準的研究進行數據提取。
1.2.3 數據分析
似然分析法(activation likelihood estimation,ALE)是一種由Turkehaub等[15]提出的基于體素坐標的功能腦區定位分析方法,通過對納入文獻的相關坐標進行三維高斯函數平滑和排列檢驗,達到定位腦區的目的。為了減少研究結果假陽性率,Eickhoff等[16]對統計學算法進行了補充,引入一種基于錯誤發現率(false discovery rate,FDR)的檢驗方法,通過控制拒絕假設檢驗中出現誤判的比例來確定閾值,避免假陽性率發生。Eickhoff等[16]改進了原有的統計學模型,把固定效應模型變為隨機效應模型,使得分析結果更加客觀、準確。
具體方法:(1)利用Icbm2tal軟件的坐標轉換功能將所得到的Talairach坐標統一轉換為MNI (Montreal Neurological Institute coordinates)坐標,依據ALE手冊中數據錄入方法將坐標數據分組錄入Ginger-ALE軟件。(2)使用Ginger-ALE 2.3軟件進行數據分析并計算腦區ALE分布圖。根據最大激活坐標峰值,按三維高斯分布建模,具體設定參數如下:高斯濾波全寬半高(full width half maximum,FWHM)值為8 mm,錯誤發現率(false discovery rate,FDR)值為0.005,像素簇閾值>200 mm3,經過軟件運算后得出腦區ALE分布圖。
1.2.4 腦區圖像結果
使用mango軟件(rii.uthscsa.edu/mango)以及brainmap.org標準腦解剖模板(http://brainmap.org/ ale/colin1.1_2X2X2.nii)顯示。
2 結果
2.1 檢索結果
數據庫檢索Pubmed、EMBASE、Web Science、Science Direct、Springerlink、brainmap自建庫至2016年9月符合納入標準的所有fMRI研究。初步檢索到文獻437篇,手工補充檢索12篇;通過閱讀文章題目、摘要、全文,排除重復文獻、非相關文獻以及使用SPM、AFNI、FSL以外軟件的文獻等,最終共納入20篇文獻(表1)。
2.2 Meta分析結果
納入的20篇文獻,共389例慢性疼痛患者,Meta分析結果表明,慢性疼痛狀態下,島葉與默認網絡之間的功能連接存在明顯異常(圖1);對默認網絡之間的腦區進行Meta分析,結果表明:默認網絡之間腦區的連接活動性,也存在異常。經過ALE軟件運算,島葉,前扣帶回,后扣帶回、楔前葉,頂下小葉,內側前額葉(表2,圖2~6),共提取出16個坐標。
3 討論
慢性疼痛是一種復雜的心理活動,是臨床上最常見的癥狀之一[1]。運用fMRI研究慢性疼痛是近年來的研究熱點[13-14,29-30]。根據研究目的不同大體可分:靜息態fMRI和任務態fMRI。靜息態fMRI因受試者無需實施特定任務,減少了由于個體差異帶來的誤差,因此具有較好的臨床應用價值[8]。相關研究表明:疼痛可導致大腦血流動力學的改變,使痛覺加工環路改變[31-33]。但目前尚無慢性疼痛對靜息態腦功能影響的循證分析,未能對其作用和有效性做出客觀評價。
功能連接是利用低頻BOLD信號的波動來研究不同腦區之間的功能相關性,其結果可以反映出神經元之間的內部聯系。本研究通過提取相關腦區的MNI坐標,對慢性疼痛患者靜息態腦功能連接研究的數據進行Meta分析,Meta分析結果表明,慢性疼痛會導致默認網絡的功能連接出現異常,說明疼痛腦加工與認知和情緒相關腦區活動有關。本研究選取島葉作為種子點,研究發現:島葉和楔前葉;島葉和前扣帶回;島葉和后扣帶回;島葉和頂下小葉;島葉和內側前額葉的功能連接均出現異常。除上述腦區之外,內側顳葉,腦干等區域,也會因為臨近腦區的異常連接活動性受到不同程度的影響。
華盛頓大學的Raichle等[13]采用PET技術最早定義了默認網絡。默認網絡是指大腦靜息態下相對活躍的區域,也是腦部復雜活動的重要支撐,包含多個重要功能的腦區,如:前扣帶回,后扣帶回,頂下小葉,內側前額葉等,這些腦區在靜息態時功能活動明顯[10]。Pyka等[14]認為:默認網絡同內外環境監測,自我意識及情緒加工等高級認知活動密切相關。研究顯示,慢性疼痛患者后扣帶回的功能連接明顯增強,充分說明了默認網絡的參與。另外,Fujiwara等[29]發現,默認網絡中的后扣帶回參與“獎賞中樞”的信息整合,通過對傳導信息的攝入進行推測判斷,促使相關腺體分泌多巴胺、內啡肽等物質,這些物質對痛覺起到了一定的抑制作用,從而間接參與患者的認知與情緒調控。
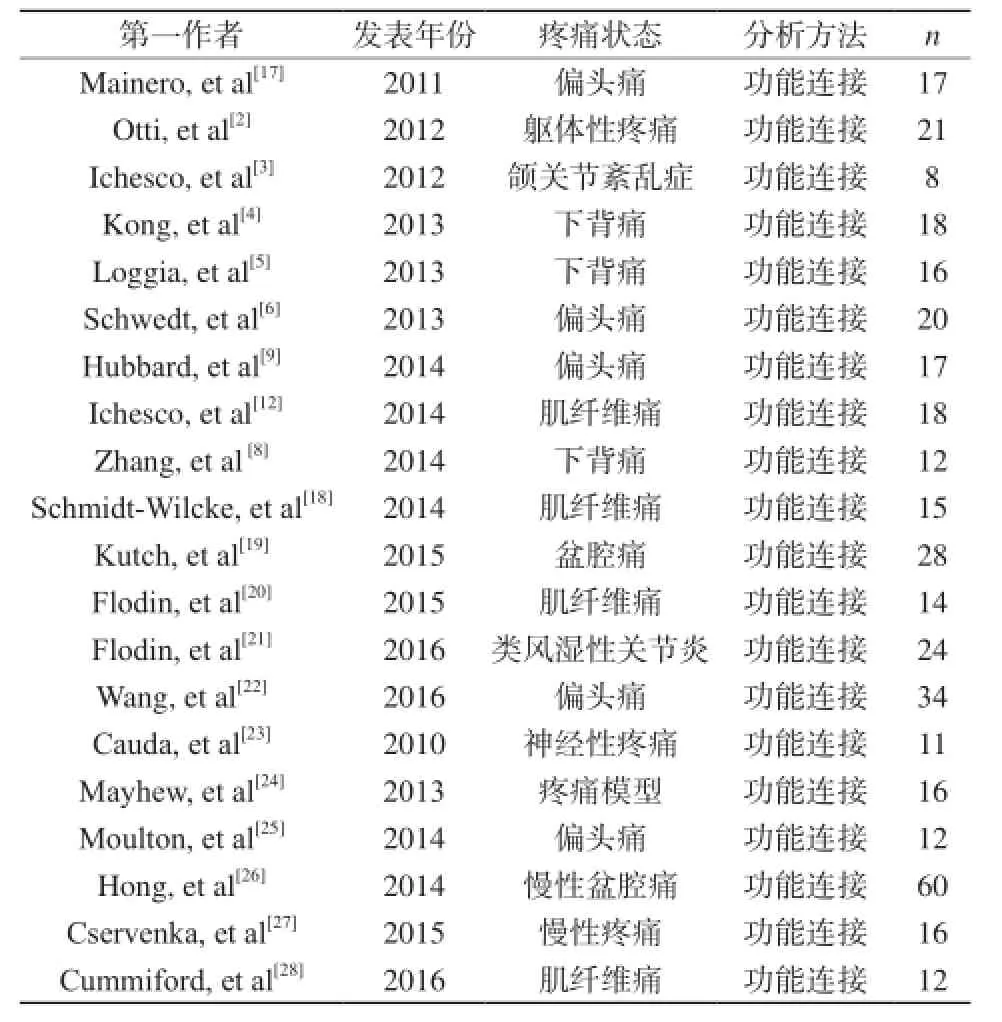
表1 納入文獻資料Tab. 1 Included in literature
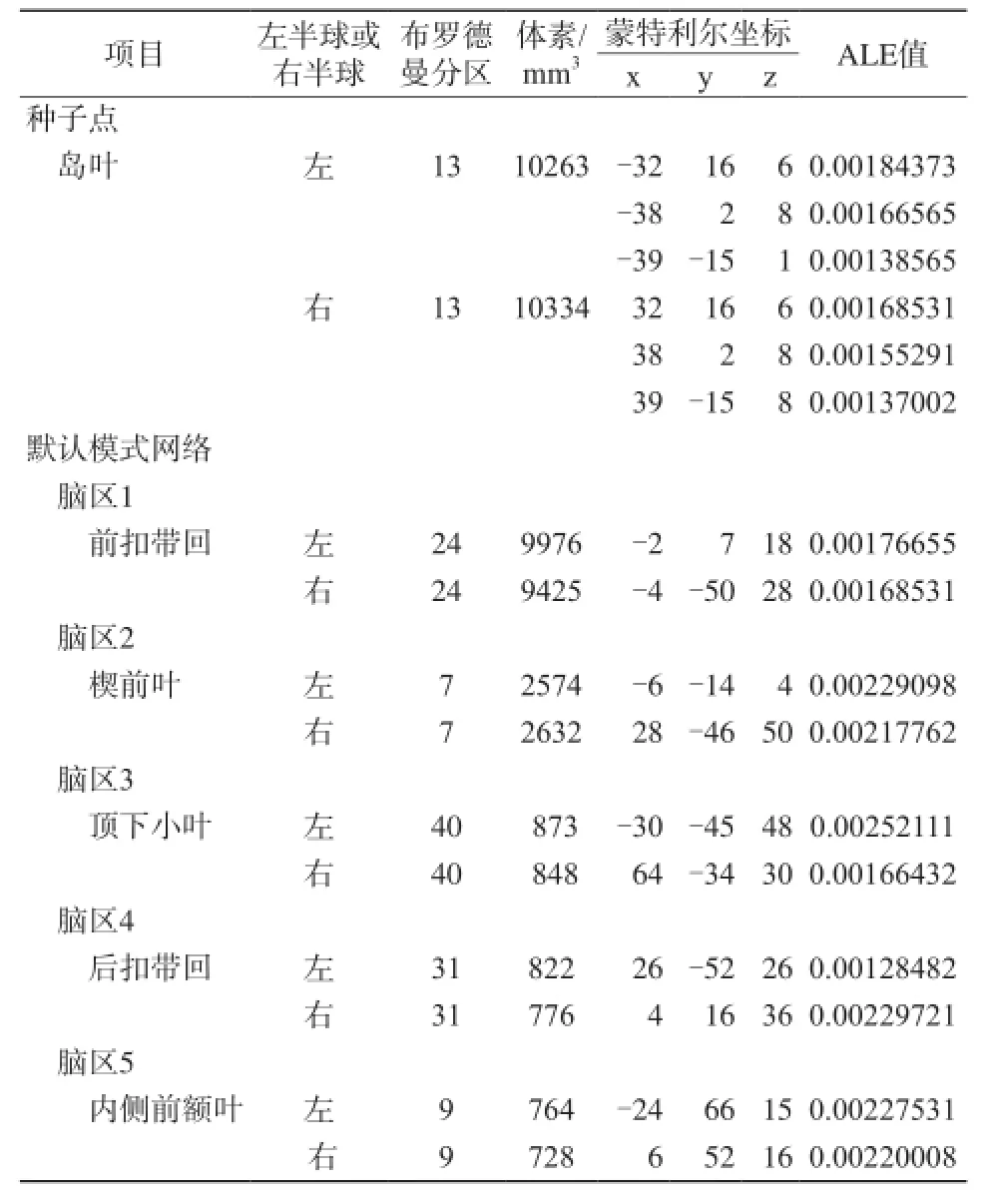
表2 慢性疼痛狀態下與島葉功能連接的腦區Tab. 2 Brain areas associated with the functional connectivity of the insular lobe in chronic pain
3.1 島葉
島葉與感覺、情感、認知等加工有關,是慢性疼痛中最常見的激活腦區之一,慢性疼痛患者的島葉區域活動性會明顯增強,這說明島葉對機體疼痛辨認以及內外感覺加工具有重要作用。Cservenka等[27]認為,島 葉 的激活也 會 明顯增加慢性疼痛對機體的影響,這一研究支持我們的結論。島葉表面的島中央溝將島葉分為前后兩部,前島葉接收來自丘腦腹內側核及杏仁核的投射纖維,與情感功能密切相關,影像證據表明,前島葉與邊緣系統存在廣泛聯系,可能是引起疼痛患者情緒變化的一個重要機制[34-35]。后島葉與次級感覺皮層相連,與軀體感覺以及運動功能相關。Zhang等[8]認為,靜息態下腰背痛患者的島葉與大腦皮質下區域存在廣泛的功能連接異常,這可能與中樞神經網絡編碼異常有關。
3.2 扣帶回
扣帶回(前扣帶回,后扣帶回)屬于默認網絡的重要組成部分,并且無論功能連接增強還是減弱,扣帶回都有參與,所以該區域在慢性疼痛中扮演了重要角色[11]。扣帶回與大腦皮層以及皮層下的許多核團都存在直接或間接的纖維聯系,可能在痛覺的整合、記憶、執行中扮演著重要角色。Flodin等[20]的研究發現,慢性疼痛患者的多個腦區與扣帶回的功能連接出現異常,這些連接異常可能與持續的慢性疼痛刺激有關。例如:在Cummiford等[28]的研究中,扣帶回與中央后回的功能連接強度減弱。此外,既往研究中發現,扣帶回和前額葉共同參與了軀體傷害-回避反應,而慢性疼痛會導致這種功能聯系減弱,可能與機體在長期疼痛中產生的適應性有關。另外,相關研究表明[17],該區域是控制痛覺傳導的重要結構,疼痛傳導信號也可對其產生抑制效應,并且會促使相關腺體分泌類嗎啡的生物激素,這可能與感覺傳導通路中的腦區神經元的反饋作用有關。Schwedt等[6]認 為,前 扣帶 回 作為 調節痛 覺的重要組成部分,會促使垂體分泌內啡肽,而內啡肽具有一定的鎮痛作用,與人類的情緒反應密切相關,這有力地支持了本組結論。
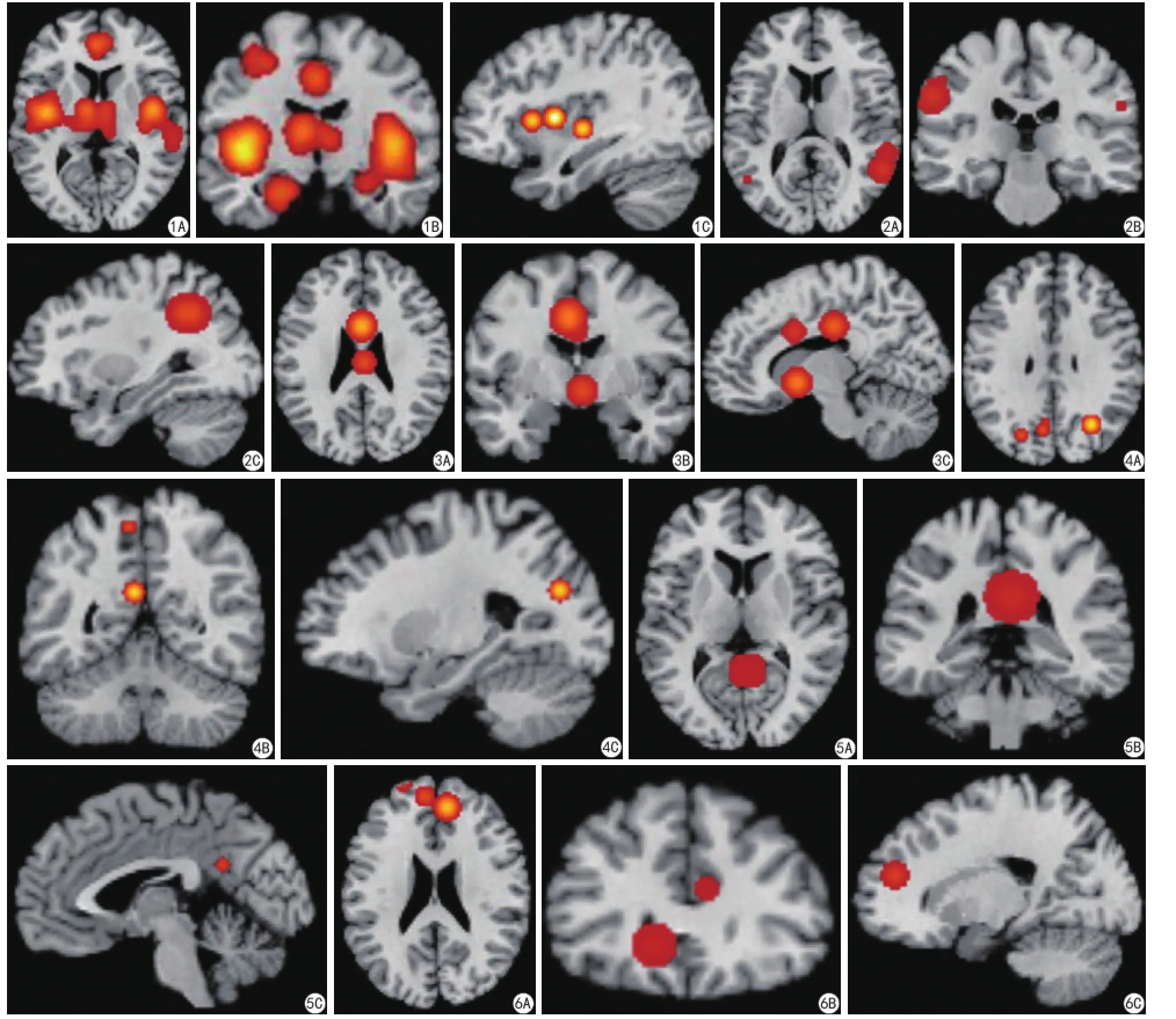
圖1 A:軸面;B:冠狀面;C:矢狀面。慢性疼痛狀態下,島葉與默認網絡功能連接異常,包括:島葉,前扣帶回,后扣帶回,楔前葉,頂下小葉,內側前額葉 圖2 A:軸面;B:冠狀面;C:矢狀面。頂下小葉的異常連接活動性 圖3 A:軸面;B:冠狀面;C:矢狀面。前扣帶回的異常連接活動性 圖4 A:軸面;B:冠狀面;C:矢狀面。楔前葉的異常連接活動性 圖5 A:軸面;B:冠狀面;C:矢狀面。后扣帶回的異常連接活動性 圖6 A:軸面;B:冠狀面;C:矢狀面。內側前額葉的異常連接活動性Fig. 1 A: Axial. B: Coronal. C: Sagittal. Brain areas with abnormal connectivity during resting-state fMRI in chronic pain: insula, anterior cingulate, posterior cingulate, precuneus, inferior parietal, medial prefrontal. Fig. 2 A: Axial. B: Coronal. C: Sagittal. Brain areas with abnormal connectivity during resting-state fMRI in chronic pain about inferior parietal. Fig. 3 A: Axial. B: Coronal. C: Sagittal. Brain areas with abnormal connectivity during restingstate fMRI in chronic pain about anterior cingulate. Fig. 4 A: Axial. B: Coronal. C: Sagittal. Brain areas with abnormal connectivity during restingstate fMRI in chronic pain about precuneus. Fig. 5 A: Axial. B: Coronal. C: Sagittal. Brain areas with abnormal connectivity during resting-state fMRI in chronic pain about posterior cingulate. Fig. 6 A: Axial. B: Coronal. C: Sagittal. Brain areas with abnormal connectivity during resting-state fMRI in chronic pain about medial prefrontal.
3.3 楔前葉
楔前葉與許多高水平的認知功能有關,如情景記憶、自我相關的信息處理,并參與注意-抑制網絡,能夠對干擾抑制進行調節[31-34],Kutch等[19]研究認為,楔前葉在調節注意-抑制網絡中起重要作用,該網絡存在大量節點,而節點與節點之間的功能連接變化可能是慢性疼痛患者認知功能改變的又一個潛在神經機制。
3.4 頂下小葉
頂下小葉也屬于默認網絡,具有整理、記憶和 存儲 功 能[36], 可 能 與 疼 痛 緩 解 的機 制 存 在 密切聯系,其機制尚不明確,有待于人們進一步研究。
3.5 內側前額葉
與扣帶回一樣,腦區連接活動性出現異常,內側前額葉都有參與。研究表明,內側前額葉可對痛覺感受性信息的傳入產生抑制性調制[37-38]。Mainero 等[17]的研究發現, 該 區 域接受痛覺信息后,可產生抑制效應,通過與鄰近腦區的相互作用可影響患者的認知功能。Wiech等[7]和Zhang等[8]的研究認為,慢性疼痛患者的內側前額葉與島葉前部存在明顯的功能連接,而額葉區是負責人類情感和認知活動的主要腦區,該區域的功能連接異常會導致其情感和認知異常而產生代償作用,這一研究有力地支持了我們的結論。
3.6 不足
本研究采用的ALE分析法,雖然可以整合既往同類的fMRI研究結果,但還是無法從整體的角度來觀察腦區之間的異常變化;此外,納入文獻中,由于慢性疼痛的病因、實驗條件不完全相同,仍然會存在一定的偏倚風險。這些是本研究的不足,還有待進一步改善。
3.7 結論
通過對既往研究Meta分析認為,靜息態下慢性疼痛患者的島葉與默認網絡的功能連接異常,反映出疼痛腦加工與感知覺辨認、認知和情緒相關腦區活動有關,為慢性疼痛下的神經認知模型提供了實證基礎,有助于人們進一步探索疼痛與腦之間的聯系。
[References]
[1]Linnman C, Beucke JC, Jensen KB, et al. Sex similarities and differences in pain-related periaqueductal gray connectivity. Pain, 2012, 153(2): 444-454.
[2]Otti A, Guendel H, Henningsen P, et al. Functional network connectivity of pain-related resting state networks in somatoform paindisorder: an exploratory fMRI study. J Psychiatr Neurosci, 2013, 38(1): 57-65.
[3]Ichesco E, Quintero A, Clauw DJ, et al. Schmidt-wilcke, altered functional connectivity between the insula and the cingulate cortex in patients with temporomandibular disorder: a pilot Study. Headache, 2012, 52(3):441-454.
[4]Kong J, Spaeth RB, Wey HY, et al. S1 is associated with chroniclow back pain: a functional and structural MRI study. Mol Pain, 2013, 9: 43.
[5]Loggia ML, Kim J, Gollub RL, et al. Default mode network connectivity encodes clinical pain: an arterial spin labeling study. Pain, 2013, 154(1): 24-33.
[6]Schwedt TJ, Schlaggar BL, Mar S, et al. Atypical resting-state functional connectivity of affective pain regions in chronic migraine. Headache, 2013, 53(5): 737-751.
[7]Wiech K, Ploner M, Tracey I. Neurocognitive aspects of pain perception. Trends Cognit Sci, 2008, 12(8): 306-313.
[8]Zhang S, Wu W, Huang G, et al. Resting-state connectivity inthe default mode network and insula during experimental low back pain, Neural Regen Res, 2014, 9(2): 135-142.
[9]Hubbard CS, Khan SA, Keaser ML, et al. Altered brain structure and function correlate with disease severity and pain catastrophizing in migraine patients. eNeuro, 2014, 1(1): e20.
[10]Derbyshire SW. Exploring the pain “neuromatrix”. Curr Rev Pain, 2000, 4(6): 467-477.
[11] Vincent JL, Kahn I, Snyder AZ, et al. Evidence for a frontoparietalcontrol system revealed by intrinsic functional connectivity. J Neurophysiol, 2008, 100(6): 3328-3342.
[12]Ichesco E, Schmidt-Wilcke T, Bhavsar R, et al. Altered resting state connectivity of theinsular cortex in individuals with fibromyalgia. Pain, 2014, 15(8): 815-823.
[13]Raichle EM, Snyder AZ. A default mode of brain function: abrief history of an evolvingidea. Neuroimage, 2007, 37(4): 1083-1090.
[14]Pyka M, Beckmann CF, Sch?ning S, et al. Impact of working memory load on fMRI resting state pattern in subsequent resting phases. PloS One, 2008, 4(9): e7198.
[15]Turkeltaub PE, Eden GF, Jones KM, et al. Meta-analysis of the functional neuro anatomy of single-word reading: method and validation. Neuroimage, 2002, 16(3 Pt 1): 765-780.
[16]Eickhoff SB, Laird AR, Grefkes C, et al. Coordinate-basedactivation likelihood estimation Meta-analysis of neuroimaging data: a randomeffects approachbased on empirical estimates of spatial uncertainty. Hum Brain Mapp, 2009, 30(9): 2907-2926.
[17]Mainero C, Boshyan J, Hadjikhani N, et al. Altered functional magnetic resonance imagingresting-state connectivity in periaqueductal gray networks in migraine. Ann Neurol, 2011, 70(5): 838-845.
[18]Schmidt-Wilcke T, Ichesco E, Hampson JP, et al. Resting state connectivity correlates with drug and placebo response in fibromyalgiapatients. Neuroimage Clin, 2014, 6: 252-261.
[19]Kutch JJ, Yani MS, Asavasopon S, et al. Altered resting stateneuromotor connectivity in men with chronic prostatitischronic pelvic pain syndrome. A MAPP: research network neuroimaging study. Neuroimage Clin, 2015, 8: 493-502.
[20]Flodin P, Martinsen S, Mannerkorpi K, et al. Normalization of aberrant resting state functional connectivity in fibromyalgia patientsfollowing a three month physical exercise therapy. Neuroimage Clinl, 2015, 9: 134-139.
[21]Flodin P, Martinsen S, Altawil R, et al. Intrinsic brain connectivity in chronic pain: a resting-state fmri study in patients with rheumatoid arthritis. Front Hum Neurosci, 2016, 10: 107.
[22]Wang T, Chen N, Zhan W, et al. Altered effective connectivity of posterior thalamus in migraine with cutaneous allodynia: aresting-state fMRI study with granger causality analysis. J Headache Pain, 2016, 17: 17.
[23]Cauda F, D'Agata F, Sacco K, et al. Altered resting state attentional networks in diabetic neuropathic pain. J Neurol Neurosurg Psychiatry, 2010, 81(7): 806-811.
[24]Mayhew SD, Hylands-White N, Porcaro C, et al. Intrinsicvariability in the human response to pain is assembled from multiple, dynamic brain processes. Neuroimage, 2013, 75: 68-78.
[25]Moulton EA, Becerra L, Johnson A, et al. Altered hypothalamic functional connectivity with autonomic circuits and the locus coeruleus in migraine. PloS One, 2014, 9(4): e95508.
[26]Hong JY, Kilpatrick LA, Labus J, et al. Patients with chronic visceral pain show sex-related alterations in intrinsic oscillations of the resting brain. J Neurosci, 2013, 33(29): 11994-12002.
[27]Cservenka A, Stein H, Wilson AC, et al. Neurobiological phenotypes of familial chronic pain in adolescence: a pilot fMRI study. J Pain, 2015, 16(9): 913-925.
[28]Cummiford CM, Nascimento TD, Foerster BR, et al. Changes in resting state functional connectivity after repetitive transcranial directcurrent stimulation applied to motor cortex in fibromyalgia patients. Arthritis Res Ther, 2016, 18: 40.
[29]Fujiwara J, Tobler PN, Taira M, et al. Segregated and Integrated Coding of Reward and Punishment in the Cingulate Cortex. J Neurophysiol, 2009, 101(6): 3284-3293.
[30]Wey H, Catana C, Hooker JM, et al. Simultaneous fMRI-PET of the opioidergic pain system inhuman brain. Neuroimage, 2014, 102(Pt 2): 275-282.
[31]Napadow V, LaCount L, Park K, et al. Intrinsic brainconnectivity in fibromyalgia is associated with chronic pain intensity. Arthritis Rheum, 2010, 62(8): 2545-2555.
[32]Blessing EM, Beissner F, Schumann A, et al. A data-driven approach tomapping cortical and subcortical intrinsic functional connectivity along the longitudinal hippocampal axis. Hum Brain Mapp, 2016, 37(2): 462-476.
[33]Cauda F, Sacco K, D' Agata F, et al. Low-frequency BOLD fluctuations demonstrate altered thalamocortical connectivity in diabeticneuropathic pain. BMC Neurosci, 2009, 138(10): 1-14.
[34] Turkeltaub PE, Eden GF, Jones KM, et al. Meta-analysis of the functional neuroanatomy of single-word reading: method and validation. Neuroimage, 2002, 16(3 Pt 1): 765-780.
[35]Baliki MN, Geha PY, Apkarian AV, et al. Beyond feeling: chronic pain hurts the brain, disrupting the default-mode network dynamics. J Neurosci, 2008, 28(6):1398-1403
[36]Banks SJ, Eddy KT, Angstadt M, et al. Amygdala-frontal connectivity during emotion regulation. Soc Cogn Affect Neurosci, 2007, 2(4): 303-312.
[37]Duke Han S, Buchman AS, Arfanakis K, et al. Bennett, Functional connectivity networks associated with chronic musculoskeletal pain in old age. Int J Geriatr Psych, 2013, 28(8): 858-867.
[38]Tessitore A, Russo A, Giordano A, et al. Disrupted default mode network connectivity in migraine without aura. J Headache Pain, 2013, 14: 89.
Imbalanced communication among brain networks in chronic pain disorder: Meta-analysis of resting-state functional connectivity
CHENG Jian, WU wen*
Department of Rehabilitation Medicine, Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China
*
Wu W, E-mail: wuwen66@163.com
Received 29 Sep 2016, Accepted 27 Nov 2016
ACKNOWLEDGMENTSThis work was supported by Grants from the National Natural Science Foundation of China (NNSFC), China (No. 81473769) and the Natural Science Foundation of Guangdong Province, China (No. 2014A030313335).
Objective:To describe the change of functional connectivity of resting-state brain in chronic pain status by Meta-analysis.Materials and Methods:A database search was performed in PubMed, EMBASE, Web of Science, and BrainMap for literature published from database establishment to September 2016. Based on inclusion and exclusion criteria, studies supporting fMRI analysis of the resting-state brain in chronic pain were collected. The Talairach coordinates are uniformly transformed into MNI coordinates using Icbm2tal software.Results:Twenty studies were identified with a total of 389 subjects. Meta-analysis showed that chronic pain causes abnormal functioning of the default network. We chose insula as seed, the hyperconnectivity consists between insula and regions of default mode network include anterior cingulate, posterior cingulate, precuneus, inferior parietal lobule and medial prefrontal cortex.Conclusions:Our results suggest that abnormal functional connectivity between insula and default mode networks, may reflect chronic pain towards cognitive control and emotion processing. These findings provide an empirical foundation for a neurocognitive model in which brain network underlies core cognitive and affective abnormalities in chronic pain.
Chronic pain; Functional connectivity; Magnetic resonance imaging; Meta-analysis
國家自然科學基金資助課題(編號:81473769);廣東省自然科學基金項目(編號:2014A030313335)
南方醫科大學附屬珠江醫院康復科,廣州 510282
吳文,E-mail:wuwen66@163.com
2016-09-29
R445.2;R441.1
A
10.12015/issn.1674-8034.2017.01.007
接受日期:2016-11-27

