白細胞介素-9在肺結核患者血漿和T細胞中表達水平的研究
廖莎 霍鳳敏 楊新婷 唐神結 陳效友 孫照剛
?
·論著·
白細胞介素-9在肺結核患者血漿和T細胞中表達水平的研究
廖莎 霍鳳敏 楊新婷 唐神結 陳效友 孫照剛
目的 比較肺結核患者、結核潛伏感染(latent tuberculosis infection,LTBI)者和健康人群血漿中白細胞介素-9(interleukin-9,IL-9)表達水平,以及各人群輔助性T細胞9(Th9)細胞亞群經結核特異性早期分泌抗原靶蛋白6(early secreting antigen target 6 kD,ESAT-6)刺激前后的變化,探索IL-9的表達特點。方法 選取2015年4月至2016年4月于首都醫科大學附屬北京胸科醫院結核科住院治療的43例初治肺結核患者作為肺結核組;LTBI 組和健康對照組均來自2015年12月于本院進行體檢的健康體檢者,其中健康對照組33名,LTBI組38例。收集研究對象血漿,采用酶聯免疫吸附法檢測其血漿中IL-9水平;采用流式細胞術檢測各組人群外周血單核淋巴細胞經ESAT-6刺激前后Th9細胞的比率。結果 肺結核組血漿IL-9表達水平為175.04(149.67~221.70) pg/ml,LTBI組為60.21(48.43~102.37) pg/ml,健康對照組為88.19(73.82~113.79) pg/ml。肺結核組血漿IL-9表達水平明顯高于LTBI組(Z=7.64,P<0.01)和健康對照組(Z=5.18,P<0.01)。肺結核組Th9淋巴細胞比率為0.17% (0.14%~0.23%),LTBI組為0.14%(0.10%~0.16%),健康對照組為0.15%(0.11%~0.20%),各組間比較差異無統計學意義(H=4.45,P>0.05)。經ESAT-6刺激培養后,肺結核組Th9細胞比率為0.11%(0.09%~0.14%),LTBI組為0.10%(0.07%~0.12%),健康對照組為0.11%(0.11%~0.14%),三組比較差異無統計學意義(H=1.13,P>0.05);各組刺激前后Th9細胞比率,肺結核組差異有統計學意義(Z=-3.20,P<0.05);LTBI組差異有統計學意義(Z=-3.32,P<0.05)。結論 IL-9在肺結核患者血漿中的表達水平高于LTBI者和健康人群,其對肺結核診斷具有一定的輔助價值。
結核,肺; 白細胞介素9; 酶聯免疫吸附測定; 流式細胞術; 評價研究
結核病是由結核分枝桿菌(Mycobacteriumtuberculosis,MTB)感染引起的一種慢性傳染性疾病,全球約有1/3的人群感染MTB,約有5%~10%的結核潛伏感染(latent tuberculosis infection,LTBI)者發展為活動性結核病[1-2]。我國是結核病高發國家,LTBI率達44.5%[3]。現有的診斷方法,如結核菌素皮膚試驗(tuberculin skin test,TST)和γ-干擾素釋放試驗(interferon gamma release assay,IGRA)等目前廣泛使用的結核病免疫診斷方法,不能滿足現實的需求[4-6]。因此,探索用于輔助診斷的新方法將有力促進結核病的控制[7]。
白細胞介素-9(interleukin-9,IL-9)主要由新型效應性T細胞Th9分泌,同時Th2、Th17、調節性T細胞(regulatory T cell,Treg)、自然殺傷性T細胞(nature killer T cell,NKT)和肥大細胞等也可以分泌。IL-9是一種多效應的細胞因子,在多種疾病中起著重要的應答和調節作用[3],其在活動性結核病患者血清中的分泌水平高于健康人群。但是,目前尚沒有系統比較IL-9在肺結核患者、LTBI者和健康人群中表達差異的研究。筆者通過檢測健康人群、LTBI者和肺結核患者血漿中IL-9表達水平,以及各人群Th9細胞亞群經結核特異性早期分泌抗原靶蛋白6(early secreting antigen target 6 kD,ESAT-6)刺激前后的變化,探索IL-9的表達特點。
對象和方法
一、研究對象和樣本收集
選取2015年4月至2016年4月于首都醫科大學附屬北京胸科醫院結核科住院治療的初治肺結核患者作為肺結核組,共43例;患者均經臨床癥狀、胸部CT掃描、痰涂片抗酸染色、結核分枝桿菌培養及菌群鑒定確診,其中11例痰培養陽性,9例痰涂片抗酸染色陽性,其余23例經病理學、影像學和GeneXpert檢測確診,且入組前治療時間均≤4周。排除慢性非傳染性疾病(如糖尿病、肺部腫瘤)、自身免疫性疾病(如腎炎、類風濕性關節炎、系統性紅斑狼瘡等)、感染性疾病(如病毒性肝炎、寄生蟲感染等)、其他呼吸系統疾病患者,以及HIV感染者和免疫抑制劑使用者。
LTBI組和健康對照組均來自2015年12月于首都醫科大學附屬北京胸科醫院進行體檢的健康體檢者。健康對照組共33名, TST硬結平均直徑均<5 mm,經結核感染T細胞斑點試驗(T-SPOT.TB)檢測提示MTB感染陰性,無咳嗽、咯痰、發熱等相關癥狀,無慢性病史,無呼吸系統疾病。LTBI組共38例, TST硬結平均直徑均>10 mm,T-SPOT.TB檢測陽性,均無咳嗽、咯痰、發熱等相關癥狀,胸部X線攝影檢查無異常,無慢性病史,無呼吸系統疾病。
所有研究對象均抽取4 ml靜脈血于肝素鈉抗凝管中備用。本研究經首都醫科大學附屬北京胸科醫院倫理委員會批準,研究對象入組前均簽訂知情同意書。
二、主要設備和試劑
1.設備:流式細胞分析采用美國BD公司FACSCalibur型流式細胞儀,酶標儀為美國Thermo Fisher公司生產。CO2培養箱購自上海Heal Force公司。離心機購自日本日立公司。
2.試劑:IL-9檢測試劑盒購自美國Cloud-Clone公司。單克隆抗體:CD3-PerCP、CD4-FITC、CD8-APC、溶血素、阻斷劑均購自美國BD公司;IL-9-PE、固定劑和破膜劑均購自美國eBioscience公司;ESAT-6特異性抗原購自英國Oxford公司;RPMI1640培養基購自美國Hyclone公司。
三、實驗檢測
1.酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA):取各組研究對象靜脈血液3 ml于肝素鈉抗凝管中,4 ℃離心15 min,離心轉速為3000 r/min,離心半徑為15 cm。收集上清于凍存管中,置于-80 ℃凍存備用。ELISA法檢測研究對象血漿IL-9水平,操作過程嚴格按照試劑盒說明進行。
2.流式細胞術分析:取研究對象肝素鈉抗凝血0.5 ml于12孔細胞培養板中,加入RPIM1640培養基充分混勻,總體積1 ml。研究對象均設置ESAT-6刺激培養組和未刺激組。抗原刺激組加入ESAT-6(終濃度為10 μg/ml),未刺激組加入等體積RPMI1640培養基,充分混勻,置于5% CO2培養箱中,37 ℃孵育。20 h后在培養體系中加入阻斷劑,終濃度為0.7 μl/ml,繼續培養5~6 h。進行細胞表面CD3-PerCP、CD8-APC、溶血素、破膜劑、細胞內IL-9-PE因子染色。具體操作均參照各抗體說明書進行。應用流式細胞儀進行結果檢測分析。在淋巴細胞設門里分析CD3+細胞表達情況,在CD3+細胞設門里分析Th9細胞的表達情況。
四、統計學分析
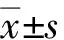
結 果
一、基本情況
肺結核組43例,其中,男23例(53.5%),女20例(46.5%),平均年齡(36.5±10.5)歲;LTBI組共38例,其中,男20例(52.6%),女18例(47.4%),平均年齡(34.4±12.9)歲;健康對照組共33名,其中,男18名(54.5%),女15例(45.5%),平均年齡(27.7±5.2)歲。三組研究對象年齡和性別構成均衡可比(F=1.58,P=0.119;χ2=0.02,P=0.980)。
二、血漿IL-9水平檢測
肺結核組血漿IL-9表達水平為175.04(149.67~221.70) pg/ml,LTBI組為60.21(48.43~102.37) pg/ml,健康對照組為88.19(73.82~113.79) pg/ml。肺結核組血漿IL-9表達水平明顯高于LTBI組(Z=7.64,P<0.01)和健康對照組(Z=5.18,P<0.01),健康對照組和LTBI組比較,差異無統計學意義(Z=-2.11,P>0.05)。
三、外周血單核細胞中Th9細胞比率
血漿中的IL-9主要來源于Th9淋巴細胞,因此,進一步采用流式細胞分析技術檢測Th9淋巴細胞在外周血單核細胞中的比率。結果顯示,肺結核組Th9淋巴細胞比率為0.17% (0.14%~0.23%),LTBI組為0.14%(0.10%~0.16%),健康對照組為0.15%(0.11%~0.20%),各組間比較差異無統計學意義(H=4.45,P>0.05)。
四、抗原刺激對Th9細胞比率的影響
在結核特異性抗原ESAT-6刺激培養后,肺結核組Th9細胞比率為0.11%(0.09%~0.14%),LTBI組為0.10%(0.07%~0.12%),健康對照組為0.11%(0.11%~0.14%),三組比較差異無統計學意義(H=1.13,P>0.05)。分別比較各組研究對象經ESAT-6刺激培養前后Th9細胞比率,肺結核組差異有統計學意義(Z=-3.20,P<0.05);LTBI組差異有統計學意義(Z=-3.32,P<0.05);健康對照組差異無統計學意義(Z=-1.83,P>0.05)。
討 論
免疫學方法是一種簡單、快速、無創的結核病輔助診斷方法,本研究探索了IL-9在肺結核患者中的分泌特點及其潛在的應用價值。IL-9是主要由新型效應T細胞Th9淋巴細胞分泌的一種細胞因子[8-9],同時CD8+T細胞、γδ T細胞也有一定的分泌[10]。研究表明,IL-9 是一種具有多種生物學功能的細胞因子,參與機體多種疾病的免疫調節過程。研究發現,IL-9在諸如慢性乙型肝炎[11]、寄生蟲感染[12]等患病過程中表達升高,但在幽門螺旋桿菌感染中有不同的報道[13-14]。另有研究表明IL-9在肺結核患者血清中的表達水平高于健康人群[7,10]。本研究用ELISA方法檢測肺結核患者、LTBI者、健康對照者血漿中IL-9的表達水平,研究發現肺結核患者血漿中IL-9的表達水平明顯高于健康對照者,與其他研究結果相似[7],同時本研究發現肺結核患者血漿中IL-9的表達水平明顯高于LTBI者。可見,血漿中IL-9水平的檢測對于結核病診斷有一定的輔助意義。
同時,筆者在細胞水平檢測了Th9細胞的比率,通過流式細胞技術分析研究對象經結核特異性抗原ESAT-6刺激前后Th9細胞在外周血單核細胞中比率的變化。結果表明,肺結核患者Th9細胞比率與LTBI者及健康人群相比差異沒有統計學意義。考慮由于淋巴細胞亞群中Th9細胞的比率較低,流式細胞檢測術敏感度不足,因此,本次研究未能發現Th9細胞的比率在肺結核患者、LTBI者和健康人群間的差異。
研究發現,IL-9參與損傷Th1型細胞抗結核免疫反應,IL-9的表達水平與γ-干擾素(IFN-γ)的表達水平呈明顯負相關甚至拮抗關系,通過外原性中和IL-9或者敲除IL-9基因,可以明顯提高體內外IFN-γ的表達水平[15]。同時,IFN-γ可以通過抑制IL-4的表達來降低IL-9的表達水平[16]。筆者發現,通過結核特異性抗原刺激后,肺結核患者Th9細胞比率明顯低于刺激前,可能因ESAT-6刺激外周血單核細胞后IFN-γ釋放水平上升,從而抑制IL-9的表達[14-15]。
綜上所述,本研究發現IL-9在肺結核患者血漿中的表達水平明顯高于LTBI者和健康對照者,提示有望通過檢測人群血漿IL-9來予以區分;肺結核患者血漿標本經結核特異性抗原刺激后,Th9細胞在外周血單核細胞中的比率降低,說明經抗原刺激后流式細胞分析法并不適合Th9細胞比率的檢測。針對以上結論,還應擴大樣本量進一步研究;同時,本次研究未納入其他呼吸系統感染性疾病患者,對于IL-9在肺結核與其他呼吸系統疾病中的表達差異有待繼續探索。
[1] World Health Organization. Global tuberculosis report 2015. Geneva: World Health Organization, 2015.
[2] Zumla A, George A, Sharma V, et al. WHO’s 2013 global report on tuberculosis: successes, threats, and opportunities. Lancet, 2013, 382(9907): 1765-1767.
[3] 劉二勇, 周林, 成詩明. 結核分枝桿菌潛伏性感染及預防性治療研究進展的系統評價. 中國防癆雜志, 2013, 35(4): 231-239.
[4] Diagnostic standards and classification of tuberculosis in adults and children. Am J Respir Crit Care Med, 2000, 161(4 Pt 1): 1376-1395.
[5] Morgan M, Kalantri S, Flores L, et al. A commercial line probe assay for the rapid detection of rifampicin resistance inMycobacteriumtuberculosis: a systematic review and meta-ana-lysis. BMC Infect Dis, 2005, 5: 62.
[6] Chegou NN, Black GF, Kidd M, et al. Host markers in QuantiFERON supernatants differentiate active TB from latent TB infection: preliminary report. BMC Pulm Med, 2009, 9: 21.
[7] Hur YG, Kang YA, Jang SH, et al. Adjunctive biomarkers for improving diagnosis of tuberculosis and monitoring therapeutic effects. J Infect, 2015, 70(4): 346-355.
[8] Dardalhon V, Awasthi A, Kwon H, et al. IL-4 inhibits TGF-beta-induced Foxp3+T cells and, together with TGF-beta, generates IL-9+IL-10+Foxp3-effector T cells. Nat Immunol, 2008, 9(12): 1347-1355.
[9] Veldhoen M, Uyttenhove C, van Snick J, et al. Transforming growth factor-beta ‘reprograms’ the differentiation of T hel-per 2 cells and promotes an interleukin 9-producing subset. Nat Immunol, 2008, 9(12): 1341-1346.
[10] 梁友寶. 肺結核患者外周血中分泌IL-9的淋巴細胞亞群的探討. 蚌埠: 蚌埠醫學院, 2011.
[11] 鄧勇, 蘇智軍, 余雪平, 等. 慢性乙型肝炎患者外周血IL-9和IL-10及TGF-β1檢測及其意義. 中國病毒病雜志, 2012, 2(4): 296-300.
[12] 沙地克·阿帕爾, 吐爾洪江·吐遜, 馬海長, 等. 肝臟泡型包蟲病患者外周血單個核細胞IL-9、PU.1及IRF-4 mRNA表達水平的研究. 中國病原生物學雜志, 2015, 10(1): 46-49.
[13] 余抒, 鄒全明. 腸出血性大腸桿菌O157:H7E07表位的免疫學性質研究和IL-9/CD4+IL-9+T細胞在幽門螺桿菌感染中的作用研究. 重慶: 第三軍醫大學, 2011.
[14] 程平. IL-9+CD4+T細胞/IL-9與幽門螺桿菌感染的相關性研究和γδT細胞在金黃色葡萄球菌肺炎的宿主應答中的作用. 重慶: 第三軍醫大學, 2013.
[15] Wu B, Huang C, Kato-Maeda M, et al. IL-9 is associated with an impaired Th1 immune response in patients with tuberculosis. Clin Immunol, 2008, 126(2): 202-210.
[16] Schmitt E, Germann T, Goedert S, et al. IL-9 production of naive CD4+T cells depends on IL-2, is synergistically enhanced by a combination of TGF-beta and IL-4, and is inhibited by IFN-gamma. J Immunol, 1994, 153(9): 3989-3996.
(本文編輯:李敬文)
A study of the interleukin-9 expression in plasma and T cells in pulmonary tuberculosis patients
LIAOSha,HUOFeng-min,YANGXin-ting,TANGShen-jie,CHENXiao-you,SUNZhao-gang.
NationalClinicalLaboratoryonTuberculosis,BeijingChestHospital,CapitalMedicalUniversity,Beijing101149,China
Correspondingauthor:SUNZhao-gang,Email:sunzg75@163.com
Objective To compare interleukin-9 (IL-9) expression in plasma and the proportion of Th9 cell subsets change before and after stimulated byMycobacteriumtuberculosisspecific early secreting antigen target 6 kD (ESAT-6) in pulmonary tuberculosis patients, latent tuberculosis infection (LTBI) ones and healthy-control people, in order to explore the feature of IL-9 expression. Methods A total of 43 pulmonary tuberculosis patients with initial treatment were selected from Department of Tuberculosis, Beijing Chest Hospital, Capital Medical University between April 2015 and April 2016. The LTBI group (n=38) and the healthy control group (n=33) were all from those who getting physical examination in our hospital on December 2015. Plasma levels of IL-9 were measured by enzyme linked immunosorbent assay (ELISA), and the ratio of Th9 cells in peripheral blood mononuclear cells was measured by flow cytometry before and after stimulation with ESAT-6. Results The plasma level of IL-9 in pulmonary tuberculosis group, LTBI group, heathy-control group were 175.04 (149.67-221.70) pg/ml, 60.21 (48.43-102.37) pg/ml, and 88.19 (73.82-113.79) pg/ml respectively. The level of IL-9 in pulmonary tuberculosis group was significantly higher than those in LTBI group (Z=7.64,P<0.01) and heathy-control group (Z=5.18,P<0.01). Percents of Th9 in the three groups were 0.17% (0.14%-0.23%), 0.14% (0.10%-0.16%), and 0.15% (0.11%-0.20%) respectively; there was no statistical significance (H=4.45,P>0.05). After stimu-lated with ESAT-6, differences of percents of Th9 in the three groups were 0.11% (0.09%-0.14%), 0.10% (0.07%-0.12%), 0.11% (0.11%-0.14%) respectively and there was no statistical significance in the three groups (H=1.13,P>0.05). However, significant differences of Th9 before and after stimulated with ESAT-6 were found in in pulmonary tuberculosis group (Z=-3.20,P<0.05) and LTBI group (Z=-3.32,P<0.05). Conclusion The plasma level of IL-9 in pulmonary tuberculosis patients is significantly higher than those in LTBI or heathy-control ones, which has subsidiary value in the diagnosis of tuberculosis.
Tuberculosis, pulmonary; Interleukin-9; Enzyme-linked immunosorbent assay; Flow cytometry; Evaluation studies
10.3969/j.issn.1000-6621.2017.03.013
北京市醫院管理局臨床醫學發展專項基金(ZYLX201304);首都醫學發展專項基金(2016-2-1043);北京結核病臨床數據和樣本資源庫項目(D131100005313012)
101149 首都醫科大學附屬北京胸科醫院國家結核病臨床實驗室(廖莎、霍鳳敏、孫照剛),結核三科(楊新婷、陳效友),結核一科(唐神結)
孫照剛,Email:sunzg75@163.com
2016-09-06)

