牛腹瀉病毒檢測(PCR法)及其影響因素分析
林春麗+張海波+陳紅霞+侯春燕+云雨生


摘要:PCR技術是一種體外模擬自然DNA復制過程的核酸擴增技術,該技術通過重復高溫變性、低溫退火、中溫延伸等簡單的3個溫度循環,能將靶DNA擴增數百萬倍,獲得極高的檢測敏感性。通過PCR技術對新生牛是否帶有牛病毒性腹瀉病毒的血清樣本進行檢驗,并對影響其檢測效果的因素進行了分析。
關鍵詞:牛腹瀉病毒(BVDV);PCR;引物
中圖分類號:S858.23 文獻標識碼:A 文章編號:1007-273X(2017)04-0005-02
牛病毒性腹瀉(黏膜病)是由牛病毒性腹瀉病毒[1](Bovine viral diarrhea virus,BVDV)引起的傳染病,各種年齡的牛均易感染、以幼齡牛易感性最高。
牛病毒性腹瀉(黏膜病)的病原體屬于披膜病毒科瘟病毒屬的成員。病毒粒子呈圓形,有囊膜,直徑50~80 nm。RNA核芯直徑(24±4)nm,分子量3×106,沉降系數80~90 s。
牛病毒性腹瀉(黏膜病)可以穿過胎盤感染,特別是懷孕早期。其病毒血清抗體陰性的母牛一旦感染,常常通過胎盤使胎兒產生免疫抑制,引起持續性病毒血癥,如果小牛正常產出,病毒血癥能持續地帶入成年期,這種牛臨床貌似健康,血清中又無保護性抗體,但體內始終帶毒,是牛群中最危險的傳染源[2]。
本研究是通過PCR技術檢驗新生牛是否帶有牛病毒性腹瀉病毒,排除患病牛,制備無病毒血清,進一步用于獸藥的研制,并對影響其檢測效果的因素進行了分析。
1 材料與方法
1.1 材料
1.1.1 主要試劑 RNAiso plus,購自Takara公司;氯仿、無水乙醇、75%乙醇,DEPC水、ddH2O、DNA Marker購自TakaRa公司;核酸染料購自百泰克有限公司。
1.1.2 器材、儀器準備 1 000 μL槍,200 μL槍,50 μL槍,1 000 μL槍頭,200 μL槍頭,75%酒精棉,止血鉗,EP管,EP管架;PCR擴增儀(美國伯樂公司,型號為S1000)等。
1.1.3 樣品 共24個樣本,包括22個未知樣本(均為新生牛初血清),陰性對照和陽性對照。
1.2 方法
PCR技術,即聚合酶鏈式反應(Polymerase chain reaction,PCR)是由Saiki發明,因其技術對世界生物醫學的巨大推動作用,獲得了1992年的諾貝爾醫學獎[3]。由美國PE-Cetus公司的Kary Banks Mulis在1985年建立的[4]。這項技術可在試管內經數小時反應就將特定的DNA片段擴增數百萬倍,這種迅速獲取大量單一核酸片段的技術在分子生物學研究中具有舉足輕重的意義,極大地推動了生命科學的研究進展。
1.2.1 提取步驟
(1)取2 mL無菌無酶EP管,加入RNA Siso Plus(裂解液)900 μL(加液過程中如槍頭接觸到EP管壁或其他物品,需更換槍頭),再分別吸取待測血清樣品、陽性對照、陰性對照各200 μL于EP管中,每加一次樣品換一次槍頭。輕輕上下顛倒搖勻至底部無沉淀,顏色均一,冰盒中靜置5 min。將已檢測樣品放-20 ℃冷凍保存(陰性對照放在中間順序)。
(2)12 000 r/min、4 ℃離心1 min。加入200 μL的氯仿,上下顛倒20次混勻,至顏色均一為乳粉色,冰盒中靜置8 min。
(3)12 000 r/min、4 ℃離心15 min。在離心剩余2 min時準備新1.5 mL無菌無酶EP管,加入800 mL -20 ℃預冷的異丙醇。從離心機輕拿輕放取出EP管(離心后液體分為三層,底層為有機溶液層,中層蛋白質,上層上清液含RNA)。吸取400 μL上清液(分兩次,每次200 μL吸取,吸取上層液體時切勿碰觸或吸取中層蛋白質),放入事先加好異丙醇的新1.5 mLEP管中,輕輕上下顛倒20次搖勻,-20 ℃靜置20 min[5]。
(4)12 000 r/min、4 ℃離心15 min。離心機中EP管擺放方向保持一致,以使沉淀在管底同一側。若離心后不出沉淀繼續-20 ℃放置10~20 min后離心。棄上清,保留沉淀。沉淀即為RNA提取物,量很少,在倒上清液時注意切勿將沉淀倒出。
(5)加入1 mL75%乙醇(DEPC水配制,加乙醇過程中如槍頭接觸到EP管壁或其他物品,需更換槍頭),輕輕上下顛倒,洗滌沉淀,將沉淀懸浮起來即可。
(6)7 500 r/min、4 ℃離心5 min。棄上清,保留沉淀。用200 μL槍頭將管底殘余乙醇液體吸凈,吸取一個樣品換一個槍頭,注意不要碰觸和吸取到RNA沉淀。
(7)EP管中的RNA在超凈工作臺中室溫下自然干燥10 min。加入20 μL的無RNase水(將水加到沉淀上),輕彈溶解沉淀,短期使用-20 ℃保存,長期使用保存于-70 ℃下。
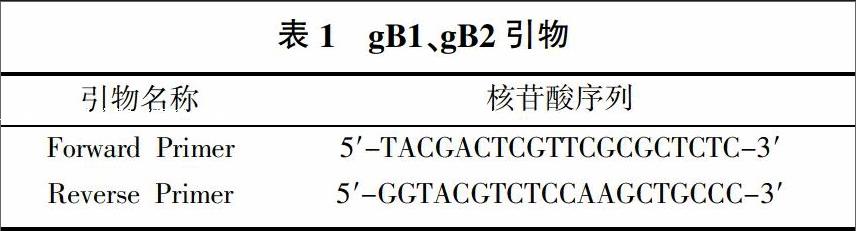
1.2.2 引物設計 根據GeneBank數據庫,使用引物設計軟件Primeier 5.0設計BVDV特異性引物(表1、表2)。
PCR反應:反應體系:25 μL,配制在冰盒上進行,設定好反應程序后,將裝有上述體系液體PCR反應管包括對照管(空白PCR體系管和水樣PCR體系管)放入Smart CycLer System中按照表3參數設定PCR儀進行 PCR反應。
1.2.3 電泳分析
(1)制膠。稱取1.35 g瓊脂糖粉放入錐形瓶中(注:倒入過程中避免瓊脂糖粉末粘在錐形瓶壁上)。加入90 mL 1×TBE溶液,微波爐加熱無絮狀物至完全溶解(注:至少沸騰3次),取出錐形瓶后,冷卻至60 ℃左右,加入17μL的核酸染料,搖至徹底混勻后倒入帶有梳子的膠槽中(輕輕混勻即可,避免氣泡產生),冷卻凝固40 min。
(2)將制好的膠放入電泳槽中,倒入1×TBE,液位高于膠面2 mm。
(3)用移液槍取樣品與6×Loading Buffer混合點于膠孔中。
(4)將電泳儀正負極對應連接,開啟電泳儀電源開關,在120 V電壓下電泳50 min。將跑完的瓊脂糖凝膠從電泳槽取出,放在凝膠成像儀中,進行觀察。
2 結果與分析
2.1 結果
由圖2可見,12號為陰性對照,無明亮的條帶;24號為陽性對照,出現明亮的條帶,證明試驗成立。剩余樣本在316 bp處,8、9、10、11、20、21、23號出現明亮的條帶,說明該樣本血清樣本染牛腹瀉病毒。
2.2 影響PCR檢測的因素
2.2.1 dNTP的質量與濃度 dNTP的質量與濃度和PCR擴增效率有密切關系,如保存不當易變性失去生物學活性。在PCR反應中,dNTP應為50~200 μmol/L,尤其是注意4種dNTP的濃度要相等,如其中任何一種濃度不同于其他幾種時(偏高或偏低),就會引起錯配[6]。
2.2.2 Mg2+濃度 Mg2+對PCR擴增的特異性和產量有顯著影響。在一般的PCR反應中,各種dNTP濃度為200 μmol/L 時,Mg2+濃度為1.5~2.0 mmol/L為宜。Mg2+濃度過高,反應特異性降低,出現非特異擴增,濃度過低會降低Taq DNA聚合酶的活性,使反應產物減少。
2.2.3 溫度與時間的設置 基于PCR原理三步驟而設置變性-退火-延伸三個溫度點[7]。在標準反應中采用三溫度點法,雙鏈DNA在90~95 ℃變性,再迅速冷卻至40~60 ℃,引物退火并結合到靶序列上,然后快速升溫至70~75 ℃,在Taq DNA聚合酶的作用下,使引物鏈沿模板延伸。
2.2.4 循環次數 循環次數決定PCR擴增程度。PCR循環次數主要取決于模板DNA的濃度。一般的循環次數選在30~40次之間,循環次數越多,非特異性產物的量亦隨之增多。一般認為PCR產物應在48 h以內完成電泳檢測,有些最好于當日電泳檢測,大于48 h后帶型就會出現不規則,甚至消失。所以精細的分子實驗,操作過程的每一步都必須謹慎細致,才可保證準確的實驗結果。
參考文獻:
[1] 王建領,付彤,劉 杰,等.牛病毒性腹瀉分子及血清流行病學研究進展[J].河南農業科學,2012(3):7-11.
[2] 張會敏,鄭明學,古少鵬,等.牛病毒性腹瀉的流行情況及防制[J].中國畜牧獸醫,2009(11):120-122.
[3] 覃德文,云朝光,秦武明,等.PCR技術發展狀況研究[J].林業實用技術,2013(6):6-8.
[4] 張許文琦.PCR技術的研究及應用[J].長江工程職業技術學院學報,2013(3):4-7,12.
[5] 徐平麗,趙晉平,孟靜靜,等.一種適宜擬南芥PCR檢測的DNA提取方法[J].安徽農業科學,2010,38(13):6653-6654.
[6] 彭仕明,黃 勉,陳 武,等.棕熊蛔蟲ITS rDNA的PCR擴增與序列分析[J].中國獸醫寄生蟲病,2008(3):1-5.
[7] 金宇良.PCR技術的研究進展[J].現代農業科技,2012(10):47-48.

