辣椒疫霉效應因子RxLR101012的表達純化與結晶初探
馬璐璐,王玉姣,孫柏華,陳姍姍,張修國
山東農業大學 植物保護學院,山東省蔬菜病蟲生物學省級重點實驗室,山東 泰安 271018
辣椒疫霉效應因子RxLR101012的表達純化與結晶初探
馬璐璐,王玉姣,孫柏華,陳姍姍,張修國*
山東農業大學 植物保護學院,山東省蔬菜病蟲生物學省級重點實驗室,山東 泰安 271018
植物病原卵菌會分泌一系列的效應分子進入寄主體內,從而促進病原菌的侵染。這些效應分子或在質外體積累或進入宿主細胞內來調控寄主的免疫反應。但效應分子如何逃避寄主的免疫識別,使植物發病的分子機制目前還不清楚。本研究從辣椒疫霉強致病性菌株SD33中克隆分離獲得1個效應分子RxLR101012,利用相關生物信息學軟件分析了該效應分子的基因序列,并對其進行了原核表達與純化,確定了該基因高效表達條件,利用親和層析、離子交換層析和凝膠過濾層析,獲得RxLR101012高純度蛋白,得到RxLR101012蛋白晶體,為后續解析RxLR效應分子蛋白三維結構,從結構生物學角度探知RxLR效應分子生理生化功能奠定了基礎。
辣椒疫霉;效應分子;原核表達;蛋白純化
疫霉菌是一類重要的植物病原菌,由其引起的植物病害統稱為疫病,常給農業生產帶來重大損失[1],辣椒疫病由辣椒疫霉侵染導致的重要土傳病害[2,3]。辣椒疫霉隸屬于植物病原卵菌,分布廣泛,寄主范圍廣譜。卵菌是一類真核生物,包括許多重要的植物和動物病原菌。其中疫霉屬包含許多能夠引起作物毀滅性病害的病原菌,如19世紀中葉危害馬鈴薯引起愛爾蘭大饑饉的致病疫霉[4]。
植物病原卵菌在侵染寄主或為在寄主中順利定殖會分泌大量的效應分子(Effectors)調控寄主的防衛反應以躲避寄主的免疫識別[5]。卵菌效應分子被分泌到質外體或進入寄主細胞內
從而調控寄主的免疫反應[6,7]。近年來,關于辣椒疫霉關鍵效應分子及致病流行機制研究已受到越來越多的關注。病原卵菌效應分子能夠引發寄主細胞壞死或誘導寄主細胞產生防衛反應[8]。生物信息學分析表明卵菌基因組中存在大量效應蛋白,其中辣椒疫霉基因組中有300多個效應分子基因[9]與大豆疫霉中的效應分子數量相當[10]。它們大都有保守的N端序列,C端具有多態性。有報道發現N端保守的RxLR基序參與效應分子向寄主細胞轉運的功能[11,12]。許多效應分子能夠抑制由其它效應分子或病原菌引發的細胞程序性死亡或是效應分子本身能夠引起細胞壞死[13]。效應分子有的被分泌到質外體,有的效應分子被分泌到細胞質內,分別與不同的亞細胞結構相結合。有關辣椒疫霉RxLR效應分子蛋白表達純化及其功能機制特性的研究資料積累較少,本研究克隆了辣椒疫霉的1個RxLR效應分子,基于原核表達及蛋白純化技術獲得了該效應分子較高純度的可溶性蛋白,并篩選得到了該蛋白的晶體生長條件,為該蛋白晶體繼續優化培養及結構解析提供了基礎。
1 材料方法
1.1 材料來源
高致病性辣椒疫霉(Phytophthora capsici Leonian)菌株SD33由山東省蔬菜病蟲生物學重點實驗室分離鑒定。
1.2 辣椒疫霉效應分子RxLR101012引物設計與克隆
基于辣椒疫霉全基因組數據庫,利用生物信息學軟件比對發現,辣椒疫霉基因組中含有1個效應蛋白分子RxLR101012。依據RxLR101012基因去掉信號肽之后的片段5’端和3’端序列分別設計含有BamH I和Xho I酶切位點的特異性克隆引物RxLR101012-F:5’-CGGG
ATCCGCTGTCCAAGACAACGAGTA-3’;RxLR101012-R:5’-CCGCTCGAGCGAGGTGCGGTATT TCTTGG-3’,該引物序列由鉑尚生物技術(上海)有限公司合成。
基于辣椒疫霉全基因組數據庫,利用辣椒疫霉SD33菌株的cDNA為模板,對RxLR101012進行PCR擴增:95℃預變性5 min;94℃變性30 s,56℃退火30 s,72℃延伸1 min,共30個循環;最后72℃延伸5 min;4℃保存。
擴增后的基因通過1%的瓊脂糖凝膠電泳驗證,進行純化回收。對回收后的DNA片段和pET-28a載體進行雙酶切,酶切產物回收后進行連接轉化。重組后的質粒經菌落PCR篩選,測序驗證正確后,提取重組質粒備用。
1.3 重組蛋白的表達
將測序正確的重組質粒轉入表達宿主E.coli Rosetta(DE3)菌株中進行表達。涂布于具有卡那霉素抗性的LB固體培養基上37℃培養12~14 h;挑取10個生長良好的單克隆菌落,接入1 mL含有卡那霉素抗性的LB培養液中,37℃震蕩培養3~5 h至菌液渾濁;各取200μL菌液于5 mL含卡那霉素的LB培養液中,37℃,200 rpm震蕩培養至OD為0.6~0.8之間,取1 mL菌液做誘導前對照;加入5 μL的IPTG(1 mol/L,終濃度為1 mmol/L),37℃,200 rpm誘導表達3 h;誘導結束后各取1 mL菌液,與誘導前的對照菌液共離心,12000 rpm離心2 min;棄上清,各加入50 μL的2×Binding Buffer和50 μL的2×Loading Buffer混勻;沸水煮10 min,每5 min渦旋震蕩1次,離心12000 rpm,2 min;15%SDS-PAGE電泳分析。根據電泳結果,將原始菌液活化后按照1:50的比例接種到含有卡那霉素抗性的1 L LB培養基中,37℃,180 rpm震蕩培養至OD600為0.6~0.8;培養基降溫到16℃后,加入1 mL 1 mol/L的IPTG,120 rpm培養20 h;離心收集菌體,4℃,8000 rpm,4 min;預冷的50 mL重懸液(20 mmol/L Tris pH7.5,150 mmol/L NaCl)重懸菌體,-20℃保存備用。
1.4 重組蛋白的純化
1.4.1 親和層析純化 細胞破碎及親和層析前處理(1)Ni-NTA層析柱的預處理:用0.5 mol/L的EDTA螯合除去介質中的金屬離子,超純水沖洗3個柱體積,加入0.5 mol/L的氯化鎳浸泡30 min,之后用重懸液平衡1到2個柱體積4℃放置備用。(2)細胞超聲破碎:將收集好的放置于-20℃保存備用的50 mL細胞菌體置于冰上,加入10%的甘油,0.5%的TWEEN-20,冰浴下混勻后超聲破碎(超聲3 s、間隔3 s、30 min、功率280 w)。4℃,14000 rpm高速離心30 min,收集上清液,置于冰上。
1.4.2 親和層析純化 (1)將離心后的上清液,4℃條件下通過處理好的Ni-NTA親和層析柱中,反復過柱3遍;(2)用低濃度洗雜液(20 mmol/L Tris-HCl,150 mmol/L NaCl,20 mmol/L咪唑,pH7.5)沖洗親和層析柱,沖洗200 mL;(3)加入15 mL洗脫液(20 mmol/L Tris-HCl,150 mmol/L NaCl,400 mmol/L咪唑,pH7.5)沖洗掛過蛋白的層析柱,收集目標蛋白。
1.4.3 離子交換層析 RxLR101012蛋白預測等電點PI為9.4左右,在pH6.8的PBS緩沖液中可以結合在陽離子交換柱上,通過降低緩沖液的鹽濃度增加蛋白質與介質的親和度,目的蛋白通過親和介質后,逐步提高鹽離子濃度,將目標蛋白洗脫下來。具體步驟為:(1)將親和層析純化之后的重組蛋白樣品用A泵液(25 mmol/L PBS pH6.8)稀釋后注入50 mL上樣環;(2)將HiTrap SP FF-5 mL預裝柱連接到?KTA蛋白純化系統上,用A泵液(25 mmol/L PBS pH6.8)平衡3個柱體積;(3)預設程序,并運行,B泵液(25 mmol/L PBS pH6.8,1 mol/L NaCl)進行梯度洗脫純化目標蛋白;
1.4.4 凝膠過濾層析純化 (1)將Superdex200預裝柱接到?KTA蛋白純化儀上,用A泵平衡液(20 mmol/L Tris,150 mmol/LNaCl,pH7.5)平衡2個柱體積;(2)將離子親和層析之后目的蛋白置于截留分子量為10 KDa的超濾管中,4℃,3000 rpm,離心濃縮至1 mL;(3)將1 ml蛋白樣品4℃,12000 rpm,離心5 min,將蛋白樣品注入1 mL上樣環,運行程序;(4)取峰值對應處的蛋白做樣,并進行SDS-PAGE檢驗分離純化效果。
1.5 晶體的篩選
本實驗形成晶體的方法采用蒸汽擴散法,包括懸滴法和坐滴法。本試驗所有的蛋白質結晶試劑盒均購自Hampton Research公司包括Crystal screen、Crystal screen II、SaltRx I、SaltRx II、PEGRx I、PEGRxII、PEG ion I、PEG ion II等,從中篩選生長晶體的條件。
2 結果與分析
2.1 辣椒疫霉RxLR101012基因克隆與基因序列結構分析
依據辣椒疫霉基因組中效應蛋白RxLR101012基因序列設計引物,從高致病性菌株SD33中克隆RxLR101012基因。基因測序以及BLAST比對最終獲得了RxLR101012基因,其核苷酸序列和氨基酸序列(見圖1)。

圖1 辣椒疫霉菌效應蛋白分子RxLR101012基因氨基酸序列(*為終止密碼子)Fig.1Amino-acid sequence of Phytophthora capsici effector gene RxLR101012(*is terminal code)
2.2 RxLR101012蛋白的理化性質
辣椒疫霉效應蛋白RxLR101012基因完整的開放閱讀框ORF序列為672 bp,編碼224個氨基酸,預測編碼蛋白的分子量為26.1 kD。利用SignalP4.1 Server預測RxLR101012基因含有一個長度為19個氨基酸的信號肽,有跨膜區(見圖2)。去掉信號肽之后預測發現跨膜區消失。該基因預測存在信號肽和跨膜區,并且去掉信號肽之后跨膜區消失,說明該基因編碼的是外泌蛋白(見圖3)。
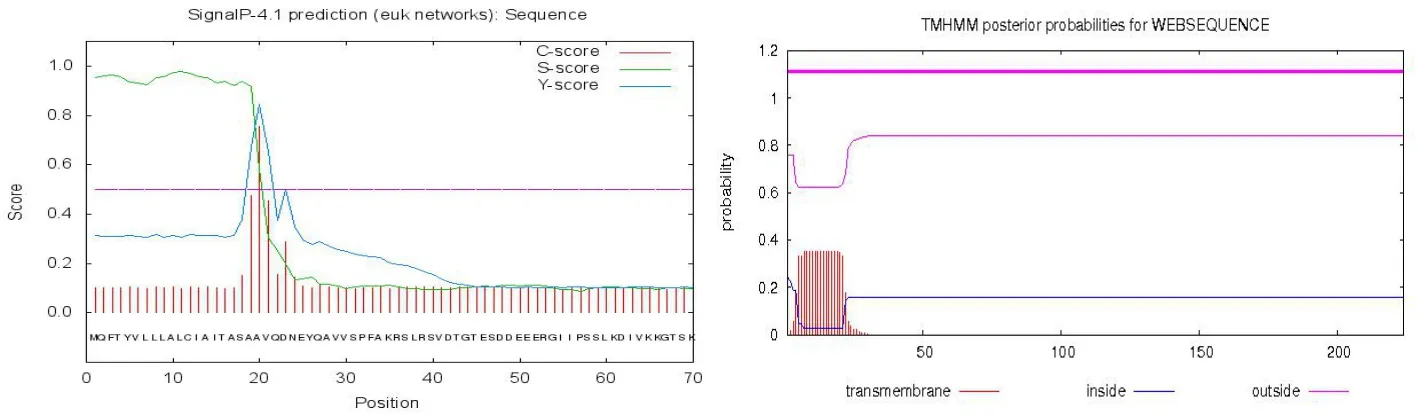
圖2 效應分子RxLR101012信號肽預測與跨膜區預測Fig.2 The predication of RxLR101012 signal peptide and transmembrane domain
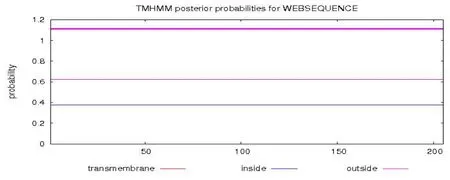
圖3 效應分子RxLR101012去掉信號肽之后的跨膜區預測Fig.3 The predication of RxLR101012 transmembrane domain without signal peptide sequence
2.3 RxLR101012重組質粒構建與鑒定
PCR擴增產物經1.0%瓊脂糖凝膠電泳檢測,電泳圖顯示有DNA條帶,與預期值675 bp大小相符(見圖4)。RxLR101012-28a重組質粒構建經PCR篩選,送上海鉑尚生物公司測序,結果表明開放閱讀框架完全正確,表明重組質粒構建成功。
2.4 RxLR101012蛋白表達
將重組質粒轉到表達菌株Rosetta中,經誘導表達后取樣進行SDS-PAGE檢測,電泳圖顯示RxLR101012重組蛋白在大腸桿菌中表達明顯提高,圖中1號泳道為marker,2號泳道為誘導前CK,3~6號泳道為加入IPTG 37℃誘導3 h后樣品,電泳結果顯示誘導表達效果明顯,與目標目的蛋白26.1 KDa相似(見圖5)。
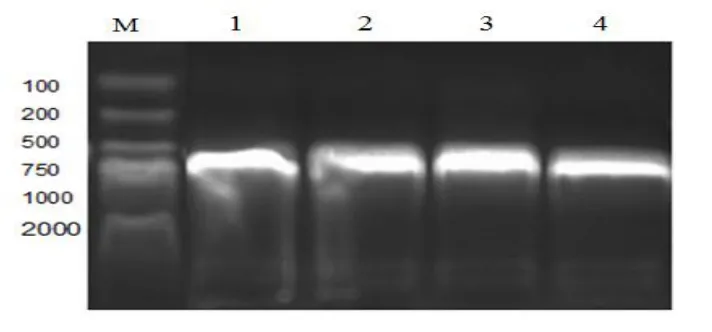
圖4 RxLR101012基因PCR擴增結果Fig.4 PCR amplification of RxLR101012
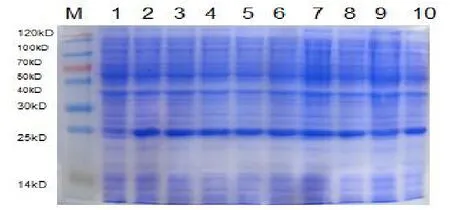
圖5 RxLR101012誘導表達結果Fig.5 The induced expression of RxLR101012
2.5 RxLR101012蛋白純化
經鎳柱親和層析,離子交換層析及凝膠層析之后的蛋白純化結果(見圖6,圖7)。
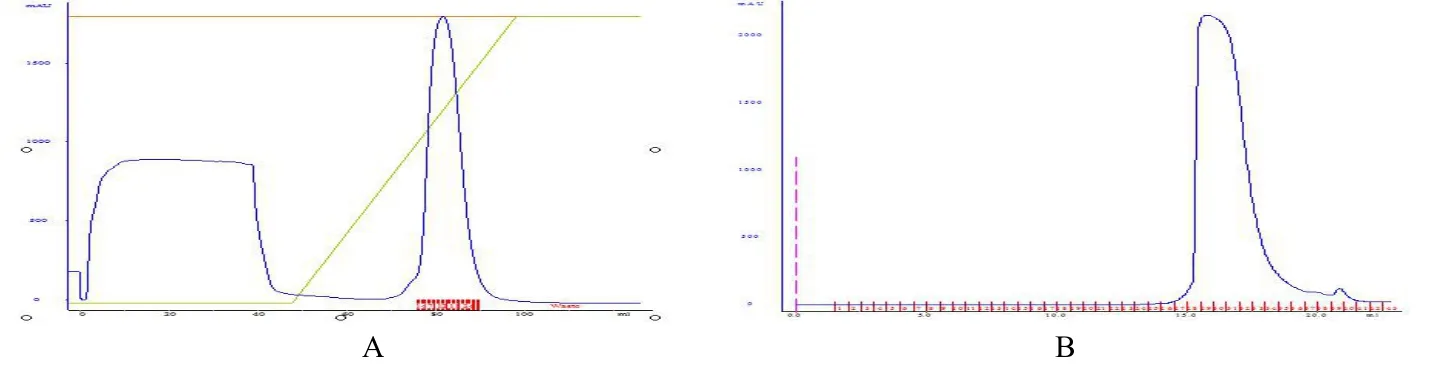
圖6 A:RxLR101012陽離子交換柱純化結果;B:RxLR101012凝膠層析結果Fig.6A:Ion Exchange Chromatography of RxLR101012;B:Gel filtration purification of RxLR101012
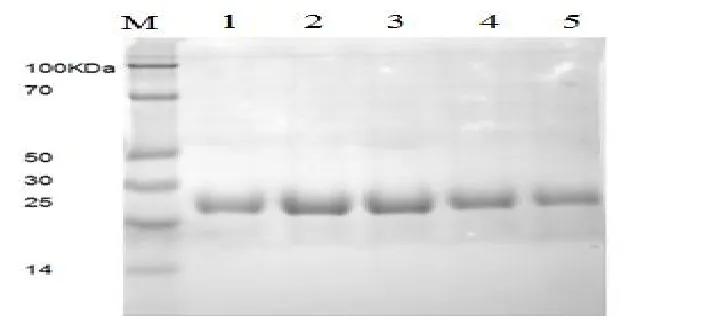
圖7 凝膠層析之后的SDS-PAGE電泳結果Fig.7 SDS-PAGE after Gel filtration purification analysis
2.6 蛋白晶體的初篩
將純化獲得的目的蛋白進行超濾濃縮,獲得濃度為12 mg/mL,純度95%以上的目的蛋白,用坐滴法篩選晶體生長初始條件篩選得到的蛋白晶體(見圖8)。

圖8 RxLR101012經篩選得到的蛋白晶體Fig.8 The crystals of RxLR101012
3 討論
對于眾多用生物化學和生物物理學進行的實驗研究來講,成功獲得高純度高濃度可溶性蛋白溶液是至關重要的一步。本研究從辣椒疫霉全基因組中克隆得到1個效應分子,并利用原核表達體系對其進行了高效表達。卵菌效應分子信號肽具調控效應分子分泌的功能,效應分子RxLR101012經生物信息學分析發現有長度為19個氨基酸的信號肽,在辣椒疫霉菌侵染致病的過程中,可被分泌至寄主細胞行使其相應功能,基于上述分析推測RxLR101012基因可能是有重要的作用的功能基因。
在蛋白純化和晶體篩選過程中,我們發現當蛋白純度達到90%以上,濃度達到10 mg/mL,適合進行蛋白晶體篩選,并利于獲得蛋白晶體。晶體生長的臨界條件是溶液達到一個適宜的過飽和度,才會生成少數的晶核,隨著溶液過飽和度逐漸降低,最后溶液和晶體處于平衡狀態,晶體就停止生長。如果過飽和度太高,晶體會大量析出形成微晶,甚至成無定型狀態[14]。蛋白晶體生長過程中選擇不同的方法會直接影響到晶體的生長[15]。在晶體優化過程中,緩沖液pH的選擇,離子濃度的改變,溫度的調節以及添加劑的有無等都會影響蛋白晶體的生長。在晶體優化過程中通常會選擇保持唯一變量,通過設置一系列條件梯度進行晶體優化,以期得到衍射數據良好的蛋白晶體。
目前關于卵菌效應分子結構生物學研究信息較少,其致病機理亦不明了。因此,開展卵菌效應分子表達純化,獲得高純度蛋白,對于開展晶體結構生物學研究具重要的意義。本研究制備了該效應分子的高純度蛋白,并得到了蛋白晶體,為進一步優化及進行蛋白結構生物學研究提供了依據。
[1]鄭小波.疫霉菌及其研究技術[M].北京:中國農業出版社,1997
[2]張海英,劉永剛,呂和平,等.河西地區辣椒疫病菌的形態特征及其致病力的初步研究[J].西北農業學報,2008,17(1):74-76
[3]王曉敏,鞏振輝,逯紅棟,等.辣椒疫霉菌孢子誘導技術研究[J].西北農業學報,2006,15(2):59-62
[4]熊 琴.疫霉菌RNA沉默抑制子PsPSR2及其同源效應分子的功能分析[D].江蘇:南京農業大學,2014
[5]Yu D,Mpina MH,Birch PRJ,et al.Phytophthora infestans RxLR effector AVR1 interacts with exocyst component Sec 5 to manipulate plant immunity[J].Plant Physiology,2015,169(3):1975-1990
[6]KamounS.Acatalogueof theeffectorsecretomeof plantpathogenicoomycetes[J].AnnuRevPhytopathol,2006,44(1):41-60
[7]Oliva R,Win J,Raffaele S,et al.Recent developments in effector biology of filamentous plant pathogens[J].Cell Microbiol,2010,12(7):705-715
[8]Saunders DGO,Breen S,Win J,et al.Host Protein BSL1 Associates with Phytophthora infestans RXLR Effector AVR2 and the Solanum demissum Immune Receptor R2 to Mediate Disease Resistance[J].Plant Cell,2012,24:3420-3434
[9]Baxter L,Tripathy S,Ishaque N,et al.Signatures of adaptation to obligate biotrophy in the Hyaloperonospora arabidopsidis genome[J].Science,2010,330(6010):1549-1551
[10]Jiang RH,Tyler BM,Govers F.Comparative analysis of Phytophthora genes encoding secreted proteins reveals conserved synteny and lineage-specific gene duplications and deletions[J].MPMI,2006,19(12):1311-1321
[11]Dou D,Kale SD,Wang X,et al.RXLR-mediated entry of Phytophthora sojae effector Avr1b into soybean cell does not require pathogen-encoded machinery[J].Plant Cell,2008,20(7):1930-1947
[12]Whisson SC,Boevink PC,Moleleki L,et al.A translocation signal for delivery of oomycete effector protein into host plant cells[J].Nature,2007,450(7166):115-118
[13]Wang Q,Han C,Ferreira AO,et al.Transcriptional programming and functional interactions within the Phytophthora sojae RxLR effector repertoire[J].Plant Cell,2011,23(6):2064-2086
[14]Chernov AA.Protein crystals and their growth[J].Journal of structural biology,2003,142(1):3-21
[15]舒占永,畢汝昌.蛋白質晶體的優化生長[J].生物化學與生物物理進展,1997,24(5):396-401
PreliminaryExplorationforExpression,PurificationandCrystallization ofRxLR101012fromPhytophthoracapsici
MALu-lu,WANG Yu-jiao,SUN Bai-hua,CHEN Shan-shan,ZHANG Xiu-guo*
College of Plant Protection,Key Laboratory of Vegetable Pest and Biology of Shandong Province/Shandong Agricultural University,Tai’an 271018,China
A number of effector proteins are delivered by phytopathogens into host plant cells to promote infection.These proteins accumulate in the plant intercellular space or translocate into host cells to modulate host immune responses. However,the immunolohical recognition how effectors escape hosts and pathogenetic molecular mechanisms in plants have been understood.In this study,we cloned an effector gene RxLR101012 from high-virulent Phytophthora capsici SD33 and then analyzed the sequence structure of RxLR101012 gene based on the BLAST and SignalP4.1 Server software.At the same time,we expressed and purified of RxLR101012 effector in the Escherichia coli and determined the optimization conditions that could induce RxLR101012 gene to be effective expression.Finally,we prepared the high quality protein of RxLR101012 gene which would be beneficial to further study on crystal structure of it.
Phytophthora capsici;effector;prokaryotic expression;protein purification
S436.418.1+2
:A
:1000-2324(2017)02-0210-05
10.3969/j.issn.1000-2324.2017.02.009
2016-11-07
:2017-01-23
國家大宗蔬菜產業技術體系(CARS-25-03B)
馬璐璐(1990-),女,在讀碩士研究生.研究方向:植物病原真菌學和真菌資源利用.
*通訊作者:Author for correspondence.E-mail:zhxg@sdau.edu.cn

