無機磷溶解菌的分離篩選及其對扁穗雀麥生長的影響
舒健虹,王普昶,李顯剛,王小利,李小冬*
(1.貴州省草業研究所,貴州 貴陽 550006;2.黔南州飼草飼料工作站,貴州 都勻 558000)
?
無機磷溶解菌的分離篩選及其對扁穗雀麥生長的影響
舒健虹1,王普昶1,李顯剛2,王小利1,李小冬1*
(1.貴州省草業研究所,貴州 貴陽 550006;2.黔南州飼草飼料工作站,貴州 都勻 558000)
對扁穗雀麥根際溶磷微生物進行分離篩選,測定其溶磷、分泌IAA能力及對扁穗雀麥的促生效果。結果表明,不同菌株對不同無機磷底物具有選擇性,以磷酸鈣為磷源時,篩選的溶磷菌株都有溶磷活性,其中Br17的溶磷活性最高;以磷酸鋁為磷源時,只有Br1、Br7與Br8具有溶磷活性,其中Br7溶磷活性最高。IAA測定結果顯示Br4、Br8、Br17與Br24具有較強IAA分泌能力,添加生長素前體物質色氨酸時菌株分泌IAA能力增強。對培養基pH分析發現,篩選的8株溶磷菌株都為產酸型微生物。將純化后的溶磷菌接種到扁穗雀麥無菌苗,對根長、根數、株高以及生物產量等性狀考察發現接種Br8、Br13、Br17與Br24菌株對扁穗雀麥的根系影響較大,主要表現為主根變短,根數變多。接種Br7、Br8、Br13與Br24菌株促進扁穗雀麥株高增高、產量增加。綜合分析,Br24在貴州地區的應用潛力最大。
溶磷菌;溶磷能力;IAA;扁穗雀麥
生物肥料在現代農業中應用越來越廣泛,固氮菌和溶磷菌是應用最廣泛的兩種土壤益生菌類的肥料[1]。固氮菌通過固定空氣中的氮氣,以提高土壤肥力[2]。溶磷微生物能夠依靠自身的代謝產物或其他生物協同溶解土壤中的難溶無機磷,以提高土壤中磷的利用率[3-4],減少化學肥料施用量,降低農業投入成本,具有對環境進行微生物修復等功能。然而不同溶磷菌株對其生態環境以及宿主植物的專一性較高[5-8],禾本科溶磷菌的研究已經有研究報道,張堃[9]發現溶磷菌、固氮菌等植物益生菌能在青稞(Hordeumvulgare)不同生長發育階段起促進作用。馬文文[10]對高寒草地7種禾本科牧草的根際促生菌進行篩選鑒定,共獲得453株促生菌,并建立了數據庫。然而目前禾本科根際促生菌的研究主要集中在北方或高寒草地,對南方草地尤其是西南卡斯特溶巖山區的研究較少。
扁穗雀麥(Bromuscatharticus)屬于禾本科一年生牧草,起源于地中海地區,在澳大利亞和新西蘭等國家廣為種植,在貴州主要分布在海拔900~2200 m的地區,具再生性好、分蘗能力強、產草量高、品質好等優點,是南方牧場冬春季主要草種之一[11]。然而其在發芽[12]以及苗期生長[13]都面臨低磷脅迫,同時貴州土壤中含有豐富的難溶性無機磷,如何讓植物能夠高效利用這些營養元素是當前研究的熱點之一。研究并開發相應溶磷微生物以提高扁穗雀麥牧草營養供給和生產性能,對推動地方牧草品種產業化和生態畜牧業發展具有重要意義。本研究針對貴州省扁穗雀麥根際溶磷菌的溶磷量、分泌植物生長素(IAA)特性及其對植物促生效應等進行研究,為研制和推廣溶磷菌劑應用提供基礎資料和理論依據。
1 材料與方法
1.1 樣品采集
2011年5月,以5點法采集扁穗雀麥根際土壤,低溫保存帶回實驗室進行溶磷菌分離。采集地點為貴州省獨山縣貴州省草業研究所試驗地,位于東經107°17′55″-107°50′05″,北緯25°12′46″-26°01′05″,系喀斯特巖溶地區,屬中亞熱帶季風性濕潤氣候,年平均降雨量1392.15 mm,年均氣溫在15 ℃,年冰凍期15 d。
1.2 菌株分離及初篩
選用PKO(Pikovaskaia’s培養基)無機磷培養基分離菌株,無機磷源為磷酸鈣[Ca3(PO4)2]與磷酸鋁(AlPO4),培養基組成及配方參考李鳳霞等[14]。將分離具有溶磷圈的菌株分別接種于PKO上,每個菌株接種4個重復,28 ℃恒溫培養3,6,9和12 d,分別測量每個菌株的溶磷圈直徑(D)和菌落直徑(d),計算D/d值,挑選D/d值相對較大的菌株純化后保存(4 ℃)備用。
1.3 溶解磷酸鹽活力測定
接種0.5 mL菌懸液到50 mL滅菌PKO無機磷液體培養基中,每個菌株接種3個重復,空白對照接種0.5 mL滅菌水。28 ℃、150 r/min恒溫搖床上振蕩培養7 d;10000 r/min、4 ℃離心15 min,取1 mL上清液采用鉬銻抗比色法測培養液中可溶性磷含量,菌株溶磷量以可溶性磷素表示[15]。
1.4 溶磷量動態分析
將篩選溶磷量較好的菌株轉接0.5 mL到50 mL PKO無機磷液體培養基中,每個菌株接種3次重復,對照接種0.5 mL蒸餾水。28 ℃、150 r/min恒溫振蕩培養3,6,9,12 d,分別測定菌液中可溶性磷含量。
1.5 分泌IAA能力測定
定性分析:以加生長素前體物質色氨酸和不加色氨酸的king液體培養基[16]培養菌株。接種劑量及重復數同1.3。接種后28 ℃,150 r/min培養3 d。取1 mL菌液滴入檢測板中,加入等量PC比色液(FeCl312 g,7.9 mol/L H2SO41 L,定容到1000 mL),對照用1 mL 50、30和10 μg/mL的植物生長激素(IAA)溶液,室溫孵育15 min后觀察不同菌液顏色變化,確定菌株分泌IAA強度差異[16-17]。定量分析:利用上述標準品計算標準曲線,10000 r/min離心10 min,取1 mL上清液等比例加比色液,混勻,黑暗中靜置30 min后測定530 nm的吸光值,根據標準曲線計算菌液中IAA含量(μg/mL)[18]。
1.6 產酸和堿性能的測定
將純化菌株接種于30 mL無氮液體培養基(NFM)中[18],每個菌株3個重復。28 ℃,于150 r/min培養72 h,觀察并記錄培養基顏色的變化,同時采用雷磁PHS-3c pH計測定菌株懸浮液的pH值。培養基顏色變成黃色,表明其為產酸菌株;變為藍色為產堿菌株;不變色為中性菌株。
1.7 溶磷菌對扁穗雀麥的促生效應分析
扁穗雀麥種子去皮用75%的酒精浸種5 min,1%的氯化汞消毒20 min,無菌水沖洗2~3次,然后播種在4 cm×50 cm的無菌組配管中,培養基為Hoagland半固體有氮培養液[Ca(NO3)20.945 g,KNO30.506 g,NH4NO30.08 g,Ca3(PO4)20.31 g,AlPO40.31 g,MgSO40.493 g,鐵鹽溶液 2.5 mL,微量元素液 2 mL,pH 6.0,Agar 3.5 g,蒸餾水1000 mL][19],每管1株苗,溶磷菌的準備同1.4,處理組接0.5 mL溶磷菌培養液,對照加入0.5 mL蒸餾水培養液,每個菌株重復7次。21 d后用卷尺和直尺測定扁穗雀麥的株高、根長并計算根數,在105 ℃殺青15 min,65 ℃烘至恒重測植株生物量(干重)。
1.8 數據處理
采用Excel 2003和SPSS 16.0軟件進行統計分析。
2 結果與分析
2.1 溶磷菌篩選與溶磷能力分析
采集扁穗雀麥土樣并從土壤、根際以及根內獲得31株溶解磷酸鈣的分離物,其中在PKO固體培養基上有8株菌株菌落出現了明顯透明圈,編號依次為:Br1、Br4、Br7、Br8、Br13、Br17、Br20和Br24。通過比較不同溶磷菌在以磷酸鈣為磷源培養基上生長3,6,9及12 d時的菌落直徑(d)和產生透明圈直徑(D)發現,各溶磷菌株隨培養時間延長,D/d值變化不盡相同。8個菌株的D/d值都隨培養時間增加而減小。菌株Br1、Br4、Br7、Br8、Br13和Br24在第3天時各菌株D/d值達到最大,分別為1.62,2.23,1.76,3.00,2.42,2.60,隨后逐漸減小。而菌株Br17與Br20的D/d值在培養第9 天時達最大,第12 天時菌株Br20的D/d值趨于穩定,菌株Br17的D/d值呈減小趨勢。以第9天為例,8個菌株的D/d值在1.35~2.25之間(表1),菌株菌落直徑(d)在0.35~0.74 cm范圍,大小關系為Br4>Br13>Br1>Br8=Br24>Br7>Br20>Br17,透明圈(D)在0.75~1.35 cm范圍, 大小關系為Br8>Br4>Br24>Br13>Br20>Br1>Br7>Br17。總體而言,隨著菌株培養時間的延長,各菌株D/d值均有逐漸減小趨勢,但降低的速度不一,說明各菌株對磷酸鈣的溶解能力和溶解速度不同。
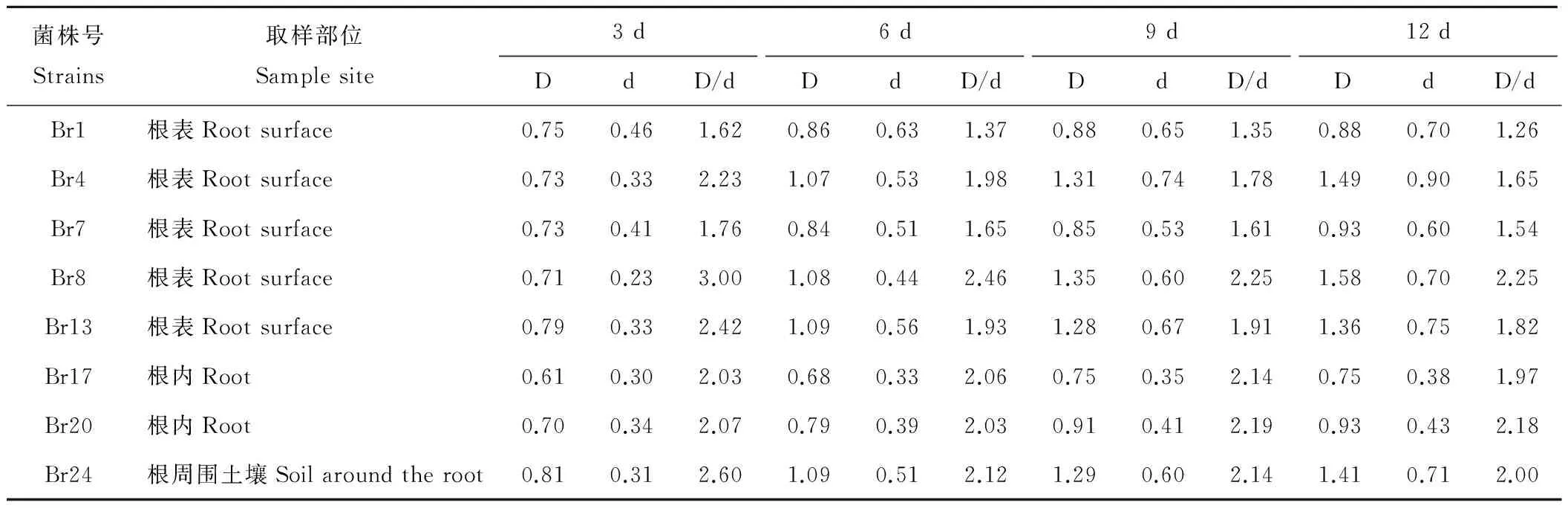
表1 溶磷菌在PKO無機磷培養基上不同天數的D/d值Table 1 The D/d value of different phosphate-solubilizing bacteria on PKO in different days
D:菌斑直徑The diameter of plaque (cm);d:菌落直徑 The diameter of colony (cm).
2.2 溶磷菌底物特異性分析
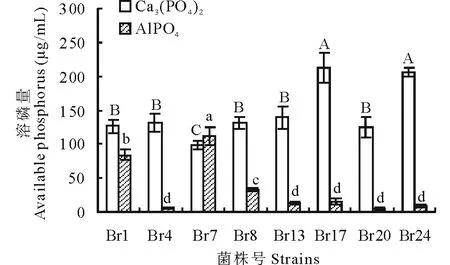
圖1 不同溶磷菌菌株對磷酸鈣、磷酸鋁溶解量比較Fig.1 The comparison of available phosphorus from different phosphate-solubilizing bacteria to dissolve the calcium phosphate and aluminum phosphate 不同大寫字母與小寫字母分別表示以磷酸鈣和磷酸鋁為磷源的溶磷能力差異顯著(P<0.05)。Different letters stand for significant difference tests of phosphate-solubilizing abilities at P<0.05 level, capital and lowercase stand for calcium phosphate and aluminium phosphate, respectively.
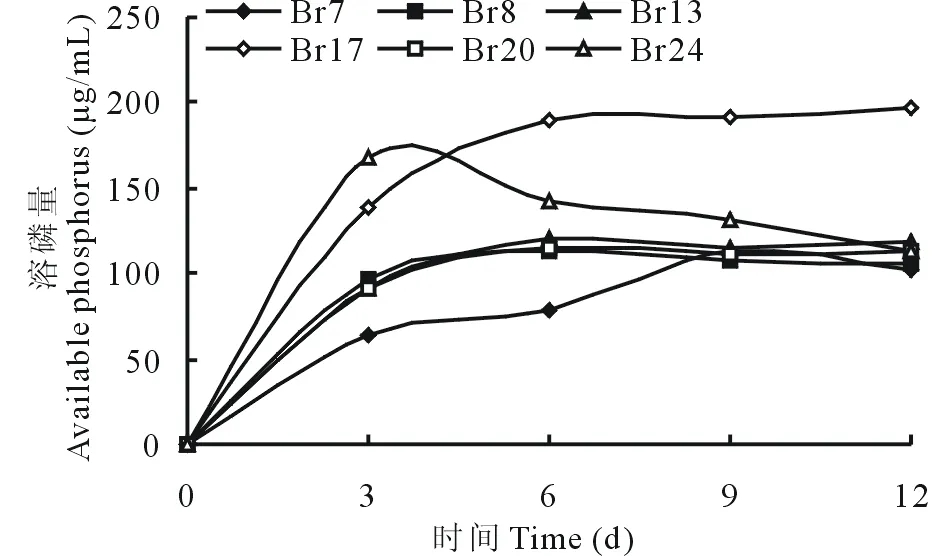
圖2 不同菌株在PKO培養基[以Ca3(PO4)2為底物]中溶磷量的動態變化Fig.2 The dynamic changes of available phosphorus of different phosphate-solubilizing bacteria on PKO culture medium with calcium phosphate
以不同的磷酸鹽為磷源培養7 d后,定量測定8個菌株的解磷活力,發現各菌株對不同磷源的溶磷能力差異較大(圖1)。以磷酸鈣為磷源時,菌株Br17和Br24的溶磷量最高,Br7溶磷量最小,其余5個菌株的溶磷能力介于兩者之間。以磷酸鋁為磷源時,僅有3個菌株表現出溶磷能力,其中溶磷量最大的是菌株Br7,其次為Br1和Br8,其余菌株均沒有表現出溶磷能力(P<0.05)。以上結果說明,篩選的溶磷菌株易溶解磷酸鈣,而不易溶解磷酸鋁。其中Br7、Br1和Br8 3個菌株對底物選擇性較低,能同時溶解兩種難溶性磷源。以磷酸鈣為磷源時,Br17和Br24的溶磷能力最強。
2.3 溶磷菌溶磷動力學分析
試驗選取6個菌株(Br1與Br4在實驗過程中被雜菌污染剔除,沒有用于分析)在不同培養時間對磷酸鈣培養基中磷的溶解狀況進行了動態測定,不同菌株的解磷能力顯著不同,其中菌株Br7的溶磷量在第9天達最大值,第12 天開始降低;菌株Br8、Br13、Br20的溶磷隨培養時間延長逐漸提高,到第6 天達到最大值;菌株Br17第6 天達到最大值,并一直保持穩定,而菌株Br24在第3 天時溶磷量達最大值其后逐漸下降。與底物篩選實驗類似,當以磷酸鈣為底物時,Br7的早期溶磷速率最快,Br24和Br17的溶磷能力最強(圖2)。
2.4 菌株分泌IAA能力
有研究表明,多數溶磷微生物具有分泌激素類物質的能力,生長素前體物質色氨酸常常用來加強IAA顯色反應。首先,定性檢測各菌株分泌IAA的能力,在無色氨酸溶液里,菌株Br13、Br17和Br24的培養液呈深粉紅色,它們可能具有較強分泌IAA能力;Br4呈粉紅色,Br8呈淺粉色;Br1、Br7和Br20顏色沒有變化。加入色氨酸后,菌株Br4、Br13、Br17和Br24呈深粉紅色,Br8呈粉紅色;菌株Br1、Br7和Br20沒有顏色反應(表2)。
定量測定結果表明,不加前體物質色氨酸時,除了Br13,各菌株分泌IAA的能力整體處于較低水平,Br13分泌IAA量最高,為10.39 μg/mL。在添加色氨酸后,不具有分泌IAA能力的Br1、Br7、Br20菌株IAA含量基本沒有變化,Br13的含量也維持在添加色氨酸之前的水平,Br4、Br8、Br17、Br24菌株的IAA分泌量都有不同程度上升,其中Br17和Br24 IAA分泌量最高,分別為11.53和11.56 μg/mL(表2)。
2.5 溶磷菌株對培養基pH值的影響
采用顯色反應對扁穗雀麥根際分離的8個溶磷菌株、空白對照(無菌水)以及生長地的土壤pH值進行定性以及培養3 d后定量測定。采樣地區土壤浸出液pH為5.97,為弱酸性土壤。接種無菌水的培養液(對照)顏色沒有變化,其pH值為6.82,而不同的菌株培養液顏色均由草綠色變為了黃色,其培養液pH值在3.37~5.63之間(表3)。
2.6 溶磷菌對扁穗雀麥的促生效果分析
對篩選的溶磷菌株進行模擬接種試驗,對篩選的8個菌株(Br1與Br4因接種污染沒有分析)接種到扁穗雀麥幼苗,培養21 d后,分析主根長、根數、幼苗株高以及生物產量4個性狀。與對照相比,接種Br8、Br13、Br17以及Br24菌株的材料主根顯著比對照短(P<0.05),而接種Br7與Br20的主根與對照相當(P>0.05,圖3A)。接種Br8、Br13、Br17以及Br24材料的根數顯著比對照多(P<0.05),而接種Br7與Br20的根數與對照沒有顯著差異(P>0.05,圖3B)。
株高是植物的形態指標,是產量的主要決定性狀之一。在接種實驗中,除接種菌株Br20的扁穗雀麥苗期株高較對照低16.16%外,接種其他菌株的扁穗雀麥苗期株高比對照增加11.30%~52.02%。其中接種菌株Br24處理的扁穗雀麥苗期株高促生效果最好,比對照提高52.02%(P<0.05);其中接種菌株Br7、Br8和Br13的菌株也顯著高于對照(P<0.05),Br17與對照差異不顯著(P>0.05,圖3C)。
接種各菌株處理對扁穗雀麥單株植株生物量的影響較大,其中接種菌株Br24與Br7的扁穗雀麥單株植株生物量分別較對照提高了75.97%和61.84%(P<0.05)。接種菌株Br8、Br13的扁穗雀麥單株植株生物量也較對照提高38.9%與25.4%(P<0.05)。與株高的結果類似,接種菌株Br20的生物產量與對照差異不顯著。綜合分析主根長、根數、株高及植株生物量的結果,菌株Br24的促生效果最好,有較好的應用潛力。
3 討論
溶解土壤中的磷酸鹽是溶磷微生物一個重要的功能,能顯著提高植物對磷元素的利用效率。此外,其具有分泌IAA和促生功能,對農作物以及其他經濟作物等產量的提高及其土壤生態恢復有重要意義。溶磷能力受菌種和底物差異多種因素的影響,鐘傳青等[20-21]研究了溶磷細菌對不同產地磷礦粉的溶解能力,發現不同溶磷菌株對底物具有專一性。通過比較細菌、霉菌、酵母菌對不同難溶磷酸鹽和磷礦粉等的溶解效果發現不同微生物對不同磷源的親和溶解能力不同,這種現象可能是由于微生物對不同化學結構含磷物質的親和能力不同,或由于菌株對不同磷源物質的溶解機制不同造成的[22]。本研究篩選的溶磷菌對以磷酸鈣和磷酸鋁兩種不同的磷源的溶解能力具有顯著不同。
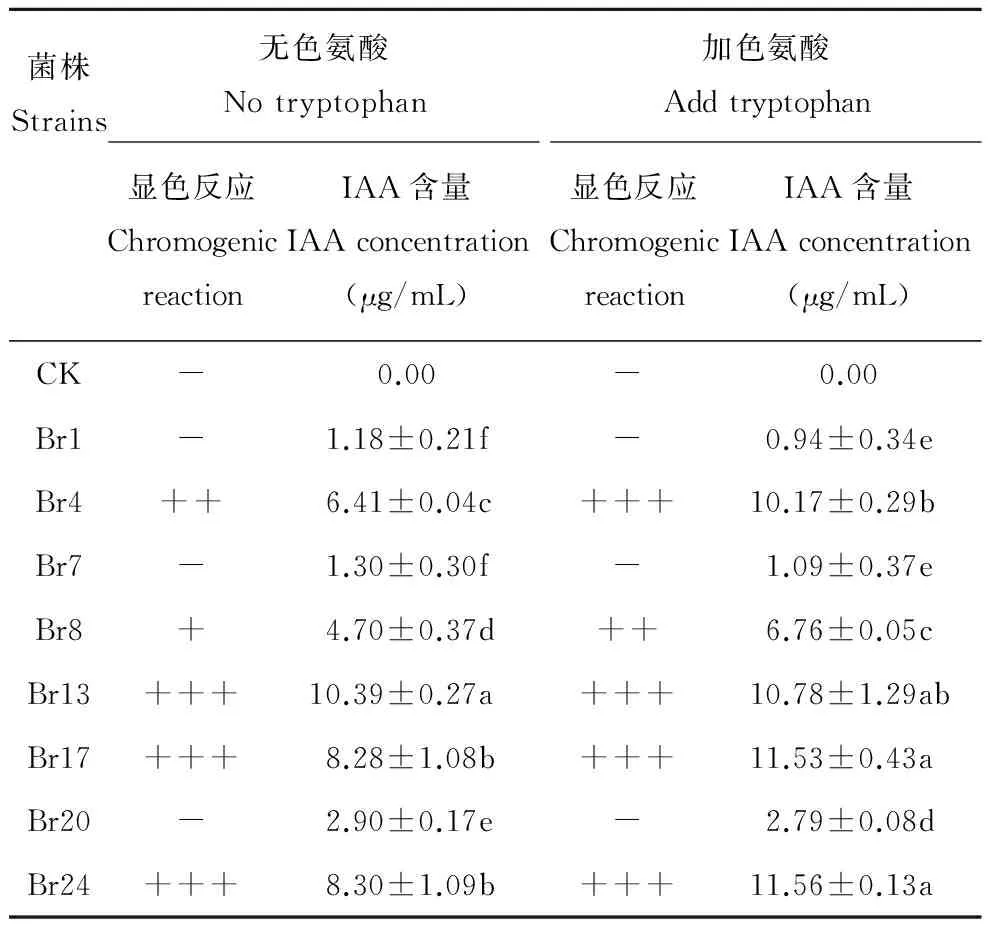
表2 菌株分泌IAA的性能 Table 2 The concentration of IAA secrete from phosphate-solubilizing bacteria
“+++”表示深粉紅;“++”表示粉紅;“+”表示淺粉紅及“-”表示無顏色變化。不同字母表示不同菌株間差異顯著(P<0.05)。
“+++”deep pink; “++”pink;“+”light pink and “-”no color. Different letters stand for significant difference between strains atP<0.05 level.
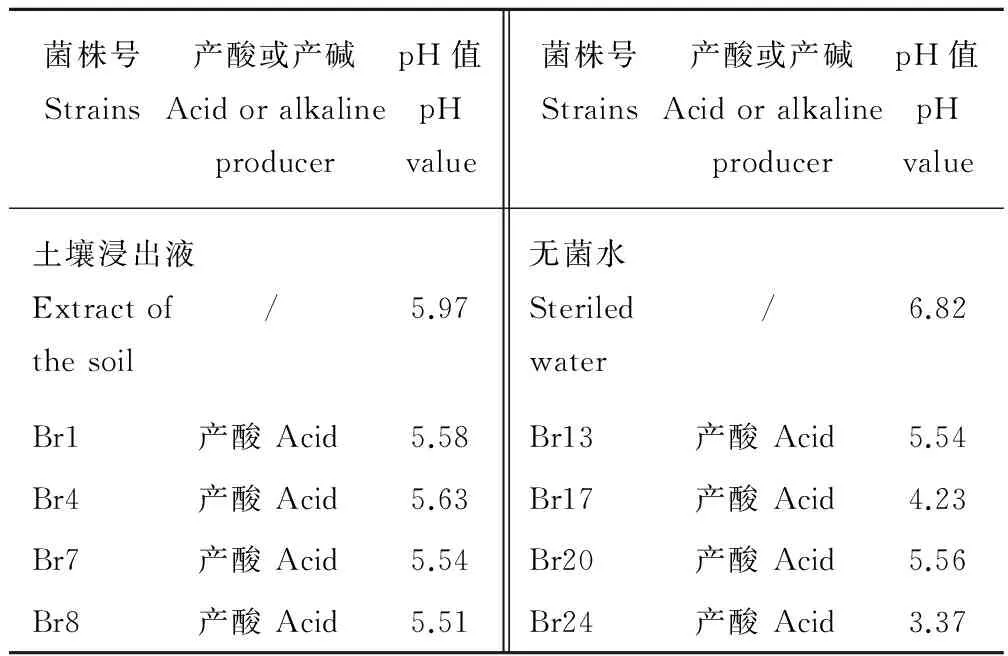
表3 溶磷菌對培養基pH值的影響Table 3 The phosphate-solubilizing strains affect pH value of the medium
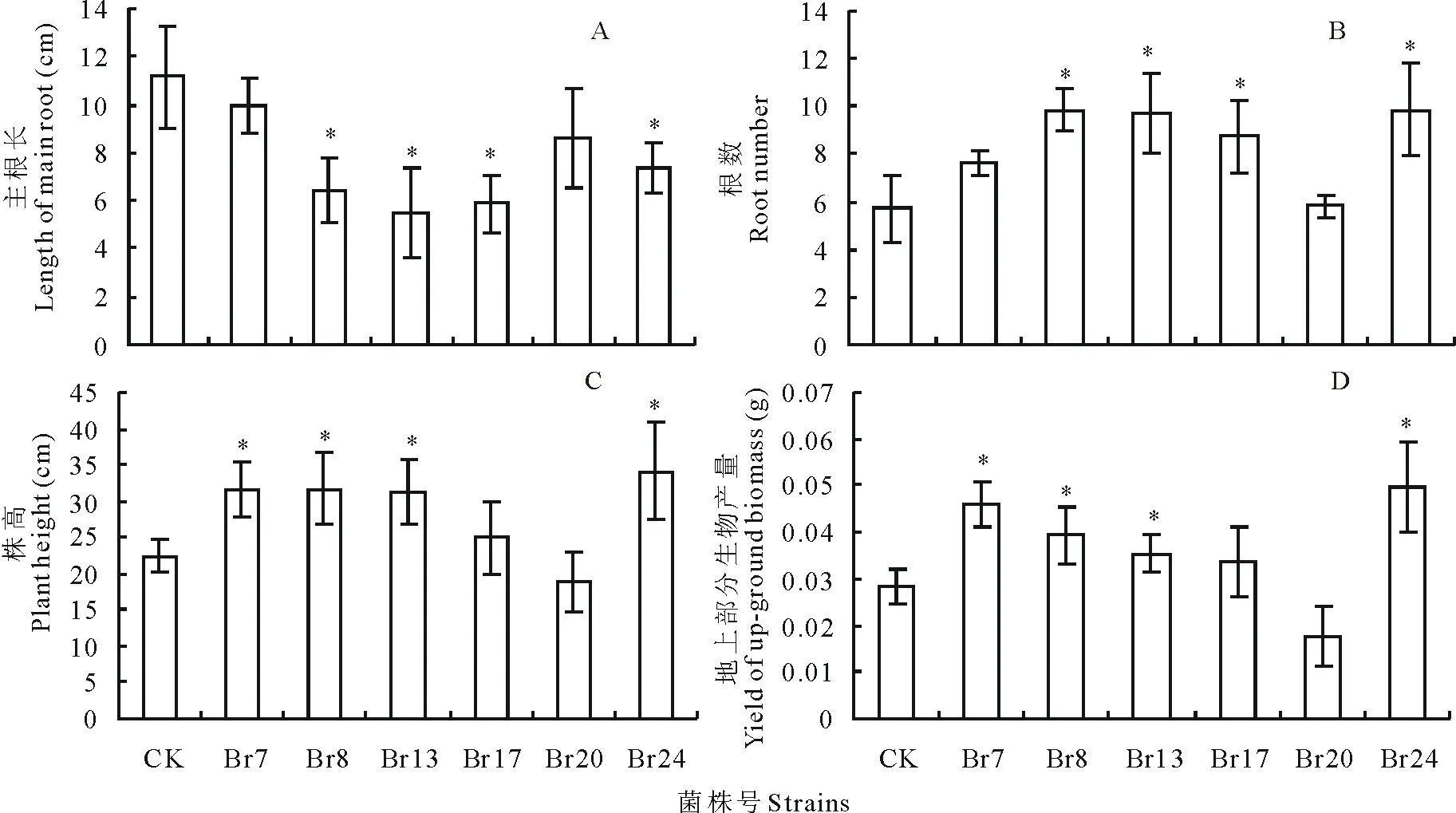
圖3 不同溶磷菌對扁穗雀麥根長(A)、根數(B)、株高(C)以及植株生物量(D)的影響Fig.3 Different PSB strains affect the root length (A), root number (B), plant height (C) and biomass yield (D) of B. cartharticus *表示差異顯著水平為P<0.05,n=7。* stands for a significant difference at P<0.05 level. n=7.
謝達平等[23]和徐幼平等[24]的研究發現植物根際產生植物生長調節物質的微生物群落數量很大,從不同植物根際中分離出來的微生物大約有88.6%,58.0%和90.0%分別可以分泌生長激素(IAA)、赤霉素(GA)或激動素類物質,這些物質在根毛區很容易被吸收利用。姚拓[25]從禾本科植物根際分離的聯合固氮菌株大多數具有分泌IAA能力,從而促進植物根系的生長。本研究發現部分扁穗雀麥根際溶磷菌具有與禾本科植物聯合固氮菌相同的分泌IAA的能力,并且添加色氨酸的菌株分泌IAA量大于不加色氨酸的濃度,在自然界中,色氨酸(生長素的前體)能由植物根分泌,也可由微生物的代謝產物或微生物自溶而得,大多數溶磷菌都能促進合成生長激素[20]。在制作微生物肥料進行生產應用時,應篩選更廉價的原材料以減低生產成本。
許多研究結果表明,溶磷菌能夠分泌甲酸、乳酸、葡萄糖酸、檸檬酸、丙酸、丁二酸等多種有機酸[22,26-27],其溶磷機理之一是菌體生長過程中分泌有機酸,這些酸既能降低pH值,又可與鐵、鋁、鈣等離子螯合,從而使難溶磷轉化為有效磷。培養液酸堿度的變化與溶磷能力之間存在顯著相關性[28-29];但也有研究表明溶磷量隨pH下降而增加,溶磷量與所分泌的有機酸量之間不存在顯著相關性[30]。本研究篩選的溶磷菌培養3 d后顯著降低培養基pH值,并且溶磷能力最強的Br24與Br17的pH值最低(圖1,表3),但pH值下降是否由于有機酸的分泌還有待于進一步研究。
接種有益菌于作物根際可以起到調節生態平衡的作用,促進有益菌群對作物生長功能的發揮(包括促生、防病、解磷等作用)。郜春花等[31]利用解磷菌株B2和B67研制的菌劑對盆栽玉米(Zeamays)、青菜(Brassicachinensisvar.chinensis)以及小麥(Triticumaestivum)等都有不同程度的促生作用。在本研究中,菌株Br8、Br13、Br17和Br24改變了扁穗雀麥根系發育,其可能是由于高濃度的IAA抑制了其主根伸長,促進了側根發生,抑制有明顯的促生作用,而Br7與Br20的生長素濃度及根系發育與對照沒有顯著差別(表2,圖3)。對株高與植株生物產量分析發現,除了Br17外,在生長素和根系中表現促進的菌株均對株高與生物產量表現為促進作用,但在生長素與根系發育中表現為陰性的Br7也顯著促進了扁穗雀麥的生長,因此在土壤微生物中可能還存在某種未知的機制促進植物與土壤微生物之間的互作。
4 結論
從貴州喀斯特地區禾本科牧草扁穗雀麥根際篩選8株溶磷菌微生物,對磷酸鈣都具有較好的溶解能力,其中Br7、Br1和Br8能夠溶解2種不同難溶性磷酸鹽。
以磷酸鈣為底物時,Br24與Br17的溶磷能力最強,可能與菌株的產酸能力顯著相關。
Br8、Br13、Br17和Br24主要通過分泌生長素影響根系發育,但植株生物產量與菌株分泌生長素特性不存在必然聯系(Br17分泌生長素,但生物產量沒有增加),因此不同溶磷菌可能存在多種促生機制促進植物生長。
綜合溶磷量、產酸以及對扁穗雀麥的促生效果,Br24是最具有應用潛力的溶磷菌株。
References:
[1] Gholamreza N, Madani H, Farahani E. The assessment effects of bio and chemical fertilizers on vegetative growth and essential oil of hyssop (HyssopusofficinalisL.). Science and Education, 2015, 1(1): 1-4.
[2] Arora M, Saxena P, Choudhary D K,etal. Dual symbiosis betweenPiriformosporaindicaandAzotobacterchroococcumenhances the artemisinin content inArtemisiaannuaL. World Journal of Microbiology & Biotechnology, 2015, 32(2): 1-10.
[3] Feng Y H, Yao T, Long R J. Research progress of phosphate-dissolving microorganisms in plant rhizosphere. Grassland and Turf, 2003, (1): 3-7. 馮月紅, 姚拓, 龍瑞軍. 土壤解磷菌研究進展. 草原與草坪, 2003, (1): 3-7.
[4] Wang G H, Zhao Y, Zhou D R,etal. Review of phosphate soluablizing microorganism. Ecology and Environment, 2003, 12(1): 96-101. 王光華, 趙英, 周德瑞, 等. 解磷菌的研究現狀與展望. 生態環境, 2003, 12(1): 96-101.
[5] Aziz A, Verhagen B, Magnin-Robert M,etal. Effectiveness of beneficial bacteria to promote systemic resistance of grapevine to gray mold as related to phytoalexin production in vineyards. Plant & Soil, 2015, 26(12): 47-51.
[6] Davison J. Plant beneficial bacteria. Nature Biotechnology, 1988, 6(6): 282-286.
[7] Bautista C A, Ortiz H Y D, Martínez G V,etal. Effect of phosphate-solubilizing bacteria isolated from semiarid soils on pitahaya seedlings (Hylocereusundatus). Idesia, 2015, 33(2): 65-68.
[8] Lugtenberg B, Kamilova F. Plant-growth-promoting rhizobacteria. Annual Review of Microbiology, 2009, 63(1): 541-556.
[9] Zhang K. The Making of the Plant Growth-promoting Rhizobacteria Bio-fertilizer and Effects on Highland Barly[D]. Lanzhou: Gansu Agriculture University, 2002. 張堃. 禾本科牧草根際促生菌肥(PGPR菌肥)研制及其促生效應研究[D]. 蘭州: 甘肅農業大學, 2002.
[10] Ma W W. Screening Plant Growth Promoting Rhizobacteria (PGPR) from Rhizosphere of Grasses and Establishing Their Database Management System[D]. Lanzhou: Gansu Agriculture University, 2014. 馬文文. 禾草根際促生菌資源篩選及其數據庫管理系統構建[D]. 蘭州: 甘肅農業大學, 2014.
[11] Shang Y S, Chen Y P, Shu J H,etal. Breeding of Qiancao 3#, a new forage variety (rescue brome). Guizhou Agricultural Sciences, 2009, 37(4): 7-10. 尚以順, 陳燕萍, 舒健虹, 等. 牧草新品種黔草3號扁穗雀麥的選育. 貴州農業科學, 2009, 37(4): 7-10.
[12] Li X G, Ban M G, Zhou Z Y,etal. Effects of bacterial suspension of different substrates and different dose on the germination of Qiannan flat bromegrass seed. Soil and Fertilizer in China, 2014, (2): 88-92. 李顯剛, 班鎂光, 周澤英, 等. 基于不同基質和劑量的溶磷菌液對黔南扁穗雀麥種子發芽的影響. 中國土壤與肥料, 2014, (2): 88-92.
[13] Shu J H, Yang C Y, Wang P C,etal. Effect of phosphate solubilizing bacterial on seedling growth of bromegrass. Guizhou Agricultural Sciences, 2013, 41(8): 151-153. 舒健虹, 楊春燕, 王普昶, 等. 溶磷菌對扁穗雀麥發芽及幼苗生長的影響. 貴州農業科學, 2013, 41(8): 151-153.
[14] Li F X, Zhang D G, Yao T. Study on cultural conditions of plant growth promoting rhizobacteria in rhizosphere of oat in alpine region. Journal of Gansu Agricultural University, 2004, 39(3): 316-320. 李鳳霞, 張德罡, 姚拓. 高寒地區燕麥根際高效PGPR菌培養條件研究. 甘肅農業大學學報, 2004, 39(3): 316-320.
[15] Smith K P, Goodman R M. Host variation for interactions with beneficial plant-associated microbes. Annual Review of Phytopathology, 1999, 37: 37473-37491.
[16] Xi L Q, Yao T, Yang J J,etal. Property of associative nitrogen-fixing bacteria producing IAA and its promoting growth of oat. Grassland and Turf, 2005, (4): 25-29. 席琳喬, 姚拓, 楊俊基, 等. 聯合固氮菌株分泌能力及其對燕麥的促生效應測定. 草原與草坪, 2005, (4): 25-29.
[17] Wu Y, Xi L Q. Dynamic of IAA produced nitrogen fixation bacterial around oat root system. Journal of Anhui Agricultural Sciences, 2007, 35(15): 4424-4425. 吳瑛, 席琳喬. 燕麥根際固氮菌分泌IAA的動態變化研究. 安徽農業科學, 2007, 35(15): 4424-4425.
[18] Thakuria D, Talukdar N C, Goswami C,etal. Characterization and screening of bacteria from rhizosphere of rice grown in acidic soils of Assam. Current Science, 2004, 86(7): 978-985.
[19] Yao T. Characteristics and Biofertilizer of Plant Growth Promoting Rhizobacteria Isolated from Oat and Wheat in Northwest China[D]. Lanzhou: Gansu Agriculture University, 2002. 姚拓. 飼用燕麥和小麥根際促生菌特性研究及其生物菌肥的初步研制[D]. 蘭州: 甘肅農業大學, 2002.
[20] Zhong C Q, Huang W Y. Effects and mechanism of P-solubilizing bacilus P17 strain on phosphorus solubilization of different phosphate rocks. Acta Pedologica Sinica, 2004, 41(6): 931-937. 鐘傳青, 黃為一. 磷細菌P17對不同來源磷礦粉的溶磷作用及機制. 土壤學報, 2004, 41(6): 931-937.
[21] Zhong C Q, Huang W Y. Comparison in P-solubilizing effects between different P-solubilizing microbes and variation of activities of their phosphatases. Acta Pedologica Sinica, 2005, 42(2): 286-294. 鐘傳青, 黃為一. 不同種類解磷微生物的溶磷效果及其磷酸酶活性的變化. 土壤學報, 2005, 42(2): 286-294.
[22] Rodríguez H, Fraga R, Gonzalez T,etal. Genetics of phosphate solubilization and its potential applications for improving plant growth-promoting bacteria. International Journal of Cultural Studies, 2006, 9(5): 329.
[23] Xie D P, Lei N X, Peng D L,etal. The study of the bacteria manure’ s role to the crop. Journal of Changde Teachers University: Natural Science Edition, 2002, 14(1): 48-50. 謝達平, 雷女孝, 彭道林, 等. 微生物菌肥的作用機理研究. 常德師范學院學報: 自然科學版, 2002, 14(1): 48-50.
[24] Xu Y P, Zang R C, Chen W L,etal. Plant grows promoting function and IAA analysis of Enterobacter B8 fermented liquid. Journal of Zhejiang University: Agricultural and Life Science Edition, 2001, 27(3): 282-284. 徐幼平, 臧榮春, 陳衛良, 等. 陰溝腸桿菌B8發酵液對植物的促生作用和IAA分析. 浙江大學學報: 農業與生命科學版, 2001, 27(3): 282-284.
[25] Yao T. Associative nitrogen-fixing bacteria in the rhizosphere ofAvenasativain an alpine region ⅡPhosphate-solubilizing power and auxin production. Acta Prataculturae Sinica, 2004, 13(3): 85-90. 姚拓. 高寒地區燕麥根際聯合固氮菌研究 Ⅱ固氮菌的溶磷性和分泌植物生長素特性測定. 草業學報, 2004, 13(3): 85-90.
[26] Whitelaw M A, Harden T J, Helyar K R. Phosphate solubilisation in solution culture by the soil fungusPenicilliumradicum. Soil Biology & Biochemistry, 2013, 31(5): 655-665.
[27] Chen Y P, Rekha P D, Arun A B,etal. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities. Applied Soil Ecology, 2006, 34(1): 33-41.
[28] Paul N B, Rao W V B S. Phosphate-dissolving bacteria in the rhizosphere of some cultivated legumes. Plant & Soil, 1971, 35(1): 127-132.
[29] Seshadri S, Ignacimuthu S, Lakshminarasimhan C. Effect of nitrogen and carbon sources on the inorganic phosphate solubilization by different aspergillus niger strains. Chemical Engineering Communications, 2004, 8: 1043-1052.
[30] Narsian V, Patel H H. Aspergillus aculeatus as a rock phosphate solubilizer. Soil Biology & Biochemistry, 2000, 32(4): 559-565.
[31] Gao C H, Lu C D, Zhang Q. Effects of phosphate liberation bacteria on crop growth and phosphate in soil. Journal of Soil and Water Conservation, 2006, 20(4): 54-56. 郜春花, 盧朝東, 張強. 解磷菌劑對作物生長和土壤磷素的影響. 水土保持學報, 2006, 20(4): 54-56.
Isolation and screening of inorganic phosphate-solubilizing bacteria and their effect on the growth ofBromuscartharticus
SHU Jian-Hong1, WANG Pu-Chang1, LI Xian-Gang2, WANG Xiao-Li1, LI Xiao-Dong1*
1.GuizhouInstituteofPrataculture,Guiyang550006,China; 2.QiannanForageStation,Duyun558000,China
We screened rhizosphere microorganisms of bromegrass (Bromuscartharticus) and isolated bacteria with phosphate-solubilization activity. The isolated bacteria were further analyzed to quantify their phosphorus-solubilization activity, indole acetic acid (IAA) secretion capacity, and their ability to promote the growth of bromegrass. The isolated microorganisms showed differences in their ability to utilize different inorganic phosphate substrates. All the selected strains had phosphate solubilization activity with calcium phosphate as the phosphorus source, whereas only strains Br1, Br7 and Br8 were able to solubilize phosphate with aluminum phosphate as the phosphorus source. Strain Br7 had the strongest phosphate-solubilization ability. Strains Br4, Br8, Br17, and Br24 secreted relatively large amounts of IAA, and IAA secretion was enhanced when exogenous tryptophan (an IAA precursor) was added. Analyses of the medium pH indicated that all eight isolated strains were acid-producing bacteria. The root length, root number, plant height, and total biomass of bromegrass inoculated with these isolated strains were measured. Strains Br8, Br13, Br17, and Br24 strongly affected root growth, resulting in a shorter main root but more abundant roots. Strains Br7, Br8, Br13, and Br24 increased bromegrass plant height and biomass. These results indicate that strain Br24 has great potential to improve the growth of bromegrass in Guizhou province.
phosphate solubilization bacteria; phosphate solubilization ability; IAA; bromegrass
10.11686/cyxb2016215
http://cyxb.lzu.edu.cn
2016-05-23;改回日期:2016-06-07
貴州省科技支撐計劃(黔科合支撐[2016]2504號),貴州省社會發展攻關(黔科合NY字[2011]3104號),農業科學院自主創新科研專項(黔農科院自主創新科研專項字[2014]010號)和貴州省農業科技攻關(黔科合NY字[2010]3045號)資助。
舒健虹(1972-),女,湖南長沙人,助理研究員。 E-mail: gzsjhong@126.com*通信作者Corresponding author. E-mail: lixiaodongzl@163.com
舒健虹, 王普昶, 李顯剛, 王小利, 李小冬. 無機磷溶解菌的分離篩選及其對扁穗雀麥生長的影響. 草業學報, 2017, 26(5): 173-180.
SHU Jian-Hong, WANG Pu-Chang, LI Xian-Gang, WANG Xiao-Li, LI Xiao-Dong. Isolation and screening of inorganic phosphate-solubilizing bacteria and their effect on the growth ofBromuscartharticus. Acta Prataculturae Sinica, 2017, 26(5): 173-180.

