楸樹體胚發生過程中5種酶的活性變化研究
金玉佩 劉佳 紀若璇 梁宏偉 張麗萍

摘 要 以楸樹體胚發生過程中不同時期的組織為材料,分析測定體胚發生過程不同階段的過氧化物酶(POD)、超氧化物岐化酶(SOD)、腺嘌呤核苷三磷酸酶(ATP)、淀粉酶(AMY)、酯酶(EST)這5種酶類的活性,以探討楸樹胚胎發生過程中的生理生化變化特征。結果表明:楸樹體胚發生過程中的不同時期,這5種酶類的活性也會相應發生變化。POD、SOD和EST酶活反應在旺盛增殖分化的黃色胚性愈傷組織(YEC)的活性最高,ATP和AMY酶活反應在開始萌發的綠色子葉胚(GCE)中活性最高。在黑色愈傷組織和非胚性愈傷組織中,SOD、AMY和EST酶的活性很低,與此類組織的不能分化及處于生長停滯狀態具有一定相關性。
關鍵詞 楸樹; 體細胞胚胎發生; 酶活測定
中圖分類號 Q418 文獻標識碼 A
Abstract In this study, in order to explore the physiological and biochemical changes in the embryogenesis of C. bungei, we analyzed the activities of five enzymes, such as amylase(AMY), superoxide dismutase(SOD), peroxidase(POD), enzyme adenosine triphosphate(ATP)and esterase(EST), in different stages of somatic embryogenesis. The results showed that the five kinds of enzyme activities could change in accordingly to different stages on the process of somatic embryogenesis in C. bungei. The POD, SOD and EST enzyme activities were the highest in yellow embryogenic callus which had strong proliferation and differentiation, ATP and AMY enzyme activities were the highest in the green cotyledonary somatic embryo which was germinating. In black callus and non-embryogenic callus, the enzyme activities of SOD, AMY and EST were very low, which were related to the indifferentiation and growth stagnation of these tissues.
Key words Catalpa bungei; somatic embryogenesis; enzyme activity assay
doi 10.3969/j.issn.1000-2561.2017.02.011
楸樹(Catalpa bungei C. A. Mey.)屬紫葳科(Bignoniaceae)梓屬(Catalpa)落葉大喬木,是中國特有的珍貴用材和觀賞樹種。楸樹自然狀態下自交不親和[1],自然結實率低。目前楸樹通常采用嫁接和扦插等方式進行無性繁殖,嫁接法繁殖揪樹須培育砧木、嫁接品種接穗,技術環節多,育苗周期長[2]。楸樹扦插有多種因素影響扦插成活率,其中嫩枝扦插有較高的成活率[3],且有關扦插的生根機理還有待進一步研究[4]。在幾位學者的研究下已經建立楸樹組織再生體系。體細胞胚胎發生具有快速、高增殖率及高再生率等優點,能使楸樹新品種快速繁殖。
目前,許多裸子植物和被子植物都通過體細胞胚途徑獲得了再生植株,國內外有關體細胞胚發生的研究日益增多。在國內,關于植物體細胞胚胎發生機制的研究進展比較緩慢,尤其是關于胚胎相關基因的表達與調控、人工種子制備以及體細胞胚胎的生產應用方面的研究較國際上先進水平落后很多[5]。國內研究較多梓屬植物有花楸、滇楸、楸樹等,目前都已建立了組培再生體系。其中研究了滇楸體胚發生過程中細胞生物學和特異蛋白[6],花楸種子生物學和體細胞胚再生體系的建立[5]。甚少關于體胚發生過程中關鍵酶活性的研究,而有關楸樹在體胚發生過程中各酶類的活性變化還未見報道。
本試驗通過對楸樹體細胞胚胎發生過程中不同發育階段組織材料的代謝相關酶類(過氧化物酶、超氧化物歧化酶、腺嘌呤核苷三磷酸酶、淀粉酶和酯酶)的活性測定和分析,有助于在生理生化水平上研究楸樹體細胞胚發生機制。
1 材料與方法
1.1 材料
以6月底至7月初楸樹未成熟合子胚進行愈傷組織誘導,獲得的初代愈傷組織是非胚性愈傷組織,為膨大松散的淡黃綠色無定型組織團,繼代培養增殖后轉變為無明顯變化;以初代愈傷組織誘導胚性愈傷組織,在體胚分化誘導過程中最先出現的是黑色愈傷組織,繼而在黑色愈傷組織上分化產生淡黃色胚性愈傷組織,為緊實細膩的淡黃色顆粒狀組織團。繼續培養黃色胚性愈傷組織,會出現分化產生白色子葉胚,繼續分化產生綠色子葉胚(圖1)。
多次繼代培養后挑取非胚性愈傷組織(Non-embryogenic callus, NC)、黑色愈傷組織(Black callus, BC)、黃色胚性愈傷組織(Yellow embryogenic callus, YEC)、白色子葉胚(White cotyledon embryo, WCE)和綠色子葉胚(Green cotyledon embryo, GCE)各1 g,錫紙包裹過液氮中速凍后置于-80℃超低溫冰箱中保存備用。
1.2 方法
1.2.1 粗酶液提取 分別取-80 ℃保存的非胚性愈傷組織材料和不同發育時期的胚性愈傷組織材料各1.0 g,加入聚乙烯吡咯烷酮(Polyvinyl Pyrrolidone,PVPP)0.2 g,邊加液氮邊進行研磨,研磨成粉后加入磷酸鹽緩沖液(PBS)5.0 mL(pH7.8,使用前預冷),繼續研磨成勻漿后,12 000 r/min,4 ℃離心20 min,取上清液重復上述步驟,取上清液即為酶提取液,分裝于200 μL離心管中,用于酶活性測定分析。
1.2.2 酶活測定 過氧化物酶活性的測定:采用創愈木酚法[7]測定POD酶活性;超氧化物岐化酶活性測定:以SOD對NBT光化還原的抑制作用來定量測定SOD酶活性[8];腺嘌呤核苷三磷酸酶活性測定:通過酶促反應所釋放的無機磷的量[9]來測定ATP酶活性;淀粉酶活性測定:參照李雯等[10]改進的用淀粉酶分解麥芽糖的方法來測定AMY酶活性;酯酶活性測定:分解醋酸-α-萘酯的方法[11]來測定EST酶活性;使用美國Thermo紫外可見光分光光度計Evolution 220測定不同發育階段的各酶類的活性,重復3次。
1.3 數據處理
將得到的數據結果用Microsoft excel 2010軟件進行處理,生成圖表并分析。
2 結果與分析
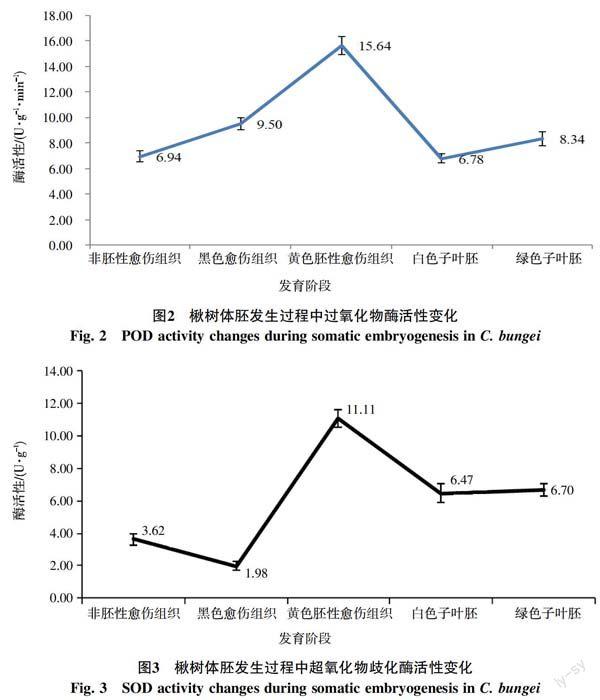
2.1 不同發育階段的過氧化物酶活性變化
由圖2可以看出,各組織中過氧化物酶活性由高到低依次為:黃色胚性愈傷組織、黑色愈傷組織、綠色子葉胚、非胚性愈傷組織和白色子葉胚。黃色胚性愈傷組織在幾種組織中的過氧化物酶活性最高,達到15.64 U/(g·min),表明在黃色胚性愈傷組織中存在旺盛的POD酶生理生化代謝過程,以利于體細胞胚胎的分化發生。白色子葉胚時期為體細胞胚發育成熟階段,其過氧化酶活性最低,僅為6.78 U/(g·min),說明在萌發之前處于較低的POD生理生化代謝狀態下,與成熟種子胚的狀態相類似。
2.2 不同發育階段的超氧化物歧化酶活性變化
由圖3可以直觀地觀察到各發育時期的組織中超氧化物歧化酶活性由高到低依次為:黃色胚性愈傷組織、綠色子葉胚、白色子葉胚、非胚性愈傷組織和黑色愈傷組織。SOD是植物細胞中清除活性氧第一個發揮作用的酶。黃色胚性愈傷組織中存在活躍的生長分化過程,分化產生體細胞胚胎,故其細胞內生理生化代謝反應旺盛,高活性的SOD酶有助于清除快速細胞生長分裂過程中產生的活性氧自由基,故其組織內SOD酶活性最高,達到11.11 U/g;黑色愈傷組織是黃色胚性愈傷組織的上一發育階段,其生長緩慢近乎停滯,因而SOD酶活性最低,僅為1.98 U/g。白色子葉胚與綠色子葉胚時期中SOD酶活性較為穩定,無明顯變化。
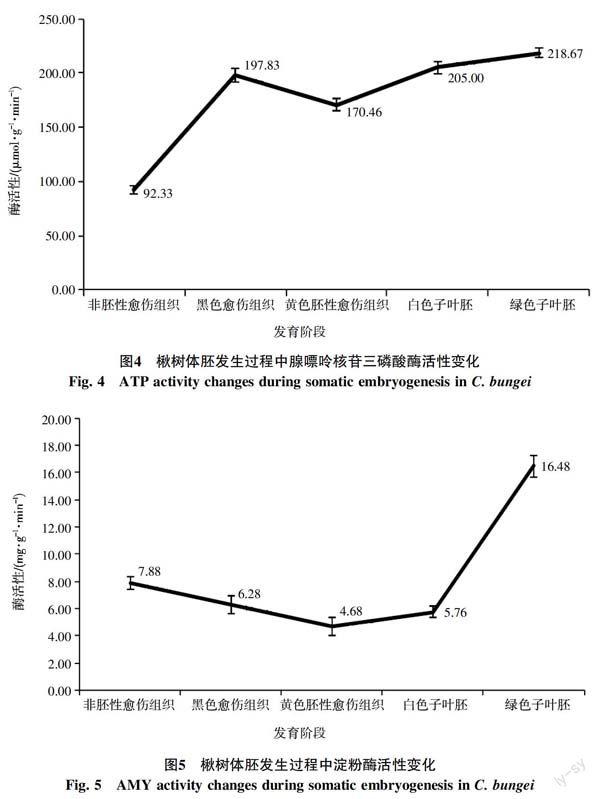
2.3 不同發育階段的腺嘌呤核苷三磷酸酶活性變化
由圖4可以觀察到各發育時期組織中腺嘌呤核苷三磷酸酶活性由高到低依次為:綠色子葉胚、白色子葉胚、黑色愈傷組織、黃色胚性愈傷組織和非胚性愈傷組織。ATP酶活性越高,能夠為細胞生長分化發生提供的能量越多。非胚性愈傷組織主要由含有大液泡的薄壁細胞構成,幾乎不具有分化再生能力,僅僅維持增殖,其組織細胞內ATP酶生理生化反應是最低的。黑色胚性愈傷組織是黃色胚性愈傷組織的前體階段,向胚性愈傷組織轉變過程中需要耗能巨大,其酶活達到197.83 μmol/(g·min),為非胚性愈傷組織的2.14倍;而綠色子葉胚是白色子葉體胚開始萌發成苗的階段,綠色子葉胚進一步發育即可形成完整小植株,其細胞內生理生化代謝最活躍,酶活性為218.67 μmol/(g·min),因此組織內ATP酶的生理生化活性最高。
2.4 不同發育階段的淀粉酶活性變化
由圖5可以明顯看到淀粉酶活性由高到低依次為:綠色子葉胚、非胚性愈傷組織、黑色愈傷組織、白色子葉胚和黃色胚性愈傷組織。淀粉酶用于水解淀粉麥芽糖,并進一步水解為葡萄糖后進入糖酵解供給能量,在萌發的種子中活力最強。綠色子葉胚是正在萌發的體胚,其組織細胞內生理生化代謝旺盛,酶活達到16.48 mg/(g·min),不斷地降解淀粉為其生長發育提供大量能量,故其淀粉酶活性最高。在其他體胚發育階段的淀粉酶活性變化差異不大。
2.5 不同發育階段的酯酶活性變化
由圖6可以明顯觀察到酯酶活性在不同組織中差異較大。酯酶活性由高到低依次為:黃色胚性愈傷組織、白色子葉胚、綠色子葉胚、黑色愈傷組織和非胚性愈傷組織。酯酶能夠催化水解脂肪酸族和芳香族酯類化合物,參與組織細胞內相對較為活躍的各類生理反應。黃色胚性愈傷組織在培養過程中不斷分化產生體細胞胚胎,其細胞內各類代謝反應活躍,其EST酶活性達到74.53 U/(g·s),因此其組織細胞內酯酶活性最高。非胚性愈傷組織與黑色愈傷組織酯酶活性較接近且較低,說明其組織細胞內各類生理反應相對不活躍,這與其不能分化及處于生長停滯狀態相對應。
3 討論
楸樹胚性愈傷組織和非胚性愈傷組織及其他發育階段在形態上存在明顯的差異,其中的各類酶活性水平也存在明顯的差異。本試驗發現POD、SOD和EST在黃色愈傷組織中活性最高。SOD與POD酶相互協調配合,清除植物代謝旺盛和逆境脅迫下產生的過剩自由基[12-13]。2種酶作用相互協調正如本實驗中這2種酶活性變化趨勢相似,黃色愈傷組織期間兩酶活性最高與其活躍的生長分化旺盛狀態相符合。白色到綠色子葉胚階段POD酶活性上升與其他學者研究的滇楸[14]和花楸[15]體胚發生中POD酶活性在子葉胚時期后上升的趨勢一致。EST能夠催化蛋白質的去磷酸化,催化細胞信號物質的合成和轉化[16],能夠水解非生理存在的酯類化合物,因此對植物可能有去毒的功能[17]。本試驗EST酶活性在黃色愈傷組織中最高,與鐵皮石斛球形胚和心形胚時期的酯酶同工酶[18]出現特異條帶相印證。故而黃色愈傷組織內各類生理反應與其他階段比相對較活躍,且進一步說明有相對較強的代謝過程和抗逆性。
ATP酶和淀粉酶在綠色子葉胚中活性最強。隨著胚性細胞后期細胞壁的加厚,ATP酶活性沉積物出現,為胚性細胞的分裂和發育提供能量[19]。因此綠色子葉胚作為體胚萌發的初始階段,其ATP酶活性是最強的。在雜交鵝掌楸的研究中發現胚性細胞早期和后期ATP酶活性高[20],這與本試驗中黑色愈傷組織分化到綠色子葉胚發育的ATP酶活性高相符合。沉積于胚乳組織淀粉粒邊緣的淀粉酶與其細胞生理學功能緊密聯系,能催化淀粉水解為種子萌發提供能量[21]。因此,綠色子葉胚淀粉酶活性最高,其生理學功能與種子相同。本試驗的綠色子葉胚發育與任鶯[22]文章中Ⅰ型綠色愈傷組織一致,其淀粉酶活性高與細胞學觀察到淀粉粒豐富一致。
酶活性的分布和定位變化,從一個側面反映了胚性細胞在分化和發育過程中的生理和代謝狀態[15]。如上述,EST、POD和SOD 3種酶的活性強弱可作為鑒定楸樹體細胞胚胎發生過程中特定時期的生化參考標記。
參考文獻
[1] 王改萍. 楸樹花器官特性及自交不親和性研究[D]. 南京: 南京林業大學, 2013.
[2] 楊 燕. 楸樹組織培養研究[D]. 南京: 南京林業大學, 2013.
[3] 梁有旺, 彭方仁, 王順才. 揪樹嫩枝扦插試驗初報[J]. 林業科技開發, 2006, 20(1): 67-69.
[4] 許波濤, 陳建森. 揪樹扦插繁育研究現狀及生根機理[J]. 中國園藝文摘, 2013(5): 46-87.
[5] 楊 玲. 花揪種子生物學和體細胞胚發生體系研究[D]. 哈爾濱: 東北林業大學, 2007.
[6] 江榮翠. 滇楸體細胞胚胎發生及其機理研究[D]. 南京: 南京林業大學, 2010.
[7] 李忠光, 龔 明. 愈創木酚法測定植物過氧化物酶活性的改進[J]. 植物生理學通訊, 2008, 44(2): 323-324.
[8] 王愛國, 羅廣華, 邵從本. 大豆種子超氧物歧化酶的研究[J]. 植物生理學報, 1983, 9(1): 77-84.
[9] 張志良, 瞿偉菁. 植物生理學實驗指導[M]. 3版. 北京: 高等教育出版社, 2003: 89-90.
[10] 李 雯, 邵遠志, 陳維信. 淀粉酶活性測定方法的改進[J]. 植物生理學通訊. 2005, 41(5): 655-656.
[11] 劉春紅, 馮志彪. 以α-乙酸萘酯為底物植物酯酶活力測定條件的優化[J]. 食品工業科技, 2008, 29(6): 145-151.
[12] 梁艷榮, 胡曉紅, 張穎力, 等. 植物過氧化物酶生理功能研究進展[J]. 內蒙古農業大學學報, 2003, 24(2): 110-113.
[13] 夏民旋, 王 維, 袁 瑞, 等. 氧化物歧化酶與植物抗逆性[J]. 分子植物育種, 2015, 13(11): 2 633-2 646.
[14] 江榮翠, 彭方仁, 譚鵬鵬. 滇楸體胚發生及生理生化特性研究[J]. 林業科技開發, 2014, 28(1): 25-29.
[15] 張建瑛. 花楸體胚發生的外植體和培養基效應及生化物質變化研究[D]. 哈爾濱: 東北林業大學, 2007.
[16] 張立軍, 弓 雪, 汪 澈, 等. 酯酶功能和編碼基因的多樣性[J]. 沈陽農業大學學報, 2010, 41(5): 515-520.
[17] 張 春, 張以忠, 駱 強. 幾種泥炭蘚屬植物酯酶同工酶研究[J]. 安徽農業科學, 2012, 40(22): 1 161-1 162.
[18] 趙 鵬. 鐵皮石解體細胞胚胎發生研究[D]. 成都: 西南交通大學, 2007.
[19] 李 杉, 邢更妹, 崔凱榮, 等. 植物體細胞胚發生中ATP酶活性時空分布動態與內源激素的變化[J]. 植物學通報, 2001, 18(3): 308-317.
[20] 陳金慧, 施季森, 甘習華, 等. 雜交鵝掌楸體胚發生過程中ATP酶活性的超微細胞化學定位[J]. 西北植物學報, 2006, 26(1): 12-17.
[21] 齊繼艷, 陳舟舟, 盧 晗, 等. 植物β-淀粉酶[J]. 植物生理學通訊, 2008, 44(2): 334-340.
[22] 任 鶯, 彭方仁, 楊 燕, 等. 楸樹不同類型胚性和非胚性愈傷組織的細胞學觀察[J]. 林業科技開發, 2011, 5(25): 43-45.

