響應面分析優化蒽酮硫酸法測定葡萄葉片中可溶性糖的含量
徐美蓉,李曉蓉,李婷
摘要:測定葡萄葉片中的可溶性糖,對葡萄葉片可溶性糖提取條件進行了比較;利用響應面法(RSM)對測定可溶性糖含量的蒽酮-硫酸顯色方法參數進行優化,并得到回歸模型。結果表明,葡萄葉片可溶性糖提取的最佳提取劑為水,采用21.9%乙酸鋅和10.6%亞鐵氰化鉀可以最大限度的去除共提物干擾,確定檢測波長為625 nm。用0.2 mg/mL蒽酮-硫酸試劑12 mL,在沸水浴中加熱12 min。在此條件下測定的可溶性糖平均含量為2.54%~6.93%,精密度實驗RSD為0.68%~0.81%,平均加標回收率99.4%,RSD=2.7%(n=3)。
關鍵詞:葡萄葉片;可溶性糖;蒽酮-硫酸法;響應面法
中圖分類號:S132 文獻標志碼:A 文章編號:1001-1463(2017)11-0025-05
doi:10.3969/j.issn.1001-1463.2017.11.008
Determination of Soluble Sugar from Grape Leaves by Optimizing of
Anthrone-Sulfuric Acid Method by Response Surface Methodology
XU Meirong, LI Xiaorong, LI Ting
(Institute of Agricultural Quality Standards and Detection Technology, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China)
Abstract:An anthrone-sulfuric acid method for the extraction of soluble sugar from grape leaves is optimized using response surface methodology (RSM). The result indicates the optimum extraction agent of soluble sugar glucose is water, adding 21.9% zinc acetate and 10.6% potassium ferrocyanide could not interfere with co-extract extremely, and detection wavelength is 625 nm. In addition, we suggest 12 mL of 0.2 mg/mL anthrone-sulfuric acid agent should be added and perform water-bathing for 12 min. on the basis of the conditions, the content of soluble sugar is found in the range of 2.54~6.93%, the relative standard deviation (RSD) ranged from 0.68% to 0.81%, and the average recovery is 99.4% (RSD=2.7%, n=3).
Key words:Grape leaves;Soluble sugar;Anthracenone-sulfate method;Response surface method (RSM)
葡萄在我國屬于六大水果之一,在果樹種植中有著舉足輕重的作用[1 - 2 ]。可溶性糖不僅是高等植物的主要光合產物,而且是碳水化合物代謝和暫時貯藏的主要形式。在研究葡萄果實生長發育的過程中,掌握整個植物體內可溶性糖含量變化,特別是葉片的可溶性糖含量變化,有助于了解其光合性能和糖份及干物質積累等過程[3 - 7 ]。一般以葡萄糖作為可溶性糖的測定指標,其測定方法主要有蒽酮-硫酸法[8 ]、苯酚-硫酸法[9 ]、3,5-二硝基水楊酸比色法[10 ]和鐵氰化鉀法[11 ]等。3,5-二硝基水楊酸比色法適用于直接測定植株中還原糖。苯酚-硫酸法測定時影響因素較多,苯酚試劑見光或遇氧即逐漸氧化成淡紅色,而且加入試劑反應劇烈,容易濺出,往往導致結果偏差[12 ]。鐵氰化鉀法操作繁瑣,整個操作過程需要在微沸狀態下進行,試劑的滴定速度、加熱時間、熱源穩定程度等對測定結果的準確度都有很大的影響[9 ]。蒽酮-硫酸比色法則顯色穩定、重現性好、操作簡便、結果穩定。目前對葡萄葉片可溶性糖含量測定的報道并不多見。我們對葡萄葉片中可溶性糖的含量進行了測定,并通過優化前處理提取條件,利用響應面法對蒽酮-硫酸比色法測定條件進行了進一步的優化,以期準確測定葡萄葉片中可溶性糖的含量,為實現葡萄高產、優質栽培及其副產品的開發提供參 考。
1 材料與方法
1.1 材料與設備
供試葡萄鮮葉片采自甘肅省農業科學院林果花卉研究所葡萄園。用烘箱低溫烘干至恒重,粉碎過40目篩,放入封口袋備用。所用試劑有葡萄糖、蒽酮、濃硫酸、乙醇、丙酮,葡萄糖為GR,其余試劑均為AR。純水三級。實驗儀器主要有瓦里安Cary50紫外-可見分光光度計、AG204分析天平(上海梅特勒-托利多儀器有限公司提供)、高速離心機、水浴鍋。
1.2 實驗方法
1.2.1 葡萄糖標準溶液的配制 準確稱取105 ℃干燥至恒重的葡萄糖250 mg,混勻后用蒸餾水溶解并定容至250 mL,得到濃度為1.0 mg/L的葡萄糖標準品溶液,待用。
1.2.2 蒽酮試液的配制 精密稱取蒽酮0.2 g,加入85%濃硫酸溶液中,完全溶解后定容至100 mL,放于棕色瓶內,現用現配。
1.2.3 測定波長的選擇 吸取一定體積的葡萄糖標品溶液,經蒽酮-硫酸比色法處理,用紫外分光光度計在波長550~700 nm進行全波長掃描,以最大吸收值確定檢測波長。
1.2.4 標準曲線的繪制 依次吸取葡萄糖標準溶液0、1.00、3.00、5.00、7.00、9.00 mL,置于100 mL容量瓶內,定容。分別吸取標準溶液2.0 mL,在冰水浴中緩緩加入12.0 mL的蒽酮試劑,100 ℃水浴反應12 min,迅速冷卻,室溫放置20 min,待顯色穩定后測定吸光度,繪制標準曲線。
1.2.5 樣品測定方法 準確稱取烘干粉碎的葡萄葉片0.500 0 g,放入50 mL塑料離心管,置于80 ℃水浴中,用一定體積提取液提取30 min,取出離心,收集提取液于量杯中。用此方法對殘渣重復提取2次,使糖提取完全。加入去干擾劑后定容,過濾,待測。
1.2.6 提取劑的選擇 由于可溶性糖易溶于水及乙醇,因此 GB/T 5009.7-2008、GB/T 5009.8-2008、GB/T 5513-2008 以及一些糖的測定方法中,用于糖的提取溶液最常用是水和80%乙醇。選取處理好的葡萄葉片,分別用水和80%乙醇提取,進行測定可溶性糖的比較試驗,方法同1.2.5。
1.2.7 去干擾劑的選擇 蒽酮比色法產生的糖醛顯色反應,往往會受到樣品共提物的影響,所以在植物樣品提取,特別是從含有較多色素以及蛋白質的樣品中提取可溶性糖,需要去干擾劑。根據國標以及其他文獻,采用21.9%乙酸鋅和10.6%亞鐵氰化鉀(A)、30%硫酸鋅和16%亞鐵氰化鉀(B)、酸洗活性炭(C)3種組合進行對比試驗,測定方法同1.2.5。
1.2.8 單因素試驗設計 用一定濃度的葡萄糖標準溶液對蒽酮顯色反應中的試劑用量、顯色時間、顯色溫度因素進行實驗比對,以吸光度為指標,確定各因素對結果的影響。
①蒽酮試劑用量的選擇 分別取0.3 mg/mL的標準品溶液2 mL,置于8支10 mL的具塞試管中,分別加入0.2 mg/mL的蒽酮試劑10.00、10.50、 11. 00、11.50、12.00、12.50、13.00、13.50 mL,于100 ℃水浴中反應10 min,冷卻至室溫,靜置20 min,于625 nm下測定吸光值。
②顯色溫度的選擇 按①步驟,在4支試管中加入蒽酮試劑12.00 mL分別在25、50、75、100 ℃水浴中進行顯色反應10 min,冷卻,靜置,測定吸光值。
③顯色時間的選擇 按①步驟,在試管中加入蒽酮試劑12.00 mL,在100 ℃水浴中加熱4、6、8、10、12、14、16 min,冷卻,靜置,測定吸光值。
1.2.9 響應面實驗 依據1.2.8實驗結果,采用Design Expert 8.0軟件設計進行三因素三水平響應面試驗方案,優化可溶性糖含量測定條件。
2 結果與分析
2.1 測定波長的確定
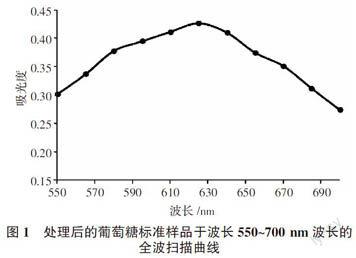
吸取葡萄糖標準溶液2.00 mL,經1.2.4進行顯色反應,在550~700 nm處掃描(圖1)。可以看出,在(625±1) nm處吸收值最大,因此確定測定波長為625 nm。
2.2 葡萄糖標準曲線
以標準溶液濃度(X)為橫坐標,以吸光度(Y)為縱坐標進行線性回歸,得標準曲線如圖1所示。線性方程為Y=0.0082X+0.0296,R2=0.9994。結果表明,糖含量在0~0.9 mg/mL范圍內與吸光度的線性關系良好。
2.3 提取液的比較
水和80%乙醇提取液實驗結果如表1所示。可以看出,2種提取液測定的葡萄葉片可溶性糖的結果相差不大,3次平行測定的結果差值為0.13%,低于算數平均值的10%。因此,對于葡萄葉片中可溶性糖的提取,水和80%乙醇提取結果無明顯差別,均可作為提取液。考慮到實驗成本,我們選擇用水做提取液。
2.4 去干擾劑比較
通過圖3可以看出,通過對21.9%乙酸鋅和10.6%亞鐵氰化鉀(A)、30%硫酸鋅和16%亞鐵氰化鉀(B)、酸洗活性炭(C)對可溶性糖的測定結果的比較,酸洗活性炭的測定結果明顯低于其他2種,因為酸洗活性炭(C)在去除色素方面具有一定優勢,但含有其它共提物時,去除效果并沒有組合沉淀劑好,并且在實驗過程中,最后處理過的提取液還有一定的渾濁,易導致結果偏低。而乙酸鋅-亞鐵氰化鉀(A)沉淀速度快速、易混勻,故選用硫酸鋅-亞鐵氰化鉀作為測定葡萄葉片可溶性糖的沉淀劑。
2.5 單因素實驗
2.5.1 蒽酮試劑用量 顯色溫度為100 ℃,反應時間為10 min時,蒽酮試劑用量對吸光值的影響結果見圖4。可以看出,隨蒽酮試劑用量增加,吸光值呈先增高后遞減趨勢,說明蒽酮試劑用量不夠;反應沒有達到完全;當用量到12 mL時,吸光值達到最大,蒽酮試劑用量再繼續增加反而使吸光值有明顯的降低,因此,初步選擇蒽酮試劑用量為12 mL。
2.5.2 顯色溫度 通過圖5可以看出,蒽酮試劑用量為12 mL、反應時間為10 min時,隨著顯色溫度的升高,吸光值逐步增加。綜合考慮顯色溫度對吸光值的影響,顯色溫度定為100 ℃。
2.5.3 顯色時間 蒽酮試劑用量為12 mL、顯色溫度為100 ℃時,顯色時間對吸光值的影響見圖6。可以看出,顯色時間在12 min以前時,隨著時間增加吸光值不斷增加,超過12 min后吸光值有明顯的降低,因此,確定顯色時間12 min左右為最佳。
2.6 響應面優化分析
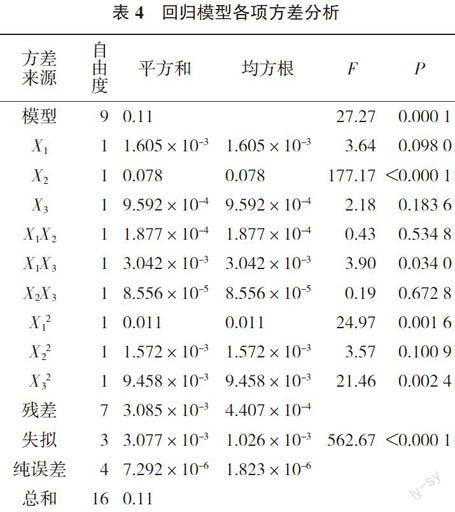
2.6.1 因素的選取及模型評價 以單因素試驗結果為基礎,根據Box-Behnken中心組合實驗設計,采用3因素3水平共17個實驗點(5個中心點)的響應面分析實驗設計(表2)。通過實驗數據(表3)可以看出,利用Design-Expert 8.0軟件對表3數據進行二次多項式逐步回歸擬合,得到數學模型Y=0.12-0.014X1+0.099X2-0.011X3+0.006 85X1X2- 0.028X1X3+0.004 525X2X3-0.051X12-0.019X22-0.049X32。從方差分析結果(表4)和各項系數顯著性檢驗結果可知,模型的F=9.28、P=0.000 1(注:P < 0.05為差異顯著,P < 0.01為差異極顯著),說明本實驗所采用的二次模型顯著。模型的X2、X1X3、X12、X32的P值均小于0.05,說明顯色溫度、蒽酮試劑用量和顯色時間的交互項、蒽酮試劑用量和顯色時間的二次項都具有顯著影響;決定因素R2值為0.972 3,說明模型能夠很好的反應響應值的變化,擬合度好。各關系的效應關系為顯色溫度 > 蒽酮試劑用量 > 顯色時間。
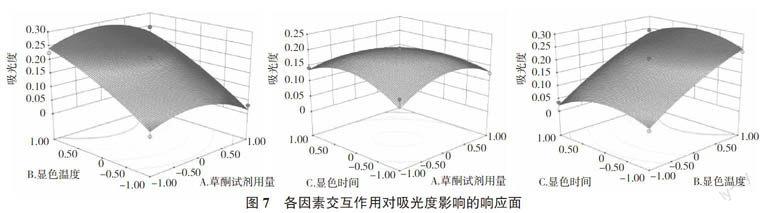
2.6.2 響應面分析 通過圖7可以看出,當蒽酮試劑用量和顯色時間都固定時,吸光值隨顯色溫度的變化幅度較大,而隨著蒽酮試劑用量以及顯色時間的變化幅度相對較小,所以顯色溫度對吸光值的影響較為顯著。通過最優化分析,確定的最佳測定條件為蒽酮試劑用量11.79 mL、顯色溫度99.79 ℃、顯色時間11.26 min。考慮到實際操作的局限性,將實驗條件修正為蒽酮試劑用量12 mL、顯色溫度100 ℃、顯色時間12 min,以此條件做5次平行實驗,測得吸光值平均為0.277 6,與預測值基本相符,證實了響應面法所得的回歸方程的準確性和實用性。
2.7 實際樣品測定
2.7.1 精密度與回收率實驗 選擇可溶性糖含量不同的葡萄葉片B、C,進行方法的精密度與穩定性實驗,所得結果如表5。平行測定6次,實驗結果的RSD值為0.68%~0.81%,均符合實驗要求,表明本方法具有良好的精密度。
2.7.2 準確度與加標回收率實驗 通過表6可以看出,加標回收率為97.5%~102.5%,平均加標回收率為99.4%,RSD值為2.7%,表明本方法的準確度較好。
2.7.3 葡萄葉片中可溶性糖含量 根據優化實驗條件,測得不同批次葡萄葉片中的可溶性糖含量范圍為2.54%~6.93%。
3 結論
通過對葡萄葉片可溶性糖提取及測定過程中的單因素條件,并在此基礎上利用響應面法(RSM)對蒽酮-硫酸測定方法進行優化。得出葡萄葉片可溶性糖含量的測定方法是提取劑為水,用21.9%乙酸鋅和10.6%亞鐵氰化鉀作為去除顯色干擾物沉淀劑,定容過濾,吸取2 mL濾液,加入0.2 mg/mL蒽酮-硫酸試劑12 mL,在沸水浴中加熱12 min,冷卻后在波長 625 nm 處測定其吸光度。
在最優條件下,得到蒽酮-硫酸法測定葡萄葉片可溶性糖含量的精密度實驗RSD為0.68%~0.81%,平均加標回收率 99.4%,RSD=2.7%(n=3)。用該方法測得不同時期葡萄葉片中可溶性糖的平均含量為2.54 %~6.93%。該方法測定葡萄葉片中可溶性糖含量,結果穩定可靠。
參考文獻:
[1] 張致璽,張 琰,甘全善. 砧木對葡萄嫁接苗成活率的影響[J]. 甘肅農業科技,2013(8):8-10.
[2] 巨智強,成自勇,王 棟,等. 水分脅迫對紅地球葡萄生理生長的影響[J]. 甘肅農業科技,2015(2):42-45.
[3] 徐惠風,金研銘,張春祥,等. 向日葵葉片可溶性糖含量的研究[J]. 吉林農業大學學報,2000,22(1):23-25.
[4] 陳立松,劉星輝. 水分脅迫對荔枝葉片糖代謝的影響及其與抗旱性的關系[J]. 熱帶作物學報,1999,20(2):31-35.
[5] WANG Z C,STUTE G W. The role of carbohyd rates in active osmotic adjustment in apple under water stress[J]. J. Amer. Soc. Hort. Sci.,1992,117:816-823.
[6] 劉 華. 鹽脅迫下對堿茅生長及碳水化合物含量的影響[J]. 草業學報,1997,14(1):18-19.
[7] 姜 東,于振文,李永庚,等. 冬小麥葉莖可溶性糖含量變化與籽粒淀粉積累的關系[J]. 麥類作物學報,2001,21(3):38.
[8] 中國科學院上海植物生理研究所,上海市植物生理學會. 現代植物生理學實驗指南[M]. 北京:科學出版社,1999.
[9] 黃生權,敖 宏,郭愛玲. 真菌保健食品中多糖含量測定方法的比較[J]. 現代食品科技,2010,26(7):767-771.
[10] 叢峰松. 生物化學實驗[M]. 上海:上海交通大學出版社,2005.
[11] 李鳳玉. 用鐵氰化鉀法測定王漿中總糖的含量[J]. 養蜂科技,2005(3):5-6.
[12] 魏曉明,符 紅,萬幼平. 硫酸蒽酮比色法測定鹿龜酒中多糖的含量[J]. 中成藥,2000,22(5):380-382.
(本文責編:陳 偉)

