脈動流下血管支架耦合系統(tǒng)血流動力學(xué)實驗研究
魏延賓,程 潔*
脈動流下血管支架耦合系統(tǒng)血流動力學(xué)實驗研究
魏延賓,程 潔*
(東南大學(xué)機械工程學(xué)院,南京 210096)
為了探究血流動力學(xué)性能對再狹窄的影響,本文介紹了一種基于圓柱形內(nèi)壁模型的血管支架耦合系統(tǒng)血流動力學(xué)性能的測試方法,并根據(jù)此方法自行設(shè)計并搭建一套實驗裝置,通過此裝置對本實驗室自制的冠脈支架進行了血流動力學(xué)性能測試實驗。實驗在脈動流下進行,實驗結(jié)果表明,一個脈動周期內(nèi),靠近壁面的粒子運動速度先增大后減小,且速度總體數(shù)值很小;在同一時刻隨著離壁面距離的增大,速度一直呈遞增的趨勢;在距離壁面同一位置處,速度隨時間先增大后趨于平緩,在周期末尾時急劇下降到零,并伴有回流現(xiàn)象。通過計算壁面剪應(yīng)力發(fā)現(xiàn),一個周期內(nèi),壁面剪應(yīng)力隨時間變化先增大后減小;低于0.4Pa的時間占整個周期的一半,且分布在周期的開端和末端,是容易發(fā)生再狹窄的時間區(qū)分布。本實驗對后續(xù)血流動力學(xué)性能測量提供了一定的實驗基礎(chǔ),并且對后期支架的設(shè)計和優(yōu)化提供了驗證的手段。
血管支架;壁面剪應(yīng)力;脈動流;再狹窄
血管支架是一種近幾十年來迅速發(fā)展的微創(chuàng)醫(yī)療器械,對于由血管堵塞引起的冠心病等疾病,介入療法以其微創(chuàng)﹑恢復(fù)快﹑效果顯著等優(yōu)點,在心血管疾病治療領(lǐng)域取得了長足的進步,但是支架的引入改變了心血管微環(huán)境,術(shù)后六個月再狹窄率達(dá)到15%至30%[1]。大量研究表明,再狹窄是血管內(nèi)膜增生導(dǎo)致的[2],而誘發(fā)血管內(nèi)膜增生與血管內(nèi)局部血流動力學(xué)性能密切相關(guān),壁面剪應(yīng)力(WSS, Wall Shear Stress)的變化可以影響動脈粥樣硬化的行程過程[3]。
近年來,隨著支架技術(shù)的不斷推廣應(yīng)用以及應(yīng)用過程中出現(xiàn)的再狹窄等問題顯現(xiàn),對于支架的研究也越來越多,其中關(guān)于支架血流動力學(xué)性能的研究也相應(yīng)增長。Moore等人分析了支架植入對于血流與血管內(nèi)應(yīng)力的影響,他們指出支架設(shè)計與植入所引起的血流紊亂及血管內(nèi)應(yīng)力具有密切聯(lián)系,因此支架的分析與評價以及優(yōu)化設(shè)計應(yīng)從流體力學(xué)與固體力學(xué)兩個方面考慮[4]。N.Benard等將血管支架模型在平面上展開,并采用粒子示蹤方法 (PTV, Particles Track Velocimetry)研究了流體流過支架網(wǎng)格時的流線分布與速度場,得到了不同的支架區(qū)域的剪應(yīng)力分布情況,探索了0-1.5pa的低壁面剪應(yīng)力區(qū)域,并比較了相同結(jié)構(gòu)在不同流域的應(yīng)力情況,給出了與再狹窄的關(guān)系[5][6]。Glenn等模擬支架植入產(chǎn)生的擾動并將模型放大,對彎曲動脈模型的二次流結(jié)構(gòu)進行研究,在一個脈動周期內(nèi)的不同時刻分別對彎曲血管從不同角度進行二次流觀察,得到復(fù)合形態(tài)下的渦流對區(qū)域分布以及無量綱加速度參數(shù)[7];王山山等利用電化學(xué)方法對T型動脈分叉模型進行了壁面剪應(yīng)力的測量,確定了分叉部位的高壁面剪應(yīng)力和低壁面剪應(yīng)力分布[8][9]。程潔等對血管支架介入耦合系統(tǒng)進行了血流動力學(xué)數(shù)值模擬,并研制了脈動流環(huán)境下平均WSS測試模塊,采用電化學(xué)探針方法,實驗結(jié)果表明,支架植入會明顯降低壁面剪應(yīng)力,產(chǎn)生流動停滯區(qū)域[10][11]。中科院物理研究所鄭旭等基于3D打印和微流控技術(shù),采用數(shù)值模擬和體外實驗兩種方法,探究了恒流條件下支架植入位置對壁面剪應(yīng)力分布的影響,并得到支架放入動脈分叉區(qū)域后WSS分布,并給出了臨界壁面剪應(yīng)力約為0.4-0.5Pa,低于臨界WSS的區(qū)域更容易誘發(fā)內(nèi)皮增生,產(chǎn)生再狹窄[12]。
前面的學(xué)者對于血流動力學(xué)的研究多數(shù)是在恒流的條件下進行的,現(xiàn)在國內(nèi)尚無在脈動流下對血流動力學(xué)進行實驗研究。目前對于血流動力學(xué)性能現(xiàn)代實驗研究方法中,對于WSS的測量方法主要就是粒子示蹤法和電化學(xué)探針法,其中電化學(xué)探針法在恒流狀態(tài)下測試具有一定的準(zhǔn)確性,且對設(shè)備要求不高,但其測量的是一段極短時間內(nèi)的平均值,對于脈動狀態(tài)下的瞬時剪應(yīng)力的修正方法復(fù)雜,誤差較大。而粒子示蹤方法雖然測試過程復(fù)雜﹑數(shù)據(jù)量龐大,但借助于高速數(shù)字?jǐn)z像機可以準(zhǔn)確的測量脈動狀態(tài)下的瞬時速度分布。故本實驗選擇粒子示蹤方法,自主設(shè)計并搭建實驗平臺,測量速度場分布并計算WSS。
1 材料和方法
本文所采用的實驗平臺為自主設(shè)計的用于測量血管支架血流動力學(xué)性能的測試裝置。如圖1所示,整套裝置包括:動力發(fā)生裝置﹑壓力測量模塊﹑被測血管支架耦合系統(tǒng)﹑PTV測量模塊﹑回路模塊。
動力發(fā)生裝置為蠕動泵(Longer Pump BT100-1F,配YZ1515x泵頭);壓力測量模塊由壓力傳感器(高華MB300,0-60Kpa)﹑數(shù)據(jù)采集卡(National Instruments USB-6211)和電腦組成;被測血管支架耦合系統(tǒng)由PDMS模擬血管和36L不銹鋼冠脈支架組成;PTV測量模塊由光源﹑高速CCD(Ametek Vision Research Phantom V,含軟件PCC)和倒置顯微鏡(Olympus IX71)和電腦組成;回路模塊由密閉水箱﹑旋轉(zhuǎn)壓力泵和單向閥組成。測量程序基于NI LabVIEW開發(fā),負(fù)責(zé)測量過程中回路中壓力信號的采集與在線處理。測量結(jié)果經(jīng)程序自動導(dǎo)出至Excel (Microsoft 2010, Inc.)。
實驗裝置的關(guān)鍵模塊之一是血管支架耦合系統(tǒng)模塊,其中又以模擬血管制作的情況,決定了體外實驗?zāi)M真實血管的相似度。藍(lán)蠟的融點在60℃左右,適合用來做流道內(nèi)模型;PDMS透光性好,便于觀察粒子在流道的運動情況。由此,模擬血管的制作過程為:首先用建模軟件Pro/E(PTC, Inc.)繪制狹窄血管內(nèi)芯的實體模型;然后采用3D打印的方法,以藍(lán)蠟為打印材料,制作出用于當(dāng)作流道內(nèi)芯的蠟?zāi)#粚⑾災(zāi)7湃隤DMS溶液(溶液與固化劑的配比為11:1)后,放在恒溫箱80℃加熱2小時;然后水浴融掉蠟?zāi)#玫侥M血管。本實驗所用的流道內(nèi)直徑2.65mm。
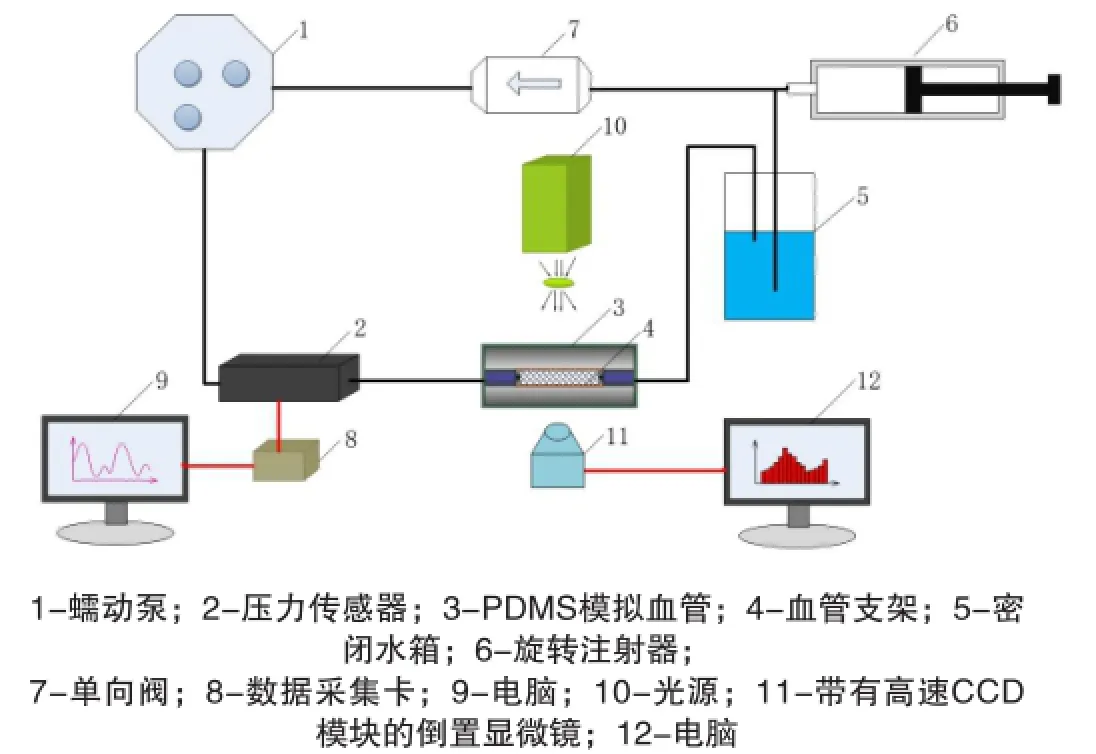
圖1 血管支架血流動力學(xué)性能PTV測試平臺示意圖(a)血管支架耦合系統(tǒng)實物圖;(b)擴張之前的球囊跟支架;(c)支架在PDMS流道中示意圖
本實驗所用的血管支架為實驗室自主設(shè)計制造的一種管形網(wǎng)狀冠脈支架。擴張前的冠脈支架參數(shù)如表1所示,支架材料為36L不銹鋼,由不銹鋼微管經(jīng)激光雕刻而成,其結(jié)構(gòu)為M型連接桿連接在軸向重復(fù)的正弦支撐環(huán)上,支撐環(huán)由周向重復(fù)的6個波形單元組成。擴張前支架直徑為1.2mm,長度20mm,擴張后的直徑達(dá)到3mm。圖2 (b)為擴張前的支架實物,圖2 (c)為支架在PDMS流道中擴張之后的示意圖(本文只給出了兩個軸向波形單元),圖2 (a)為擴張后的血管支架耦合系統(tǒng)實物圖。

圖2 血管支架耦合系統(tǒng)圖

表1 擴張前冠脈支架幾何參數(shù)
蠕動泵的可以輸出的流量范圍是0.051~51ml/min,使用的軟管內(nèi)徑為2.4mm,外徑為4mm。在實驗中,設(shè)置流量為10ml/min,由壓力傳感器測得壓力變化,由于傳感器測出來的信號噪聲較大,需對其進行降噪處理:這里采用MATLAB濾波的形式,濾波后的信號如圖3所示。這里可以看出,濾波之后的信號經(jīng)過擬合,已經(jīng)是明顯的脈動分布,且近似于正弦分布。脈動基礎(chǔ)壓力為13Kpa,峰值和谷值分別為15Kpa﹑11Kpa。與真實的人體冠脈壓力環(huán)境已經(jīng)非常接近[13]。

圖3 壓力傳感器信號濾波前與濾波后比較
人體血液的粘度為3.5×10-3Pa·s,密度為1.060×10-3Kg/ m3[14]。全血的透光性差,在目前的條件下,選擇PTV方法進行體外實驗,采用全血還很難實現(xiàn)。去離子水在粘度和密度方面區(qū)別于全血,但透光性好,便于觀察,故溶液選擇去離子水來模擬血液。同時用15μm的聚苯乙烯粒子來模擬血液細(xì)胞[15]。
血管中的血液可認(rèn)為是不可壓縮流體,而血液的雷諾數(shù)約為50[10],其流動情況可認(rèn)為是軸對稱層流運動。雷諾數(shù)Re定義為:

ρ是血液密度,ν是速度,L是管路直徑,μ是血液動力粘度。采用笛卡爾直角坐標(biāo)系,血管軸線與z軸重合,端面與x y面重合,其運動可以用以下兩個方程表示:
連續(xù)性方程:

Navier-Stokes方程:
Vx﹑Vy﹑Vz分別是速度 在x﹑y﹑z三個坐標(biāo)方向上的矢量,ρ是血液密度,p是壓力,t是時間,fx﹑fy﹑fz分別為單位質(zhì)量力在x, y, z方向上的投影,μ是血液動力粘度。
血管壁是具有粘彈性的薄壁管,根據(jù)Womersley理論,將其簡化為均勻的薄壁圓柱管,即血管壁的厚度h跟血管直徑的比值是一個小量。同時假定血管壁是各向同性的胡克彈性體,利用厚度均勻的附加層來代替血管內(nèi)壁周圍的結(jié)締組織,并引進有效壁厚H[16]:

式中,ρ1﹑ r1﹑ h1分別表示附加層的密度﹑半徑和厚度, ρw﹑R ﹑h 分別為血管壁的密度﹑半徑和厚度。由于H的值很小,而用PDMS制作的血管與真實的人體血管在生物活性上有區(qū)別,將其看成無彈性的壁面,故在本實驗中忽略血管壁的影響。
冠脈內(nèi)血流動力學(xué)的一項關(guān)鍵指標(biāo)就是血管壁面剪應(yīng)力。而壁面剪應(yīng)力與剪切 速率有關(guān),剪切速率的計算公式[17]為:

式中, u﹑v﹑w 分別為血流速度在x﹑y﹑z三個方向上的分量。由此便可以計算出壁面上各個位置上的剪應(yīng)力。在本實驗中,理論上y和z方向上速度為零,實際操作中可能會出現(xiàn)極小的速度,對此忽略y和z方向上的速度,剪切速率的計算公式可以化為:

L為到壁面的距離,本實驗中流動狀況為層流且流體沿著血管流動,根據(jù)牛頓內(nèi)摩擦定律,流體的切應(yīng)力τ為:

式中,μ動力粘度, y為剪切速率,w為沿軸線方向速度,L為距壁面的距離。
2 實驗過程
將實驗裝置的各個部分按照圖1所示,裝配完整。蠕動泵的軟管接至壓力傳感器,壓力傳感器后面接PDMS模擬血管(里面已經(jīng)含有支架),模擬血管后面是密閉水箱,密閉水箱出來的軟管經(jīng)三叉接頭分別接旋轉(zhuǎn)壓力泵和單向閥,單向閥的出口接到蠕動泵的軟管上面,形成完整回路。取50ml左右的去離子水,在其中添加15μm聚苯乙烯粒子,并搖晃均勻。為了避免管路中有雜質(zhì)混入到溶液,依次用酒精和去離子水沖洗管路,完畢后將含有聚苯乙烯粒子的溶液注入回路,排干凈回路中的空氣。
調(diào)節(jié)蠕動泵的流量輸出為10ml/min,接下來是實驗的視覺觀測模塊啟動,將熒光顯微鏡調(diào)至明場狀態(tài)(脈動狀態(tài)下粒子流速變化快,暗場條件下,熒光粒子被激發(fā)的光,難以觀察),并打開高速CCD模塊,調(diào)節(jié)PDMS模擬血管在載物臺上的位置,使在視野上的圖像位置正確,并調(diào)節(jié)顯微鏡的光強旋鈕,使圖像清晰。每張圖像的曝光時間為1.7μs,連續(xù)兩張圖像的時間間隔ta是161.29μs,每秒拍攝的張數(shù)是6200,拍攝圖像的像素是1280×800,拍攝的軟件是PCC。蠕動泵運行穩(wěn)定3分鐘后,再開始拍攝圖像,以保證管路中的流體做周期性的脈動流動。處理圖像的軟件是PCC和ImageJ。在PCC軟件中的measure模塊中設(shè)置像素比為1.960784×10-3mm/ pixel,那么出現(xiàn)在視野中的粒子,其距離壁面的距離L可以測得。粒子連續(xù)的出現(xiàn)在視野中,將這部分連續(xù)的圖像在ImageJ中疊加,如圖4所示,其運動的軌跡被記錄下來,可以得到粒子運動的距離La,這部分圖像的張數(shù)Z也可以得到,這部分軌跡的運動時間Ta的計算公式為Ta=Z×ta,一般Ta<2ms,時間間隔非常小,可以近似認(rèn)為粒子在這微小的時間段的平均速度就是粒子的瞬時速度,Va=La/Ta,以此類推,可以得到全場域范圍內(nèi)的粒子瞬時速度分布。每個粒子的同一位置同一時刻,統(tǒng)計5-10組數(shù)據(jù)取平均值(粒子出現(xiàn)在壁面處的概率小于出現(xiàn)在流道中部的概率,壁面處的粒子統(tǒng)計組數(shù)小于流道中部組數(shù)),同時也計算出標(biāo)準(zhǔn)差。而每7350張圖像,粒子運動會重復(fù)一次,故一個周期T=1.185s,每個周期的結(jié)束到下個周期的開始的時候會有粒子的回流現(xiàn)象,以視野中的所有粒子開始運動的時刻作為周期的開始,由此可以確定后面的粒子的流過測量位置的時間坐標(biāo)。

圖4 距離壁面不同的距離的時候,粒子疊加后的的運動軌跡
3 實驗結(jié)果
通過實驗發(fā)現(xiàn),粒子到壁面的距離小于100μm的時候,粒子在一個脈動周期的時間內(nèi)速度很小,而且速度的變化也很小。如圖5所示,在一個周期的開端和末端,所有粒子的運動速度都為零;在0.1T的時刻,粒子速度隨著距離壁面的的增大而增大;在0.2T 時刻這種現(xiàn)象更加明顯,到壁面的距離超過350μm的時候,速度隨著距離的增加而趨于平緩;當(dāng)時間處于0.3T到0.8T的時候,速度的變化曲線非常接近,都是隨著距離的變大呈現(xiàn)遞增的趨勢,并出現(xiàn)最高速度0.054m/s;當(dāng)處于0.9T時刻的時候,粒子運動方向發(fā)生改變,出現(xiàn)反向運動,到壁面距離越大,粒子反向流動的速度越大,但總體回流速度并不大。
如圖6所示,速度隨著距離增大而增大的現(xiàn)象顯得更加明顯,粒子在0-0.1T的時間段內(nèi),速度開始增加,此段數(shù)值較小但斜率較大;在到達(dá)0.2T的時候,速度顯著增大,L=0.3mm處的速度達(dá)到了0.0207m/s,這種增速一直保持到0.3T處,從0.3T時刻到0.8T時刻,粒子的速度處于高位平衡狀態(tài),在一定的范圍內(nèi)上下波動,且波動范圍較小;而從0.8T時刻到0.9T時刻,粒子的速度急劇下降到零值左右;然后粒子反向流動直至周期結(jié)束。
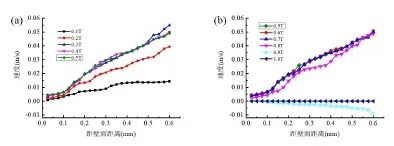
圖5 一個周期內(nèi)不同的時刻的粒子速度隨著壁面距離變化

圖6 距離壁面不同的位置的粒子速度隨著時間的變化
通過對粒子運動軌跡的分析,不但可以獲得粒子的速度分布,還可以通過前面的公式來計算WSS。靠近血管壁面的粒子的運動速度除以粒子到壁面的距離,再乘以粘度,即可得到WSS。這里的計算需要引入一個計算系數(shù)3.5,去離子水的粘度常溫下認(rèn)為是1×10-3Pa·s,而人體血液的粘度3.5×10-3Pa·s。根據(jù)公式 (6) 和公式 (7) 可以計算出一個周期內(nèi)的壁面剪應(yīng)力變化。如圖7所示,在一個脈動周期內(nèi)且隨著時間WSS先增大后減小,WSS的最大值出現(xiàn)在0.5T時刻,為0.644 Pa ,而在0.1T時刻為0.125 Pa ,在0.9T時刻為0.126 Pa。且0.1T﹑0.2T﹑0.8T﹑0.9T時刻的WSS值低于0.4Pa,根據(jù)前面的討論,WSS低于0.4Pa為低壁面剪應(yīng)力區(qū)域,容易誘發(fā)出現(xiàn)再狹窄,而在0.3T﹑0.4T﹑0.5T﹑0.6T﹑0.7T時刻,WSS均高于0.4Pa。一個脈動周期內(nèi)有一半的時間壁面剪應(yīng)力處于臨界值以下,原因是支架的植入改變了血液流動的微環(huán)境,網(wǎng)狀的支架在血管壁上會形成流動停滯區(qū)域,降低血液的流動速度,從而形成低壁面剪應(yīng)力區(qū)域。

圖7 一個周期內(nèi)WSS的變化
4 結(jié)語
本文提出了一種血管支架耦合系統(tǒng)血流動力學(xué)分析測試方法,并搭建體外實驗測試平臺對實驗室自制血管支架進行實驗。結(jié)果表明,支架植入血管后,距離壁面100μm的范圍內(nèi)流速非常低,很容易形成低WSS區(qū)域,因此靠近壁面的區(qū)域是容易引發(fā)再狹窄的區(qū)域。在一個血流脈動周期內(nèi),0-0.2T和0.8-1T的時間段內(nèi),WSS低于0.4Pa,是極易引發(fā)內(nèi)皮增生產(chǎn)生再狹窄的時間區(qū)域。下一步的研究方向是探究支架網(wǎng)孔內(nèi)WSS分布以及入口﹑出口處的WSS分布。
[1] Serruys P W, de Jaegere P, Kiemeneij F, et al.A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease[J].New England Journal of Medicine, 1994, 331(8): 489-495.
[2] Carter A J, Laird J R, Farb A, et al.Morphologic characteristics of lesion formation and time course of smooth muscle cell proliferation in a porcine proliferative restenosis model[J].Journal of the American College of Cardiology, 1994, 24(5): 1398-1405.
[3] 戴敬, 呂樹錚, 宋現(xiàn)濤, 等.支架再狹窄的機制及防治新進展[J].中華老年心腦血管病雜志, 2014, 16(03): 322-323.
[4] Moore Jr J E, Berry J L.Fluid and solid mechanical implications of vascular stenting[J].Annals of biomedical engineering, 2002, 30(4): 498-508.
[5] Benard N, Coisne D, Donal E, et al.Experimental study of laminar blood flow through an artery treated by a stent implantation: characterisation of intra-stent wall shear stress[J].Journal of biomechanics, 2003, 36(7): 991-998.
[6] Benard N, Coisne D, Perrault R.Experimental study of blood laminar flow through a stented artery [C]//Engineering in Medicine and Biology Society, 2001.Proceedings of the 23rd Annual International Conference of the IEEE.IEEE, 2001, 1: 83-85.
[7] Glenn A L, Bulusu K V, Shu F, et al.Secondary flow structures under stent-induced perturbations for cardiovascular flow in a curved artery model[J].International Journal of Heat and Fluid Flow, 2012, 35: 76-83.
[8] 王山山, 邱玲.用電化學(xué)方法測試動脈模型壁面剪應(yīng)力[J].應(yīng)用力學(xué)學(xué)報, 2000, 17(2): 55-61.
[9] 王山山, 邱玲.提高電化學(xué)法測試壁面剪應(yīng)力精度的方法[J].實驗力學(xué), 2001, 16(1): 1-6.
[10] 程潔.血管支架介入耦合系統(tǒng)血流動力學(xué)數(shù)值模擬與實驗研究[D].東南大學(xué), 2011.
[11] 程潔, 周嘯, 李俐軍, 等.冠脈支架的多功能體外力學(xué)性能測試裝置及實驗研究[J].東南大學(xué)學(xué)報(自然科學(xué)版), 2010, 40(2): 341-345.
[12] Wang H, Liu J, Zheng X, et al.Three-dimensional virtual surgery models for percutaneous coronary intervention (PCI) optimization strategies[J].Scientific Reports, 2015, 5: 10945.
[13] Wong K K L, Tu J, Kelso R M, et al.Cardiac flow component analysis [J].Medical Engineering & Physics, 2010, 32(2):174-188.
[14] Foad K, Ghista D N, Boyang S, et al.In vitro measurements of velocity and wall shear stress in a novel sequential anastomotic graft design model under pulsatile flow conditions[J].Medical Engineering & Physics, 2014, 36(10):1233-1245.
[15] Xiang N, Ni Z.High-throughput blood cell focusing and plasma isolation using spiral inertial microfluidic devices[J].Biomedical Microdevices, 2015, 17(6): 1-11.
[16] 柳兆榮.心血管流體力學(xué)[M].復(fù)旦大學(xué)出版社, 1986.
[17] 卡里.血液循環(huán)力學(xué)[M].科學(xué)出版社, 1986.
Hemodynamics Experimental Research of Stent Coupling System of Pulse Flow
Wei Yanbin, Cheng Jie*
(School of Mechanical Engineering, Southeast University, Nanjing 210096, China)
In this report, we presented a novel approach for hemodynamics study of stent coupling system based on cylindrical inner wall model to investigate the ef f ect of hemodynamic performance on restenosis.A set of experimental apparatus has been assembled based on this approach.Coronary artery stent that designed by our lab was used in the hemodynamics experimental research which was done in pulsating flow.The hemodynamics experimental research results showed that the velocities of particles near the wall increase at fi rst then decreases and the overall speed is small.With the increase of distance, velocity has been increased.Velocity increased from the bottom to the peak value, after which became fl at and swooped suddenly to the bottom, with the time passed in a pulsation period.Countercurrent has been captured towards the end of pulsation period.The calculation results have shown that wall shear stress increases with time then decrease.The lasting of wall shear stress which was lower than 0.4Pa accounted for half of the pulsation period and distributed at the beginning and end of the cycle which is prone to restenosis.Consequently, the study not only provided a basis for the subsequent measurement of hemodynamic performance but also supplied artif i ce that provides verif i cation for the design and optimization of stents.
stent; wall shear stress; periodic pulsing fl ow; restenosis
R318.11, TB126 [Document Code] A
10.11967/ 2017150205
R318.11,TB126
A DOI:10.11967/ 2017150205
基金支持:國家自然科學(xué)基金資助項目(51275089﹑51575106).
魏延賓(1991-),男,碩士研究生;程潔(聯(lián)系人),女,博士,副教授,碩士研究生導(dǎo)師,cjgrace@sina.com.

