玉竹初代培養最適條件的篩選
霍妍++趙春莉

摘要:以玉竹[Polygonatum odoratum (Mill.) Druce]的葉片、莖段以及根莖作為外殖體,采用不同滅菌方式進行滅菌,在不同基本培養基上進行培養,添加不同種類生長調節劑,分析其最適的初代培養條件。結果表明,最適滅菌方法為75%乙醇處理10 s配合0.1%升汞處理7 min,其污染率為13.3%。根莖作為外殖體有較高的誘導率,達到90.0%;在培養中,最適宜初代培養的基本培養基為MS,其誘導率為86.7%;最適宜根莖分化的生長調節劑為MS+1.0 mg/L 6-BA+0.5 mg/L NAA,其次為MS+1.0 mg/L 6-BA+0.5 mg/L IAA,其分化率分別為80%和62%。
關鍵詞:玉竹[Polygonatum odoratum (Mill.) Druce];初代培養;根莖;組織培養
中圖分類號:R282;Q813.1 文獻標識碼:A 文章編號:0439-8114(2017)09-1763-04
DOI:10.14088/j.cnki.issn0439-8114.2017.09.041
Screening of Optimum Conditions of Polygonayum odorayum (Mill.) Druce Primary Culture
HUO Yan,ZHAO Chun-li
(College of Horticulture,Jilin Agriculture University,Changchun 130118, China)
Abstract:Using Polygonatum odoratum(Mill.) Druce leaves,stem and rhizome as explants, and the explants were sterilized with different sterilization,incubated with different basic medium,in different types of additional hormone to investigate the optimum primary culture conditions. The results showed that the optimum method of sterilizing time and 0.1% corrosive sublimate 7 min with 75% alcohol 10 s,the pollution rate was 13.3%. Rhizome as explants had high induction rate,the induction rate was 90.0%. In culture,the most appropriate primary culture of basal medium was MS, the induction rate was 86.7%. Optimum hormone rhizome differentiation of 1.0 mg/L 6-BA+0.5 mg/L NAA,followed by 1.0 mg/L 6-BA+0.5 mg/L IAA,differentiation rate of 80% and 62%.
Key words: Polygonatum odoratum (Mill.) Druce; primary culture; rhizome; tissue culture
玉竹[Polygonatum odoratum (Mill.) Druce]為百合科多年生草本植物,別名尾參、玉參、鈴鐺菜、甜根草[1]。玉竹性微寒、味甘,具有潤燥養陰、生津止渴的功效,治療口渴咽干、肺胃陰傷、內熱消渴的療效[2]。玉竹的藥用價值十分豐富,其提純物能增強身體的免疫力,煎劑服用具有擴張血管、抗衰老、抗心肌缺血、抗腫瘤等作用。玉竹可以藥食兩用,園林中宜植于林下、林緣及建筑物遮陰處作為觀賞地被植物,也可盆栽觀賞[3-8]。因此,尋找玉竹快速的繁殖途徑非常重要。
寧慧等[9]在玉竹組織培養與快速繁殖的研究中發現,其根狀莖可作為愈傷組織誘導的外殖體,尤其具有潛伏芽的根狀莖有利于玉竹愈傷組織的誘導。宋艷梅[10]等用花蕾和根莖作為外殖體研究發現,在玉竹愈傷組織的誘導中,6-BA、NAA、2,4-D均有利于愈傷組織的誘導和不定芽的分化。本研究以玉竹葉片、莖段及根莖作為外殖體,采用不同滅菌方式進行滅菌,不同的基本培養基進行培養,添加不同種類的生長調節劑,以探討其最適的初代培養條件,為玉竹的組織培養提供參考。
1 材料與方法
1.1 材料
供試材料為玉竹,為野外采集的完整植株,采集后保存于吉林農業大學花卉溫室內。選取無病蟲害、無機械損傷、生長健壯的玉竹植株作為供試材料。
1.2 方法
1.2.1 外殖體的消毒與滅菌方法篩選 滅菌方法:將處理過的外殖體用流水沖洗表面浮土,洗潔精清洗,流水沖洗3 h,用去離子水清洗干凈后,放入超凈工作臺上的無菌燒杯中,75%乙醇浸泡,無菌水沖洗5~6次,再用0.1%升汞消毒,無菌水沖洗5~6次,每次停留3 min,期間不斷振蕩。
滅菌時間:外殖體滅菌時間的長短在誘導愈傷組織時起重要作用。滅菌時間過長,容易使外殖體發生藥害甚至導致死亡;時間過短,滅菌不徹底,會導致污染。為了得到良好的滅菌效果,尋找較適宜的滅菌時間,設置外殖體的滅菌時間處理如表1所示。在無菌條件下,將處理好的外殖體根莖接種于MS培養基上。每個處理10個外殖體,3次重復。30 d后計算污染數和污染率。
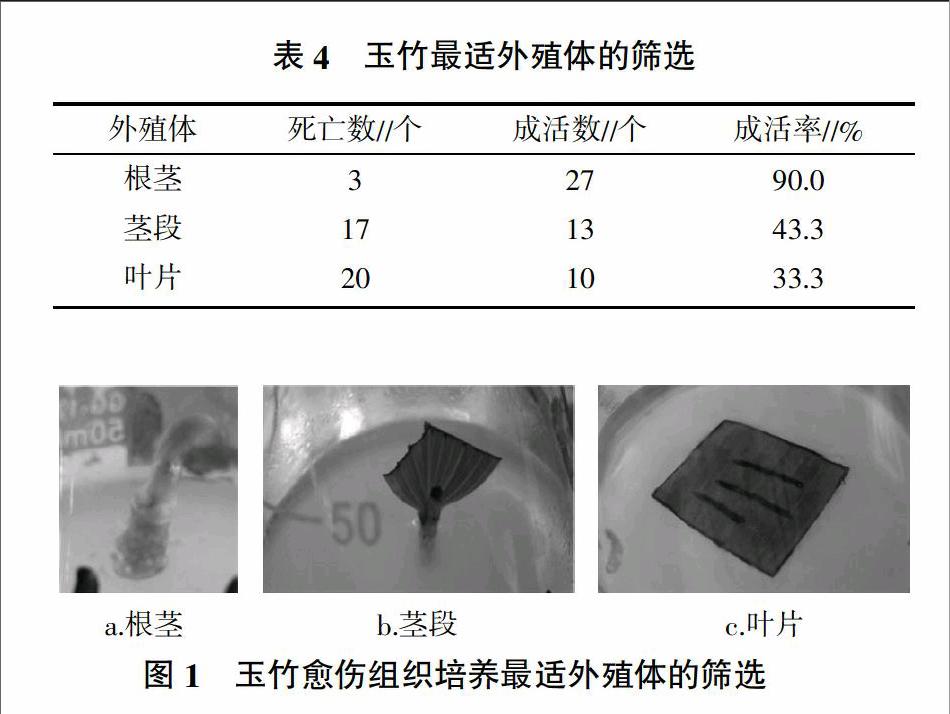
1.2.2 最適外殖體的篩選 選擇玉竹的根莖、莖段以及葉片作為外殖體,滅菌后,用濾紙吸干表面水分,切去受損不健康的組織,接種到MS培養基中,每個處理10個外殖體,3次重復。所有處理溫度與光照相同,培養30 d后觀察并記錄其成活數與成活率。
1.2.3 最適基本培養基的篩選 取玉竹的最適外殖體,在無菌條件下接種到培養基上,接種的培養基分別為MS、1/2MS、1/4MS、WPM培養基。每個處理10個外殖體,3次重復。接種30 d后記錄其死亡數、誘導數以及誘導率。
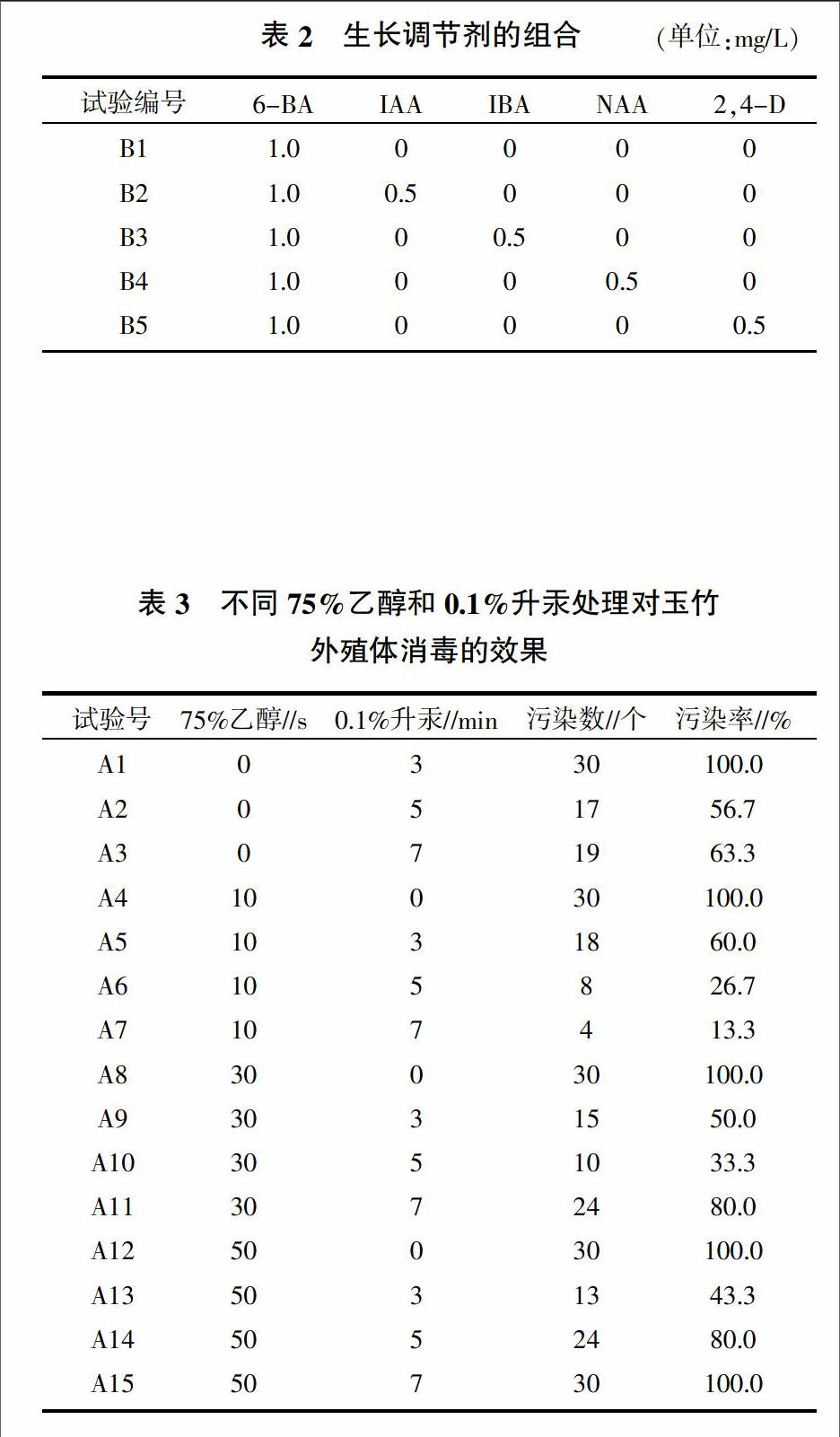
1.2.4 不同生長調節劑的篩選 取玉竹的最適外殖體,在無菌條件下接種到培養基上,誘導培養基選擇MS為基本培養基,配合6-BA、IBA、IAA、NAA、2,4-D 5種生長調節劑組合,其濃度梯度如表2所示,每個處理10個外殖體,5次重復。接種30 d后統計不定芽的分化芽數、分化率以及生長情況。
1.2.5 培養條件 在培養過程中,培養基中加入蔗糖30 g/L,瓊脂12~13 g/L, pH 5.5~6.0,培養溫 度(23±2) ℃,光照時間24 h/d,光照度30~40 μmsl/(m2·s),光源為日光燈。
1.3 試驗數據分析
污染率=(污染的植株數/接種數)×100%。
分化率=(分化芽外殖體數/接種數)×100%。
誘導率=(誘導芽外殖體數/接種數)×100%。
成活率=(外植體成活數/接種數)×100%。
2 結果與分析
2.1 外殖體的消毒與滅菌方法的篩選
將清洗過的玉竹外殖體按照不同方法進行消毒滅菌。由表3可知,培養30 d后,處理A1、A4、A8、A12、A15全部污染死亡,其中處理A1、A8、A4、A12可能由于消毒時間不夠,滅菌不徹底,最終導致外殖體全部污染死亡;而處理A15可能由于消毒滅菌時間過長,最終導致外殖體死亡。處理A7的污染率最低,污染數量最少,成活的外殖體數量較多,效果最好。
2.2 最適外殖體的篩選
將玉竹的外殖體(莖段、葉片、根莖)接種在MS培養基中,用表1中處理A7的方法進行消毒滅菌。其中莖段切成1 cm左右的小段,并保留腋芽,切取大部分葉片,保留少部分進行光合作用,切斜莖段并插入培養基中;葉片切成1 cm左右的方形,并用刀片將葉片垂直葉脈方向切割,注意不要切斷葉片邊緣,將葉背接觸培養基,平鋪在培養基中進行培養;根莖培養時,用剪刀減去根莖上的須根,切成0.5 cm左右的小段,切面接觸培養基進行培養。由表4可知,培養30 d后,根莖的成活率較高,其成活率達到了90.0%,并且生長情況良好,莖段與葉片的成活率較低,分別為43.3%和33.3%,并且污染死亡數較多,未污染的外殖體生長較慢或不生長(圖1)。
2.3 最適基本培養基的篩選
取玉竹根莖,75%乙醇處理10 s,無菌水沖洗5~6次,0.1%升汞處理7 min,無菌水沖洗5~6次,分別在MS、1/2MS、1/4MS、WPM培養基中培養。由表5可知,培養30 d后,MS培養基中玉竹根莖外殖體的死亡數量最少,誘導率最高為86.7%,其次為1/2MS培養基的死亡數量較少,其誘導率為73.3%,誘導率相對較低的為1/4MS與WPM培養基,其誘導率分別為56.7%和60.0%(圖2)。
2.4 不同生長調節劑的篩選
選取根莖作為外殖體,采用處理A7的方法進行消毒滅菌,MS作為基本培養基,添加不同不同生長調節劑進行培養。由表6可知,培養30 d后,處理B4(MS+1.0 mg/L 6-BA+0.5 mg/L NAA)與對照B1(MS+1.0 mg/L 6-BA)相比,其分化率最高,達到了80%,培養期間生長速度較快,植株健壯,污染數量與死亡數量較少;其次為處理B3(MS+1.0 mg/L 6-BA+0.5 mg/L IAA)的分化數量較高,達到62%;處理B2與處理B5的差異不大,且分化率相對較低,但在培養中處理B5的根莖外殖體產生了須根,不利于玉竹外殖體不定芽的產生,不利于增值培養,適宜玉竹根莖外殖體初代培養的培養基為處理B4(MS+1.0 mg/L 6-BA+0.5 mg/L NAA)(圖3)。
3 小結與討論
在相同條件下,外殖體的滅菌采用75%乙醇處理10 s配合0.1%升汞處理7 min,與其他處理相比,該處理下的外殖體消毒滅菌效果最好,且生長較健壯。在組織培養中,取植株的不同部位作為外殖體,其培養的效果也不同。本試驗選取玉竹的根莖、莖段以及葉片作為外殖體,在相同條件下培養根莖的成活率最高,在玉竹的初代培養中,根莖是作為其初代培養最適宜的外殖體,這與寧慧等[9]的研究結果相符。
在初代培養中,基本培養基的種類起重要作用。本試驗利用最有效的滅菌效果,用玉竹的根莖作為初代培養外殖體,在MS、1/2MS、1/4MS以及WPM培養基中培養。試驗結果表明,MS培養基最適宜作為玉竹初代培養的基本培養基。在玉竹的初代培養中,外殖體需要足夠的大量元素、微量元素以及其他營養物質,其他處理培養基中的不能提供其生長所需要的養分。
本試驗中MS+1.0 mg/L 6-BA+0.5 mg/L NAA培養基中根莖外殖體的生長效果最好,生長較快且植株健壯,污染和死亡數量較小,其根莖外殖體分化率達到80%,其次為MS+1.0 mg/L 6-BA+0.5 mg/L IAA培養基,其分化率為62%;但在MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D培養基中,雖然根莖外殖體的生長效果較好,但不如MS+1.0 mg/L 6-BA+0.5 mg/L NAA與MS+1.0 mg/L 6-BA+0.5 mg/L IAA培養基中的外殖體生長效果好,并且培養基中有少量須根產生,不利于玉竹外殖體增殖。由此說明,在玉竹的初代培養中,激素6-BA、NAA以及IAA均有利于玉竹外殖體的生長,這與宋艷梅等[10]的研究結果相符,但與寧慧等[9]的2,4-D有利于不定芽誘導的研究結果不符,可能是由于激素的濃度配比有關,也可能與外殖體采集的時間、地點和季節等有關。
綜上所述,在玉竹的初代培養中,利用75%乙醇處理10 s配合0.1%升汞處理10 min進行消毒滅菌,用根莖作為外殖體,MS作為基本培養基并添加1.0 mg/L 6-BA與0.5 mg/L NAA,可有利于玉竹初代培養中不定芽的誘導,這為下一步玉竹組織培養的研究提供依據。
參考文獻:
[1] TAKAGI H,SHIMOFUSA S,KANNO Y.Promotion of seed germination in Polygonatum odoratum and P. macranthum[J].Bulletin of Yamagata University Agriculture Science,2006,15(1):1-10.
[2] 國家藥典委員會.中國藥典(一部)[S].北京:中國醫藥科技出版社, 2010.
[3] 王 琴,張 虹,王洪泉.黃精及玉竹中甾體苷成分的研究[J].中國臨床醫藥,2003,4(2):75-77.
[4] 林厚文,韓公羽,廖時萱.中藥玉竹有效成分研究[J].藥學學報,1994,29(3):215-222.
[5] 胡潤生.幾種植物藥降血糖活性的研究[J].國外醫藥·植物藥分冊,1996,10(3):115-117.
[6] 加藤篤.中藥玉竹的降血糖作用[J].國外醫藥·中醫中藥分冊, 1991,13(6):36-38.
[7] 丁登峰,向大雄,劉 韶,等.玉竹多糖的提取及其對鏈脲佐菌素誘導糖尿病大鼠血糖的影響[J].中南藥學,2005,3(4):222-223.
[8] 楊立平.玉竹總苷對大鼠血流動力學的影響[J].湖南中醫藥導報,200,14(4):68-69.
[9] 寧 慧,楊培君.玉竹組織培養與快速繁殖[J].西北植物學報,2009,29(11):2339-2344.
[10] 宋艷梅,李 峰.玉竹組織培養研究[J].遼寧中醫藥大學學報,2011,5(3):62-63.

