右美托咪定對缺血缺氧性腦損傷新生大鼠的神經保護作用及機制
姜衛榮 蔣士新 孫永梅
(山東省醫學科學院附屬醫院麻醉科,山東 濟南 250031)
右美托咪定對缺血缺氧性腦損傷新生大鼠的神經保護作用及機制
姜衛榮 蔣士新1孫永梅2
(山東省醫學科學院附屬醫院麻醉科,山東 濟南 250031)
目的 探討右美托咪定(DEX)對缺血缺氧性腦損傷(HIBD)新生大鼠神經功能的影響。方法 36只健康雄性SD大鼠,按照隨機數字法分為假手術組(S組)、模型組(M組)和DEX組(D組),每組12只。D組大鼠腹腔注射100 μg/kg鹽酸右美托咪定注射液,而S組和M組大鼠按照相同的劑量注射等量的生理鹽水。每組隨機取8只大鼠進行神經功能缺損程度評分(NDS),應用酶聯免疫吸附測定法檢測腦組織勻漿液中的炎癥因子白細胞介素(IL)-6、IL-8、IL-10和腫瘤壞死因子(TNF)-α,采用分光光度法測量谷氨酸(Glu)和γ-氨基丁酸(GABA)水平,采用氯化三苯基四氮唑(TTC)染色法計算大腦的梗死體積和腦梗死體積百分比。結果 與S組相比,M組和D組NDS評分及腦梗死相關指標均明顯升高,且D組各指標明顯低于M組(P<0.05);M組和D組腦組織勻漿中IL-6、IL-8和TNF-α水平明顯高于S組,而IL-10水平顯著低于S組,且D組炎癥因子水平改善情況明顯優于M組(P<0.05);與D組相比,其他兩組Glu水平明顯升高,而GABA水平顯著下降,另外,與M組相比,D組腦組織中氨基酸水平的改善情況更明顯(均P<0.05)。結論 DEX可以改善HIBD新生大鼠的神經功能,減少腦梗體積和腦梗死體積百分比,降低腦組織中的炎癥因子和興奮性氨基酸的水平,從而發揮神經保護功能,為臨床用藥提供理論依據。
右美托咪定;缺血缺氧性腦損傷;神經保護
大腦對缺血和缺氧最敏感。一旦出現缺血缺氧損傷,可能會導致腦神經功能受到損傷,且損傷不可逆,甚至導致死亡〔1〕。缺血缺氧性腦損傷(HIBD)發病率高,尤其是多發于新生兒的缺血缺氧性腦病(HIE)〔2〕。HIE發病過程中釋放大量的興奮性氨基酸、炎癥因子參與神經功能損傷的過程,從而誘發一系列的腦功能障礙疾病〔3〕。右美托咪定(DEX)是美托咪定的右旋異構體,對于α2腎上腺素受體具有較高的選擇性激活能力,并作用于哺乳動物的大腦組織,雖然其作為可樂定的同類藥物,但是其活性是可樂定的8倍,可以在極低濃度下產生作用〔1〕。另外研究發現DEX還是一種麻醉藥,通過激活突觸后膜的α2腎上腺素受體,從而產生交感神經阻滯和鎮靜鎮痛的作用〔4〕。本文旨在探討DEX對HIBD新生大鼠神經功能的影響。
1 材料與方法
1.1 實驗動物 清潔級健康雄性SD大鼠36只,7日齡,體重13~15 g,由華中科技大學動物同濟醫學院實驗動物中心提供,所有大鼠均于清潔級飼養室內適應性飼養1 w,自由飲食,溫度控制在(25±2)℃,相對濕度為40%~60%,自由飲食,每隔8 h進行通風換氣,自然光照。按照隨機數表法將分為假手術組(S組)、模型組(M組)和DEX組(D組),每組12只。
1.2 方法
1.2.1 建模 所有大鼠均采用無水乙醚麻醉,S組大鼠僅分離左側頸總動脈,并不進行結扎和缺氧處理,而M組和D組大鼠均按照樊書娟等〔5〕描述的方法建立HIBD動物模型:在大鼠的頸部正中做1個約1 cm的切口,使用手術鑷子分離出左側頸總動脈,隨后使用手術線結扎,之后逐層縫合頸部切口,半個小時后將大鼠置于37℃恒溫缺氧倉中,缺氧倉中的氣體組成為92%的氮氣和8%的氧氣,氣體流量為2 L/min,2 h后將大鼠取出。D組大鼠于造模成功后腹腔注射鹽酸右美托咪定注射液(江蘇恒瑞醫藥股份有限公司,生產批號:20150705,規格200 μg/2 ml),100 μg/kg,S組和M組大鼠按照相同的劑量注射等量的生理鹽水。
1.2.2 取材 缺氧24 h后,給每組存活的大鼠腹腔注射10%水合氯醛(400 mg/kg),完全麻醉后,斷頭處死,開顱取出左側腦組織,用預冷的磷酸鹽緩沖液(PBS)清洗表面,濾紙吸干后稱重,剪碎,加入9 ml/g PBS后高速勻漿,5 000 r/min離心10 min,吸取上清液,并用生理鹽水稀釋。
1.3 觀察指標 每組隨機取8只大鼠于取材前進行神經功能缺損程度評分(NDS),評分標準參考Bederson等〔6〕的方法:0分,無神經缺損癥狀;1分,左前肢不能內向屈曲;2分,向左旋轉或左側行走;3分,追尾狀向左轉圈。應用酶聯免疫吸附測定法,嚴格按照說明書檢測炎癥因子白細胞介素(IL)-6、IL-8、IL-10和腫瘤壞死因子(TNF)-α。采用分光光度法測量谷氨酸(Glu)和γ-氨基丁酸(GABA)水平。
采用氯化三苯基四氮唑(TTC)染色法計算大腦的梗死面積:斷頭處死大鼠后,摘除小腦及腦干,置于-20℃冰箱中冷凍10 min后,將腦組織切成厚度為2 mm的腦片,并置于新配制的2%TTC溶液中,在37℃水浴中,避光孵育30 min,完全顯色后置于10%甲醛中至少固定24 h,保存于黑暗處。正常組織經過TTC染色后呈現紅色,梗死組織呈現白色。對固定好的腦片拍照后輸入計算機,應用IBAS 2.7型全自動圖像分析系統分析圖像,腦梗死體積的近似值=腦片缺血面積×厚度,腦梗死面積百分比=(腦梗死體積/腦組織體積)×100%。
1.4 統計學方法 應用SPSS19.0軟件進行方差分析、t檢驗和χ2檢驗。
2 結 果
2.1 3組NDS評分及腦梗死相關指標對比 3組NDS評分、腦梗死體積及梗死面積百分比差異有統計學意義(P<0.05)。與S組相比,M組和D組NDS評分及腦梗死相關指標均明顯升高,D組各指標明顯低于M組(均P<0.05)。見表1。
2.2 3組炎癥因子水平比較 3組炎癥因子水平差異有統計學意義(P<0.05)。M組和D組IL-6、IL-8和TNF-α水平明顯高于S組,而IL-10水平顯著低于S組,D組炎癥因子水平改善情況明顯優于M組(均P<0.05)。見表2。
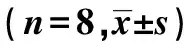
表1 3組NDS評分及腦梗死相關指標對比
與S組比較:1)P<0.05;與M組比較:2)P<0.05;下表同
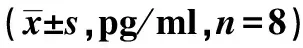
表2 3組炎癥因子水平比較
2.3 3組Glu和GABA水平比較 3組Glu和GABA水平差異有統計學意義(P<0.05)。與S組相比,M組和D組Glu水平明顯升高,而GABA水平顯著下降,與M組相比,D組氨基酸水平的改善情況更明顯(均P<0.05)。見表3。

表3 3組Glu和GABA水平比較
3 討 論
腦部出現缺血缺氧是一個復雜的病理過程,如果不能進行及時治療,可能會導致腦損傷加重。目前臨床療效突出的藥物主要為DEX,于2009年引入我國,具有鎮靜、抗焦慮和穩定血流動力學等作用,并且通過動物實驗和臨床研究證實其對HIBD具有良好的臨床療效〔7〕。DEX的作用部位為中樞的α2-腎上腺素受體而發揮作用,同時α2受體親和力是α1的1 640倍,其藥效是可樂定的8倍〔8〕。發揮神經保護作用機制可以多方面的〔9,10〕:①抑制兒茶酚胺的釋放;②營養神經元并抑制神經元凋亡;③抗氧化作用;④降低炎癥因子水平;⑤減少腦內興奮性神經遞質的釋放。
在腦部缺血缺氧發生的過程中往往會引起運動、認知等方面的損傷,因此需要通過Bederson法對肢體神經功能障礙進行評分,并對其嚴重程度進行分析,而腦部梗死體積可以用于評價腦缺血缺氧程度,此次研究中采用TTC染色法對腦部梗死區域進行檢測,并采用專業的圖像分析軟件分析,可以最大限度地保證圖片的客觀性,并降低實驗誤差〔11〕。本研究結果提示DEX可以改善HIBD新生大鼠的神經缺損功能,并減少腦梗死面積,主要是由于DEX可以通過激活α2-腎上腺素受體,抑制腺苷酸環化酶的活化,提高磷酸化的黏著斑激酶含量,從而發揮神經保護作用,另外DEX還可以減少胞內鈣離子內流,從而減少腦梗死面積,繼而發揮大腦保護作用〔4〕。
腦組織出現缺血缺氧時能夠產生大量損傷因子,誘發腦水腫,進而弱化血腦屏障功能,加速炎癥因子進入腦組織的進程,加劇對腦部的損傷〔12〕。其中IL-6是腦部缺血缺氧過程產生的重要炎癥因子之一,能夠誘發腦部炎性損傷;IL-10作為一種抗感染因子,可以在腦缺血損傷過程中發揮抗感染、抗氧化等多種腦保護作用,并能降低TNF-α的分泌;TNF-α是一種前炎癥因子,主要來源于活化的小膠質細胞,作為炎癥反應的觸發因子可促進腦組織的神經病變。IL-8主要發揮炎癥趨化作用,通過激活腦部中性粒細胞釋放大量的氧自由基,加重腦部區域的損傷〔13〕。本研究結果提示DEX可以改善HIBD新生大鼠的炎癥狀態,主要是由于DEX通過抑制中性粒細胞的浸潤和活化,加速其凋亡,從而抑制炎癥反應〔12〕。另外,DEX能夠激活膽堿能神經通路和抑制交感神經而起到抗感染的作用〔8〕。
氨基酸作為中樞神經系統的主要神經遞質,可以分為興奮性氨基酸和抑制性氨基酸,興奮性氨基酸主要為Glu,可以參與興奮性傳導,同時也可以引起興奮性中毒,機體處于正常狀態時,Glu多存在于細胞內,遠高于細胞外的含量〔7〕。而GABA主要分布在黑質和蒼白球中,同時還分布在海馬或小腦皮質中,作為一種抑制性氨基酸,可以阻斷Glu的興奮性。本研究結果表明,DEX可以通過抑制電壓門控件鈣離子通道而抑制Glu的釋放,或者是選擇性作用于星型膠質細胞上的α2受體,加速星型膠質細胞對Glu的攝取和降解。但是DEX升高GABA的作用機制尚未明確,有待于進一步研究。
1 侯冠峰.不同劑量右美托咪定對大鼠腦缺血再灌注損傷的影響〔D〕.合肥:安徽醫科大學,2013.
2 趙 彬,程江霞,胡錦濤,等.右美托咪定聯合淺低溫對腦缺血損傷大鼠神經保護作用中炎癥因子的影響〔J〕.武漢大學學報(醫學版),2013;34(5):654-6.
3 Zalewska T,Jaworska J,Ziemka-Nalecz M.Current and experimental pharmacological approaches in neonatal hypoxic-ischemic encephalopathy〔J〕.Curr Pharm Des,2015;21(11):1433-9.
4 崔 敏,葉 紅,孟麗巍,等.右美托咪定在血管外科介入手術麻醉中的應用〔J〕.現代生物醫學進展,2015;15(23):4487-9.
5 樊書娟,余 玲,艾 婷,等.缺血后處理對新生大鼠缺氧缺血性腦損傷的影響〔J〕.中國新生兒科雜志,2015;30(2):132-7.
6 Bederson JB,Pitts LH,Tsuji M,etal.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination〔J〕.Stroke,1986;17(3):472-6.
7 賈建麗,蔡勁松,戚 翔,等.右美托咪定預先給藥對大鼠全腦缺血再灌注損傷的影響〔J〕.河北醫藥,2015;37(17):2565-9.
8 劉曉云.鹽酸右美托咪定對顱內手術患者的腦保護作用〔D〕.唐山:河北聯合大學,2015.
9 陳麗嬌,薛慶生,于布為,等.右美托咪定的神經保護作用及其相關機制〔J〕.中國藥理學通報,2015;31(11):1493-5,1496.
10 李志鵬,王 飛.右美托咪啶對腦神經保護機制的研究進展〔J〕.醫學綜述,2014;20(21):3947-9.
11 顧 琴.右美托咪定改善大鼠局灶性腦缺血再灌注損傷的實驗研究〔D〕.蘇州:蘇州大學,2014.
12 李 霞,程江霞,鮑 磊,等.右美托咪定對缺血缺氧性腦損傷新生大鼠腦組織中TNF-α、IL-1β、NGF、BDNF表達的影響〔J〕.實用臨床醫藥雜志,2016;20(1):13-5.
13 Granica S,Piwowarski JP,Kiss AK.Ellagitannins modulate the inflammatory response of human neutrophils ex vivo〔J〕.Phytomedicine,2015;22(14):1215-22.
〔2016-11-22修回〕
(編輯 袁左鳴/滕欣航)
姜衛榮(1972-),女,主治醫師,主要從事麻醉學研究。
R742
A
1005-9202(2017)10-2407-03;
10.3969/j.issn.1005-9202.2017.10.025
1 濟南市槐蔭人民醫院內科 2 山東省交通醫院麻醉科

