巖原鯉致病性維氏氣單胞菌的分離與鑒定
朱成科,劉桂嘉,張爭世,蒲德成,朱 龍,周朝偉,雷 駱,鄭宗林
?
巖原鯉致病性維氏氣單胞菌的分離與鑒定
朱成科1,劉桂嘉1,張爭世1,蒲德成2,朱 龍1,周朝偉1,雷 駱1,鄭宗林1
目的 2016年6月從重慶永川某養殖場瀕臨死亡的巖原鯉內臟分離到一株維氏氣單胞菌,分析其生物學特征,為預防和治療該病提供理論依據和參考。方法 從患病魚體獲得一株致病菌YY01,經形態學觀察、生理生化特性測定、16S rRNA和gyrB基因序列分析其分類地位;通過人工感染試驗和毒力基因檢測確定其致病性,并同時開展藥物敏感試驗篩選其敏感藥物。結果 病原菌16S rRNA與gyrB序列構建的進化樹顯示該菌與維氏氣單胞菌同聚為一支,相似性在99%以上;結合其形態學特征和生理生化特性,確認為維氏氣單胞菌(Aeromonasveronii)。人工感染試驗結果顯示菌株YY01對巖原鯉的半致死量為5.06×104CFU/g。通過病原菌毒力基因檢測發現,能從菌株YY01基因組中擴增到氣溶素(Aer)、溶血素(Hly)、外膜蛋白(OmpA)和黏附素(Aha)4種毒力基因。藥敏試驗表明菌株YY01對多粘霉素B、阿米卡星、先鋒霉素V等22種藥物敏感;對青霉素、羧芐西林等11種藥物耐藥。結論 所檢出的維氏氣單胞菌為巖原鯉的致病菌,該菌對巖原鯉有較強的致病性。
維氏氣單胞菌;巖原鯉;致病性;藥敏試驗
Supported by the Ecological Fishery Industry Technology System of Chongqing (Nos. 40800115 and 40800216) and the Youth Foundation of Southwest University Rongchang Campus (No. 20700913) Corresponding author: Zheng Zong-lin, Email: zhengzonglin@126.com
巖原鯉(Procyprisrabaudi)又名巖鯉、黑鯉魚,隸屬鯉形目(Cypriniformes),鯉科(Cyprinidae),鯉亞科(Cyprininae),原鯉屬(Procypris),主要分布于我國長江中上游及其支流水域,屬雜食性底層魚類,其肉質細嫩,味道鮮美,少肌間刺,含肉率高,是上等的食用魚類,市場前景廣闊[1]。近年來,由于長江中上游水體污染和過度捕撈,加上三峽樞紐等水利設施的興建,嚴重破壞了巖原鯉的棲息環境,其野生資源銳減,已被列為《中國瀕危動物紅皮書(魚類)》中的易危物種[2]。隨著重慶、四川、湖北、貴州等省市相繼開展了巖原鯉的人工繁殖和養殖技術研究,極大地推動了巖原鯉養殖業的發展。近年來,隨著養殖密度的加大,集約化程度的增高,巖原鯉養殖環境惡化,各種細菌性疾病、真菌性疾病和寄生蟲病頻發,嚴重困擾著巖原鯉養殖業的健康發展。其中,細菌性疾病對巖原鯉危害最為嚴重,目前報道的主要有嗜水氣單胞菌(A.hydrophila)、腸形點狀氣單胞菌(A.punctataf.intestinalis)、熒光假單胞菌(Pseudomonasfluorescens)和柱狀黃桿菌(Flavobacteriumcolumnare)等[3-4]。
2016年6月,在重慶永川某養殖場出現巖原鯉大批患病并出現死亡的現象,患病魚主要臨床癥狀為:體表充血,肛門紅腫、外突,鰭條基部充血發紅,腹部腫脹,腹腔中大量紅色腹水,內臟點狀出血,腸道充血等癥狀。本實驗室研究人員從自然發病魚體內臟實質器官進行了病原菌分離,并通過病原菌形態學觀察、生理生化測定和分子生物學特性進行鑒定確定,該菌為維氏氣單胞菌(A.veronii),同時進行了病原菌藥物敏感性及毒力基因的檢測,以期為該病的致病機制和有效病害防控研究奠定基礎。
1 材料與方法
1.1 實驗動物 病魚采自重慶市永川區某養殖場,體質量為150-250 g,具有典型的臨床癥狀。健康巖原鯉購自重慶市萬州區水產研究所,體長為15.3±1.5 cm,體質量為53.6±4.2 g,暫養于90×50×60 cm的水族缸中,試驗用水為充分曝氣的自來水,水溫(26.5±1.0)℃,pH 7.0-7.5,觀察7 d確認健康無異常后進行人工感染試驗。
1.2 主要試劑和儀器 普通營養瓊脂培養基(Oxoid公司),細菌DNA提取試劑盒(北京天根生化科技有限公司),PCR反應體系(Takara公司),pMD-19T(Takara公司),API 20E試劑盒(Biomerieux公司),藥敏紙片(杭州微生物試劑有限公司);恒溫搖床(江蘇省金壇市盛威實驗儀器廠),生化培養箱(寧波新芝生物科技股份有限公司),核酸蛋白測量儀(德國eppendef公司),PCR擴增儀(美國Bio-Rad公司),DYY-8C型電泳儀(北京市六一儀器廠),凝膠成像系統(美國Bio-Rad公司)等。
1.3 病原菌的分離與培養 選取患病癥狀典型的瀕臨死亡巖原鯉,在無菌操作臺中,用70%酒精棉球擦拭魚體,用接種環取其肝、脾、腎和腹水分別于普通營養瓊脂平板上進行劃線,在28 ℃生化培養箱中培養24 h,觀察細菌菌落生長狀況,然后挑取形態一致的單個優勢菌落在營養瓊脂培養基平板中,再次純化培養24 h,將純化后的分離菌株用營養瓊脂斜面培養基4 ℃保存備用。
1.4 病原菌的形態觀察 將純化的菌株接種于營養瓊脂培養基28 ℃培養24 h,觀察菌落形態特征。挑選單菌落經革蘭氏染液染色后,在顯微鏡下觀察細菌形態。
1.5 人工感染試驗 將分離菌株涂布接種于營養瓊脂培養基上,28 ℃恒溫培養箱中培養8 h,用0.65%無菌生理鹽水洗脫,參照麥氏比濁法調整菌液濃度,稀釋成1.0×108CFU/mL、1.0×107CFU/mL、1.0×106CFU/mL、1.0×105CFU/mL的菌懸濁液。采用胸鰭注射法,每尾魚分別注射各濃度菌液0.2 mL,15尾/組。空白對照組注射等量0.65%無菌生理鹽水。接種后觀察魚的發病和死亡情況,對上述感染死亡的魚進行致病菌分離鑒定和感染試驗。
1.6 病原菌生理生化特征鑒定 參照ATB系統細菌自動鑒定儀(法國Bio-merieux公司)API 20E試劑盒使用說明進行細菌鑒定,鑒定結果參照參考《伯杰氏細菌鑒定手冊》[5]和《常見細菌系統鑒定手冊》[6]的標準判斷細菌的種類。
1.7 16S rRNA和gyrB序列的擴增和測定
1.7.1 菌株DNA提取:無菌條件下,在5.0 mL的EP管中加入1.0 mL普通肉湯液體培養基,將單個活化的菌群接種在其中。于恒溫振蕩器中28 ℃,120 r/min培養6 h后,4 000 r/min離心1 min,棄上清液。參照細菌基因組DNA提取試劑盒說明書提取制備DNA。
1.7.2 16S rRNA和gyrBPCR擴增:采用一對16S rRNA基因PCR擴增的通用引物F-D1/R-D1。上游引物為F-D1:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物為R-D1:5′-AAGGAGGTGATCCA GCCGCA-3′[7]。采用一對gyrB基因PCR擴增的通用引物3F/14R。上游引物為3F:5′-TCCGGCGGTCTGCACGGCGT-3′;下游引物為14R:5′-TTGTCCGGGTTGTACTCGTC-3′[8]。PCR用25 μL反應體系:10×PCR Buffer 2.5 μL,25 mM MgCl21.5 μL,10 mM dNTP 0.5 μL,上、下游引物各0.5 μL,模板DNA 1 μL,rTaq酶(5 U/μL)0.25 μL,ddH2O 補足余下體積。基因擴增條件:94 ℃預變性4 min;94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸1 min,共31個循環;最后,72 ℃延伸10 min。1%瓊脂糖凝膠電泳檢測。用TaKaRa公司的瓊脂糖凝膠DNA回收試劑盒進行PCR產物回收純化,pMD-19T載體連接,轉化進DH5α感受態細胞,挑選陽性克隆送上海英駿生物技術測序公司測序。
1.7.3 序列分析與系統發育樹的構建:將菌株的16S rRNA和gyrB基因序列在GenBank數據庫中的Blast進行相似性比較。采用MEGA 4.0軟件構建系統發育樹,通過自舉分析(bootstrap)進行置信度檢測,自舉數集1000次。
1.8 病原菌毒力基因的檢測 以分離菌株的DNA為模板,對氣溶素基因(Aer)[9]、溶血素基因(Hly)[10]、外膜蛋白基因(OmpA)[11]和黏附素基因(Aha)[11]進行PCR擴增。引物序列、退火溫度和片段大小見表1。在用1%瓊脂糖凝膠電泳檢測PCR擴增產物大小,TaKaRa瓊脂糖凝膠DNA回收試劑盒進行PCR產物回收純化,克隆并測序。
表1 相關毒力基因的引物序列
Tab.1 Sequence of oligonucleotide primers used in the study
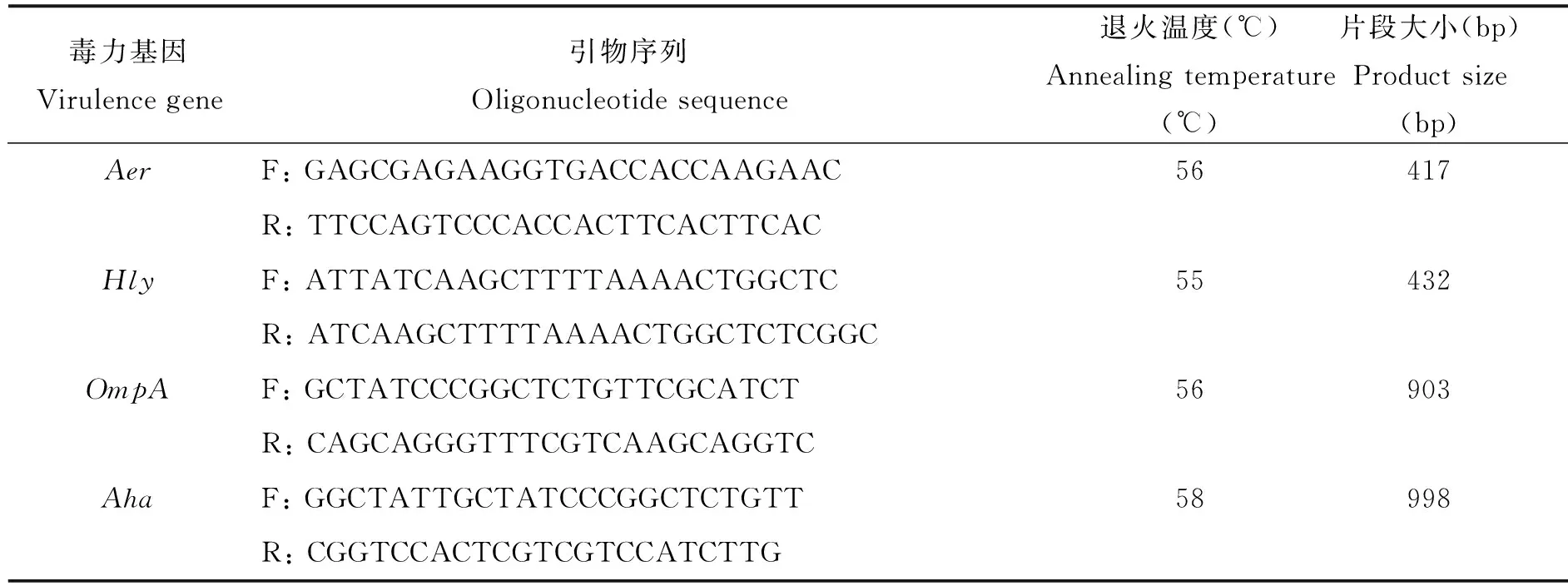
毒力基因Virulencegene引物序列Oligonucleotidesequence退火溫度(℃)Annealingtemperature(℃)片段大小(bp)Productsize(bp)AerF:GAGCGAGAAGGTGACCACCAAGAAC56417R:TTCCAGTCCCACCACTTCACTTCACHlyF:ATTATCAAGCTTTTAAAACTGGCTC55432R:ATCAAGCTTTTAAAACTGGCTCTCGGCOmpAF:GCTATCCCGGCTCTGTTCGCATCT56903R:CAGCAGGGTTTCGTCAAGCAGGTCAhaF:GGCTATTGCTATCCCGGCTCTGTT58998R:CGGTCCACTCGTCGTCCATCTTG
1.9 藥敏試驗 藥敏試驗采用K-B法進行。將菌懸液制成1.0×108CFU/mL。用無菌棉簽蘸取菌懸液均勻涂布在營養瓊脂培養基上,貼上藥敏紙片,置于28 ℃恒溫培養24 h測定抑菌圈直徑大小。參照說明書判斷藥物敏感性。
2 結 果
2.1 致病菌分離 從瀕臨死亡病魚肝、脾、腎分離到一株優勢病原菌,編號為YY01。菌株YY01在普通肉湯液體培養基中生長良好,培養液中渾濁均勻。在普通肉湯瓊脂平板上28 ℃培養24 h,形成圓形、邊緣整齊、隆起、光滑濕潤、灰白色至淡黃色,直徑在1.0-1.5 mm的菌落。經革蘭氏染色鏡檢可見革蘭陰性短桿菌,菌體大小為1.50×0.48 μm,兩端鈍圓或平直,多數單個排列。
2.2 人工感染試驗 胸鰭基部注射菌株YY01后,攻毒后7 d各組巖原鯉死亡結果見表2。由表2可見,高濃度組(1.0×108CFU/mL)巖原鯉在2 d內全部死亡,死亡率高達100%;1.0×107CFU/mL組在攻毒后7天內累積死亡率為73.3%,對照組無魚體死亡,表明分離菌株具有較強的致病性。人工感染死亡的巖原鯉出現下頜、鰭基出血,腹部膨大,肛門紅腫,解剖后,腹部出現腹水,惡臭等癥狀,與自然發病巖原鯉癥狀和病變相似。并從人工感染瀕臨死亡的試驗魚肝、脾臟和腹水中分離到一株優勢菌,該菌形態學、生理生化特征和分子生物學鑒定結果與菌株YY01一致,表明YY01是該病的病原菌。通過人工感染試驗結果,根據改良寇氏法[12]計算出菌株YY01的半致死濃度LD50為:5.06×104CFU/g。
表2 菌株YY01對健康巖原鯉人工感染試驗結果
Tab.2 Results of artificial infection of YY01 inProcyprisrabaudi

注射濃度Concentration(CFU/mL)魚數No.(n)感染7d內每d死亡尾數Deathno.ineachday1234567死亡總數No.ofdeath(n)死亡率Mortalityrate/%1.0×108151140000015100.01.0×1071525310001173.31.0×106150210100426.71.0×10515000100016.70.65%NaCl15000000000.0
2.3 生理生化鑒定結果 菌株YY01的VP試驗、MR試驗和七葉靈水解陽性;產生吲哚,不能產生H2S;賴氨酸脫羧酶、氧化酶陽性,精氨酸雙水解酶陰性;能利用D-葡萄糖、D-甘露醇、蔗糖、麥芽糖和纖維二糖,不能利用阿拉伯糖、肌醇、衛矛醇、乳糖、棉籽糖、木糖、鼠李糖、水楊苷,其生理生化特性見表3。經ATB Expression生化自動鑒定儀(IS32 STREP)軟件的分析結果,可初步鑒定分離菌株為維氏氣單胞菌。
2.4 基因序列分析與系統發育樹的構建 用細菌的16S rRNA和gyrB通用引物,經PCR擴增獲得預期條帶大小約為1 500 bp和1 200 bp(如圖2),與預期的結果相一致。對目的條帶進行割膠回收、純化、連接、轉化、挑選陽性克隆測序,菌株YY01所獲得的16S rRNA和gyrB序列片段大小分別為1 497 bp和1 084 bp。
菌株YY01 16S rRNA(登錄號:KY624577)與GenBank上登錄的維氏氣單胞菌(登錄號:AF099024和HQ407242)的相似性高達99.9%;菌株YY01gyrB基因(登錄號:KY624576)與GenBank上登錄的維氏氣單胞菌(登錄號:KR537458)的相似性高達100.0%。根據YY01菌株16S rRNA和gyrB基因序列與GenBank已登錄的其它氣單胞菌屬序列,并以霍亂弧菌(V.cholerae)和副溶血性弧菌(V.parahaemolyticus)為外類群,運用MEGA4.0軟件分別建立系統進化樹,結果顯示,YY01均與維氏氣單胞菌聚為一支(支持率均為100%),見圖2、圖3。
2.5 毒力基因的檢測結果 根據維氏氣單胞菌Aer、Hly、OmpA、Aha基因設計基因特性引物,進行特異性PCR擴增,分別獲得大小約410 bp、430 bp、900 bp和1 000 bp的DNA片段(圖4),與預期結果相符。從而進一步說明引起巖原鯉患病的維氏氣單胞菌菌株YY01含有AerA、Hly、OmpA、Aha基因,從分子水平上說明該菌株具有較強的致病性,與人工回歸感染結果相一致。
表3 分離菌株YY01的生理生化特征
Tab.3 Biochemical and physiological characteristics of the isolated strain YY01

實驗項目 Items結果Result實驗項目 Items結果ResultD-葡萄糖(D-glucose)+衛矛醇(Galactitol)-D-甘露醇(D-mannitol)+乳糖(Lactose)-蔗糖(Sucrose)+棉籽糖(Raffinose)-阿拉伯糖(Arabinose)-木糖(Xylose)-肌醇(Inositol)-鼠李糖(Rhamnose)-賴氨酸脫羧酶(Lysdecarboxylase)+氧化酶(Oxidase)+精氨酸雙水解酶(Argdihydrolase)-脲酶(Urease)-鳥氨酸脫羧酶(Orndecarboxylase)-硫化氫(H2S)-苯丙氨酸脫氨酶(Phedeaminase)-吲哚(Indol)+七葉靈水解(Esculinhydrolyse)+水楊苷(Salicin)-丙二酸鹽(Malonate)-纖維二糖(Cellobiose)+麥芽糖(Maltose)+0%NaCl+VP(Voges-Proskauertest)+3%NaCl+MR(Methyl-Redtest)+6%NaCl-葡糖糖產氣(D-glucoseproducinggas)+8%NaCl-枸椽酸鹽(Citrate)-10%NaCl-
Notes: “+” indicates positive, “-” indicates negative.
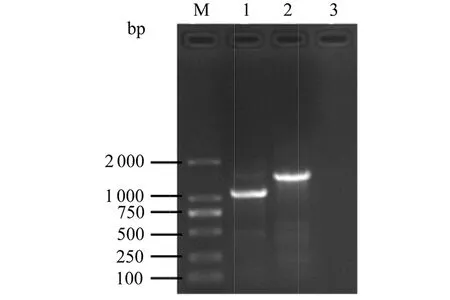
M: DL2000 DNA maker; 1: gyrB; 2: 16S rRNA; 3: negative control圖1 病原菌株YY01的gyrB和16S rRNA基因PCR擴增結果Fig.1 PCR amplification of gyrB and 16S rRNA gene in strain YY01
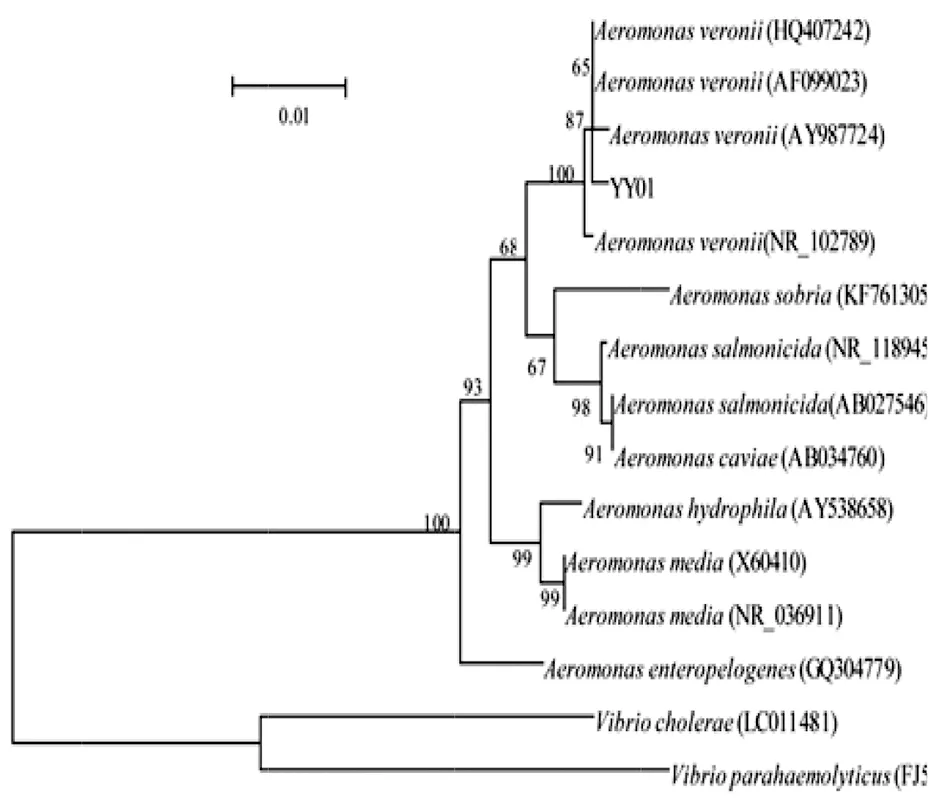
圖2 菌株YY01 16S rRNA基因序列構建的系統發育樹Fig.2 Phylogenetic tree based on 16S rRNA gene sequences.
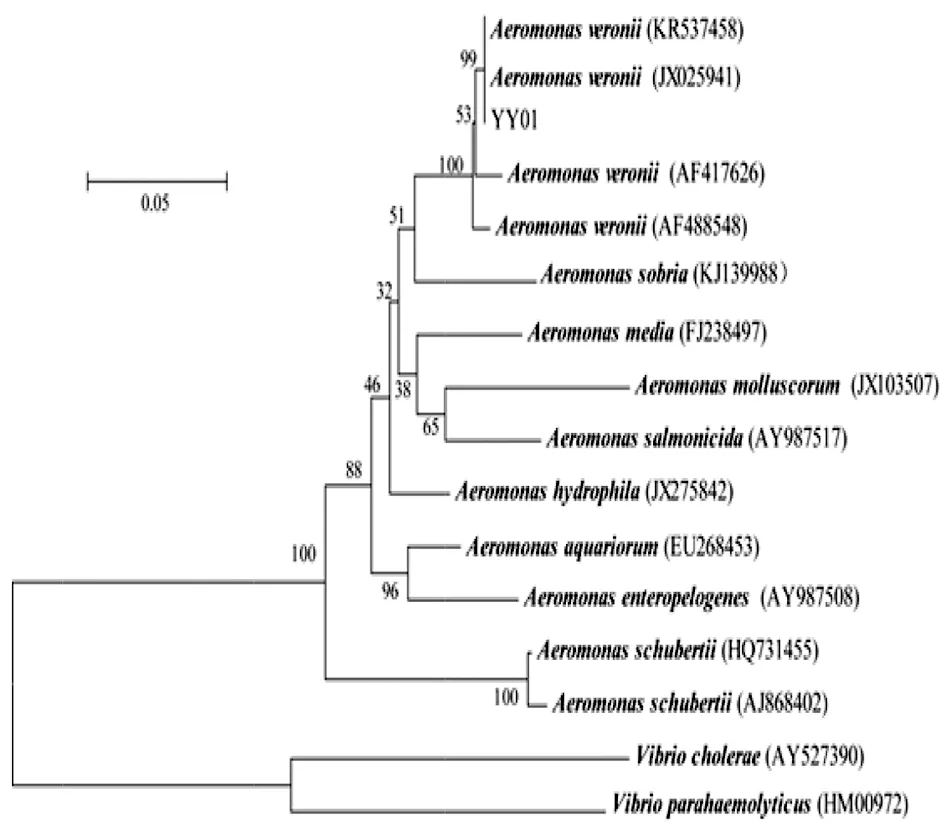
圖3 菌株YY01 gyrB基因序列構建的系統發育樹Fig.3 Phylogenetic tree based on gyrB gene sequences
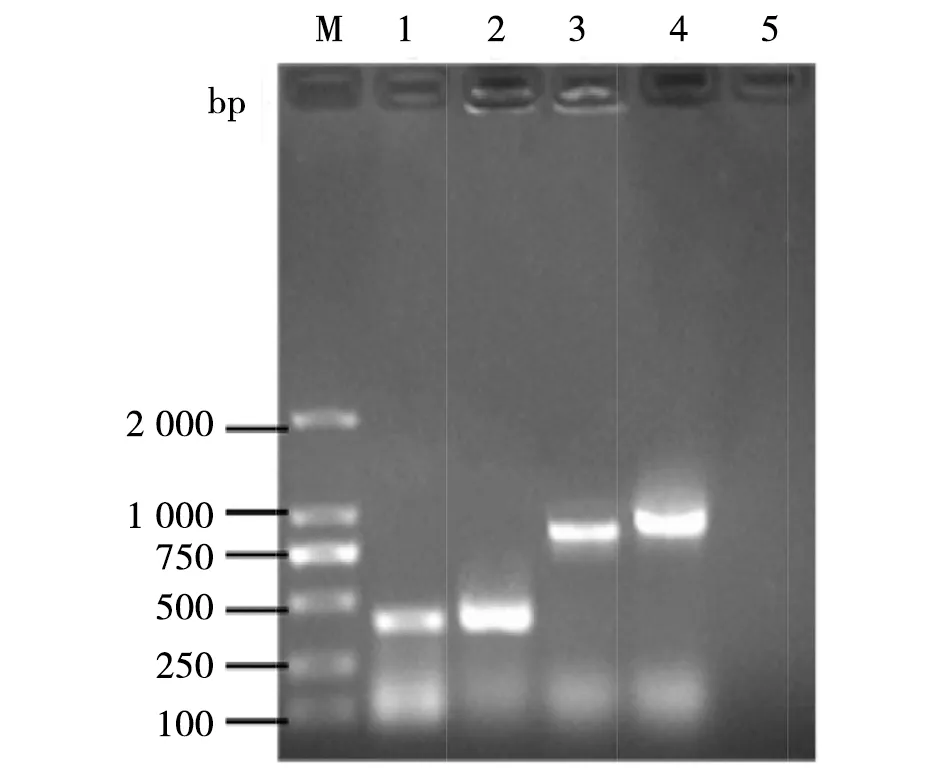
M: DL2000 DNA maker; 1:Aer;2:Hly;3:OmpA;4:Aha;5:negative control圖4 菌株YY01的毒力基因片段電泳結果Fig.4 PCR amplification of four virulence genes of strain YY01
2.6 藥敏試驗 本試驗檢測了YY01對40種抗生素(包括大環內酯類、β-內酰胺類、四環素類、硝基呋喃類、磺胺類、氨基糖苷類、喹諾酮類、氯霉素類、林可霉素類和其它類抗生素)的藥物敏感性,見表4。結果顯示YY01對多粘霉素B、阿米卡星、先鋒霉素V、呋喃妥因和呋喃唑酮等22種藥物敏感;對鏈霉素、妥布霉素、慶大霉素、先鋒霉素Ⅵ、利福平等8種藥物中度敏感;對青霉素、羧芐西林等10種藥物耐藥。
3 討 論
菌株YY01的形態學特性和生理生化的檢測結果與維氏氣單胞菌非常相似,且維氏氣單胞菌區別氣單胞菌屬其它細菌的主要特征為賴氨酸脫羧酶陽性、精氨酸雙水解酶陰性[13]。結合《伯杰氏細菌鑒定手冊》和《常見細菌系統鑒定手冊》[5-6]進行種類鑒定,初步確定該病原菌為維氏氣單胞菌(A.veronii)。但菌株YY01苯丙氨酸脫氨酶、水楊苷和纖維二糖陰性與維氏氣單胞菌模式菌株ATCC35624存在差異,其原因可能是同一種細菌在不同地域分離獲得,存在個體差異引起[14]。為了進一步確定分離菌株的分類地位,本研究采取了細菌的16S rRNA和gyrB。16S rRNA基因進化速率緩慢,功能保守,被稱為細菌“分子化石”,常用于細菌的分類鑒定[15],但對同屬親緣關系較近的種間關系分辨率不夠[16]。gyrB基因屬于信息通路中與DNA復制、限制、修飾和修復有關的蛋白編碼基因,對細菌DNA的轉錄和復制很重要[17]。研究發現gyrB基因相對于16S rRNA具有較高的替換率,并且作為蛋白編碼基因,特別適合親緣關系較近的菌種區別和鑒定[8]。本研究分離到了菌株YY01gyrB基因與登錄已知維氏氣單胞菌相似性高達99.0%以上,而與氣單胞菌屬其它菌種相似性低于95.0%,結合生理生化鑒定結果,鑒定分離菌株為維氏氣單胞菌(A.veronii)。因此,在病原菌的鑒定過程中,將細菌形態學和生理生化特性結合分子生物學鑒定相結合,鑒定結果更精確。
表4 菌株YY01的藥敏試驗結果
Tab.4 Sensitivity of strain YY01 to antibiotics
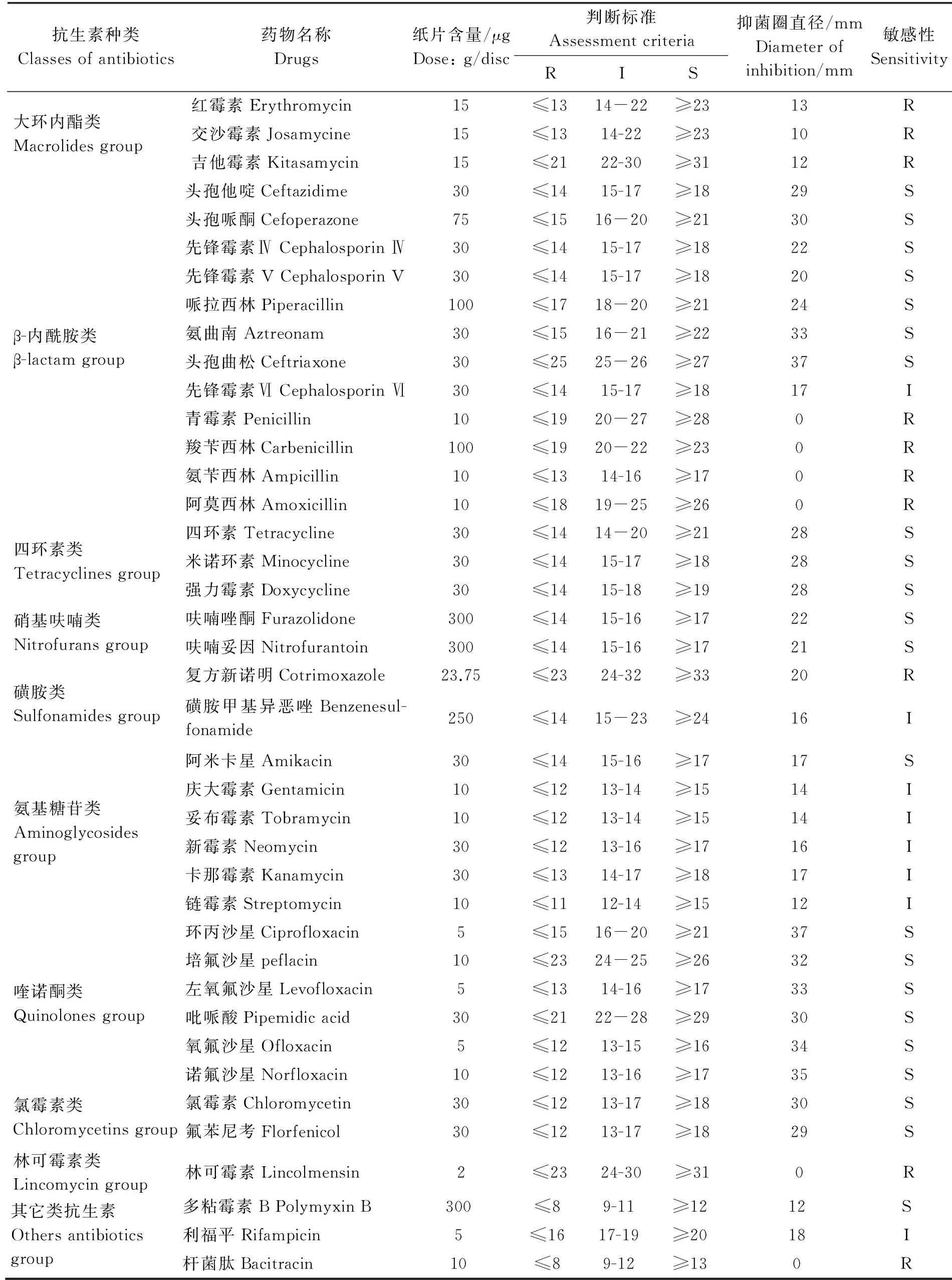
抗生素種類Classesofantibiotics藥物名稱Drugs紙片含量/μgDose:g/disc判斷標準AssessmentcriteriaRIS抑菌圈直徑/mmDiameterofinhibition/mm敏感性Sensitivity大環內酯類Macrolidesgroup紅霉素Erythromycin15≤1314-22≥2313R交沙霉素Josamycine15≤1314-22≥2310R吉他霉素Kitasamycin15≤2122-30≥3112Rβ-內酰胺類β-lactamgroup頭孢他啶Ceftazidime30≤1415-17≥1829S頭孢哌酮Cefoperazone75≤1516-20≥2130S先鋒霉素ⅣCephalosporinⅣ30≤1415-17≥1822S先鋒霉素VCephalosporinV30≤1415-17≥1820S哌拉西林Piperacillin100≤1718-20≥2124S氨曲南Aztreonam30≤1516-21≥2233S頭孢曲松Ceftriaxone30≤2525-26≥2737S先鋒霉素ⅥCephalosporinⅥ30≤1415-17≥1817I青霉素Penicillin10≤1920-27≥280R羧芐西林Carbenicillin100≤1920-22≥230R氨芐西林Ampicillin10≤1314-16≥170R阿莫西林Amoxicillin10≤1819-25≥260R四環素類Tetracyclinesgroup四環素Tetracycline30≤1414-20≥2128S米諾環素Minocycline30≤1415-17≥1828S強力霉素Doxycycline30≤1415-18≥1928S硝基呋喃類Nitrofuransgroup呋喃唑酮Furazolidone300≤1415-16≥1722S呋喃妥因Nitrofurantoin300≤1415-16≥1721S磺胺類Sulfonamidesgroup復方新諾明Cotrimoxazole23.75≤2324-32≥3320R磺胺甲基異惡唑Benzenesul-fonamide250≤1415-23≥2416I氨基糖苷類Aminoglycosidesgroup阿米卡星Amikacin30≤1415-16≥1717S慶大霉素Gentamicin10≤1213-14≥1514I妥布霉素Tobramycin10≤1213-14≥1514I新霉素Neomycin30≤1213-16≥1716I卡那霉素Kanamycin30≤1314-17≥1817I鏈霉素Streptomycin10≤1112-14≥1512I喹諾酮類Quinolonesgroup環丙沙星Ciprofloxacin5≤1516-20≥2137S培氟沙星peflacin10≤2324-25≥2632S左氧氟沙星Levofloxacin5≤1314-16≥1733S吡哌酸Pipemidicacid30≤2122-28≥2930S氧氟沙星Ofloxacin5≤1213-15≥1634S諾氟沙星Norfloxacin10≤1213-16≥1735S氯霉素類Chloromycetinsgroup氯霉素Chloromycetin30≤1213-17≥1830S氟苯尼考Florfenicol30≤1213-17≥1829S林可霉素類Lincomycingroup林可霉素Lincolmensin2≤2324-30≥310R其它類抗生素Othersantibioticsgroup多粘霉素BPolymyxinB300≤89-11≥1212S利福平Rifampicin5≤1617-19≥2018I桿菌肽Bacitracin10≤89-12≥130R
S: Sensitive; I: Intermediate; R: Resistant.
維氏氣單胞菌(A.veronii)亦被稱為維羅納氣單胞菌,普遍存在于海水、淡水、污水和土壤中,是一種重要的人—畜—魚共患致病菌[18],在人免疫力低下時,維氏氣單胞菌可引發腹瀉、腦膜炎和敗血癥等病癥[19-20]。李偉杰等[21]報道了該菌能引起狐貍(Vulpesvulpes)腹瀉等疾病,嚴重的將致其死亡。維氏氣單胞菌也是對水產動物造成危害較大的病原菌,潘曉藝等[22]報道了該菌能引起青蝦(Macrobrachiumnipponense)掉肢、軟殼、肝胰腺發黃和肌肉水腫等癥狀,導致大量死亡。房海等[23]從瀕臨死亡的中華絨螯蟹(Eriocheirsinensis)肝胰臟中分離到該菌,病蟹體腔內積水,鰓暗灰色,肝胰腺呈淺黃等癥狀。團頭魴(Megalobramaamblycephala)、框鏡鯉(Cyprinuscarpio)、西伯利亞鱘(Acipenserbaerii)、斑點叉尾鮰(Ictalunespunctatus)等養殖魚類感染該菌后,主要表現潰瘍、出血和腹水等癥狀[18, 24-26]。此外,國內還有該菌引起大鯢(Andriasdavidianus)[27]和中華鱉(Trionyxsinensis)[28]感染死亡的研究報道。
維氏氣單胞菌致病機制較為復雜,目前研究表明該菌能產生黏附素、細胞毒素、腸毒素、氣溶素和溶血素等毒力因子,這些毒力因子相互作用在水產動物感染過程中起著重要作用[29]。因此研究病原菌的毒力基因在探討該菌致病機制尤為重要,據報道,Aer、Hly、OmpA、Aha為維氏氣單胞菌重要毒力基因,其中,氣溶素(Aer)可以使全身臟器廣泛出血,并破壞宿主細胞膜,導致細胞死亡,產生氣溶素是氣單胞菌具有致病性的重要標志之一[9,18];溶血素(Hly)是基因組DNA編碼的毒力因子,形成共聚后插入細胞膜上,形成管道,導致溶血[10];外膜蛋白(OmpA)在增強細菌粘附作用,維持外模結構、逃避宿主殺傷起到重要作用[30];黏附素(Aha)能促進細菌粘附、侵襲以及對宿主防御機能的抵抗[31]。總之,這些毒力基因在病原菌粘附、侵襲、增殖、抵抗機體防御和釋放毒素過程中有著重要作用,本研究從致病菌株YY01檢測到上述4種毒力基因,表明菌株YY01為較強致病菌株,這與人工感染試驗相佐證,且從分子生物學層面進一步確認分離到的病原菌為維氏氣單胞菌(A.veronii)。
藥敏試驗表明菌株YY01對β-內酰胺類中的頭孢他啶等7種抗生素、四環素等3種四環素類抗生素、呋喃唑酮等2種硝基呋喃類抗生素、對環丙沙星等6種喹諾酮類抗生素、對氯霉素等2種氯霉素類抗生素敏感;對紅霉素等3種大環內酯類抗生素、β-內酰胺類中的青霉素等4抗生素、對慶大霉素等5種氨基糖苷類抗生素耐藥,此結果為巖原鯉防治該病提供了科學依據。但藥敏試驗結果與從青蝦(M.nipponense)[22]、框鏡鯉(C.carpio)[24]、西伯利亞鱘(A.baerii)[25]和中華鱉(T.sinensis)[28]體內分離到的維氏氣單胞菌藥敏特性不盡相同,這可能是菌株不同來源、不同區域及抗生素藥物使用史等原因有關。因此在該病實際防治過程中,應該參照分離菌株的藥敏試驗結果,同時結合國家允許的漁用藥物準則(NY5071-2002,無公害食品、漁用藥物使用準則[S]),選擇最有效的藥物開展治療,謹防菌株抗藥性的產生。
[1] Zhu CK, Zhang QZ, Yuan J, et al. Analysis on genetic diversity of mitochondrial DNA D-loop region of rock carp (Procyprisrabaudi(Tchang)) in the Three Gorges Reservoir[J]. J Southwest Univ (Nat Sci Ed), 2008, 30(12): 126-133. DOI: 1673-9868(2008)12-0126-08 (in Chinese)
朱成科, 張其中, 袁娟, 等. 三峽水庫巖原鯉線粒體控制區遺傳多樣性分析[J]. 西南大學學報(自然科學版), 2008, 30(12): 126-133.
[2] Yue PQ, Chen YY. China red data book of endangered animals: Pisces[M]. Beijing: Science Press, 1998: 170-172. (in Chinese)
樂佩琪, 陳宜瑜. 中國瀕危動物紅皮書:魚類[M]. 北京: 科學出版社, 1998: 170-172.
[3] Tuo Y. Advances in research onProcyprisrabaudi(Tchang)[J]. Hubei Agr Sci, 2009, 48(11): 2878-2881. DOI: 10.14088/j. issn. 0439-8114. 2009. 11. 077(in Chinese)
庹云. 巖原鯉的研究概況和進展[J]. 湖北農業科學, 2009, 48(11): 2878-2881.
[4] Huang H, Li Z, Yang X, et al. Artificial propagation and fry rearing ofProcyprisrabaudi[J]. J Hydroecol, 2008, 28(1): 72-73. DOI: 10.15928/j. 1674-3075. 2008. 01. 028 (in Chinese)
黃輝, 李正友, 楊興, 等. 巖原鯉人工繁殖與苗種培育技術研究[J]. 水生態學雜志, 2008, 28(1): 72-73.
[5] Dong XZ, Cai MY. Manual of systematic and determinative bacteriology[M]. Beijing: Science Press. 2001: 114-115. (in Chinese)
東秀珠, 蔡妙英. 常見細菌系統鑒定手冊[M]. 北京: 科學出版社. 2001, 114-115.
[6] Buchannan RE, Gibbons NE. Berge’s manual of systematic bacteriology[M]. Beijing: Academic Press, 1992: 482-486. (in Chinese)
RE 布坎南, NE. 吉奉斯. 伯杰氏細菌鑒定手冊(第8版)[M]. 北京: 科學出版社, 1992, 482-486.
[7] Gao ZL, Ji X, Chen P, et al. Identification and antimicrobial resistance of pathogenicAeromonashydrophila[J]. Chin J Zoonoses, 2016, 32(4): 400-405. DOI: 10. 3969/j. issn. 1002-2694. 2016. 04. 016 (in Chinese)
高智玲, 紀雪, 陳萍, 等. 致病性嗜水氣單胞菌的分離鑒定及耐藥性分析[J]. 中國人獸共患病學報, 2016, 32(4): 400-405.
[8] Jeyaram K, Romi W, Singh TA, et al. Distinct differentiation of closely related species ofBacillussubtilisgroup with industrial importance[J]. J Microbiol Meth, 2011, 87(2): 161-164. DOI: 0. 1016/j. mimet. 2011. 08. 011
[9] Gao ZL, Ji X, Guo XJ, et al. Establishment and application of a duplex real-time fluorescence quantitative PCR assay for detection ofAeromonahydrophila[J]. Chin J Zoonoses, 2016, 32(12): 1126-1130. DOI: 10.3639/j. issn. 1002-2694. 2016. 012. 016
高智玲, 紀雪, 郭雪軍, 等. 嗜水氣單胞菌雙重熒光定量PCR檢測方法的建立與初步應用[J]. 中國人獸共患病學報, 2016, 32(12): 1126-1130.
[10] Shan X, Guo W, Wu T, et al. Cloning and bioinformatic analysis of hemolysin ofAeromonasveroniifromCyprinuscarpio[J]. Chin J Vet Med, 2011, 47(12): 22-24. DOI: 10. 3969/j. issn. 0529-6005. 2011. 12. 007 (in Chinese)
單曉楓, 吳同壘, 孟慶峰, 等. 框鏡鯉維氏氣單胞菌溶血素基因片段的克隆與序列分析[J]. 中國獸醫雜志, 2011, 47(12): 22-24.
[11] Hu J, Li AH, Hu CY, et al. Effects of temperature and pH on expression of virulence factors fromAeromonasHydrophila[J]. J Nanjing Univ Sci Technol, 2006, 30(3): 375-380. DOI: 10. 3969/j. issn. 1005-9830. 2006. 03. 030 (in Chinese)
胡靖, 李愛華, 胡成鈺, 等. 溫度和pH值對嗜水氣單胞菌毒力基因表達的影響[J]. 南京理工大學學報, 2006, 30(3): 375-380.
[12] Zou YX, Zhang PJ, Mo ZL, et al. Isolation and identification of the pathogenic bacteria fromScophthalmusmaximus[J]. High Technol Lett, 2004, 14(4): 89-93. DOI: 10. 3321/j. issn: 1002-0470. 2004. 04. 019 (in Chinese)
鄒玉霞, 張培軍, 莫照蘭, 等. 大菱鲆出血癥病原菌的分離和鑒定[J]. 高技術通訊, 2004, 14(4): 89-93.
[13] Pidiyar V, Kaznowski A, Narayan NB, et al.Aeromonasculicicolasp. Nov., from the midgut ofCulexquinquefasciatus[J]. Int J Syst Enol Microbiol, 2002, 52(5): 1723-1728. DOI: 10. 1099/00207713-52-5-1723
[14] Ma AM, Yan MC, Hu LH, et al. Identification of aVibriosplendidusstrain isolated from illSciaenopsocellatus[J]. Acta Microbiol Sinica, 2010, 50(4): 542-547. DOI: 10. 13343/j. cnki. wsxb. 2010. 04. 015 (in Chinese)
馬愛敏, 閆茂倉, 胡利華, 等. 患潰爛癥的眼斑擬石首魚分離的燦爛弧菌的鑒定[J]. 微生物學報, 2010, 50(4): 542-547.
[15] Shen LH, Kong QX, Sun JR, et al. Development and application of multi-PCR and SYBR Green I real-time ramification amplification method for detection ofLaribacerhongkongensis[J]. Chin J Zoonoses, 2015, 31(7): 659-668. DOI: 10: 3639/cjz. J. issn. 1002-2694. 2015. 07. 014 (in Chinese)
沈林海, 孔慶鑫, 孫建榮, 等. 香港海鷗形菌多重PCR及嵌合熒光PCR檢測方法的建立與應用[J]. 中國人獸共患病學報, 2015, 31(7): 659-668.
[16] Young JP, Downer HL, Eardly BD. Phylogeny of the phototrophic rhizobium strain BTAi1 by polymerase chain reaction-based sequencing of a 16S rRNA gene segment[J]. J Bacteriol, 1991, 173(7): 2271-2277. DOI: 0021-9193/072271-07502. 00/0
[17] Hao YJ, Han SZ. Application ofgyrBgene in bacterial phylogenetic analysis[J]. Biotechnol Bull, 2008, 2: 39-41. DOI: 10. 13560/j. cnki. 1985. 2008. 04. 039 (in Chinese)
郝云婕, 韓素貞.gyrB基因在細菌系統發育分析中的應用[J]. 生物技術通報, 2008, 2: 39-41.
[18] Zhang DX, Kang YH, Zhang HY, et al. Isolation,identification and drug susceptibility of the pathogenicAeromonasveroniifromMegalobramaamblycephala[J]. Chin Vet Sci, 2016, 46(10): 1300-1307. DOI: 10. 16656/ j. issn. 1673-4696. 2016. 10. 016 (in Chinese)
張冬星, 康元環, 張海月, 等. 團頭魴致病性維氏氣單胞菌的分離鑒定及耐藥性分析[J]. 中國獸醫科學, 2016, 46(10): 1300-1307.
[19] Fraisse T, Lechiche C, Sotto A, et al.Aeromonasspp. infections: retrospective study in Nzmes university hospital, 1997-2004[J]. Pathol Biol, 2008, 56(2): 70-76. DOI: 10. 1016/j. patbio. 2007. 12. 002
[20] Thomsen RN, Kristianse MM. Three cases of bacteraemia caused byAeromonasveroniibiovarsobria[J]. Scand J Inf Dis, 2001, 33(9): 718-719. DOI: 10.1080/00365540110027042[21] Li WJ, Zhao Y, Liu Y, et al. Isolation and identification of pathogenicAeromonasveroniifrom fox[J]. Chin J Prev Vet Med, 2012, 34(4): 290-292. DOI: 10. 3969/j. issn. 1008-0589. 2012. 04. 09 (in Chinese)
李偉杰, 趙耘, 劉燕, 等. 狐貍源致病性維氏氣單胞菌的分離鑒定及耐藥性分析[J]. 中國預防獸醫學報, 2012, 34(4): 290-292.
[22] Pan XY, Shen JY, Li JY, et al. Identification and biological characteristics of the pathogen causingMacrobrachiumnipponensesoft-shell syndrome[J]. Microbiol China, 2009, 36(10): 1571-1576. DOI: 10. 13344/j. microbiol. china. 2009. 10. 029 (in Chinese)
潘曉藝, 沈錦玉, 李建應, 等. 青蝦“軟殼綜合癥”病原及其特性[J]. 微生物學通報,2009, 36(10): 1571-1576.
[23] Fang H, Chen CZ, Zhang XJ, et al. Examination of the pathogenicAeromonasveroniiisolated from crabEriocheirsinensis[J]. Chin J Zoonoses, 2008, 24(1): 45-49. DOI: 10. 3969/j. issn. 1002-2694. 2008. 01. 012 (in Chinese)
房海, 陳翠珍, 張曉君, 等. 中華絨螯蟹病原維氏氣單胞菌的檢驗[J]. 中國人獸共患病學報,2008, 24(1): 45-49.
[24] Gong J, Gao SQ, Shan XF, et al. Isolation and identification of pathogenicAeromonasveroniifromCyprinuscarpio[J]. Chin J Prev Vet Med, 2010, 32(12): 981-983. DOI: 10. 3969/j. issn. 1008-0589. 2010. 12. 18 (in Chinese)
龔倩, 高淑琴, 單曉楓, 等[J]. 框鏡鯉致病性維氏氣單胞菌的分離鑒定[J]. 中國預防獸醫學報, 2010, 32(12): 981-983.
[25] Ma ZH, Yang H, Li TL, et al. Isolation and identification of pathogenicAeromonasveroniiisolated from infected Siberian sturgeon (Acipenserbaerii)[J]. Acta Mivrobiol Sinica, 2009, 49(10): 1289-1294. DOI: 10. 3321/j. issn. 0001-6209. 2009. 10. 017 (in Chinese)
馬志宏, 楊慧, 李鐵梁, 等. 西伯利亞鱘(Acipenserbaerii)致病性維氏氣單胞菌的分離鑒定[J]. 微生物學報, 2009, 49(10): 1289-1294.
[26] Huang XL, Wu CY, Deng YQ, et al. Pathophysiological observation ofIctaluruspunctatusinfected withAeromonasveronii[J]. Chin Vet Sci, 2010, 40(07): 738-742. DOI: 1673-4696 (2010) 07-0738-05 (in Chinese)
黃小麗, 吳春艷, 鄧永強, 等. 斑點叉尾鮰維氏氣單胞菌病的病理組織學觀察[J]. 中國獸醫科學, 2010, 40(07): 738-742.
[27] Wang X, Yan QG, Lei Y, et al. Isolation and identification on pathogenic bacteria of ‘‘rotten skin’’ disease in Chinese giant salamander (Andriasdavidianus)[J]. Chin J Zoonoses, 2010, 26(10): 944-948. DOI: 10. 3969/j. issn. 1002-2694. 2010. 10. 015 (in Chinese)
王旭, 顏其貴, 雷燕, 等. 中國大鯢腐皮病病原菌的分離與鑒定[J]. 中國人獸共患病學報, 2010, 26(10): 944-948.
[28] Shen WY, Li WF, Gao Y. Isolation and drug sensitivity study of pathogenic bacteriaAeromonasveroniifrom soft-shelled turtle,Trionyxsinensis[J]. Acta Hydrobiol Sinica, 2010, 34(5): 1060-1064. DOI: 10. 3724/SP. J. 1035. 2010. 01060 (in Chinese)
沈文英, 李衛芬, 高研. 中華鱉病原性維隆氣單胞菌的分離及藥敏試驗[J]. 水生生物學報, 2010, 34(5): 1060-1064.
[29] Li YX, Liu YC, Zhou Z, et al. Complete genome sequence ofAeromonasveroniistrain B565[J]. J Bacteriol, 2011, 193(13): 3389-3390. DOI:10. 1128/JB. 00347-11
[30] Dan XF, Guo WS, Wu TL, et al. Cloning and bioinformatic analysis of outer membrane protein gene AI ofAeromonasveroniiCY0806 fromCyprinuscarpio[J]. Chin J Vet Med, 2011, 47(10): 3-6. DOI: 1002-1280(2011)10-0003-04 (in Chinese)
單曉楓, 郭偉生, 吳同壘, 等. 框鏡鯉維氏氣單胞菌CY0806株OMPA I基因的克隆及生物信息學分析[J]. 中國獸醫雜志, 2011, 47(10): 3-6.
[31] Khushiramani RM, Maiti B, Shekar M, et al. RecombinantAeromonashydrophilaouter membrane protein 48 (Omp48) induces a protective immune response againstAeromonashydrophilaandEdwardsiellatarda[J]. Res Microbiol, 2012, 163(4): 286-291. DOI: 10. 1016/j. resmic. 2012. 03. 001
Identification of a pathogenicAeromonasveroniiisolated from rock carp,Procyprisrabaudi
ZHU Cheng-ke1, LIU Gui-jia1, ZHANG Zheng-shi1, PU De-cheng2, ZHU Long1,ZHOU Chao-wei1, LEI Luo1, ZHENG Zong-lin1
(1.DepartmentofFisheriesinRongchangCampus,SouthwestUniversity,Chongqing402460,China;2.AgricultureCommitteeofWuxi,Chongqing405899,China)
In June 2016, a disease among the cultured rock carp (Procyprisrabaudi) in Yongchuan of Chongqing Municipality occurred. The aim of this study was to investigate biological characteristics and provide reference forAeromonasveroniiidentification diagnosis and treatment. Pathogenic bacteria strain YY01 from the dying fishes were examined and isolated. Strain YY01’s taxonomic status was identified by observing the morphology, studying the physiological and biochemical characters and sequencing the 16S rRNA and housekeeping genegyrB. Its pathogenicity was checked by artificial infection experiment and virulence genes. Furthermore, effective medicine was detected by drug sensitivity. The 16S rRNA andgyrBgene sequence of the strain YY01 was more than 99% homology with that ofAeromonasveronii, suggesting that the pathogen wasAeromonasveronii, which was also identified by the results of biochemical analysis. The LD50of strain YY01 to rcok carp was 5.06×104CFU/g. Four virulence genes were detected from YY01, including aerolysin (aer), hemolysin (Hly), Outer Membrane Protein Gene A (OmpA) and adhesion (Aha) genes. Antibiotic sensitivity assays showed that among 40 antibiotics tested, 22 were sensitive and 11 were resistant. In conclusion, the strain YY01 is identified asAeromonasveroniiand it is proved to have strong pathogenicity.
Aeromonasveronii;Procyprisrabaudi; pathogenity; antibiotic susceptibility test
10.3969/j.issn.1002-2694.2017.06.011
鄭宗林,Email: zhengzonglin@126.com
1.西南大學榮昌校區水產系,重慶402460; 2.巫溪縣農業委員會,重慶405899
R378
A
1002-2694(2017)06-0527-09
2017-02-27 編輯:李友松
重慶市生態漁業技術體系建設專項資金(No.40800115,40800216)和西南大學榮昌校區青年基金(No.20700913)聯合資助

