川西高寒森林溪流好氧不產氧光合細菌多樣性
黃春萍,吳福忠,楊萬勤,岳 楷,張 川,張 健*(.四川農業大學生態林業研究所,林業生態工程重點實驗室,四川 成都 630;2.四川師范大學生命科學學院,四川 成都 60068)
川西高寒森林溪流好氧不產氧光合細菌多樣性
黃春萍1,2,吳福忠1,楊萬勤1,岳 楷1,張 川1,張 健1*(1.四川農業大學生態林業研究所,林業生態工程重點實驗室,四川 成都 611130;2.四川師范大學生命科學學院,四川 成都 610068)
為了探明好氧不產氧光合菌(AAPB)在川西高寒森林溪流極端環境中的生態分布和群落結構及其環境影響因子,本實驗結合同步溫度動態和水環境特征監測,采用實時熒光定量PCR和克隆文庫的方法,檢測了川西高寒森林溪流季節性凍融循環3個關鍵時期(凍結前期、深凍期和融化期)AAPB的豐度和多樣性變化及其與環境因子之間的相關性.結果表明:AAPB豐度在凍結前期非常低,僅(2.80±0.19)×104bp/mL;深凍期迅速增加到(4.65±0.30)×104bp/mL;融化期達到(5.79±0.19)×104bp/mL.系統發育分析顯示,凍結前期AAPB類群主要為α-變形菌綱細菌;而深凍期和融化期以β-變形菌綱細菌占據主要地位.相關性分析表明,在季節性凍融循環過程中,葉綠素a、可溶性有機碳和溫度是AAPB菌群豐度和多樣性的主要影響因子.實驗結果表明冬季的川西高寒森林溪流中,AAPB類群的豐度低,但是它們高度動態變化,并且與其他淡水環境中的該類群的同源性低.
好氧不產氧光合菌;豐度和多樣性;高寒森林溪流;季節性凍融循環
好氧不產氧光合菌(AAPB)是一類含有細菌葉綠素 a,且能同時進行光合代謝和有機物質代謝吸收能量的原核生物[1-2].海洋中的AAPB已經被深入研究,這類原核生物在自然環境中占據著廣泛的生態位[2-5].然而,淡水環境中的這一類群被關注的相對較少[6-7].另一方面,AAPB的豐度只維持極小的比例,并在不同的環境中差異極大[8-9]. AAPB具有靈活的代謝活性, 并廣泛分布在水體透光層,AAPB在水生食物鏈和整個生物地球化學循環過程中具有十分重要的作用[10].已有研究表明,絕大多數的AAPB都歸屬于α-、β-和 γ-變形菌綱,并且在不同的環境中,α-或者 γ-變形菌綱占據群落優勢地位,群落結構組成也隨著不同的生態環境而發生變化[11].但是,在極端的高寒森林溪流環境中相關研究比較匱乏.
光、可溶性有機碳(DOC)、鹽、硝態氮和氨等,都可能影響水體中AAPB的分布、豐度和群落組成[10-11].在河口和海洋中的研究結果表明AAPB與葉綠素a的含量呈顯著正相關性[12].同時,基于pufM基因對AAPB季節性變化的研究結果表明,AAPB會受到環境因子、溫度、DOC、葉綠素 a以及光照的深刻影響從而表現出高度的季節性動態特征[13].但是,在溫帶的高寒森林中,關于環境因子對AAPB類群的組成結構及多樣性的調控研究非常缺乏,致使對AAPB這一類群在高寒森林溪流環境中的分布、豐度、活性及其季節性動態的理解也變得薄弱.
川西高山/亞高山森林地處青藏高原東緣和長江上游地區,是長江流域的水源涵養地,為全球氣候變化最敏感的區域之一[14],她也是長江流域最重要的“水塔”,在水源涵養、指示全球氣候變化、生物多樣性保育等方面具有十分重要且不可替代的作用和地位,其結構和功能直接關系到岷江流域乃至整個長江上游的生態安全[15].課題組在研究區域海拔3600~3700m典型高寒森林范圍內,沿主河道兩岸一共找到 18條森林溪流匯入其中[16],這些不同性質的溪流將森林、河岸和河流(湖泊)連接成為一個巨大的水源涵養體.這些溪流作為開放的生態系統并且廣泛分布,鮮有人為干擾,低鹽寡營養、低溫以及具有高寒森林典型的特點,包括從冬季雪被的完全覆蓋到夏季高輻射強度的季節性變化.本文結合同步溫度動態和水環境特征監測,采用實時熒光定量PCR和克隆文庫的方法檢測了川西高寒森林溪流冬季凍融循環3個關鍵時期(凍結前期、深凍期和融化期)AAPB的豐度、結構組成和多樣性及其季節性變化,探究影響AAPB群落結構季節性變化的主要環境因子,以期為深入研究全球氣候變暖下,高寒森林溪流環境對微生物群落的影響,理解氣候變暖情景下高寒森林生態系統的區域響應提供一定科學理論依據.
1 材料和方法
1.1 研究區域概況
研究區域位于四川省理縣畢棚溝高山森林生 態 系統 定 位站(31°14′~31°19′N,102°53′~102°57′E,海拔 2458~4619m),地處青藏高原東緣與四川盆地的過渡帶.區域氣候屬丹巴-松潘半濕潤氣候,隨著海拔上升,氣候呈現暖溫帶、溫帶、寒溫帶、亞寒帶和冰凍帶的垂直分布規律.該區域年降水量隨著海拔高度的變化而變化,大約為801~850mm,降雨主要分布在 6~9月,年均氣溫2~4℃,最高氣溫(7月)23℃,最低氣溫(1月)-18℃.研究區域土壤季節性凍結期為每年 11月初~次年4月中旬,且季節性凍融期長達5~6個月,凍融作用明顯.區域集水區系岷江上游的雜谷腦河第二大支流梭羅溝的支流,集水區面積 179km2,河長31km,年平均流量3.7m3/s.高寒森林由四川紅杉和方枝柏構成冠層優勢物種;康定柳和高山杜鵑構成了高寒森林河岸優勢植物[14,16-17].
1.2 樣品采集
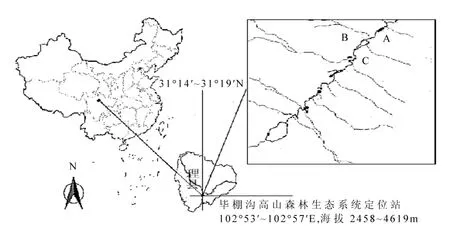
圖1 研究樣地溪流采樣位點(A, B和C)Fig.1 A pattern diagram showing the experimental streams (A, B and C) in the study site
基于前期調查的結果[26],本實驗在研究區域內沿主河道海拔 3582m 的位置選擇3條典型的高寒森林溪流作為重復采樣位點(圖 1).分別于2013年12月23日(凍結前期)、2014年3月10日(深凍期)和2014年4月23日(融化期)在各采樣點用滅菌的安剖瓶采集表層10~20cm的溪流水,低溫保存帶回實驗室.在每次采樣時即時測定采樣點水樣pH值和流速,并且在各采樣點放置1個紐扣式溫度計,同步記錄采樣點水溫每兩小時變化情況(圖2).

圖2 2013-11-13~2014-04-30高寒森林溪流和大氣溫度動態Fig.2 Temperature dynamics of the stream and the atmosphere in the alpine fir forest from Nom 13, 2013 to Aug 30, 2014)
1.3 樣品分析
將各水樣500mL用0.22μm的微孔濾膜過濾,濾液采用雙指示劑中和法測定碳酸氫根(HCO32)含量,紫外分光光度法測定磷酸根(PO43)含量,離子色譜測定銨態氮(NH4+N)和硝態氮(NO3N),multi N/C 2100, analytikjena測定水溶性有機碳(DOC)等[18],結果見表1.

表1 采樣期溪流水特征、AAPB pufM基因豐度及pufM基因所占細菌16S rRNA基因的比例Table 1 Stream water physicochemical characteristics, AAPB puf M gene numbers and % pufM gene of bacterial 16S rRNA gene in the researched area during each sampling time
濾膜采用-80℃冷凍干燥[19],一部分按照文獻[20-21]的方法,采用高效液相色譜法檢測葉綠素a和細菌葉綠素 a的含量.為了保證色素不被光降解,樣品均在暗光條件下處理[21],在采樣期內均未檢測到細菌葉綠素a,結果見表1.
另一部分濾膜參照文獻[22]的方法對總DNA進行提取與純化.AAPB pufM 基因引物為pufM-557F (5-TACGGSAACCTGTWCTAC-3)/ pufM-750R (5-CCATSGTCCAGCGCCAGAA-3),細菌 16S rRNA 基因引物為 338f (5-CCTACGGGAGGCAGCAG-3)/518r(5-ATTACCGCGGCTGCTGG-3)[2,6,23].采用經過瓊脂糖凝膠電泳回收純化后的總DNA 10~100ng作模板,進行PCR擴增.擴增得到的pufM基因產物純化后與pUC19載體進行連接,連接產物轉化感受態細胞DH5α,在含有Ampicillin、IPTG和X-Gal的LB瓊脂平板培養基上37℃培養24h,挑選陽性克隆.共創建 3個 pufM 基因克隆文庫(S-FP、S-FPD和S-TP).用M13-47和RV-M引物對進行菌落PCR擴增后,選取陽性克隆并提取質粒供qPCR反應的標準曲線使用.質粒濃度采用ScanDrop100超微量核酸蛋白測定儀測定,然后分別進行10倍梯度系列稀釋以作為定量PCR擴增的標準品進行擴增,根據所得標準曲線計算得出樣品中的基因拷貝數,最后以每克樣品(干重)中的基因拷貝數為單位進行分析.PCR反應效率和標準曲線的相關系數分別為:細菌,107.5%和r2= 0.998; AAPB,103.3%和r2= 0.995.
1.4 數據處理與分析
測序結果采用DNAstar和Cluster軟件進行序列分析,下載最相似的菌株序列作為系統發育樹的參考序列.采用 MEGA軟件,Neighborjoining法構建系統發育樹,自展數為 1000.克隆文庫的 Shannon-Weaver等指數采用 PAST program基于OTU水平計算.基因豐度和多樣性指數采用SPSS 19.0統計軟件進行單因素方差分析(ANOVA),多重比較采用最小顯著差異法(LSD),AAPB多樣性和基因豐度與環境因子的相關關系采用Pearson法分析,AAPB群落與理化因子的冗余分析(RDA)采用Canoco for Windows 4.5軟件.數據整理、計算與作圖均采用Microsoft Excel 2013軟件.測序所得的基因序列在GenBank中的登錄號為KT279202 ~KT279344.
2 結果與分析
2.1 AAPB pufM基因豐度
熒光定量PCR結果顯示,冬季不同凍融時期的溪流水中均檢測到 AAPB pufM基因.從凍結前期到融化期,AAPB pufM基因豐度呈顯著增加趨勢,凍結前期、深凍期和融化期每毫升溪流水中的拷貝數分別為(2.80±0.19)×104、(4.65±0.30)× 104和(5.79±0.19)×104;各個時期AAPB pufM基因所占細菌16S rRNA基因的比例則表現出先降低再升高的趨勢,3個時期分別為 1.625%、1.562%和1.630%(表1).
2.2 AAPB pufM 基因多樣性

表2 不同克隆文庫pufM 基因多樣性Table 2 Diversity of pufM gene in different clone libraries
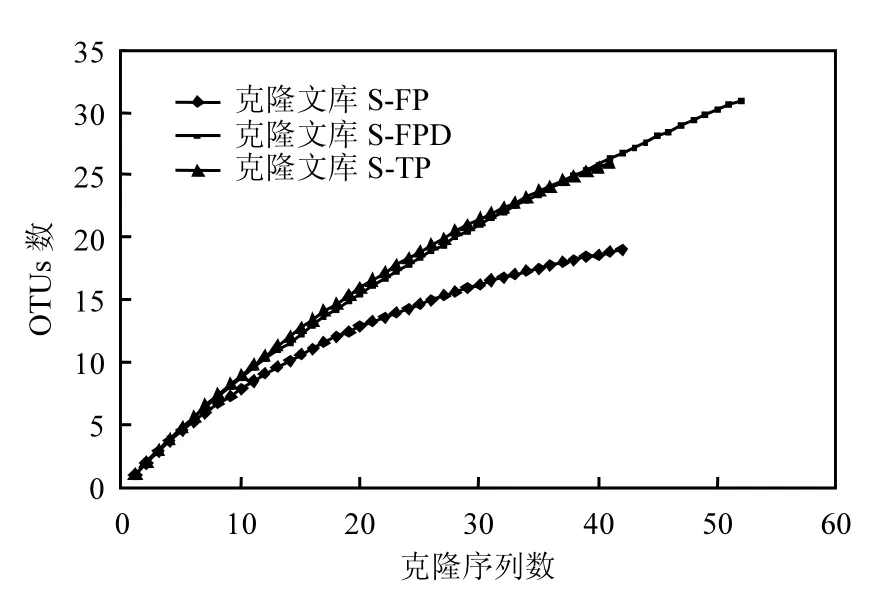
圖3 AAPB pufM基因克隆文庫稀釋曲線Fig.3 Rarefaction curve analysis of the AAPB pufM genes
采用克隆文庫的方法檢測了 3個不同時期的AAPB群落結構,構建了3個克隆文庫(S-FP、S-FPD和S-TP).總共獲得了143 條pufM 基因序列用于系統發育分析,其中S-FP 49條,S-FPD 53條,S-TP 41條.這些條帶在各自庫中的覆蓋度分別為 S-FP 83.67%,S-FPD 60.38%及 S-TP 63.41%(表2).稀釋曲線(圖3)顯示3個克隆文庫并未飽和,說明在 3個關鍵時期依然存在更豐度的AAPB物種.基于Zeng等的研究,pufM基因序列以cutoff = 0.06和0.15分別在種和屬水平進行同源性和系統發育分析[24],本實驗將得到的 143條序列,以cutoff = 0.06分為78個OTUs,主要歸屬于 α-變形菌綱(18 OTUs,占所有序列的23.68%)和 β-變形菌綱(19 OTUs,占所有序列的24.36%)(圖 4).α-變形菌綱主要包括紅假單胞菌屬(Rhodopseudomonas sp.)、 甲基桿菌 屬(Methylobacterium sp.)和 玫 瑰 桿 菌 屬(Roseobacter sp.)的細菌,而 β-變形菌綱主要包括紅長命菌屬(Rubrivivax sp.)、纖毛菌屬(Leptothrix sp.)和3個其他類群的細菌.另外,還有7個OTUs屬于γ-變形菌綱.通過分析3個克隆文庫,從凍結前期到融化期,占優勢地位的 AAPB類群發生一定的改變,凍結前期以 α-變形菌綱為主要類群,而β-變形菌綱在深凍期和融化期占據優勢地位.
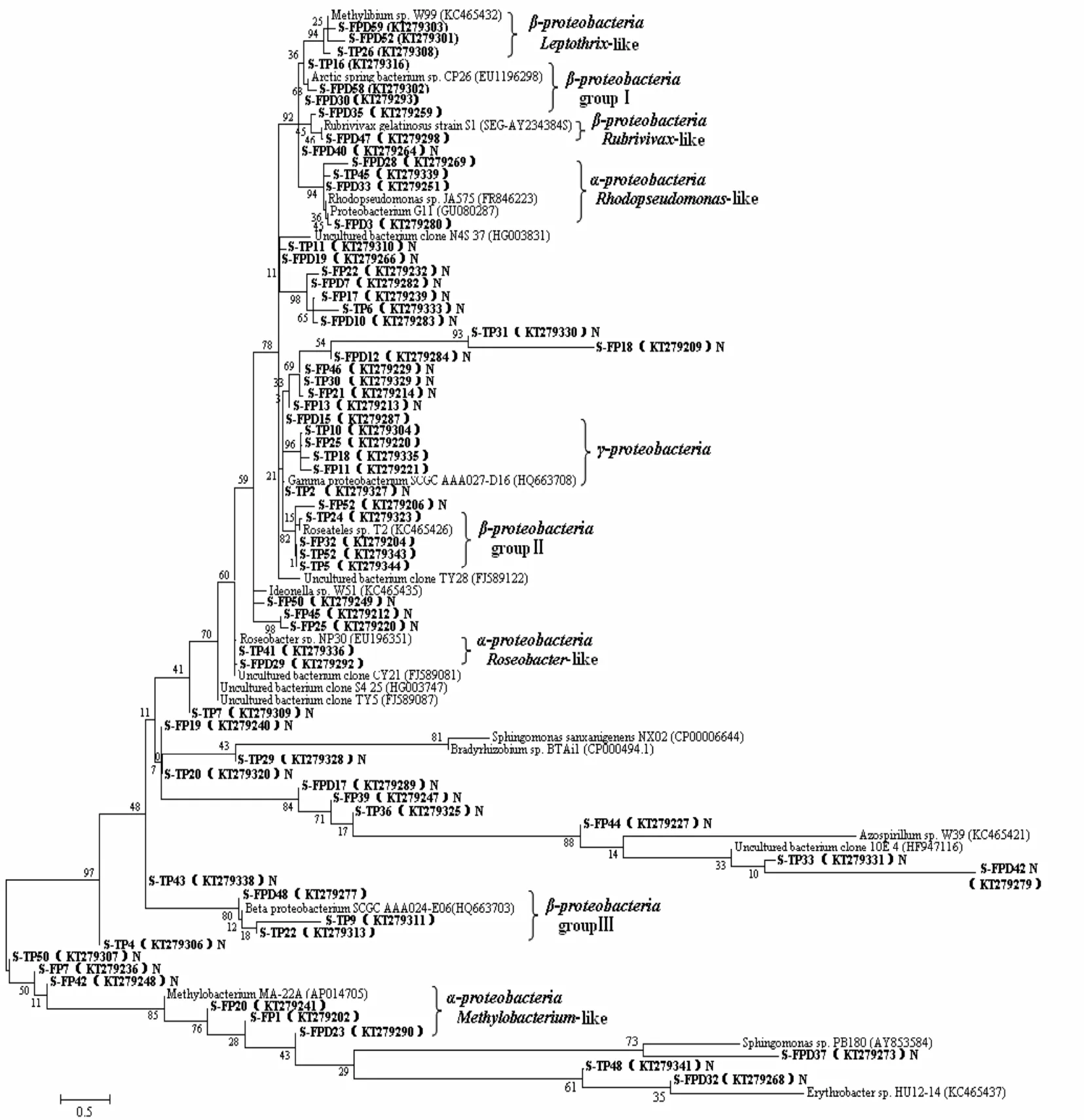
圖4 AAPB pufM基因序列系統發育分析Fig.4 Phylogenetic relationship (neighbor-joining tree ) of pufM gene clone sequences
2.3 AAPB群落結構與環境因子的相關性
為了解環境因子對AAPB的影響,對AAPB豐度及其群落結構與環境因子之間的相關性進行了分析,結果見表3.AAPB pufM基因豐度分別與細菌16S rRNA基因豐度,葉綠素a和溫度呈極顯著的正相關性(P<0.01),且與DOC呈顯著正相關性(P<0.05),將環境因子與 AAPB群落結構進行冗余分析(RDA)(圖 5),結果顯示葉綠素 a、溫度和DOC與α-變形菌綱細菌、β-變形菌綱細菌及一些未知細菌類群關系密切,呈正相關性;而葉綠素a、溫度和DOC均與γ-變形菌綱細菌呈負相關性.γ-變形菌綱細菌受到水流流速、銨態氮含量、硝態氮含量、碳酸氫根含量、磷酸根含量及 pH值的深刻影響,均呈正相關性.同時這些因子均與 α-變形菌綱細菌、β-變形菌綱細菌及未知的細菌類群呈負相關性.另外,所檢測的環境因子與AAPB的Shannon-Wiener多樣性指數呈正相關性.

表3 AAPB pufM基因豐度、細菌16S rRNA基因豐度與環境因子之間的相關性分析Table 3 Pearson’s correlation analyses among the abundance of bacteria 16S rRNA gene and AAPB pufM gene, and environmental variables

圖5 環境因子與AAPB群落結構的RDA排序Fig.5 RDA ordination diagrams showing correspondence between AAPB community structures and environmental variables
3 討論
AAPB群落結構及其動態對微生物生態學過程十分重要,海洋和河口環境中AAPB類群的系統發育,結構組成及其與環境之間的關系都有深入的研究[12].但是,溫帶高寒森林溪流生境中這類菌群的研究相對較少[13].因此,本研究對冬季凍融時期高寒森林溪流 AAPB的豐度和結構動態的深入理解具有十分重要的生態學意義.
冬季土壤凍融循環的3個關鍵時期,川西高寒森林溪流中均檢測到 AAPB,其豐度較低并呈動態變化,豐度值在已有研究的范圍內[13].凍融循環是高寒森林生態系統關鍵的季節性轉變時期[14,17],其凍融特征的差異使得微生物結構存在顯著的變化.AAPB豐度從凍結前期到融化期呈增加趨勢,而其所占細菌豐度的比例卻先降低后增長,這些結果反映了AAPB這一類群與其他微生物類群不同的季節性模式和作用,以及與其他生理類群的細菌不同的環境響應.這可能是因為AAPB個體和基因組都較普通細菌個體大,這使得它們需要更多的生存能量[25],因此在寡營養的高寒森林溪流中,相對于普通細菌,盡管AAPB能通過光合作用獲得能量,卻沒有競爭優勢.
已有研究認為光照、營養物質、溫度和葉綠素a可能是調控AAPB豐度的主要因子[10,13].本實驗結果表明溫度、葉綠素a和DOC是川西高寒森林溪流中AAPB時空分布的主要影響因子,它們強烈影響AAPB的豐度和結構,同時可溶性磷和流速也有一定程度的貢獻.與其它生境中的研究結果不同,川西高寒森林溪流中AAPB豐度與pH值、碳酸氫根、銨態氮和硝態氮呈負相關性.同時,AAPB豐度與溫度的相關性極強,這也與其它高山湖泊中的較弱相關性結果截然不同[5].自從被發現以來,AAPB的光合代謝方式在寡營養,尤其是低碳的環境中具有重要的競爭優勢[8],大部分的研究認為 AAPB在環境較好的條件下生長更好[3,6],但也有研究得到相反結果[12-13].本研究結果顯示川西高寒森林溪流中 AAPB豐度隨著葉綠素a和DOC的增加而增加,均呈極顯著正相關性(P<0.01),這與寡營養高山湖泊和海洋中DOC是調控AAPB豐度的主要因子之一的研究結果一致[26].同時可以推測,在寡營養的高寒森林溪流中,光合作用相關基因的表達并不活躍,但是營養物質濃度參與決定了pufM基因攜帶者的存在和豐度.比如,本研究中AAPB的豐度比富營養化的太湖中AAPB的豐度低3個數量級[27].
本研究中 AAPB的群落結構多樣性也與淡水環境中的相關研究結果有差異[5].稀釋曲線顯示所構建的克隆文庫并不完全飽和,而且各個時期 OTUs的精確數量可能被低估,但是實驗結果依然可以表明各個時期pufM基因的高度多樣性.同時 Shannon-Weaver指數(2.48-3.17)也表現出較其它環境中高的特點,甚至比烏梁素海Shannon-Weaver指數還高[28].系統發育分析結果顯示AAPB豐富的遺傳結構組成除了α-變形菌綱的紅假單胞菌屬、甲基桿菌屬、玫瑰桿菌屬,β-變形菌綱的紅長命菌屬和纖毛菌屬及 γ-變形菌綱的一些類群外,還有一些與 Arctic spring bacterium sp.和Roseateles sp.同源性較高的類群.甚至還有許多未知的AAPB類群,它們在系統發育分析中組成另一支,并未與參考序列混淆,這表明了川西高寒森林溪流中可能蘊藏著攜帶pufM基因的新的微生物資源.已有大量研究表明β-變形菌綱是淡水生境中的優勢 AAPB類群[7],但是本研究發現,β-變形菌綱并不總是在川西高寒森林溪流環境中占據優勢地位,α-變形菌綱的優勢地位在冬季凍結前期較β-變形菌綱更突出,只是隨著時間的推移以及環境因子的變化,這種優勢地位開始下降.另一方面,與海洋環境聯系緊密的γ-變形菌綱在川西高寒森林溪流中也被檢測到.但是,被認為在高山湖泊和河流中廣泛分布的紅育菌屬(Rhodoferax sp.)和鞘氨醇單胞菌屬(Sphingomonas sp.),卻沒有被檢測到.這可能與溫度有關,也可能是由于溪流環境冬季紫外輻射較低的原因[7,9].
4 結論
4.1 川西高寒森林冬季溪流中AAPB豐度較低,在凍融循環凍結前期僅(2.80±0.19)×104bp/mL;深凍期迅速增加到(4.65±0.30)×104bp/mL;融化期達到(5.79±0.19)×104bp/mL.同時,AAPB 群落結構多樣性豐富且高度動態變化,凍融循環凍結前期α-變形菌綱細菌為 AAPB 優勢類群,而深凍期和融化期則由β-變形菌綱細菌占據優勢地位.
4.2 環境因子共同調控著AAPB的豐度、多樣性及其群落結構.其中,葉綠素 a、可溶性有機碳和溫度是主要的調控因子,并正調控α-變形菌綱和β-變形菌綱,負調控γ-變形菌綱.
[1]Boeuf D, Humily F, Jeanthon C. Diversity of Arctic Pelagic Prokaryotes with an emphasis on photoheterotrophic bacteria: a review [J]. Biogeosciences Discussions, 2014,11(2):2419—455.
[2]Béjà O, Suzuki M T, Heldelberg J F, et al. Unsuspected diversity among marine aerobic anoxygenic phototrophs [J]. Nature, 2002, 415:630—633.
[3]Kolber Z S, Plumley F G, Lang A S, et al. Contribution of aerobic photoheterotrophic bacteria to the carbon cycle in the ocean [J]. Science, 2001,292:2492—2495.
[4]Kalashnikov A M, Gaisin V A, Sukhacheva M V. Anoxygenic phototrophic bacteria from microbial communities of Goryachinsk thermal spring (Baikal Area, Russia) [J]. Microbiology, 2014,83(4):407—421.
[5]Ma?ín M, Nedoma J, Pechar L, et al. Distribution of aerobic anoxygenic phototrophs in temperate freshwater systems [J]. Environmental Microbiology, 2008,10:1988—1996.
[6]Joan C, Emilio O C. Environmental controls and composition ofanoxygenic photoheterotrophs in ultraoligotrophic high-altitude lakes (Central Pyrenees) [J]. Environmental Microbiology Reports, 2004,6(2):145—151.
[7]Salka I, Cuperova Z, Ma?ín M, et al. Rhodoferax-related pufM gene cluster dominates the aerobic anoxygenic phototrophic communities in German freshwater lakes [J]. Environmental Microbiology, 2011,13:2865—2875.
[8]Kolber Z S, Van Dover C L, Niederman R A, et al. Bacterial photosynthesis in surface waters of the open ocean [J]. Nature, 2000,407:177—179.
[9]Waidner L A, Kirchman D L. Aerobic anoxygenic photosynthesis genes and operons in uncultured bacteria in the Delaware River [J]. Environmental Microbiology, 2005,7:1896—1908.
[10]Monica R S, Matthew T C, David L K. Leucine incorporation by aerobic anoxygenic phototrophic bacteria in the Delaware estuary [J]. International Society for Microbial Ecology, 2014,8:2339—2348.
[11]Jeanthon C, Boeuf D, Dahan O, et al. Diversity of cultivated and metabolically active aerobic anoxygenic phototrophic bacteria along an oligotrophic gradient in the Mediterranean Sea [J]. Biogeoscience, 2011,8:1955—1970.
[12]Lehours A C, Cottrell M T, Dahan O, et al. Summer distributionand diversity of aerobic anoxygenic phototrophic bacteria in the Mediterranean Sea in relation to environmental variables [J]. FEMS Microbiology Letters, 2010,74:397—409.
[13]Ferrera I, Borrego C M, Salazar G, et al. Marked seasonality of aerobic anoxygenic phototrophic bacteria in the coastal NW Mediterranean Sea as revealed by cell abundance, pigment concentration and pyrosequencing of pufM gene [J]. Environmental Microbiology, 2014,16(9):2953—2965.
[14]岳 楷,楊萬勤,彭 艷,等.高寒森林溪流對凋落葉分解過程中木質素降解的影響 [J]. 植物生態學報, 2016,40(9):893—901.
[15]何奕忻,吳 寧,朱求安,等.青藏高原東北部5000年來氣候變化與若爾蓋濕地歷史生態學研究進展 [J]. 生態學報, 2014,34(7):1615—1625.
[16]李 俊,吳福忠,楊萬勤,等.長江上游高山森林小溪流磷輸出及其匯流特征 [J]. 環境科學學報, 2015,35(4):1136—1142.
[17]He W, Wu F Z, Zhang D J, et al. The effects of forest gaps on cellulose degradation in the foliar litter of two shrub species in an alpine fir forest [J]. Plant and Soil, 2015,393(1):109—122.
[18]Chon K, Sarp S, Lee S, et al. Evaluation of a membrane bioreactor and nanofiltration for municipal waste water reclamation: Trace contaminant control and fouling mitigation [J]. Desalination, 2011,272(1):128—134.
[19]白 潔,劉小沙,侯 瑞,等.南海南部海域浮游細菌群落特征及影響因素研究 [J]. 中國環境科學, 2014,34(11):2950—2957.
[20]Mantoura R F C, Llewellyn C A. The rapid determination of algal chlorophyll and carotenoid pigments and their breakdown products in natural waters by reverse-phase high performance liquid chromatography [J]. Analytica Chimica Acta, 1983,151:297—314.
[21]Ruivo M, Cartaxana P, Cardoso M I, et al. Extraction and quantification of pigments in aerobic anoxygenic phototrophic bacteria [J]. Limnology and Oceanography: Methods, 2014,12:338—350.
[22]Wang A, Wu F Z, Yang W Q, et al. Abundance and composition dynamics of soil ammonia-oxidizing archaea in an alpine fir forest on the eastern Tibetan Plateau of China [J]. Canadian Journal of Microbiology, 2012,58:572—580.
[23]Bakkea I, Schryverb P De, Boonb N, et al. PCR-based community structure studies of Bacteria associated with eukaryotic organisms: A simple PCR strategy to avoid co-amplification of eukaryotic DNA [J]. Journal of Microbiological Methods, 2011,84(2):349—351.
[24]Zeng Y H, Chen X H, Jiao N Z. Genetic diversity assessment of anoxygenic photosynthetic bacteria by distance based grouping analysis of pufM sequences [J]. Letters in Applied Microbiology, 2007,45(6):639?645.
[25]Sieracki M E, Gilg I C, Thier E C, et al. Distribution of planktonic aerobic anoxygenic photoheterotrophic bacteria in the northwest Atlantic [J]. Limnology and Oceanography, 2006,51(1):38—46.
[26]張 瑤.海洋典型功能細菌群的生態過程研究 [D]. 廈門:廈門大學, 2006.
[27]Shi L M, Cai Y F, Chen Z T, et al. Diversity and abundance of aerobic anoxygenic phototrophic bacteria in two cyanobacterial bloom-forming lakes in China [J]. Annales De Limnologie-International Journal of Limnology, 2010,46:233—239.
[28]何一平.基于 pufM 基因的烏梁素海好氧不產氧光合細菌系統發育多樣性分析 [D]. 呼和浩特:內蒙古大學, 2010.
The diversity of aerobic anoxygenic phototrophic bacteria in a high-frigid forest stream of West Sichuan
HUANGChun-ping1,2, WU Fu-zhong1, YANG Wan-qin1, YUE Kai1, ZHANG Chuan1, ZHANG Jian1*(1.Key laboratory of Ecological Forestry Engineering of Sichuan Province, Institute of Ecology & Forest, Sichuan Agricultural University, Chengdu 611130, China;2.College of life science, Sichuan Normal University, Chengdu 610101, China). China Environmental Science, 2017,37(6):2332~2339
In order to understand AAPB community structure and distribution in a high-frigid forest stream with cold environment, here, a field investigation was carried out in West Sichuan, China. Water was sampled in the stream at onset of the freezing period (FP), the deep freezing period (FPD) and the thawing period (TP). The methods of real-time fluorescent quantitative PCR and clone library were used to check the richness and diversity of AAPB. Temperature and other water characters were also observed to analysis the relationships between environment and AAPB. The results showed that low abundance (2.80 ± 0.19) ×104bp / mL of AAPB was observed, at FP, but which rapidly increased to (4.65 ± 0.30) ×104bp / mL at FPD, then reached to (5.79 ± 0.19) ×104bp / mL at TP. Phylogenetic relationships from clone libraries displayed that Alphaproteobacteria classes dominated AAPB at FP, but Betaproteobacteria classes dominated AAPB at both FPD and TP. In addition, correlationships revealed that the concentration of chlorophyll a and dissolved organic carbon, as well as average temperature had closely relationships with AAPB abundance and diversity during the seasonal freeze-thaw period. All the results suggest that AAPB have low abundance but exhibit highly dynamical patters in the high-frigid forest streams and their communities share low homology with those in other freshwater.
aerobic anoxygenic phototrophic bacteria (AAPB);abundance and diversity;high-frigid forest stream;seasonal freeze-thaw cycle
X172
A
1000-6923(2017)06-2332-08
黃春萍(1980-),女,四川樂山人,副教授,博士,主要從事微生物生態學和環境微生物學方向研究.發表論文20余篇.
2016-11-10
國家自然科學基金資助項目(31500358,31570445, 31570601)
* 責任作者, 教授, sicauzhangjian@163.com

