循環牽張應力下BMSCs非接觸共培養對人退變纖維環細胞增殖及蛋白表達的影響
李爽,孫曉雷,馬信龍△,張楊,鄧樹才,郝永宏
循環牽張應力下BMSCs非接觸共培養對人退變纖維環細胞增殖及蛋白表達的影響
李爽1,孫曉雷1,馬信龍1△,張楊2,鄧樹才1,郝永宏1
目的比較不同大小循環牽張應力對共培養狀態下人退變纖維環細胞增殖與蛋白表達的影響。方法取手術摘除的腰椎間盤突出癥患者椎間盤,病理學方法對其退變程度進行分級,選取其中退變纖維環組織。酶消化法分離纖維環細胞,選取P3代細胞,與術中獲得的骨髓基質干細胞(BMSCs)進行非接觸式共培養。利用ElectroForce3200力學試驗儀搭載的BioDynamic生物反應器系統,以3 h為固定時間點對其進行不同大小的頻率為0.25 Hz的周期性牽張應力刺激,設置形變量分別為0、5%、10%、15%和20%,同時設定無共培養的纖維環細胞為對照組。應用流式細胞儀檢測不同應力刺激下2種纖維環細胞的增殖情況,Real-Time PCR方法檢測人退變纖維環細胞對蛋白多糖和Ⅰ型膠原的表達情況。結果在相同應變刺激下,共培養組細胞的細胞增殖指數(PI)值、S期細胞比例、Ⅰ型膠原、蛋白多糖的表達量均高于對照組(P<0.05)。退變組細胞PI值、S期細胞比例、Ⅰ型膠原、蛋白多糖的表達量最高值出現在10%形變刺激下,而共培養組上述指標中除S期細胞比例峰值出現在10%形變刺激下以外,其余各指標峰值均出現在15%形變刺激下。結論BMSCs的非接觸共培養對人退變纖維環細胞增殖及蛋白表達存在正向調節作用,且該調節作用受到力學環境的影響。
椎間盤移位;細胞,培養的;細胞增殖;椎間盤退變;循環牽張應力;纖維環細胞;共培養;骨髓基質干細胞
IVDD)是腰椎間盤突出癥等一系列脊柱退行性疾病的病理學基礎,其主要病理改變為椎間盤細胞數量減少及椎間盤基質的蛋白多糖的結構、功能、含量和類型的變化[1]。椎間盤纖維環部分的脫水變性是腰椎間盤突出的早期病理學表現,而纖維環退變的基礎則是各種物理化學因素導致的纖維環細胞(annulus fibrosus cells,AFCs)增殖及蛋白表達的改變。因此,對IVDD的早期干預已經成為細胞學治療的重要目標[2-3]。骨髓基質干細胞(bone marrow stromal cells,BMSCs)作為具有多種分化潛能的干細胞,對人體退變椎間盤細胞具有一定的激活作用。
大量研究認為,BMSCs移植治療可減緩椎間盤的退變[4-5],在重建和恢復椎間盤生物學功能方面顯示出一定的潛能[6-9]。本研究將人退變AFCs與同種異體
BMSCs在力學環境下進行共培養,通過觀察力學環境下BMSCs對人退變AFCs增殖與蛋白表達的作用,探討干細胞治療腰椎間盤退變的機制。
1 材料與方法
1.1 材料 患者椎間盤標本1例(天津市天津醫院手術室),高糖DMEM培養基、胎牛血清(Gibco公司),D-hank’s液(自制),單克隆兔抗人Ⅰ型膠原一抗、山羊抗兔二抗、SABC試劑盒(博士德公司),倒置相差顯微鏡(Olympus公司),ElectroForce3200力學試驗儀、BioDynamic生物反應器系統(Bose公司,USA),Ⅰ型膠原酶、Ⅱ型膠原酶、胰蛋白酶、EDTA(Sigma公司),細胞培養皿(Corning公司),CO2細胞培養箱(Heraeus公司),流式細胞儀以及相關分析軟件(BC公司),Real-Time PCR相關試劑及設備(康成公司,上海)。
1.2 AFCs的取材以及分離培養 取天津市天津醫院脊柱外科1例手術患者(女性,38歲,L4~5間盤突出癥患者)間盤,術前經患者知情并同意。依照經典參考文獻[10],根據標本椎間盤和髓核的界限、裂隙出現情況、蛋白多糖表達和細胞集群生長情況對患者椎間盤的退變情況進行評分與分級,樣本評分為11分,為嚴重退變椎間盤。
1.3 人 BMSCs的分離培養 根據參考文獻[11]方法,BMSCs取自天津市天津醫院脊柱外科手術患者(男性,48歲,L4椎體滑脫伴腰椎管狹窄癥)的椎弓根通道。無菌條件下,用含0.01%肝素的D-hank’s液稀釋后移入離心管中,以2 500 r/min離心15 min,棄上清液。剩余組織加入不含血清的高糖DMEM培養基混勻,取6 mL混合液疊加于3 mL Ficoll淋巴細胞分離液上,繼續以2 500 r/min常溫離心15 min。無血清DMEM/F12培養基洗滌2次,收集骨髓基質干細胞種于培養瓶內,加入含10%FBS的高糖DMEM培養基,于37℃、5%CO2恒溫箱中培養。
1.4 共培養 通過Transwell方法將所得的P3代人退變AFCs與P3代人BMSCs進行共培養(共培養組)。BMSCs種植于孔徑3 μm的半透膜上,下層種植AFCs,2種細胞之間互不接觸,僅以培養液連通。2種細胞比例為1∶1。相差顯微鏡下觀察細胞形態。同時設立無BMSCs共培養的AFCs作為對照(退變組)。
1.5 對AFCs加載單軸周期性牽張應力
1.5.1 加載裝置 本研究采用美國Boss公司BioDynamic生物反應器系統,以彈性基底膜(Dow Corning公司)作為載體[12],配合EletroForce3200控制系統對細胞進行應力加載,由Bose PCI和Win Testing系統聯合控制力學參數,如持續時間、拉伸長度、拉伸頻率等,使彈性基底膜產生精準變形,使培養在上面的細胞同時受到拉伸形變的作用。細胞所受力值大小由彈性基底膜拉伸形變率(%)表示。
1.5.2 共培養狀態下周期性牽張應力加載 自行設計共培養力學加載系統,見圖1。將體外培養的P3代AFCs以及P3代BMSCs制成密度為2×105/mL的共2 500 μL的細胞懸液(2種細胞數量比例為1∶1),分別接種于10張硅膠載體上,每張接種500 μL,繼續培養24 h,貼壁后用于實驗(此時細胞密度長滿80%左右)。將膜片固定后置于BioDynamic生物反應器中進行力學加載。
根據本課題組前期實驗結果[13],按照加載力的大小將所得細胞分為5組,每組6個樣本,分別加載0、5%、10%、15%以及20%形變量,以0.25 Hz的頻率加載3 h。培養基儲液罐置于37℃、5%CO2培養箱中,由管道和反應器相連。蠕動泵以15 mL/min的速度使培養基在整個系統中緩慢循環,以保證加載過程中反應倉內穩定的CO2濃度和溫度。細胞加載3 d后用于后續實驗。
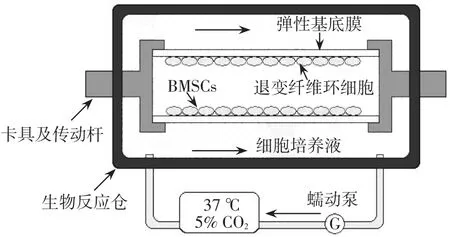
Fig.1 The co-culture CTS system圖1 共培養力學加載系統
1.6 流式細胞技術檢測細胞增殖率 用0.05%胰蛋白酶分別消化并收集2組AFCs,1 000 r/min離心5 min,棄上清后用無菌D-hank’s液漂洗2次,然后加入4℃預冷的D-hank’s液1 mL,輕輕吹打制成單細胞懸液。加入4℃預冷的無水乙醇3 mL固定(使乙醇最終濃度變為75%),4℃保存。18 h后離心棄固定液,經10 mg/L RNA酶和0.1%Triton X-
100處理30 min后,10 mg/L碘化丙啶染色,以流式細胞儀檢測細胞周期,CFlow Plus軟件處理數據。根據細胞周期中G0~G1期和 G2~M 期細胞比例(%)計算 S期細胞比例(%),進而計算細胞增殖指數(proliferative index,PI)。
1.7 Real-Time PCR檢測蛋白多糖、Ⅰ型膠原mRNA的表達 取共培養力學加載3 d后2組AFCs,棄上清,分別提取各組細胞RNA,反轉錄為cDNA。通過Real-Time PCR對蛋白多糖、Ⅰ型膠原mRNA進行擴增,β-actin作為內參,引物序列見表1。反應體系20 μL,包括上、下游引物各0.5 μL,模板 1.0 μL,SYBR MIX 10 μL,水 8.0 μL。Real-Time PCR反應步驟為95℃20 s,95℃5 s,60℃20 s,重復40個循環,采用3復孔檢測并取CT平均值。用2-△△CT計算目的基因的相對表達量。共培養實驗單獨重復3次。
目前布病所引起的肝功能異常以積極抗菌藥物治療同時聯合保肝治療[34]。利福平有肝毒性,使用時定期復查肝功能及腹部超聲。對肝功能明顯受損者,避開利福平的組合方案,可選擇替代方案多西環素+左氧氟沙星和多西環素+第三代頭孢類菌素。
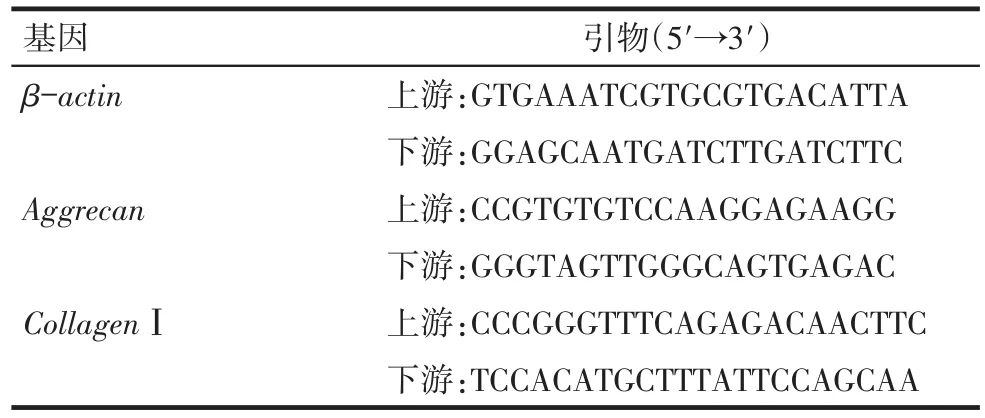
Tab.1 Primer sequences used in the real-time polymerase chain reaction analysis表1 Real-Time PCR中引物序列

Fig.2 Phase-contrast photomicrographs of primary cultured AFCs and BMSCs(×100)圖2 相差顯微鏡下AFCs及BMSCs(×100)

Fig.3 The cellular morphology pictures of AFCs after different CTS(×100)圖3 不同大小力學刺激后AFCs形態(×100)
1.8 統計學方法 采用SPSS 22.0軟件對數據進行統計學分析。計量資料用均數±標準差(±s)表示,2組間比較采用t檢驗,不同力學加載組間比較采用單因素方差分析,多重比較用LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 人退變AFCs及BMSCs的培養 AFCs接種后約1周左右長滿瓶底。處于生長期的細胞形態主要為橢圓、梭形或多角形,呈軟骨樣或成纖維樣,集落狀排列,見圖2A。BMSCs接種后約24~48 h開始貼壁,細胞形態由圓形變成長梭形、多角形,旋渦樣生長,約1周左右長滿瓶底,見圖2B。
2.2 形態學變化 無形變刺激時,共培養組和退變組細胞的形態無明顯差異;在10%形變組AFCs形態飽滿,折光性強,增殖旺盛;20%形變刺激下,細胞形態不規則,局部有脫落現象,見圖3。
2.3 流式細胞儀分析細胞周期結果 0~20%力學加載時,在相同力學刺激下,共培養組S期細胞比例、PI均高于退變組(P<0.05或P<0.01)。退變組和共培養組S期細胞比例均為10%形變量時最高,與其余形變量時比較差異均有統計學意義;退變組PI值中以10%形變量時最高,共培養組PI值以15%形變量時最高,與其余形變量時比較差異均有統計學意義,見表2。
2.4 蛋白多糖及Ⅰ型膠原酶表達情況 0~20%力學加載時,在相同力學刺激下,共培養組蛋白多糖、Ⅰ型膠原表達量均高于退變組(P<0.05或P<0.01)。退變組蛋白多糖為10%形變量時最高,共培養組為15%形變量時最高,與其余形變量時比較差異均有統計學意義;退變組Ⅰ型膠原表達量以10%形變量時最高,共培養組以15%形變量時最高,與其余形變量時比較差異均有統計學意義,見表3。
Tab.2 Comparison of the proportion of AF cells in the period of DNA synthesis and PIafter different CTS between two groups表2 不同力學刺激后2組AFCs S期細胞比例、PI變化比較 (n=6,%,±s)

Tab.2 Comparison of the proportion of AF cells in the period of DNA synthesis and PIafter different CTS between two groups表2 不同力學刺激后2組AFCs S期細胞比例、PI變化比較 (n=6,%,±s)
*P<0.05,**P<0.01;a與形變量0比較,b與形變量5%比較,c與形變量10%比較,d與形變量15%比較,P<0.05;表3同
形變量0 5%10%15%20%F S期細胞比例PI退變組1.82±0.13 2.54±0.18a2.82±0.13ab2.23±0.14abc1.34±0.08abcd105.245**共培養組2.02±0.11 2.87±0.16a3.09±0.14ab2.91±0.11ac2.42±0.13abcd65.822**t t 2.738*3.321*3.416*9.038**17.117**退變組17.03±0.35 21.77±0.98a25.37±1.10ab22.39±1.10abc18.93±0.82abcd75.134**共培養組19.86±0.30 24.05±1.42a31.04±1.50ab32.57±1.58abc25.63±1.06abcd102.057**15.025*3.245*7.492**12.994**12.251**
Tab.3 The expressions of aggrecan and collagenⅠin AFCs after different CTS in two groups表3 不同力學刺激后2組AFCs蛋白多糖及Ⅰ型膠原表達量變化 (n=6,±s)
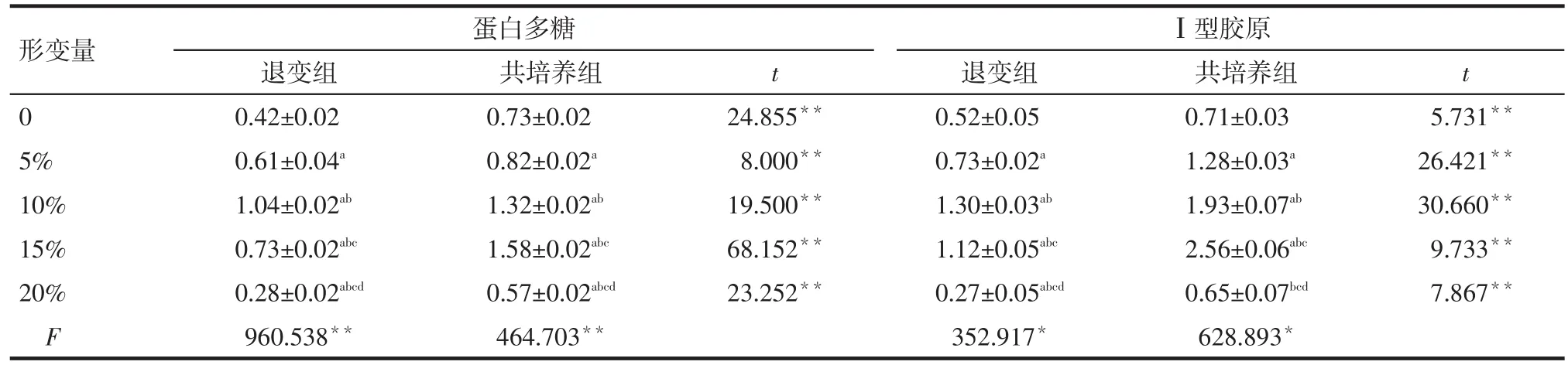
Tab.3 The expressions of aggrecan and collagenⅠin AFCs after different CTS in two groups表3 不同力學刺激后2組AFCs蛋白多糖及Ⅰ型膠原表達量變化 (n=6,±s)
形變量0 5%10%15%20%F蛋白多糖Ⅰ型膠原退變組0.42±0.02 0.61±0.04a1.04±0.02ab0.73±0.02abc0.28±0.02abcd960.538**共培養組0.73±0.02 0.82±0.02a1.32±0.02ab1.58±0.02abc0.57±0.02abcd464.703**t t 24.855**8.000**19.500**68.152**23.252**退變組0.52±0.05 0.73±0.02a1.30±0.03ab1.12±0.05abc0.27±0.05abcd352.917*共培養組0.71±0.03 1.28±0.03a1.93±0.07ab2.56±0.06abc0.65±0.07bcd628.893*5.731**26.421**30.660**9.733**7.867**
3 討論
已知IVDD是一種由生物力學和生物化學因素相互作用引起的復雜病理過程[14]。正常的椎間盤組織在體內處于相對穩定的應力環境之中,生理環境下的應力刺激對細胞增殖以及功能表達具有重要的調節作用。當椎間盤所處的力學環境急劇改變,破壞其原有的穩定環境并達到失代償狀態時,間盤細胞表達細胞外基質減少,進一步加重細胞承受的負荷。這種結構與功能的惡性循環可最終導致椎間盤退變[15]。以干細胞移植為基礎治療椎間盤退變的生物學方法主要是通過向目標組織移植干細胞,增加椎間盤細胞的增殖,促進其蛋白多糖及細胞外基質的分泌,打破惡性循環,從而達到延緩甚至逆轉椎間盤退變的目的。
BMSCs因其獲得容易、增殖能力較強、免疫原性低等特點,被認為是細胞治療和組織工程理想的種子細胞[16]。已有學者應用BMSCs與退變AFCs進行體外非接觸式共培養,發現前者對后者的功能表達可產生相應調節作用,主要體現為蛋白多糖、Ⅰ型膠原以及基質金屬蛋白酶等產物表達量的升高[11]。同時,已有研究證實,人退變AFCs的增殖與所施加機械刺激的大小存在劑量依賴性[13],且機械刺激對體外培養椎間盤細胞表達產物的代謝水平存在影響[17-18]。本文將2種刺激方式相結合,即在對人退變AFCs施加干細胞生物學干預的同時,體外模擬力學環境,觀察2種細胞在共培養狀態下的增殖及功能表達情況。結果顯示,在相同應變刺激下,共培養組細胞的PI值、S期細胞比例、Ⅰ型膠原、蛋白多糖的表達量均高于退變組,說明在相同力學刺激下,BMSCs的引入對退變AFCs的增殖與表達均存在正向調節作用。在形變初期(5%~10%),2組細胞的增殖及表達能力隨著力學強度的加載而呈現緩慢上升趨勢,并在10%~15%逐漸達到各自峰值,表現出較強的增殖和表達能力,直至當形變強度增加至20%時,退變組與共培養組的增殖能力及蛋白表達均明顯下降,最終由對力學環境的代償轉化為失代償。而2組細胞所承受的最佳力學刺激并不相同則可能意味著BMSCs的引入增加了AFCs對“惡性”力學刺激的耐受程度。
由于Ⅰ型膠原和蛋白多糖是人椎間盤纖維環組織的主要細胞外基質,其含量的增加可對內在的AFCs起到一定的保護作用。BMSCs促進退變AFCs增殖及相關基因上調表達的機制可能為:(1)在共培養過程中,BMSCs可上調合成多種營養因子并通過旁分泌作用使其進入周圍微環境,包括轉化生長因子(TGF)β1、胰島素樣生長因子(IGF)-1、表皮生長因子(EGF)、血小板衍生生長因子(PDGF)以及骨形態發生蛋白(BMP)-7等,其作用機制包括營養以及減少細胞凋亡等[19]。(2)BMSCs可減少退變 AFCs的凋亡。研究顯示,AFCs的凋亡過度是導致椎間盤退變的重要原因之一[20],退變AFCs在下調Bax表達的同時上調凋亡抑制基因 Bcl-2 的表達[21]。(3)退變AFCs與牽張應力同時作用于外源性BMSCs,以微環境誘導干細胞向軟骨樣細胞分化,兩者的協同作用最終增加了AFCs的數量及其細胞外基質的分泌。(4)適當的循環牽張應力本身可通過激活肌動蛋白細胞骨架調節促進細胞骨架重構,從而實現AFCs以及BMSCs增殖及表達的上調。
基于上述研究結果,筆者認為:(1)BMSCs的非接觸共培養對人退變AFCs的增殖及表達存在正向調節作用。(2)BMSCs的引入對人退變AFCs存在“力學保護作用”,主要體現為人退變AFCs對“惡性”應力刺激(15%及20%形變量)代償能力的增加。(3)一定范圍內的力學刺激可增加人退變AFCs的增殖及表達,且與BMSCs的共培養呈協同作用。
本研究體外模擬力學環境對共培養狀態下的人退變AFCs實施一定時間的力學干預,證實了與BMSCs共培養對人退變AFCs的力學保護作用,對IVDD的細胞學治療提供了一定的理論基礎。本研究設計基于體外力學模型,在保證實驗同質性的同時無法避免地排除了體內其他因素對AFCs的影響,有待于本課題組后續通過動物實驗進行體內研究。
[1]Walker MH,Anderson DG.Molecular basis of intervertebral disc degeneration[J].Spine,2004,4(6 Suppl):158s-166s.
[2]Kepler CK,Anderson DG,Tannoury C,et al.Intervertebral disk degeneration and emerging biologic treatments[J].J Am Acad Orthop Surg,2011,19(9):543-553.
[3]Cao C,Zou J,Liu X,et al.Bone marrow mesenchymal stem cells slow intervertebral disc degeneration through the NF-κB pathway[J].Spine J,2015,15 (3) :530-538.doi:10.1016/j.spinee.2014.11.021.
[4]Illien-Jünger S,Pattappa G,Peroglio M,et al.Homing of mesenchymal stem cells in induced degenerative intervertebral discs in a whole organ culture system[J].Spine(Phila Pa 1976),2012,37(22):1865-1873.doi:10.1097/BRS.0b013e3182544a8a.
[5]Yi Z,Guanjun T,Lin C,et al.Effects of transplantation of hTIMP1-expressing bone marrow mesenchymalstem cells on the extracellular matrix of degenerative intervertebral discs in an in vivo rabbit model[J].Spine(Phila Pa 1976),2014 Apr 8.doi:10.1097/BRS.0000000000000316.[Epub ahead of print].
[6]Wang YT,Wu XT,Wang F.Regeneration potential and mechanism of bone marrow mesenchymal stem cell transplantation for treating intervertebral disc degeneration[J].J Orthop Sci,2010,15(6):707-719.doi:10.1007/s00776-010-1536-3.
[7]Yoshikawa T,Ueda Y,Miyazaki K,et al.Disc regeneration therapy using marrow mesenchymal cell transplantation:a report of two case studies[J].Spine(Phila Pa 1976),2010,35(11):E475-480.doi:10.1097/BRS.0b013e3181cd2cf4.
[8]Orozco L,Soler R,Morera C,et al.Intervertebral disc repair by autologous mesenchymal bone marrow cells:a pilot study[J].Transplantation,2011,92(7):822-828.doi:10.1097/TP.0b013e3182298a15.
[9]王鋒,吳小濤,王運濤,等.干細胞移植修復椎間盤退變的研究現狀[J].中國修復重建外科雜志,2013,27(5):575-579.Wang F,Wu XT,Wang YT,et al.Research situation of stem cells transplantation for intervertebral disc degeneration[J].Chinese Journal of Reparative and Reconstructive Surgery,2013,27(5):575-579.doi:10.7507/1002-1892.20130127.
[10]Sive JI,Baird P,Jeziorsk M,et al.Expression of chondrocyte markers by cells of normal and degenerate intervertebral discs[J].Mol Pathol,2002,55(2):91-97.
[11]姜剛強,阮狄克,周明越,等.非接觸式共培養下兩種同源間充質干細胞對退變髓核細胞生物學影響的比較研究[J].中國脊柱脊髓雜志,2014,24(3):251-256.Jiang GQ,Ruan DK,Zhou MY,et al.Comparison of the biological effects of two kinds of homologous mesenchymal stem cells on degenerative nucleus pulposus cells under the condition of non-contact co-culture[J].Chinese Journal of Spine and Spinal Cord,2014,24(3):251-256.doi:10.3969/j.issn.1004-406X.2014.03.10.
[12]馬信龍,李爽,付鑫,等.硅橡膠膜細胞載體的應力分析及生物相容性[J].醫用生物力學,2011,26(5):426-431.Ma XL,Li S,Fu X,et al.Stress analysis and biocompatibility research on a cell carrier with silicone rubber membrane[J].Journal of Medical Biomechanics,2011,26(5):426-431.
[13]李爽,馬信龍,孫曉雷,等.循環牽張應力對人退變纖維環細胞增殖的影響[J].國際生物醫學工程雜志,2011,34(6):344-347.Li S,Ma XL,Sun XL,et al.Response of cyclic tensile strain on the human degenerative anulus fibrosus cells[J].International Journal of Biomedical Engineering,2011,34(6):344-347.doi:10.3760/cma.j.issn.1673-4181.2011.06.006.
[14]Kadow T,Sowa G,Vo N,et al.Molecular basis of intervertebral disc degeneration and herniations:whatare the important translational questions?[J].Clin Orthop Relat Res,2015,473(6):1903-1912.doi:10.1007/s11999-014-3774-8.
[15]Wang F,Cai F,Shi R,et al.Aging and age related stresses:a senescence mechanism of intervertebral disc degeneration[J].Osteoarthritis Cartilage,2016,24(3):398-408.doi:10.1016/j.joca.2015.09.019.
[16]Wu J,Wang Q,Fu X,et al.Influence of immunogenicity of allogeneic bone marrow mesenchymal stem cells on bone tissue engineering[J].Cell Transplant,2016,25(2):229-242.doi:10.3727/096368915X687967.
[17]Sowa G,Agarwal S.Cyclic tensile stress exerts a protective effect on intervertebral disc cells[J].Am J Phys Med Rehabil,2008,87(7):537-544.doi:10.3727/096368915X687967.
[18]Gilbert HT,Hoyland JA,Millward-Sadler SJ.The response of human anulus fibrosus cells to cyclic tensile strain is frequency-dependent and altered with disc degeneration[J].Artheritis Rheum,2010,62(11):3385-3394.doi:10.1002/art.27643.
[19]Wei A,Brisby H,Chung SA,et al.Bone morphogenetic protein-7 protects human intervertebral disc cells in vitro from apoptosis[J].Spine J,2008,8(3):466-474.doi:10.1016/j.spinee.2007.04.021.
[20]ZhaoCQ,JiangLS,DaiLY.Programmed celldeath in intervertebral disc degeneration[J].Apoptosis,2006,11(12):2079-2088.doi:10.1007/s10495-006-0290-7.
[21]樊守剛,吳小濤,王運濤,等.移植骨髓間充質干細胞對兔退變椎間盤髓核細胞凋亡的影響[J].中華實驗外科雜志,2010,27(7):979-982.Fan SG,Wu XT,Wang YT.Effects of mesenchymal stem cells transplantation on the apoptosis after rabbit intervertebral disc degeneration [J]. Chinese Journal of Experimental Surgery,2010,27(7):979-982.doi:10.7666/d.y1761316.
(2016-10-02收稿 2017-05-03修回)
(本文編輯 李國琪)
The response of cyclic tensile strain on the BMSCs co-cultured human degenerative anulus fibrosus cells
LI Shuang1,SUN Xiao-lei1,MA Xin-long1△,ZHANG Yang2,DENG Shu-cai1,HAO Yong-hong1
1 Department of Orthopedics,2 Institute of Orthopedics,Tianjin Hospital,Tianjin 300211,China△
E-mail:xlspine@163.com
ObjectiveTo investigate the effects of different cyclic tensile strains on the proliferation and expression of bone marrow stromal cells(BMSCs)-cocultured human degenerated anulus fibrosus(AF)cells.MethodsAF cells were isolated from a patient with degenerated intervertebral disc degeneration(IVD),which were co-cultured with BMSCs.The solely cultured AF cells were used as control group.The two groups of cells were expanded in monolayer,and cyclically strained for 3 hours,which were applied 0,5%,10%,15%and 20%strains at a frequency of 0.25 Hz using BioDynamic test instrument.A flow cytometry method was used to examine the AF cell proliferation at 24 hours followed the application of cyclic tensile strains.After the total RNA was extracted,real-time PCR technology was used to detect the gene expression of collagenⅠand aggrecan.ResultsUnder the same appropriate stress,the proliferative index(PI),the proportion of cells in the period of DNA synthesis,the expression of collagenⅠand aggrecan were significantly higher in the co-cultured group than those of control group(P<0.05).However,the best mechanical stimulation was different in the two groups.For the AF cells,the peaks of PI,the proportion of cells in the period of S period,the expression of collagenⅠand aggrecan were found in the 10%strain group,while for the co-cultured cells,they were found in the 15%strain group.ConclusionCoculturing with BMSCs has a positive effect on the proliferation and expression of human degenerative fibrous ring cells,which can protect AF cells from bad stress stimulation.
intervertebral disk displacement;cells,cultured;cell proliferation;intervertebral disc degeneration;cyclic tensile strain;anulus fibrosus cells;co-culture;BMSCs椎間盤退變(intervertebral disc degeneration,
R681.53
:A
10.11958/20161109
天津市衛生局科技基金(2012KZ052)
1天津市天津醫院骨科(郵編300211),2骨科研究所
李爽(1984),男,住院醫師,博士在讀,主要從事脊柱外科及椎間盤修復等相關研究
△通訊作者 E-mail:xlspine@163.com

