貴州小麥條銹菌群體遺傳結構分析
袁文婭++孫振宇++梁丹++時曉偉++陳靜++張梅茹++馬占鴻++劉秀峰
摘要:為了解貴州省小麥條銹菌群體的遺傳多樣性,本研究采用擴增片段長度多態性標記(AFLP)對其進行研究。結果顯示:貴州省6個縣市分離到的128個小麥條銹菌單孢子堆分離物中共獲得32個AFLP基因型,沒有檢測到頻率占絕對優勢的AFLP基因型,其中1個AFLP基因型(zy6)頻率(0.195)較高,AFLP基因型頻率介于0.050~0.100的有3個,其余28個AFLP基因型的頻率均低于0.050。香農系數及Φpt方法均顯示亞群體間遺傳差異不明顯;Mantel test顯示小麥條銹菌貴州群體遺傳差異程度與地理距離無關;最大簡約樹步長評估結果顯示小麥條銹菌貴州群體自由重組的可能性較低。表明,貴州省小麥條銹菌群體具有豐富的遺傳多樣性。
關鍵詞:小麥條銹菌;群體遺傳結構;AFLP標記
中圖分類號:S435.121.4+2文獻標識號:A文章編號:1001-4942(2017)06-0095-06
AbstractThe population genetic diversity of wheat stripe rust (Puccinia striiformis f. sp. Tritici) in Guizhou Province was analyzed by amplified fragment length polymorphism (AFLP). The results showed that 32 AFLP genotypes were obtained from 128 isolates collected from 6 counties in Guizhou Province. No predominant genotype was identified. In which, 1 genotype,zy6,had the highest frequency of 0.195, 3 genotypes had the frequency between 0.050~0.100, and the frequency of the other 28 genotypes was less than 0.050. Shannon coefficient and Φpt statistics results showed that the genetic differentiation among 6 counties was not significant. Mantel test suggested that there was no significant correlation between genetic differentiation and geographical distances. The most parsimonious tree length results showed that the possibility of free recombination for population of Puccinia striiformis f. sp. tritici in Guizhou was very lower. The results indicated that the genetic diversity of P. striiformis was rich in Guizhou Province.
KeywordsPuccinia striiformis f. sp. tritici; Population genetic structure; AFLP marker
貴州省地處云貴高原,毗鄰云南越夏區。海拔300~2 400 m地帶均有小麥種植,不同海拔地區小麥生長時期重疊,加之播種下茬作物時常不翻耕保留著大量自生麥苗,致使田間周年都有麥苗[1]。夏季低溫,具有獨特的環境條件,從理論上推測具備小麥條銹菌(Puccinia striiformis f.sp tritici)越夏條件。小麥條銹菌在貴州境內能否安全越夏長期以來并不清楚,直到2006年證實小麥條銹菌在赫章等地海拔1 700 m以上地區能夠安全越夏,引起秋苗發病[2]。2006年11月農業部印發的《小麥條銹病中長期治理指導意見》指出,貴州等地的低山、河谷、山壩是我國小麥條銹菌冬繁區之一,也是當地和流行區小麥條銹病春季流行的重要菌源地。小麥條銹菌在貴州地區既能越夏也能越冬,在一定海拔范圍內在當地能夠完成周年循環,非常適合小麥條銹菌產生遺傳變異。目前貴州菌源與周邊省份的菌源傳播關系及其對我國小麥條銹病發生流行的影響等研究資料稀少。貴州地區小麥條銹菌群體作為西南流行區系的重要組成,了解其群體遺傳結構顯然具有重要意義。本研究從貴州省6個縣市分離出128個小麥條銹菌單孢子堆分離物,通過AFLP標記和重組信號檢測進行群體遺傳結構分析,以期為了解小麥條銹病的傳播途徑提供理論依據。
1材料與方法
1.1試驗材料
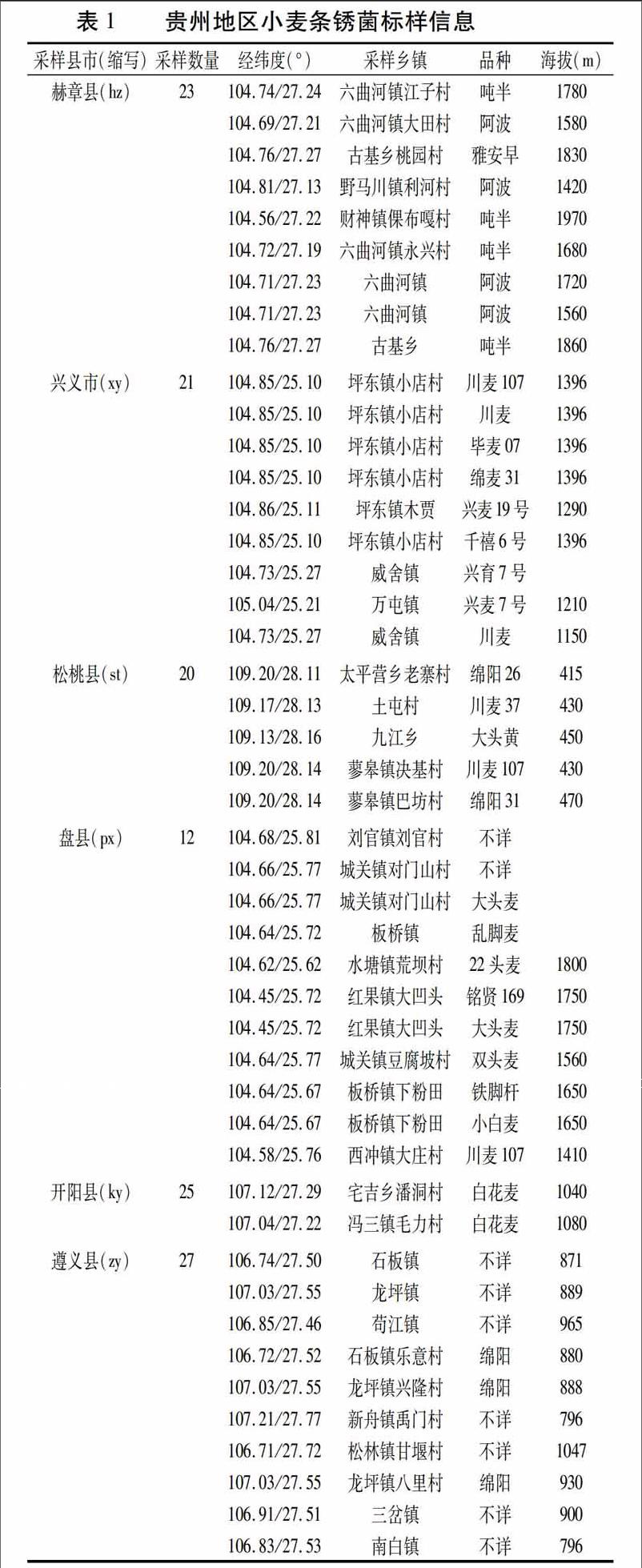
小麥條銹菌標樣采集于貴州省6個縣市,這些地區基本覆蓋了貴州省東北、西北、西南以及貴州中部。樣本具體信息見表1。
1.2試驗方法
小麥條銹菌單孢子堆基因組DNA提取、AFLP體系和反應條件采用Enjalbert等[3]報道的方法,略有修改。
1.3數據分析
同一對AFLP引物的擴增產物中電泳遷移率一致的條帶被認為具有同源性,屬于同一位點的產物。AFLP條帶在兩個以上供試小麥條銹菌分離物共有的作為多態性條帶,多態性條帶的有和無分別記作1和0。排除無法準確標識的帶,然后構建多態性條帶二進制原始數據矩陣。
1.3.1貴州小麥條銹菌群體和亞群體的AFLP基因型調查每個縣市采集到的小麥條銹菌分離物看作一個亞群體,貴州省標樣共計分為6個亞群體。采用MULTILOCUS 1.3軟件[4]計算各亞群體及貴州小麥條銹菌群體的不同AFLP基因型頻率。
1.3.2貴州小麥條銹菌亞群體內的遺傳多樣性分析用Nei 氏多樣性系數(Neis diversity index)、Nei 氏無偏多樣性系數(Neis unbiased diversity index)、香農系數(Shannons information index)以及多態位點百分率(percentage of polymorphic loci)評估貴州小麥條銹菌6個亞群體內的多樣性。
1.3.3貴州小麥條銹菌亞群體間的遺傳分化比較φpt類似于F統計,可用于評估遺傳結構,但其不需要假設可直接對顯性標記數據進行群體遺傳結構的分析[5]。Fst和φpt兩個參數用于評估貴州小麥條銹菌亞群體間的遺傳變異。同時采用GENALEX 6.0軟件[6]中的分子方差分析(analysis of molecular variance,AMOVA)評估貴州各亞群體間的遺傳差異。
1.3.4貴州小麥條銹菌遺傳距離與地理距離相關性分析根據各采樣地點的經緯度計算地理矩陣,根據Nei 氏遺傳距離計算遺傳矩陣,利用GENALEX 6.0中的Mantel test方法計算貴州地區小麥條銹菌各亞群體遺傳距離與地理距離的相關性[3] ,同時對兩個矩陣相關系數的顯著性進行1 000次permutation自舉檢驗,評估貴州小麥條銹菌各亞群體遺傳結構是否具有地理隔離現象(isolation-by-distance)。該相關性檢測中的無效假設是地理距離矩陣和遺傳距離矩陣間沒有相關性,即各亞群體間遺傳距離不隨地理距離的改變而改變。Mantel test 產生的相關系數范圍在 -1和 +1之間,如果各亞群體間遺傳距離和地理距離不相關,則真實進化值應在自舉檢測的相關系數范圍之內。
1.3.5貴州小麥條銹菌群體重組信號檢測采用連鎖不平衡系數(rd)計算連鎖不平衡時不依賴于所用位點個數,可提高不同研究者間結果比對的可行性[4]。利用rd對貴州地區小麥條銹菌各亞群體間是否有重組現象進行檢驗。應用MULTILOCUS 1.3軟件計算貴州各亞群體間的rd,同時進行1 000次permutation自舉檢驗。該檢驗中無效假設是群體間沒有連鎖不平衡,可以自由重組。如果貴州各亞群體間的連鎖不平衡系數值偏離無效假設的數據分布范圍,則表明各亞群體間不能自由重組。同時利用最大簡約樹步長評估法(parsimony tree length permutation test, PTLPT)檢測貴州地區小麥條銹菌群體是否有重組信號。PTLPT的運算在PAUP 4.0 β 10 中進行[7]。
2結果與分析
2.1貴州小麥條銹菌群體和亞群體的AFLP基因型
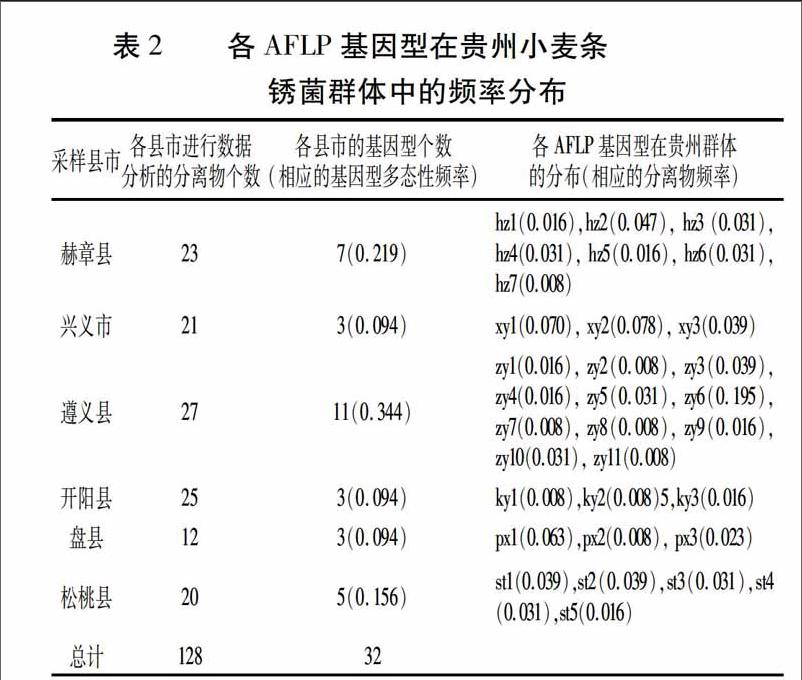
貴州地區128個小麥條銹菌分離物中共獲得32個AFLP基因型,群體的AFLP基因型多態性頻率為0.250。各AFLP基因型個數及其分布見表2。如表2所示,貴州小麥條銹菌群體沒有檢測到頻率占絕對優勢的AFLP基因型,在遵義縣南白鎮獲得的分離物的基因型(zy6)頻率占有一定優勢(頻率為0.195),基因型頻率介于0.050~0.100的有3個(xy2、xy1、px1),其余28個AFLP基因型的頻率均低于0.050。
2.2貴州小麥條銹菌亞群體內的遺傳多樣性
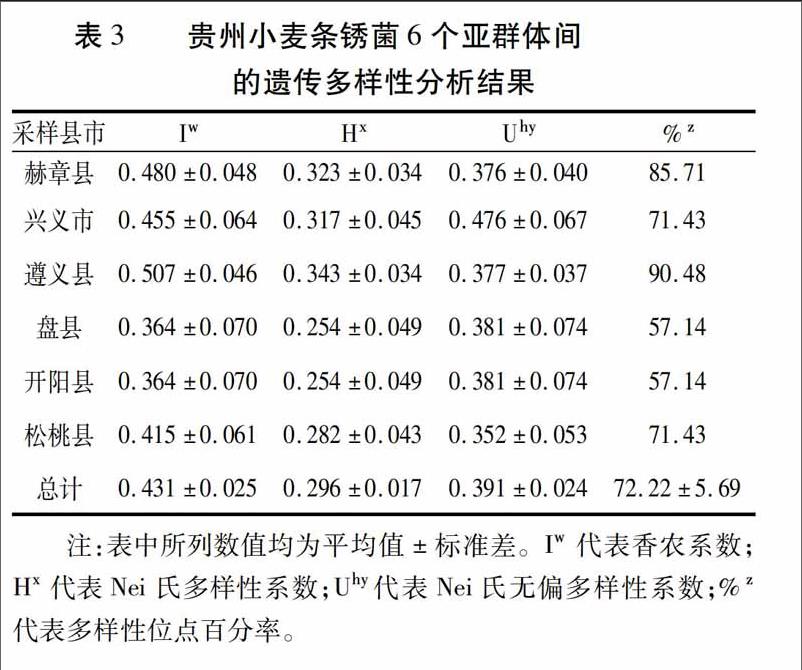
香農系數、Nei 氏多樣性系數、Nei 氏無偏系數和多態性位點百分率這幾個參數都是通過計算群體內的各對個體間距離后,得出一個衡量該群體遺傳差異的平均數。其中,香農系數計算方法更側重于存在條帶的權重,Nei 氏多樣性系數更關注于所比較個體的相似性,Nei 氏無偏系數與Nei 氏多樣性系數相似,但更適合于在群體研究數量少時采用。多態性位點百分率不能確定各條帶在頻率上的均勻程度,且受到樣本大小和條帶總數的影響,它只是衡量群體遺傳多態性的一個粗略估計值,但它計算簡單直觀,能夠反映一定的遺傳多樣性程度,在研究中得到了廣泛應用。由表3可知, 盡管這幾個參數的統計側重點有少許差異,但結果均顯示貴州小麥條銹菌各亞群體內都存在較豐富的遺傳多樣性。
2.3貴州小麥條銹菌亞群體間的遺傳變異
由表4可知,將AFLP 基因型數據作為共顯性(codominant)的雙等位基因基因型數據,用φpt參數衡量亞群體兩兩之間的遺傳差異性。利用φpt值推斷,除開陽縣-松桃縣間的φpt值稍高(φpt=0.301)外,其它亞群體兩兩間φpt值都很小,顯示貴州省小麥銹菌6個亞群體兩兩之間的遺傳差異不明顯。
本研究根據小麥條銹菌的特點選用歐氏距離平方計算和矯正基因型之間的進化距離,矯正后再進行分子方差分析,AMOVA結果(表5)表明,89%的變異來源于亞群體之內。
這些結果顯示貴州小麥條銹菌群體和6個亞群體間都存在著一定遺傳分化。
2.4貴州小麥條銹菌遺傳距離與地理距離的相關性
圖1結果顯示,貴州群體的遺傳距離和地理距離的相關系數為0.11,在1 000次假設的相關系數分布范圍內,表明小麥條銹菌貴州群體遺傳差異程度與地理距離無關。
2.5貴州小麥條銹菌群體重組信號檢測
rd值計算結果顯示,rd值明顯偏離無效假設的自由交配群體的值(rd=0.032, P<0.001),因此拒絕無效假設,表明小麥條銹菌貴州群體自由重組的可能性較低。圖2結果顯示,PTLPT構建的貴州群體最大簡約樹步長(165步)明顯短于無〖CM(21〗效假設的自由重組的簡約樹步長范圍,所以拒絕無效假設。連鎖不平衡系數rd和PTLPT結果均表明貴州小麥條銹菌群體自由重組的可能性較低。
3討論
貴州全省貫穿我國南北走向和東北-西南走向兩組山脈交匯的云貴高原,地理環境復雜,地勢起伏較大,種植小麥品種繁雜。本研究采樣地點涵蓋了松桃、興義、遵義等6個縣市,代表黔東北、黔西南、黔中不同地理區域,西南部的盤縣與云南省的富源縣接壤,而東北部的松桃縣與湖南省接壤,又結合了南亞熱帶等貴州小麥種植的主要氣候帶。鑒定的標樣采自20余個小麥品種共128份,具較好的地域代表性、氣候代表性及寄主品種代表性。
總體上比較,小麥條銹菌貴州群體的各基因型頻率相對均衡,沒有頻率非常高的優勢基因型。貴州小麥條銹菌群體的基因型中,只有zy6基因型的頻率占有一定優勢(頻率為0.195),但明顯低于小麥條銹菌云南群體中的qj3基因型頻率[8]。zy6基因型在遵義縣檢測到,但其出現頻率在遵義縣比較低,而在開陽縣檢測到該基因型的分離物較多,暗示小麥條銹菌遵義群體和開陽群體間有較高的基因型交流。與湖南接壤的松桃縣檢測到的5個基因型頻率基本相當,沒有優勢的AFLP基因型。西北部的赫章縣各個基因型的頻率也比較均衡,沒有優勢基因型或者頻率非常低的基因型。Mantel test檢驗結果表明貴州小麥條銹菌群體遺傳差異程度與地理距離無關,暗示貴州各亞群體間存在著基因型交流。與此一致,對貴州小麥條銹菌群體進行的分子方差分析結果顯示,貴州群體中變異仍然主要來自于群體內部,種群間變異較小,只占遺傳總變異的11%。小麥條銹菌貴州群體沒有發現重組信號,可將其看作克隆繁殖方式。與北美[9]、西北歐[10]、法國[11]、地中海[12] 、澳大利亞1979—2006年的小麥條銹菌群體[13]的繁殖方式相同。克隆繁殖方式使得寄生適合度高的個體得以迅速有效增長,這樣的群體能夠保持適合度高的個體迅速侵染寄主[13]。
美國Pst-130[14]和中國CY32小種[15]的基因組序列為研究小麥條銹菌提供了新的工具。利用CY32小種的基因組序列已經篩選出20個具有多態性的SSR引物,比利用表達序列標簽篩選的SSR引物具有更高的多態性[16]。若將本研究中的各AFLP基因型分離物進行重測序或某一時刻的轉錄組分析,對測序所得的數據進行全面分析,可能會對貴州地區小麥條銹菌越夏菌源與本地和周邊地區小麥發病的關系、與我國西南云貴川小麥條銹菌菌源關系以及西南地區小麥條銹菌越夏、越冬后對我國小麥條銹病發生流行的影響等有更深入認識。
4小結
貴州小麥條銹菌群體的變異主要來源于亞群體之內,亞群體間的遺傳差異不明顯,群體遺傳差異程度與地理距離不相關,貴州小麥條銹菌群體自由重組的可能性較低。結果表明貴州小麥條銹菌群體具有豐富的遺傳多樣性。
參考文獻:
[1]王海光,談孝鳳,金星,等.2006年貴州省赫章縣秋季小麥條銹病調查[J].中國農學通報, 2007,23(3):360-364.
[2]姜玉英,金星,談孝鳳,等. 黔西部小麥條銹病菌越夏考察初報[J]. 植物保護, 2007,33(1):133-134.
[3]Enjalbert J, Duan X Y, Vautrin D, et al. Isolation of twelve microsatellite loci, using an enrichment protocol, in the phytopathogenic fungus Puccinia striiformis f. sp. tritici[J]. Moecular Ecology Notes, 2002,2(4):563-565.
[4]Agapow P M, Burt A. Indices of multilocus linkage disequilibrium[J]. Molecular Ecology Notes, 2001, 1:101-102.
[5]Excoffier L, Smouse P E, Quattro J M. Analysis of molecular variance inferred from metric distances among DNA haplotypes: application to human mitochondrial DNA restriction data [J].Genetics, 1992, 131:479-491.
[6]Peakall R, Smouse P E. GENALEX 6: genetic analysis in Excel. Population genetic software for teaching and research[J]. Molecular Ecology Notes, 2006, 6:288-295.
[7]Swofford D L. PAUP: phylogenetic analysis using parsimony (and other methods), version 4.0. Sinauer Associates[M]. Sunderland MA. , 1996.
[8]Liu X F, Huang C, Sun Z Y, et al. Analysis of population structure of Puccinia striiformis in Yunnan Province of China by using AFLP[J]. European Journal of Plant Pathology, 2011,129:43-55.
[9]Chen X M, Line R F, Leung H. Relationship between virulence variation and DNA polymorphism in Puccinia striiformis[J]. Phytopathology, 1993, 83:1489-1497.
[10]Hovmller M S, Justesen A F, Brown J K M. Clonality and long-distance migration of Puccinia striiformis f. sp. tritici in north-west Europe[J]. Plant Pathology, 2002,24:24-32.
[11]Enjalbert J, Duan X Y, Leconte M, et al. Genetic evidence of local adaptation of wheat yellow rust (Puccinia striiformis f. sp. tritici) within France[J]. Molecular Ecology, 2005, 14:2065-2073.
[12]Bahri B, Leconte M, Ouffroukh A, et al. Geographic limits of a clonal population of wheat yellow rust in the Mediterranean region[J]. Molecular Ecology, 2009, 18:4165-4179.
[13]Wellings C R. Puccinia striiformis in Australia: a review of the incursion, evolution, and adaptation of stripe rust in the period 1979-2006[J]. Australian Journal of Agricultural Research, 2007, 58:567-575.
[14]Cantu D, Govindarajulu M, Kozik A, et al. Next generation sequencing provides rapid access to the genome of Puccinia striiformis f. sp. tritici, the causal agent of wheat stripe rust[J]. PLoS ONE, 2011, 6:1-8.
[15]Zheng W M, Huang L L, Huang J Q, et al. High genome heterozygosity and endemic genetic recombination in the wheat stripe rust fungus[J]. Nature Communication, 2013,4:1-10.
[16]Zhan G M, Wang F P, Luo H Y, et al. Screening for simple sequence repeat markers in Puccinia striiformis sp.tritici based on genomic sequence[J]. Journal of Zhejiang University-Science B, 2015,16(8):727-732.

