肝癌細胞HepG2中p53調控miRNA-3661的生物信息分析與功能驗證
李宇鵬 張一鳴 胡海碧 康成宇 李牧洲 郭志云
(西南交通大學生命科學與工程學院,成都 610031)
肝癌細胞HepG2中p53調控miRNA-3661的生物信息分析與功能驗證
李宇鵬 張一鳴 胡海碧 康成宇 李牧洲 郭志云
(西南交通大學生命科學與工程學院,成都 610031)
對已在前期實驗中通過Dox誘導肝癌細胞HepG2 DNA損傷發現的受p53調控的hsa-miR-3661進行生物信息學分析,并通過分子生物學實驗對其功能進行了驗證,為miR-3661在肝腫瘤中的調控機制的研究提供理論基礎。獲取miR-3661結構與序列信息;預測靶基因,使用DAVID進行miRNA靶基因功能富集分析;分析miR-3661的p53結合位點,通過基因間的相互作用構建調控網絡;進行細胞增殖實驗驗證miR-3661抑制腫瘤功能。結果表明,miR-3661序列保守,啟動子區存在p53結合位點,暗示p53與hsa-miR-3661存在直接調控;預測靶基因1 009個,369個顯著富集于細胞周期調控、細胞增殖、細胞凋亡等腫瘤相關生物學過程(P<0.05),主要參與了癌癥信號通路、MAPK信號通路與ErbB信號通路(P<0.05);通過268組基因間的相互作用數據構建了p53、hsa-miR-3661和靶基因的調控網絡,從系統生物學角度分析了參與多個腫瘤生物進程的關鍵靶基因;在實驗中證實過表達miR-3661可以顯著抑制肝癌細胞HepG2的增殖過程(P-value= 0.001 46)。miR-3661受p53直接調控,其靶基因顯著富集于多種腫瘤相關生物進程與信號通路,過表達miR-3661可顯著抑制肝癌細胞增殖。
肝細胞癌;microRNAs;生物信息學;阿霉素
原發性肝癌的發病率居全球第5位,致死率排第3位,其中以肝細胞癌(Hepatocellular carcinoma,HCC)最為常見[1]。MicroRNA是一類長度為18-24個核苷酸的小分子非編碼RNA,從線蟲到人類的多種生物種均有發現。它們可通過結合于靶mRNA非翻譯區(UTR),從而調控mRNA的翻譯和降解。大量研究表明,肝細胞中miRNA表達 異常或功能失調與其細胞增殖、細胞周期、分化、病毒復制、肝細胞癌變的發生等生理與病理學過程密切相關。p53(Tumor protein 53,TP53)作為一種腫瘤抑制轉錄因子參與調控絕大多數腫瘤的發生與發展。前期研究證實,在抗腫瘤藥物阿霉素(Doxorubicin,Dox)誘導下可激活p53從而調控包括microRNA在內的下游靶基因的轉錄調控[2]。本課題組前期通過Dox誘導肝癌HepG2細胞后進行小RNA測序(small RNA sequencing)分析發現了一系列受p53調控的miRNA[3]。通過qRT-PCR實驗證實,Dox處理HepG2細胞24 h后,miR-3661表達量上調10.17倍[3],通過文獻搜索并未有相關報道。基于上述研究以及前期分析,本研究通過生物信息學分析與分子生物學實驗手段對miR-3661在肝癌中的調控作用進行系統的分析,并從系統生物學角度發掘miR-3661與其他相關基因形成的調控網絡,旨在通過實驗證明miR-3661對肝癌細胞的抑制作用,為進一步探明miRNA與肝腫瘤的發病機理奠定了理論與實驗基礎。
1 材料與方法
1.1 材料
Hsa-miR-3661序列及結構下載自miRbase(版本21)(http://www.mirbase.org/)[4]和UCSC(https:// genome.ucsc.edu/),人類蛋白相互作用數據共268組下載自BioGRID3.4數據庫(https://thebiogrid. org/)[5]。
人肝癌細胞HepG2由本實驗室傳代保管;FBS購自法國Biowest公司;DMEM培養基購自美國Gibco公司;hsa-miR-3661 mimic、miRNA mimic control和miRNA negative control(5Cy3)購自廣州銳博;酶標儀購自美國BioTek公司;Cell Counting Kit-8 試劑盒購自美國Sigma公司;培養箱購自日本Panasonic公司。
1.2 方法
1.2.1 miR-3661的基因預測與功能富集分析 使用miRanda(版本Aug.2010)(http://www.microrna. org/)[6]對miR-3661靶基因進行預測,實驗證實的靶基因獲取自miRTarBase(6.0版本)數據庫。使用DAVID(6.7版本)[7]對miR-3661靶基因進行GO[8]與KEGG通路富集分析,以P值<0.05作為顯著性閾值。
1.2.2 miR-3661的p53結合位點篩選與p53-miR-3661調控網絡構建 設定miRNA的TSS上游10 kb和下游1 kb作為miRNA啟動子區域。將基于p53 ChIP-seq數據[9]獲取到的p53結合位點與miR-3661的啟動子區進行比對確定miR-3661的p53結合位點,整合miR-3661靶基因與BioGRID蛋白相互作用數據,使用Cytoscape(版本3.3.0)[10]軟件構建調控網絡。
1.2.3 miR-3661 對HepG2 細胞增殖的影響 設置HepG2 細胞 hsa-miR-3661 mimic 轉染和HepG2 細胞熒光陰性對照 mimic 轉染,細胞處理72 h后進行CCK-8細胞增殖檢測,計算生長抑制率:生長抑制率(%) =(1-實驗組平均OD值/對照組平均OD值)×100%。
2 結果
2.1 hsa-miR-3661基本信息
通過Dox誘導肝癌HepG2細胞,進行小RNA測序(small RNA sequencing)(兩次生物學重復)后發現了33條受p53調控的顯著差異表達miRNA。篩選標準:(1)在兩組樣品中表達倍數變化均滿足|log2(fold change)|> 1;(2)至少在一個樣品中 reads數大于10;(3)至少在一個樣品中滿足P < 0.01。我們發現hsa-miR-1277、hsa-miR-146b、hsa-miR-3661、hsa-miR-3662、hsa-miR-371a、hsamiR-4485 和hsa-miR-4521這7條miRNA在先前的肝癌研究中并未有相關報道。通過qRT-PCR證實發現,在Dox處理HepG2細胞24 h后,miR-3661表達量上調顯著(上調10.17倍),因此推測miR-3661在肝癌細胞HepG2的調控中可能發揮重要作用。為此選取miR-3661對其進行了一系列的分析與驗證。首先我們對miR-3661的基本信息進行了分析,miR-3661位于人類的第5號染色體,前體長96 bp,具有典型的莖環結構,染色體定位:chr5:134225757-134225852[+],成熟序列:UGACCUGGGACUCGGACAGCUG。在UCSC基因組瀏覽器中顯示miR-3661具有高度的保守性(圖1)。
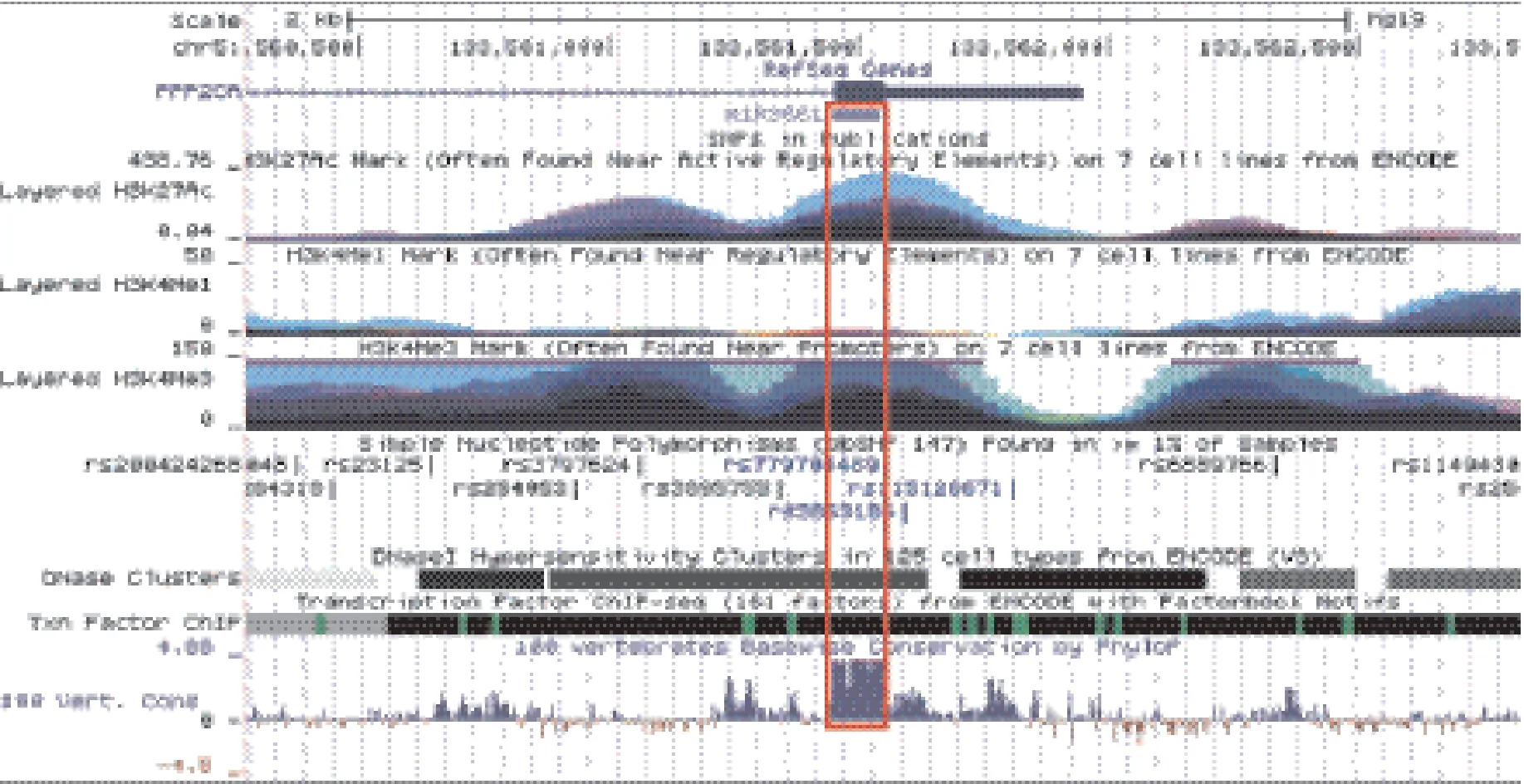
圖1 hsa-miR-3661組蛋白修飾、臨近基因、保守性
2.2 hsa-miR-3661調控靶基因預測與GO與KEGG通路功能富集分析
MiRanda軟件預測得到靶基因1 009個,miRTarBase實驗證實靶基因30個。通過DAVID對miR-3661的靶基因進行功能富集分析表明,hsamiR-3661的靶基因顯著富集于p53調控腫瘤相關生物學進程,如細胞凋亡、細胞周期阻滯、細胞遷移、細胞生長、細胞黏附、細胞分化和增殖(圖2)。其中SMAD3、GSK3B、MSX1、THBS1、TGFBR1、PTEN、WNT4、CDKN1A及TFAP4參與了上述絕大多數的生物學進程。
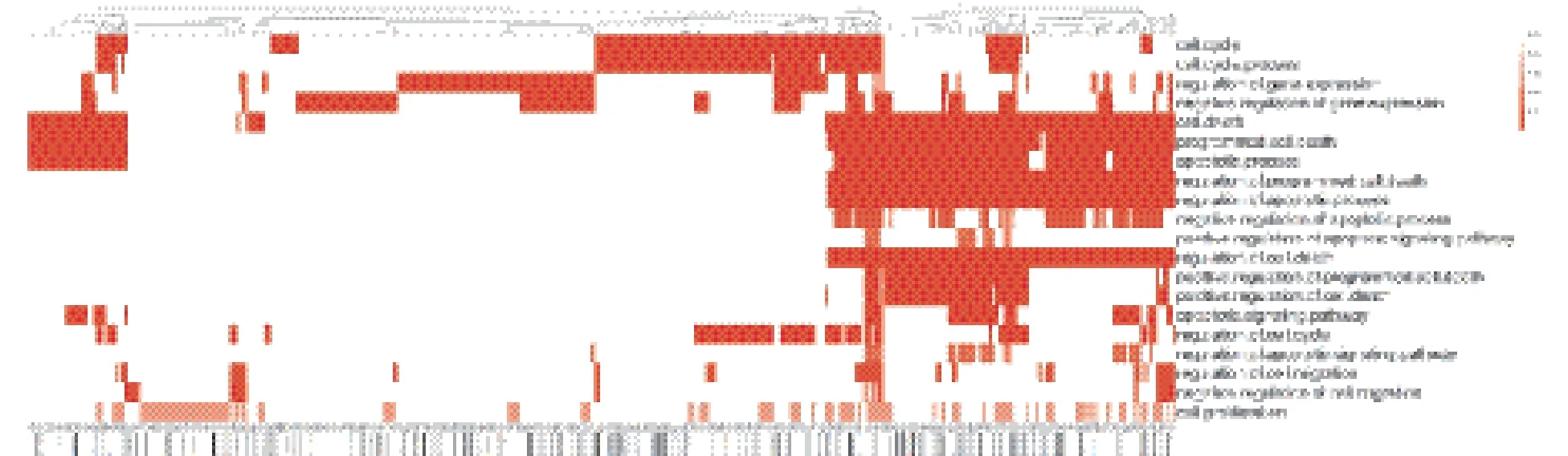
圖2 369個靶基因參與20個癌癥相關生物學功能熱圖
通過對KEGG通路進行富集分析表明,hsa-miR-3661的靶基因顯著富集于癌癥信號通路、MAPK信號通路和ErbB信號通路腫瘤相關通路(圖3)。如miRNA-3661富集到pathway in cancer通路的有34個靶基因:CYCS、akt2、TGFB3、bcr、RXRA、wnt5b、TRAF5、AXIN2、ARNT、NFKB2、FGF2、Egf、PTENP1、PPARG、tgfbr、TGFA、GSTP1、egfr、Epas1、Stat5b、NFKB1、rassf5、WNT4、Skp2、sufU、ARNT2、AXIN1、SMAD3、PTK2、IGF1R、 HIF1A、CDKN1A、GSK3B和DAPK1。其中AXIN1、SMAD3、PTK2、IGF1R、HIF1A、CDKN1A、GSK3B和DAPK1這8個基因同時也是p53的靶基因。
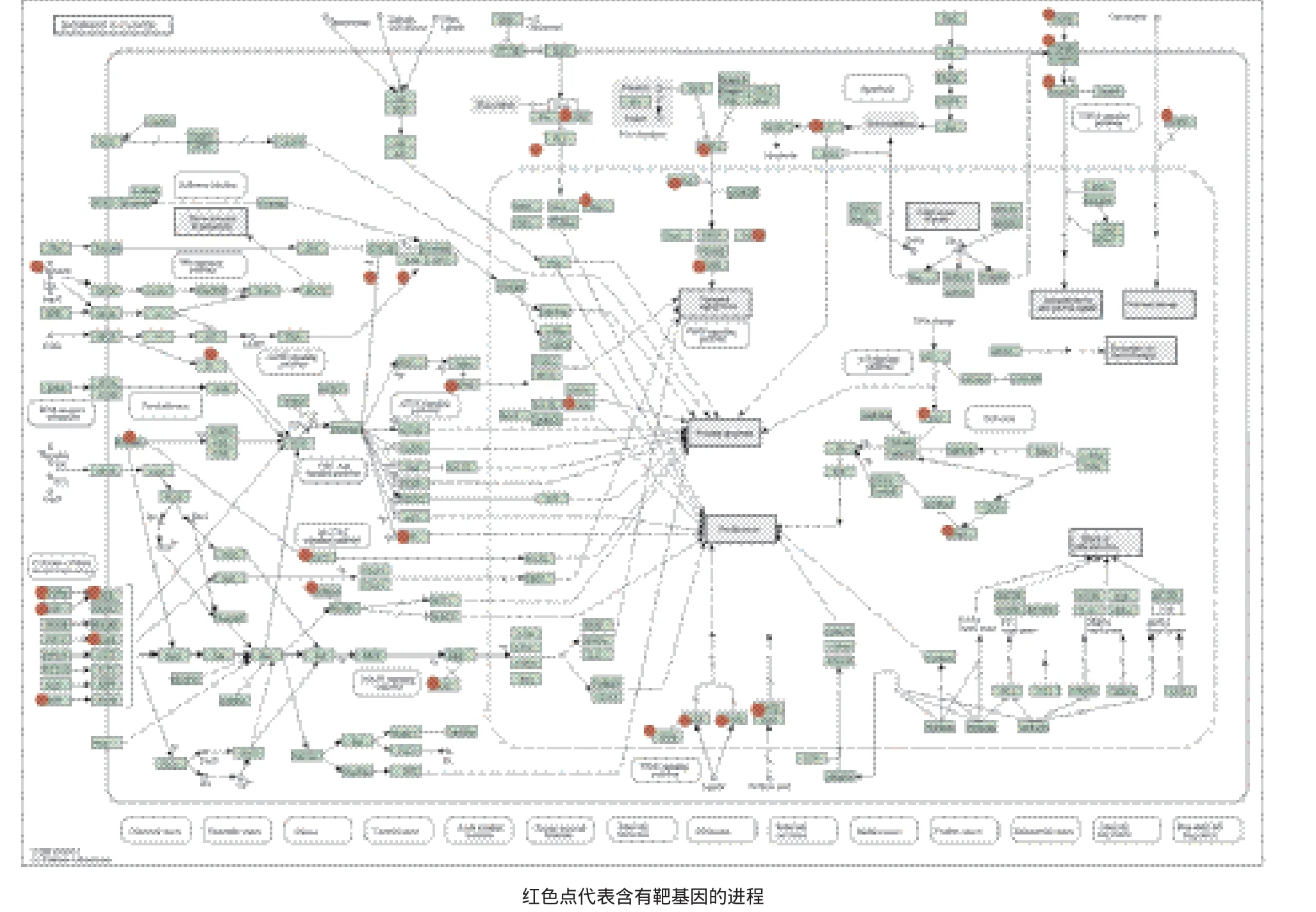
圖3 癌癥中的信號通路
2.3 hsa-miR-3661假定啟動子區p53的結合位點分析
將5個p53 ChIP-seq的p53轉錄位點(TFBS)數據與miR-3661的啟動子區域對比后發現在miR-3661的啟動子區存在一個p53結合位點,在5號染色體的133561448-133561543區域,位于TSS下游79 kb處(圖4),p53-DNA結合序列為:GCTGCAGCTGCTTGTGG。這一結果說明p53直接相互作用于miR-3661,并且誘導miR-3661表達上調從而調控下游靶基因功能。

圖4 miR-3661轉錄啟動位點與p53結合位點
2.4 p53-miRNA-mRNA調控網絡圖
MiR-3661靶基因參與的網絡復雜,為了提取和p53以及腫瘤相關的子網絡,我們對參與p53關鍵生物進程(細胞周期、細胞凋亡與細胞增殖)的miR-3661的143個靶基因進行了調控網絡圖繪制(圖5)。從BioGRID獲取了這143個靶基因的268組人蛋白相互作用數據,使用Cytoscape軟件對p53、miR-3661及參與細胞周期、細胞凋亡與細胞增殖的靶基因進行了網絡構建。從圖中可以看到,MSX1、 HIF1A、MELK、SOD2、HIPX2、CYP1B1和CLU同時參與細胞凋亡和細胞增殖的調控;BTG2、TFAP4、THBS1、ING4、E4F1、MDM4、GFBR1和SMAD3同時參與細胞周期與細胞增殖的調控;MYBBP1A參與細胞周期與細胞凋亡的調控;而ERN1和CDKN1A同時參與細胞周期、細胞凋亡與細胞增殖的調控。2.5 MiR-3661抑制HepG2細胞增殖
通過轉染miR-3661來檢驗其是否對肝腫瘤細胞HepG2有明顯抑制作用。首先通過熒光顯微鏡觀察轉染效率(圖6),發現熒光陰性對照mimic成功轉入至 HepG2細胞內,在綠色熒光的激發下呈紅色,轉染效率較高,可達80%以上。檢測結果(圖7)表明,在HepG2中過表達miR-3661顯著抑制了細胞的增殖過程,抑制率為 25.70%,P-value = 0.001 460 497,差異顯著。
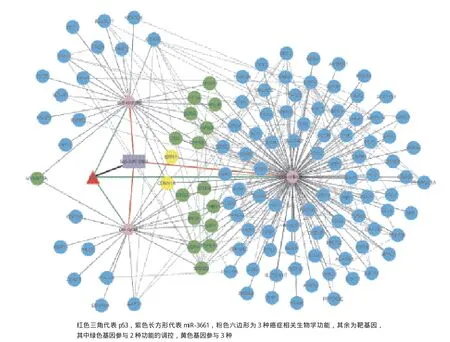
圖5 p53-miRNA-mRNA調控網絡圖
3 討論
本文從生物信息學與分子生物學實驗兩個角度證實hsa-miR-3661作為p53調控因子參與了肝癌細胞HepG2的腫瘤相關進程并抑制其增殖。MiRNA-3661位于人類的5號染色體上,發現其前體RNA(pre-miRNA)具有典型的莖環結構,經過加工,形成22 nt的單鏈RNA,這一長度與大多數的miRNA的長度一致。通過miRanda預測得到1 009個miRNA靶基因,其中有5條已被實驗證實。對靶基因進行GO功能富集分析表明,369個miR-3661的靶基因顯著富集于細胞周期、細胞凋亡、癌癥通路、細胞增殖等多種與腫瘤相關的生物學進程中。這些參與生物進程的基因中,有研究表明TGF-β1會通過p53的表達上調來促進細胞周期蛋白激酶CDK的活性來調控細胞周期,而SMAD3會終止這一過程[11];THBS1作為腫瘤特異性的細胞外基質蛋白,已發現在口腔鱗狀細胞癌中促進癌細胞遷移[12];而TFAP2C可通過上調TGFBR1進而激活PAK1信號從而促進腫瘤發展[13];PTEN作為公認的抑癌基因,在多種癌癥中表現出對癌細胞增殖的負調控;WNT4屬于WNT蛋白,在動物發育中起到重要作用,表達異常可能引起腫瘤;TFAP4參與調節眾多細胞增殖和基因表達,在結腸直腸癌和其他一些人類惡性腫瘤中表達上調,與有絲分裂的保真性密切相關[14]。同樣是在結腸直腸癌,研究發現GSK3B驅動了結腸直腸癌向IV期的發展[15]。使用KEGG通路分析發現miR-3661靶基因參與3種腫瘤相關通路。癌癥通路共富集34個靶基因,P值為0.000 48;ErbB信號通路共富集21個靶基因,P值為0.00 79;MAPK信號通路共富集23個靶基因,P值為0.037。在參與的通路中,已知AXIN1是抑癌基因,在Wnt通路中可作為抑制劑來下調信號通路中主要的效應分子[16];PTK2的高表達與腫瘤復發相關[17];IGF1R的表達上調會促進腫瘤的發生[18];而在對胃癌的相關報道中,HIF1A的高表達會促進胃癌細胞血管的再生,導致預后差[19];DAPK1(死亡相關蛋白激酶1)具有腫瘤抑制功能,并介導多種細胞過程,包括細胞凋亡和自噬[20]。
結合p53ChIP-seq數據進行分析,我們發現miRNA-3661的假定啟動子區存在一個p53結合位點,位于5號染色體的133561448-133561543區域,TSS下游79 kb處,且處于miR-3661轉錄本的莖環結構域,這種情況在研究人類基因保守的TFBS時曾被報道過:TFBS可位于miRNA的pre-miRNA區域[21]。為了從系統生物學角度闡明p53、miR-3661以及其靶基因之間的調控關系,我們構建了三者的調控網絡圖。從圖中我們發現有兩個基因:ERN1和CDKN1A,它們可同時被p53與miRNA-3661調節并可作用于p53關鍵的生物學進程:細胞周期、細胞凋亡和細胞增殖。已在乳腺癌的研究中證實,使用激酶抑制劑抑制ERN1后,會使乳腺癌細胞致瘤性下降,與Strietz等人發現的在乳腺癌中ERN1能夠抑制潛在的腫瘤啟始細胞現象一致[22]。同時CDKN1A(p21)也已經有實驗證實可以作為抑制前列腺癌增長的藥物靶向位點[23]。

圖6 HepG2細胞轉染效率
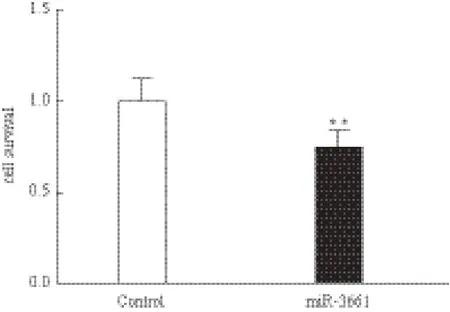
圖7 hsa-miR-3661抑制HepG2細胞增殖
前期我們通過realtimePCR實驗,證實經阿霉素處理24 h后HepG2細胞中miR-3661表達量相比對照組上調了10.17倍,這與我們前期的小RNA測序結果一致。p53作為腫瘤抑制轉錄因子其正調控的靶基因在p53表達上調后應當呈現與p53一致的生物學功能,如參與抑制細胞增殖。miR-3661作為p53的正調控靶基因,其生物學功能也應當具備抑制細胞增殖的能力,為此通過CCK-8細胞增殖實驗證實在HepG2中過表達miR-3661顯著抑制了細胞的增殖過程,抑制率為 25.70%,這與預期的miR-3661功能相一致。
4 結論
MiRNA-3661序列保守并存在p53結合位點,顯著參與腫瘤相關細胞周期調控、細胞增殖、細胞凋亡等腫瘤相關生物學過程,同時也顯著參與癌癥信號通路、MAPK信號通路與ErbB信號通路。p53、hsa-miR-3661和靶基因的調控網絡從系統生物學角度闡述了參與腫瘤生物進程的關鍵靶基因。實驗證實過表達miR-3661可以顯著抑制肝癌細胞HepG2的增殖過程(P-value= 0.00146)。
[1]Yang JD, Roberts LR. Epidemiology and management of hepatocellular carcinoma[J]. Infectious Disease Clinics of North America, 2010, 24(4):899-919.
[2]Liu J, Zhang C, Feng Z. Tumor suppressor p53 and its gain-offunction mutants in cancer[J]. Acta Biochimica et Biophysica Sinica, 2014, 46(3):170-179.
[3]Yang Y, Liu W, Ding R, et al. Comprehensive expression profiling and functional network analysis of p53-regulated MicroRNAs in HepG2 Cells treated with doxorubicin[J]. PLoS One, 2016, 11(2):e0149227.
[4]Agarwal V, Bell GW, Nam JW, Bartell DP. Predicting effective microRNA target sites in mammalian mRNAs[J]. Elife, 2015, 4:e05005.
[5]Chatr-Aryamontri A, Breitkreutz BJ, Oughtred R, et al. The BioGRID interaction database:2015 update[J]. Nucleic Acids Res, 2015, 43(Database issue):D470-478.
[6]Betel D, Koppal A, Agius P, et al. Comprehensive modeling of microRNA targets predicts functional non-conserved and noncanonical sites[J]. Genome Biology, 2010, 11(8):R90.
[7]Huang DW, Sherman BT, Lempicki RA. Bioinformatics enrichment tools:paths toward the comprehensive functional analysis of large gene lists[J]. Nucleic Acids Research, 2009, 37(1):1-13.
[8]Vlachos IS, Paraskevopoulou MD, Karagkouni D, et al. DIANATarBase v7. 0:indexing more than half a million experimentally supported miRNA:mRNA interactions[J]. Nucleic Acids Research, 2015, 43(D1):D153-D159.
[9]Zeron-Medina J, Wang X, Repapi E, et al. A polymorphic p53 response element in KIT ligand influences cancer risk and hsa undergone natural selection[J]. Cell, 2013, 155(2):410-422.
[10]Shannon P, Markiel A, Ozier O, et al. Cytoscape:a software environment for integrated models of biomolecular interaction networks[J]. Genome Research, 2003, 13(11):2498-2504.
[11] Park SJ, Yang SW, Kim BC. Transforming growth factor-beta1 induces cell cycle arrest by activating atypical cyclin-dependent kinase 5 through up-regulation of Smad3-dependent p35 expression in human MCF10A mammary epithelial cells[J]. Biochem Biophys Res Commun, 2016, 472(3):502-507.
[12]Pal SK, Nguyen CT, Morita KI, et al. THBS1 is induced by TGFB1 in the cancer stroma and promotes invasion of oral squamous cell carcinoma[J]. J Oral Pathol Med, 2016, 45(10):730-739.
[13]Kim W, Kim E, Lee S, et al. TFAP2C-mediated upregulation of TGFBR1 promotes lung tumorigenesis and epithelial-mesenchymal transition[J]. Exp Mol Med, 2016, 48(11):e273.
[14]D’Annibale S, Kim J, Magliozzi R, et al. Proteasome-dependent degradation of transcription factor activating enhancer-binding protein 4(TFAP4)controls mitotic division[J]. J Biol Chem, 2014, 289(11):7730-7737.
[15] Palaniappan A, Ramar K, Ramalingam S. Computational identification of novel stage-specific biomarkers in colorectal cancer progression[J]. PLoS One, 2016, 11(5):e0156665.
[16]Pe?ina-?laus N, Kafka A, Vladu?i? T, et al. AXIN1 expression and localization in meningiomas and association to changes of APC and e-cadherin[J]. Anticancer Res, 2016, 36(9):4583-4594.
[17]Sethuraman A, Brown M, Seagroves TN, et al. SMARCE1 regulates metastatic potential of breast cancer cells through the HIF1A/PTK2 pathway[J]. Breast Cancer Res, 2016, 18(1):81.
[18]Yasumoto M, Sakamoto E, Ogasawara S, et al. Muscle RAS oncogene homolog(MRAS)recurrent mutation in Borrmann typeIV gastric cancer[J]. Cancer Med, 2017, 6(1):235-244.
[19]Wu Y, Yun D, Zhao Y, et al. Down regulation of RNA binding motif, single-stranded interacting protein 3, along with up regulation of nuclear HIF1A correlates with poor prognosis in patients with gastric cancer[J]. Oncotarget, 2017, 8(1):1262-1277.
[20]Singh P, Ravanan P, Talwar P. Death associated protein kinase 1(DAPK1):a regulator of apoptosis and autophagy[J]. Front Mol Neurosci, 2016, 9:46.
[21]Piriyapongsa J, Jordan IK, Conley AB, et al. Transcription factor binding sites are highly enriched within microRNA precursor sequences[J]. Biology Direct, 2011, 6:61.
[22]Strietz J, Stepputtis SS, Precac BT, et al. ERN1 and ALPK1 inhibit differentiation of bi-potential tumor-initiating cells in human breast cancer[J]. Oncotarget, 2016, 7(50):83278-83293.
[23]Guo H, Xu Y, Fu Q. Curcumin inhibits growth of prostate carcinoma via miR-208-mediated CDKN1A activation[J]. Tumor Biology, 2015, 36(11):8511-8517.
(責任編輯 李楠)
Bioinformatics Analysis and Functional Verification of p53 Regulating miRNA-3661 in Hepatoma Cell HepG2
LI Yu-peng ZHANG Yi-ming HU Hai-bi KANG Cheng-yu LI Mu-zhou GUO Zhi-yun
(School of Life Science and Engineering,Southwest Jiaotong University,Chengdu 610031)
The aims of this work are to have the bioinformatics analysis of hsa-miR-3661 regulated by p53,which was found in doxorubicin(Dox)inducing the DNA damages of hepatoma cell HepG2 in previous experiment,and to verify its function by molecular biological experiment,providing theoretical basis for the regulating mechanism of miR-3661 in hepatoma cells. After acquiring the structure and sequence information of miR-3661,we predicted the target genes and used DAVID to do the functional enrichment analysis of miRNA target gene. We then analyzed the binding sites of p53 and miR-3661,and built the regulatory network by the interaction among genes. Finally,multiplication experiment verified the functions of miR-3661 in restraining tumor. The results showed that miR-3661 sequence was conserved,and the promoter region existed in the binding site of p53,suggesting that there was direct regulation between p53 and hsa-miR-3661. We predicted that there were 1009 target genes,and 369 genes of them significantly enriched in the biological procedure related to tumor,such as cell cycle regulation,proliferation,apoptosis and so on(P < 0.05),mainly involved in cancer pathway,MAPK signaling pathway,ErbB signaling pathway(P < 0.05). Using the interactions of 2830 groups of genes,we constructed the regulatory network among p53,hsa-miR-3661 and target genes,and analyzed key target gene participating in several tumorous biological process from the perspective of system biology. It was confirmed in the experiment that the overexpression of miR-3661 significantly inhibited the proliferation of hepatoma cell HepG2(P-value= 0.00146). In conclusion,miR-3661 is directly regulated by p53 and its target genes significantly enrich in various biological processes and signal pathways related to tumor. Moreover,the overexpression of miR-3661 significantly inhibits the proliferation of hepatoma cell.
hepatocellular carcinoma;microRNAs;bioinformatics;doxorubicin
10.13560/j.cnki.biotech.bull.1985.20170005
2017-01-12
中央高校基本科研業務費專項資金(2682016YXZT04),國家大學生創新性實驗計劃項目(201610613066)
李宇鵬,男,研究方向:生物信息學;E-mail:15234151228@163.com
郭志云,男,副教授,研究方向:腫瘤生物信息學;E-mail:zhiyunguo@gmail.com

