穩(wěn)定表達(dá)綠色熒光蛋白肝癌大鼠腫瘤微轉(zhuǎn)移時間窗的篩選
張 巍, 錢 晟, 朱 梁, 周 波, 楊國威, 劉 嶸, 瞿旭東, 王建華, 顏志平
復(fù)旦大學(xué)附屬中山醫(yī)院介入治療科,上海市影像醫(yī)學(xué)研究所,上海 200032
·論 著·
穩(wěn)定表達(dá)綠色熒光蛋白肝癌大鼠腫瘤微轉(zhuǎn)移時間窗的篩選
張 巍, 錢 晟, 朱 梁, 周 波, 楊國威, 劉 嶸, 瞿旭東*, 王建華, 顏志平
復(fù)旦大學(xué)附屬中山醫(yī)院介入治療科,上海市影像醫(yī)學(xué)研究所,上海 200032
目的: 探討穩(wěn)定表達(dá)增強型綠色熒光蛋白(enhanced green fluorescent protein,EGFP)的肝癌Buffalo模型大鼠腫瘤微轉(zhuǎn)移時間窗。方法: 采用McA-RH7777/EGFP細(xì)胞株皮下注射成瘤后制備瘤塊。取35只Buffalo大鼠,開腹直視下將瘤組織塊種植到肝臟,制備大鼠肝癌模型。觀察模型大鼠生物學(xué)行為,于種植后7、12、18、21、26 d檢測大鼠肝功能后分別處死7只大鼠,熒光顯微鏡下觀察肝內(nèi)腫瘤生長情況、肺轉(zhuǎn)移情況。結(jié)果: 種植后7 d行磁共振成像(MRI)掃描見大鼠肝內(nèi)均有腫瘤提示造模成功。種植后大鼠體質(zhì)量7 d內(nèi)增長不明顯,之后開始增加至21 d達(dá)高峰,隨后開始下降。大鼠肝內(nèi)腫瘤體積7 d時為(13.36±2.90) mm3,12 d時為(162.5±69.71) mm3,26 d時達(dá)(1 683.36±375.02) mm3。肝外轉(zhuǎn)移情況:21 d時肺部出現(xiàn)熒光顯微鏡下可見的小轉(zhuǎn)移灶,26 d時肺部出現(xiàn)肉眼可見多發(fā)小轉(zhuǎn)移灶。肝功能檢測發(fā)現(xiàn)26 d時白蛋白水平較前明顯下降(P<0.05)。結(jié)論: 在穩(wěn)定表達(dá)綠色熒光蛋白的肝癌Buffalo大鼠模型中,12~18 d為肝癌的微轉(zhuǎn)移期,21 d后為晚期肝癌。
肝癌;分期;微轉(zhuǎn)移;大鼠;綠色熒光蛋白
臨床上肝細(xì)胞肝癌(hepatocellular carcinoma, HCC)的治療總體分為手術(shù)治療和非手術(shù)治療。由于HCC早期癥狀不明顯,絕大多數(shù)肝癌發(fā)現(xiàn)時已處于中晚期,無法進行有效的手術(shù)治療[1]。對于符合手術(shù)切除的患者,術(shù)后復(fù)發(fā)率仍較高[2-3]。肝癌術(shù)前的準(zhǔn)確分期對臨床制定合適的治療方案十分重要,對于抑制肝癌的轉(zhuǎn)移和復(fù)發(fā)具有重要意義。
肝癌在生長過程中,癌細(xì)胞從原發(fā)灶脫落,進入淋巴系統(tǒng)、血循環(huán)、骨髓、肺等組織器官中,在相應(yīng)的器官中生長成小于2 mm的微小腫瘤灶,此時無臨床異常表現(xiàn),稱為微轉(zhuǎn)移[4]。臨床主要依據(jù)目前影像學(xué)手段所能發(fā)現(xiàn)的腫瘤轉(zhuǎn)移病灶對肝癌進行分期,發(fā)現(xiàn)時患者已處于臨床轉(zhuǎn)移時期。在腫瘤細(xì)胞從原發(fā)灶脫落到出現(xiàn)臨床影像學(xué)能夠發(fā)現(xiàn)的轉(zhuǎn)移病灶之間,必然有一個時間窗,即肝癌處于微轉(zhuǎn)移的時期。了解這一時間窗具有重要的理論意義和臨床意義。轉(zhuǎn)移早期腫瘤病灶是一個比較容易在藥物干預(yù)或其他干預(yù)下進入“休眠”狀態(tài)的階段。因此對于肝癌分期的深入研究能夠提高分期標(biāo)準(zhǔn),同時對患者治療方案的制定、治療效果的判斷及患者的預(yù)后產(chǎn)生重要的影響。
對于肝癌的動物模型目前國內(nèi)外有較多研究,但是關(guān)于肝癌動物模型的分期研究較少。本研究擬采用McA-RH7777/EGFP細(xì)胞株建立的Buffalo大鼠原位移植性肝癌模型,觀察腫瘤的發(fā)生、發(fā)展,了解從較小的早期肝癌原位生長到出現(xiàn)影像學(xué)能發(fā)現(xiàn)的轉(zhuǎn)移灶的時間窗,其中確立微轉(zhuǎn)移的具體時間,初步探討肝癌在大鼠模型上的腫瘤分期,為后續(xù)肝癌的研究提供基礎(chǔ),為臨床肝癌治療時機及方案的選擇提供參考。
1 材料與方法
1.1 細(xì)胞及動物 大鼠肝癌McA-RH7777細(xì)胞株(American Type Culture Collection公司)加入含10%胎牛血清的DMEM高糖培養(yǎng)基(杭州四季青公司),于5% CO2細(xì)胞培養(yǎng)箱中培養(yǎng)(37℃)。
近交系Buffalo大鼠購自美國Charles River Laboratory公司,8周齡,雄性,體質(zhì)量為(219±11)g,由上海斯萊克實驗動物公司繁殖,復(fù)旦大學(xué)附屬中山醫(yī)院動物實驗中心飼養(yǎng),SPF級。
1.2 主要試劑及儀器 胰酶消化液(美國Difco公司);DMEM高糖培養(yǎng)基(杭州四季青公司);PBS(上海碧云天生物技術(shù)有限公司);Puromycin(美國Sigma-Aldrich公司);1.5T超導(dǎo)磁共振成像儀(配小動物專用線圈,德國Siemens公司);體視顯微鏡(日本Nikon公司);Carestream多模式小動物成像系統(tǒng)(北京東勝創(chuàng)新生物科技有限公司);熒光顯微鏡Leica M205(德國Leica公司)。
1.3 穩(wěn)定表達(dá)綠色熒光蛋白的肝癌大鼠模型建立 參照文獻(xiàn)[5],對慢病毒載體進行包裝,將攜帶增強型綠色熒光蛋白(enhanced green fluorescent protein, EGFP)的慢病毒對McA-RH7777細(xì)胞株進行轉(zhuǎn)染,在含一定濃度Puromycin的培養(yǎng)基中進行篩選和單克隆化,構(gòu)建出表達(dá)EGFP的單克隆細(xì)胞株(McA-RH7777/EGFP)。
用McA-RH7777/EGFP細(xì)胞株采用皮下注射方式在Buffalo大鼠皮下成瘤,成瘤后,制備成1 mm3大小瘤塊。取Buffalo大鼠35只,麻醉后開腹直視下,將瘤塊種植到Buffalo大鼠的肝左葉,制備大鼠肝癌模型。術(shù)后7 d進行磁共振成像(MRI)掃描了解成瘤情況,判定是否造模成功。
1.4 生物學(xué)行為變化 分別在造模當(dāng)天及造模后記錄大鼠體質(zhì)量變化,觀察大鼠的進食、毛色、糞便性狀、活動狀態(tài)及腹部體征等方面的變化。
1.5 大鼠肝腫瘤的變化 于大鼠進行造模后的7、12、18、21、26 d分別處死7只大鼠,記錄腫瘤大小,并抽取下腔靜脈血。大鼠處死后進行徹底尸體檢查,觀察原發(fā)灶情況,記錄測算腫瘤大小。將瘤組織于10%甲醛溶液中固定,石蠟包埋,H-E染色,行病理學(xué)檢測。腫瘤體積(V)=最大徑(a)×最小徑(b)2/2。
1.6 肝外轉(zhuǎn)移情況的檢測 造模后于第7、12、18、21、26天分別處死7只大鼠,進行徹底尸體檢查,取網(wǎng)膜、腸管、肺、膈肌等器官于小動物成像系統(tǒng)及熒光顯微鏡下觀察肝外轉(zhuǎn)移情況,結(jié)合病理切片進一步觀察。
1.7 肝功能變化 在造模后第7、12、18、21、26天在深麻醉下分別處死7只大鼠,處死前開腹,暴露下腔靜脈抽血約2 mL,室溫下3 000 r/min,離心15 min,取上層血清200 μL,放入EP管,-20℃保存。用全自動生化分析儀檢測血清白蛋白(ALB)。
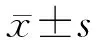
2 結(jié) 果
2.1 Buffalo大鼠移植性肝癌模型的建立 肝內(nèi)接種后7 d,采用MRI掃描35只大鼠,均有腫瘤生長,成瘤率達(dá)100%,隨著時間的延長,腫瘤逐漸增大,證實該模型的穩(wěn)定性。
2.2 大鼠體質(zhì)量及生物學(xué)行為變化 造模大鼠在術(shù)后第1天出現(xiàn)精神萎靡、覓食活動減少,但以上體征均在術(shù)后第3天消失,之后活動情況可持續(xù)隨訪最后處死的一組大鼠(7只),發(fā)現(xiàn)第24天出現(xiàn)活動逐漸減少,反應(yīng)遲鈍,對刺激反應(yīng)減弱,毛發(fā)沒有光澤,其中有3只大鼠腹部肝臟腫瘤所對應(yīng)的位置可見隆起的腫塊,腫塊固定,表面不規(guī)則,考慮為肝臟腫瘤侵犯腹壁所造成。
造模后7 d大鼠體質(zhì)量為(224.57±14.47) g,與造模時體質(zhì)量(217.71±11.32) g相比較無明顯變化,隨后體質(zhì)量開始增長;持續(xù)觀察最后一組大鼠(7只),至21 d體質(zhì)量達(dá)到(276.71±36.9) g,之后體質(zhì)量不增長,開始下降,26 d時體質(zhì)量為(265.71±46.63) g。
2.3 肝臟腫瘤的變化 第7、12、18、21、26天處死大鼠時測量肝腫瘤的長徑、短徑,根據(jù)公式計算體積。結(jié)果顯示:從造模到第7天腫瘤增長緩慢,7 d時測量腫瘤體積為(13.36±2.90) mm3,12 d時較前明顯增大,為(162.5±69.71) mm3(P<0.05);之后腫瘤體積增長迅速,26 d時達(dá)到(1 683.36±375.02) mm3。
解剖發(fā)現(xiàn)第7天腫瘤較小,白色魚肉樣,無周邊浸潤;第12天腫瘤呈膨脹性生長,周邊包膜完整,浸潤不明顯,腫瘤中央未見明顯壞死;第18天發(fā)現(xiàn)腫瘤局部有浸潤,腫瘤中心見少部分壞死灶;21 d后腫瘤明顯增大,周邊浸潤,肝臟原位瘤與周圍網(wǎng)膜、腹壁等發(fā)生輕微粘連;26 d腫瘤進行性增大,與腹壁、網(wǎng)膜粘連加重(圖1、圖2)。
2.4 肝外轉(zhuǎn)移情況 造模后于相應(yīng)時間點處死大鼠,每組進行徹底尸體檢查。取網(wǎng)膜、腸管、肺、膈肌等器官于小動物成像儀及熒光顯微鏡下觀察轉(zhuǎn)移情況。解剖顯示:在第18天前剖驗大鼠未發(fā)現(xiàn)腹壁粘連,無網(wǎng)膜、肺、膈肌等轉(zhuǎn)移;第21天剖驗大鼠,發(fā)現(xiàn)有2只出現(xiàn)網(wǎng)膜包繞腫瘤所在部位,輕微粘連,易分離,網(wǎng)膜、腸管等未見轉(zhuǎn)移灶,肉眼觀察各個肺表面未發(fā)現(xiàn)轉(zhuǎn)移灶,給予熒光顯微鏡下進一步觀察,發(fā)現(xiàn)有1例出現(xiàn)單個微小病灶表達(dá)綠色熒光,直徑小于0.1 mm,該病灶肉眼及普通顯微鏡下不可見,病理切片檢查,發(fā)現(xiàn)其余地方有散在切片能見到的轉(zhuǎn)移灶,但未發(fā)現(xiàn)直徑0.5 mm以上的轉(zhuǎn)移灶;第26天剖驗發(fā)現(xiàn)有4只大鼠肝臟瘤塊與腹壁粘連,腹壁見多發(fā)小結(jié)節(jié)狀轉(zhuǎn)移灶,腸系膜出現(xiàn)轉(zhuǎn)移灶,1只出現(xiàn)少量腹腔積液,5只肺表面見多發(fā)轉(zhuǎn)移灶,散在,肉眼可見,最大直徑約1 mm,熒光顯微鏡下可見到其他肉眼未能顯示的小轉(zhuǎn)移灶(圖1、圖2)。

圖1 熒光顯微鏡下觀察所見
A1、A2為7 d時肝內(nèi)腫瘤;B1、B2為12 d時肝內(nèi)腫瘤;C1、C2為18 d時肝內(nèi)腫瘤,周圍開始浸潤;D1、D2為21 d時肝內(nèi)腫瘤;D3、D4為肺部表面普通顯微鏡看不到轉(zhuǎn)移灶,熒光顯微鏡下發(fā)現(xiàn)表達(dá)綠熒光的微小轉(zhuǎn)移灶;E1、E2為肝內(nèi)腫瘤病灶明顯進展;E3、E4為肺部多發(fā)轉(zhuǎn)移灶;E5、E6為腸系膜轉(zhuǎn)移灶. Original magnification: ×7.8 (D1, D2, E5, E6); ×14 (D3, D4)

圖2 病理切片觀察
A、B:腫瘤在第7、12天時周邊包膜完整,分界清楚,L標(biāo)注為正常肝組織,T為腫瘤組織;C:肝腫瘤浸潤生長;D:隨著腫瘤進展出現(xiàn)多發(fā)子灶(箭頭);E:肺轉(zhuǎn)移灶;F:腸系膜轉(zhuǎn)移灶. Original magnification: ×100
2.5 肝功能變化 在全自動生化分析儀上檢測血清白蛋白(ALB),分別記錄第7、12、18、21、26天時的變化。結(jié)果發(fā)現(xiàn)21 d后ALB下降,但與之前各組相比差異無統(tǒng)計學(xué)意義[(36.57±2.37) g/L、(35.86±2.19) g/L、(35.57±1.81) g/Lvs(33.43±2.07) g/L];在26 d時為(28.8±2.85)g/L,與之前各組相比,差異有統(tǒng)計學(xué)意義(P<0.05)。結(jié)果提示隨著腫瘤進展,肝臟代償功能下降,狀態(tài)逐漸惡化。
3 討 論
HCC早期癥狀不明顯,臨床發(fā)現(xiàn)時多處于中晚期,患者往往失去手術(shù)機會,而且外科手術(shù)切除后的復(fù)發(fā)率較高。肝癌的轉(zhuǎn)移和復(fù)發(fā)是目前影響肝癌預(yù)后的重要因素,腫瘤的轉(zhuǎn)移是導(dǎo)致患者死亡的重要原因[6]。因此臨床上準(zhǔn)確地判斷肝癌的分期尤為重要,針對不同分期選擇不同治療方案,對預(yù)后具有決定性的影響;不恰當(dāng)?shù)姆制冢瑫?dǎo)致患者延誤治療或過度治療。
在肝癌的研究領(lǐng)域,臨床上采用的分期方法較多,存在的爭論也較多。目前存在的分期方法主要有:美國癌癥聯(lián)合委員會(American Joint Committee on Cancer,AJCC)/國際抗癌聯(lián)盟(International Union Against Cancer,UICC)提出的TNM分期以及巴塞羅納工作組提出的BCLC分期等[7-9]。其中BCLC分期是Llovet等[10-11]從臨床治療角度提出的,依據(jù)腫瘤的大小、個數(shù)、Child-Pugh分級、門脈高壓、有無血管侵犯、肝外轉(zhuǎn)移等因素,將肝癌分為早期、中期、進展期、晚期,對每一個時期提出了具體的治療方案,而且對于其預(yù)后有一定的評估,在臨床工作中受到很多研究者的借鑒。
臨床的腫瘤分期方法多是依據(jù)臨床癥狀、化驗結(jié)果、影像學(xué)檢查(CT、MRI、PET-CT等)來確定。而腫瘤的進展是一個多因素、多步驟的動態(tài)過程[12]:原發(fā)灶的腫瘤細(xì)胞不斷增殖,腫瘤新生血管生長;部分腫瘤細(xì)胞從原發(fā)灶脫落,侵襲基底膜進入血管、淋巴管向遠(yuǎn)處遷移;少數(shù)腫瘤細(xì)胞在侵襲和血流遷移過程中存活下來,到達(dá)其他部位或器官;腫瘤細(xì)胞穿出血管形成微小轉(zhuǎn)移灶,腫瘤細(xì)胞繼續(xù)增殖并產(chǎn)生新的血管,這些腫瘤生長后繼續(xù)侵襲和轉(zhuǎn)移。它涉及到細(xì)胞基因、黏附分子及細(xì)胞外基質(zhì)(ECM)、腫瘤血管、機體免疫等多個環(huán)節(jié)。
因此,腫瘤在由極少的細(xì)胞生長至臨床影像學(xué)所能發(fā)現(xiàn)的病灶之間,必然存在一個時間窗。UICC在腫瘤分期中指出:在腫瘤轉(zhuǎn)移中,當(dāng)遠(yuǎn)處轉(zhuǎn)移灶增殖生長到直徑1~2 mm時,稱作微轉(zhuǎn)移。在這個時間窗內(nèi)腫瘤細(xì)胞播散并存活于淋巴系統(tǒng)、血液循環(huán)、骨髓、肺等原發(fā)病灶以外的器官中,形成微小的轉(zhuǎn)移灶,直徑小于2 mm,并且患者無任何臨床表現(xiàn),目前影像學(xué)手段如CT、MRI及病理學(xué)檢查都很難發(fā)現(xiàn)[13-14]。了解這一時間窗具有重要的理論意義和臨床意義。
腫瘤的微轉(zhuǎn)移與患者的預(yù)后密切相關(guān)。Chen等[15]報道在61例行食管鱗狀細(xì)胞癌根治術(shù)的患者中,檢測其骨髓發(fā)現(xiàn)微轉(zhuǎn)移陽性率21.3%(13例),長期隨訪,發(fā)現(xiàn)微轉(zhuǎn)移陽性者的中位生存期、5年無病生存率分別為13個月、7.7%,而骨髓微轉(zhuǎn)移陰性患者的中位生存期、5年無病生存率分別為66個月、69.1%,從而證實骨髓微轉(zhuǎn)移陽性的食管癌復(fù)發(fā)和轉(zhuǎn)移率高,預(yù)后差。Dobashi等[16]對N0期非小細(xì)胞肺癌患者有淋巴結(jié)微轉(zhuǎn)移灶和無淋巴結(jié)微轉(zhuǎn)移灶兩組進行隨訪,發(fā)現(xiàn)無淋巴結(jié)微轉(zhuǎn)移灶組的5年生存率明顯優(yōu)于有轉(zhuǎn)移灶組(87%vs21%)。
研究認(rèn)為轉(zhuǎn)移早期是一個比較容易在藥物干預(yù)或其他干預(yù)下進入“休眠”狀態(tài)的階段,即腫瘤細(xì)胞處于不分裂增殖或分裂增殖與凋亡達(dá)到平衡狀態(tài)。Nakanishi等[17]研究發(fā)現(xiàn),對于皮下接種LacZ基因轉(zhuǎn)染的Lewis肺癌細(xì)胞的小鼠給予不同劑量的替加氟口飼,發(fā)現(xiàn)替加氟可抑制接種癌細(xì)胞后早期小鼠(14 d內(nèi))肺內(nèi)微轉(zhuǎn)移灶的形成,但對于晚期小鼠(22 d后)則無顯著抑制作用。結(jié)果提示微轉(zhuǎn)移初期階段的腫瘤對化療敏感,藥物可以有效抑制微轉(zhuǎn)移灶形成。
肝癌實驗研究中常用Walker-256細(xì)胞株接種SD大鼠及VX2細(xì)胞接種新西蘭大白兔造模進行肝癌的動物實驗研究,但這些均不是肝細(xì)胞癌,其實驗研究結(jié)果應(yīng)用于肝細(xì)胞癌的機制研究中有所欠缺。肝癌裸鼠模型由于缺乏免疫力,并且其動物較小,在影像學(xué)評價、介入治療等方面的使用受到了局限。McA-RH7777細(xì)胞株是Buffalo大鼠低分化肝細(xì)胞癌細(xì)胞株,將McA-RH7777細(xì)胞接種于Buffalo大鼠肝內(nèi),在肝內(nèi)進展特點與人類的HCC相似,能夠分泌甲胎蛋白(alphafetoprotein, AFP),有較高的肺轉(zhuǎn)移率,另外該大鼠本身具有免疫性,而且體積合適,能夠在介入、外科手術(shù)、影像診斷等研究方面作為模型,因此在肝癌的相關(guān)研究中受到重視[18]。
本實驗?zāi)P椭蟹N植的肝癌細(xì)胞標(biāo)記了GFP,其最大優(yōu)點是GFP基因是整合到細(xì)胞的染色體中,細(xì)胞分裂后子代細(xì)胞持有的GFP量與母代完全一樣,能夠永久地標(biāo)記不斷分裂的腫瘤細(xì)胞,模型中非腫瘤細(xì)胞則不表達(dá)熒光[19]。因此其在血液、組織等中能夠直觀、準(zhǔn)確地被檢測到,對于明確腫瘤的進展,確定分期有重要意義。
本次實驗肝功能中未檢測轉(zhuǎn)氨酶情況,考慮該腫瘤為移植型模型,無肝硬化及藥物肝損等背景,在本研究所檢測時間段內(nèi)未必會發(fā)生變化,故未予檢測。
本實驗中造模后至第7天肝臟原位瘤較小,無肝外微小轉(zhuǎn)移灶,肝功能、大鼠一般體征良好,可定為早期肝癌。在造模第7~12天時,腫瘤進行性增大,考慮進入外周血的腫瘤細(xì)胞只有少部分存活下來,觀察其他部位并未發(fā)現(xiàn)表達(dá)熒光的轉(zhuǎn)移灶,處于腫瘤逐漸進展并準(zhǔn)備開始遠(yuǎn)處轉(zhuǎn)移的階段,考慮也可以歸為早期肝癌。造模第12天后考慮隨著原位癌的生長,更多的腫瘤細(xì)胞脫落進入血液循環(huán),形成轉(zhuǎn)移灶的機會大大增加,因此12~18 d這段時間可以定為肝癌的微轉(zhuǎn)移期。造模后第21天肺部出現(xiàn)表達(dá)熒光的轉(zhuǎn)移灶,白蛋白開始下降;26 d后大鼠進食等活動差,遠(yuǎn)處多發(fā)轉(zhuǎn)移,出現(xiàn)腹腔積液,肝功能明顯下降,出現(xiàn)惡液質(zhì)傾向。因此根據(jù)模型觀察,造模18 d后腫瘤細(xì)胞逐漸在遠(yuǎn)處定植,生長形成轉(zhuǎn)移灶,造模第21天時出現(xiàn)表達(dá)綠色熒光的轉(zhuǎn)移灶,相當(dāng)于晚期肝癌。
肝癌的侵襲和轉(zhuǎn)移是臨床醫(yī)師面臨的現(xiàn)實難題,準(zhǔn)確地確定微小轉(zhuǎn)移灶,給予肝癌準(zhǔn)確的分期,可以使肝癌能夠盡早被發(fā)現(xiàn),并得到合理治療。在肝癌動物模型中,本研究結(jié)合原位癌、肝外轉(zhuǎn)移灶、肝功能、大鼠的一般活動狀態(tài)等方面因素,初步探討了解肝癌的早期、微轉(zhuǎn)移期、晚期的時間窗。依據(jù)這些分期,可以在不同的時期,評價相應(yīng)治療方案的療效。如在造模12~18 d的微轉(zhuǎn)移期,給予口服藥物或動脈化療栓塞治療,來評價其對轉(zhuǎn)移和復(fù)發(fā)的影響。該模型的分期方法在諸多方面與臨床仍有很多不同,不能完全反映臨床肝癌的進展情況,而且在不同動物種類及不同飼養(yǎng)環(huán)境等條件下,得到的分期標(biāo)準(zhǔn)有可能不同,但仍可為肝癌防治的基礎(chǔ)研究提供一定參考。
[1] LLOVET J M, DI BISCEGLIE A M, BRUIX J,et al.Design and endpoints of clinical trials in hepatocellular carcinoma[J].J Natl Cancer Inst, 2008,100(10):698-711.
[2] YIN Z, FAN X, YE H, et al. Short- and long-term outcomes after laparoscopic and open hepatectomy for hepatocellular carcinoma: a global systematic review and meta-analysis[J]. Ann Surg Oncol, 2013,20(4):1203-1215.
[3] HUANG J, LI B K, CHEN G H, et al.Long-term outcomes and prognostic factors of elderly patients with hepatocellular carcinoma undergoing hepatectomy[J]. J Gastrointest Surg, 2009,13(9):1627-1635.
[4] GHOSSEIN R A, CARUSONE L, BHATTACHARYA S.Molecular detection of micrometastases and circulating tumor cells in melanoma prostatic and breast carcinomas[J]. In Vivo, 2000,14(1):237-250.
[5] 張 巍, 錢 晟, 瞿旭東, 等. E-cadherin 在經(jīng)動脈栓塞治療肝癌時的表達(dá)及其與肝癌肺轉(zhuǎn)移的關(guān)系[J].中國臨床醫(yī)學(xué), 2015,22(1):10-14.
[6] KOW A W, KWON C H, SONG S, et al.Risk factors of peritoneal recurrence and outcome of resected peritoneal recurrence after liver resection in hepatocellular carcinoma: review of 1222 cases of hepatectomy in a tertiary institution[J]. Ann Surg Oncol, 2012,19(7):2246-2255.
[7] GOH B K, TEO J Y, CHAN C Y, et al.Importance of tumor size as a prognostic factor after partial liver resection for solitary hepatocellular carcinoma: Implications on the current AJCC staging system[J]. J Surg Oncol, 2016,113(1):89-93.
[8] LEI H J, CHAU G Y, LUI W Y,et al. Prognostic value and clinical relevance of the 6th Edition 2002 American Joint Committee on Cancer staging system in patients with resectable hepatocellular carcinoma[J]. J Am Coll Surg, 2006,203(4):426-435.
[9] CILLO U, VITALE A, GRIGOLETTO F, et al. Prospective validation of the Barcelona Clinic Liver Cancer staging system[J]. J Hepatol, 2006,44(4):723-731.
[10] LLOVET J M, BRU' C, BRUIX J.Prognosis of hepatocellular carcinoma: the BCLC staging classification[J]. Semin Liver Dis, 1999,19(3):329-338.
[11] LLOVET J M. Updated treatment approach to hepatocellular carcinoma[J]. J Gastroenterol, 2005,40(3):225-235.
[12] GEIGER T R, PEEPER D S. Metastasis mechanisms[J]. Biochim Biophys Acta, 2009,1796(2):293-308.
[13] KAHN H J, HANNA W M, CHAPMAN J A, et al. Biological significance of occult micrometastases in histologically negative axillary lymph nodes in breast cancer patients using the recent American Joint Committee on Cancer breast cancer staging system[J].Breast J, 2006,12(4):294-301.
[14] GOBARDHAN P D, ELIAS S G, MADSEN E V, et al. Prognostic value of micrometastases in sentinel lymph nodes of patients with breast carcinoma: a cohort study[J]. Ann Oncol, 2009,20(1):41-48.
[15] CHEN S B, SU X D, MA G W, et al. Prognostic value of bone marrow micrometastasis in patients with operable esophageal squamous cell carcinoma: a long-term follow-up study[J]. J Thorac Oncol, 2014,9(8):1207-1213.
[16] DOBASHI K, SUGIO K, OSAKI T, et al. Micrometastatic P53-positive cells in the lymph nodes of non-small-cell lung cancer: prognostic significance[J]. J Thorac Cardiovasc Surg, 1997,114(3):339-346.
[17] NAKANISHI H, KOBAYASHI K, NISHIMURA T, et al. Chemosensitivity of micrometastases and circulating tumor cells to uracil and tegafur as evaluated using LacZ gene-tagged Lewis lung carcinoma cell[J]. Cancer Lett, 1999,142(1):31-41.
[18] WANG G Z, FANG Z T, ZHANG W, et al. Increased metastatic potential of residual carcinoma after transarterial embolization in rat with McA-RH7777 hepatoma[J]. Oncol Rep, 2014,31(1):95-102.
[19] YAMAMOTO N, TSUCHIYA H, HOFFMAN R M. Tumor imaging with multicolor fluorescent protein expression[J]. Int J Clin Oncol, 2011,16(2):84-91.
[本文編輯] 廖曉瑜, 賈澤軍
Screen of time window of stable expression of enhanced green fluorescent for transplanted hepatocellular carcinoma in Buffalo rats
ZHANG Wei, QIAN Sheng, ZHU Liang, ZHOU Bo, YANG Guo-wei, LIU Rong, QU Xu-dong*, WANG Jian-hua, YAN Zhi-ping
Department of Intervention Radiology, Zhongshan Hospital, Fudan University, Shanghai Insitute of Medical Imaging, Shanghai 200032, China
Objective: To discuss the time window of stable expression of enhanced green fluorescent for transplanted hepatocellular carcinoma in Buffalo rats. Methods: McA-RH7777/EGFP cells were subcutaneously implanted into the Buffalo rats' right thighs. Pieces of tumor tissue were implanted into the left lobes of the livers in 35 rats. The weights and serum albumin levels of rats were measured on day 7, 12, 18, 21, 26 after tumor implanted. The subsequent growth, metastasis of the implanted tumors were observed and evaluated with whole-body fluorescence optical imaging system, fluorescent microscopy. Results: The tumors were detected with MRI in all animals on day 7 after tumor implanted. There was no significant growth of weight within 7days, but increased significantly after and reached the peak value at day 21, then decreased. The mean tumor volumes was (13.36±2.90) mm3on day 7, (162.5±69.71) mm3on day 12, increased to (1 683.36±375.02) mm3on day 26 after tumor implanted. With the fluorescent microscopy, micrometastasis tumors can be detected in lungs on day 21 after tumor implanted. Multiple small lung metastases were detected on day 26. The albumin levels on day 26 after tumor implanted were significantly lower than before (P<0.05).Conclusions: The period from 12 to 18 days in the models may be classified as the micrometastasis stage, and it becomes advanced liver cancer after 21 days.
hepatocellular carcinoma; staging; micrometastasis; rat; enhanced green fluorescent protein (EGFP)
2017-01-22 [接受日期] 2017-05-07
國家自然科學(xué)基金(81171432),復(fù)旦大學(xué)附屬中山醫(yī)院人才培養(yǎng)計劃資助項目(2015ZSYYYXQN06,2015ZSYXGG18). Supported by National Natural Science Foundation of China (81171432) and Personnel Training Program of Zhongshan Hospital Affiliated to Fudan University (2015ZSYYYXQN06,2015ZSYXGG18).
張 巍,博士,主治醫(yī)師. E-mail: zhang.wei6@zs-hospital.sh.cn
*通信作者(Corresponding author). Tel: 021-64041990-2533, E-mail: qu.xudong@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2017.20170059
R 735.7
A

