變溫發酵模式下豆瓣醬自然發酵過程中細菌多樣性研究
周紅麗,李 莎,張 靈,蔣立文,譚興和,*
(1.湖南農業大學食品科技學院,湖南 長沙 410128;2.食品科學與生物技術湖南省重點實驗室,湖南 長沙 410128)
變溫發酵模式下豆瓣醬自然發酵過程中細菌多樣性研究
周紅麗1,2,李 莎1,張 靈1,蔣立文1,2,譚興和1,2,*
(1.湖南農業大學食品科技學院,湖南 長沙 410128;2.食品科學與生物技術湖南省重點實驗室,湖南 長沙 410128)
通過DNA提取,聚合酶鏈式反應擴增以及高通量測序技術對不同溫度發酵模式下的豆瓣醬中的細菌進行多樣性分析。結果表明:先低溫后高溫發酵模式下樣品得到了2 081 個操作分類單元(operational taxonomic unit,OTU),而在先高溫后低溫模式中為1 870 個OTU。在門類水平上,2 種發酵模式中的相對豐度值最高的均為厚壁菌門,分別為72.24%(先低溫后高溫)和43.84%(先高溫后低溫);屬類水平上為葡萄球菌屬,其相對豐度值分別為44.13%和32.52%。先低溫后高溫發酵模式下細菌物種的豐富度和多樣性普遍高于先高溫后低溫的發酵模式。
溫度模式;豆瓣醬;細菌;多樣性
傳統發酵豆瓣醬在我國具有悠久的歷史,因為其獨特的生產工藝,以及發酵過程中包含的多種微生物種類,賦予了傳統發酵豆瓣醬特有的風味與功能。近年來,隨著傳統發酵豆制品生產的現代化和產業化以及消費者對食品安全的要求提高,傳統發酵豆瓣醬中的微生物多樣性逐漸成為研究熱點。
隨著科學技術的發展,分子生物學技術,如高通量測序技術在食品微生物多樣性研究中的應用越來越廣泛。利用分子生物學方法在分子水平上研究微生物的多樣性,可以將不同微生物在食品發酵過程中的消長規律以及微生物的種群結構展示出來,同時真實客觀地反映出傳統食品中微生物群落的組成結構和功能[1-4]。研究發現,細菌、酵母菌和霉菌是豆瓣醬發酵過程中的主要菌種,其所占比例分別為細菌占38.46%、酵母菌占12.09%、霉菌占49.45%[5-10],可見細菌在豆瓣醬發酵過程中擔當重要角色。但有些細菌的存在會影響豆瓣醬成品品質,具有潛在安全隱患,如枯草芽孢桿菌、糞鏈球菌以及微球菌等[11-16]。
通過對不同發酵溫度模式下不同發酵時期的豆瓣醬進行DNA提取,聚合酶鏈式反應(polymerase chain reaction,PCR)擴增及高通量測序,研究不同發酵溫度模式下豆瓣醬細菌種群結構多樣性,從而為自然發酵條件下豆瓣醬的質量安全提供有效保證和改進措施。
1 材料與方法
1.1 材料與試劑
蠶豆曲 湖南十三村食品有限公司。
Phusion High-Fidelity PCR Master Mix、DNA Library Prep Kit for Illumina(均為分析純) 紐英倫生物技術(北京)有限公司;產物回收試劑盒、100 bp DNA Ladder 天根生化科技(北京)有限公司;三氯甲烷、Tris-飽和酚、異丙醇、異戊醇(均為分析純) 國藥集團化學試劑有限公司;Trans 15K Marker 北京全式金生物公司。
1.2 儀器與設備
HC-1016高速離心機 安徽中科中佳科學儀器有限公司;DZKW-D-2電熱恒溫水浴鍋 北京市永光明醫療儀器有限公司;Qubit DNA定量儀 北京照生行儀器設備有限公司;7100梯度PCR儀 美國Bio-Rad公司;Hiseq2500高通量測序儀 美國Illumina基因測序儀器公司。
1.3 方法
1.3.1 豆瓣醬的制作
采用不同的發酵模式,即傳統先高溫后低溫發酵溫度模式[16-18]和先低溫后高溫發酵溫度模式。按照湖南特色豆瓣成熟瓣子制作工藝制作成熟瓣子:成曲→加鹽水→拌曲→發酵→養護→成熟瓣子。2 組發酵所加鹽水量、拌曲方式和養護措施都一致,唯一不同的是發酵溫度模式不一樣。將湖南十三村食品有限公司所提供的蠶豆曲6 kg,分成A、B兩組,每組2 個平行,每個平行1 kg,將蠶豆曲與8%鹽和30%水按比例混合,放入密閉的玻璃容器中進行發酵,用鹽將容器口密封,每2 d將蠶豆曲混勻一次,整個發酵階段為30 d。A組采取傳統的先高溫后低溫發酵溫度模式發酵:50 ℃ 10 d→40 ℃ 10 d→30 ℃ 10 d。B組采用先低溫后高溫模式發酵:30 ℃ 10 d→40 ℃ 10 d→50 ℃ 10 d。本實驗取發酵第0、10、20、30天的4 個時間點的樣品,并對其進行編號(表1)。

表1 樣品編號Table 1 Numbers of samples used in this study
1.3.2 不同發酵模式下不同發酵時期豆瓣醬微生物DNA的提取
吸取1 000 μL十六烷基三甲基溴化銨(hexadecyl trimethyl ammonium bromide,CTAB)裂解液至2.0 mL EP管里加入溶菌酶,將適量的豆瓣醬樣品加入裂解液中,65 ℃水浴,倒置搖晃使其混合均勻,保證樣品可以完全裂解。離心取上清液,加酚(pH 8.0)∶氯仿∶異戊醇(25∶24∶1,V/V),顛倒使其混合均勻,12 000 r/min離心10 min。將氯仿-異戊醇(24∶1,V/V)加入上清液中,顛倒使其混合均勻,12 000 r/min離心10 mim。吸取上清液1.5 mL加入離心管里,加入異丙醇,上下搖晃,-20 ℃條件下沉淀。12 000 r/min離心10 min,將液體倒出,盡量避免倒出沉淀。用1 mL 75%乙醇溶液洗滌2 次。加入ddH2O溶解DNA樣品,必要時可于55~60 ℃孵育10 min助溶。加RNaseA 1 μL消化RNA,在37 ℃放置15 min[19-21]。將適量的樣品用無菌水稀釋到1 ng/μL后放置于離心管中,用于檢測樣品DNA的濃度和純度。
1.3.3 PCR擴增[22-23]
將稀釋后的DNA上清液作為模版,使用帶Barcode的特異引物對其進行PCR擴增,16S V4區引物為515F-806R;ITS1區引物為ITS5-1737F、ITS2-2043R。其PCR體系(30 μL)為:15 μL 2×Phusion Master Mix、 3 μL 6 μmol/L Primer、10 μL 1 ng/μL DNA、2 μL ddH2O。反應程序為:98 ℃預變性1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,30 個循環;72 ℃ 5 min。
1.3.4 PCR產物的處理
對PCR擴增產物的濃度進行等濃度混樣,在充分混合均勻后,使用2%的瓊脂糖膠電泳對PCR擴增產物進行純化,選擇主帶大小在400~450 bp之間的序列,割膠回收目標條帶。
1.3.5 豆瓣醬樣品測序
由天津諾禾致源生物信息科技有限公司測定。利用試劑盒構建文庫,使用HiSeq對經過Qubit定量和文庫檢測合格的文庫進行測序。
1.3.6 豆瓣醬細菌測序數據分析
通過Uparse等相關軟件對結果進行分析[10-14],當豆瓣醬樣品序列間的相似性大于97%時就可以判定為同樣的操作分類單元(operational taxonomic unit,OTU)。根據OTUs聚類結果,一方面對每個OTU的代表序列做物種注釋,從而得到相對應的細菌菌落物種信息,以及菌落物種的豐度分布情況。同時,通過計算分析OTUs豐度以及Alpha多樣性,從而得到豆瓣醬樣品內菌落物種的豐富度信息、不同樣品之間或分組之間共有和特有OTUs信息等。另一方面,可以對OTUs進行多序列比對并構建系統發生樹,并進一步得到豆瓣醬不同樣品和分組的群落結構差異,通過主坐標分析(principal coordinate analysis,PCoA)和主成分分析(principal compoments analysis,PCA)、非度量多維尺度分析(non-metric multi-dimensional scaling,NMDS)等降維圖和樣品聚類樹進行展示。
2 結果與分析
2.1 豆瓣醬微生物DNA提取及PCR擴增

圖1 豆瓣醬微生物總DNA提取電泳圖Fig. 1 Electrophoretogram of total bacterial DNA extracted from soybean paste

圖2 PCR擴增產物電泳圖Fig. 2 Electrophoretogram of PCR amplified products
圖1 為不同發酵溫度模式下不同發酵時間14 個豆瓣醬樣品總DNA提取的電泳圖,可以看出所提取DNA的純度符合下一步PCR擴增模板的要求,可以進行下一步的擴增操作。以樣品總DNA作為模板,使用16S rDNA引物進行擴增,結果如圖2所示,PCR產物目的條帶大小正確,條帶明顯,無拖尾片段,總量滿足2 次或者2 次以上建庫需要,可進行后續建庫。
2.2 不同溫度發酵模式下豆瓣醬細菌序列分析
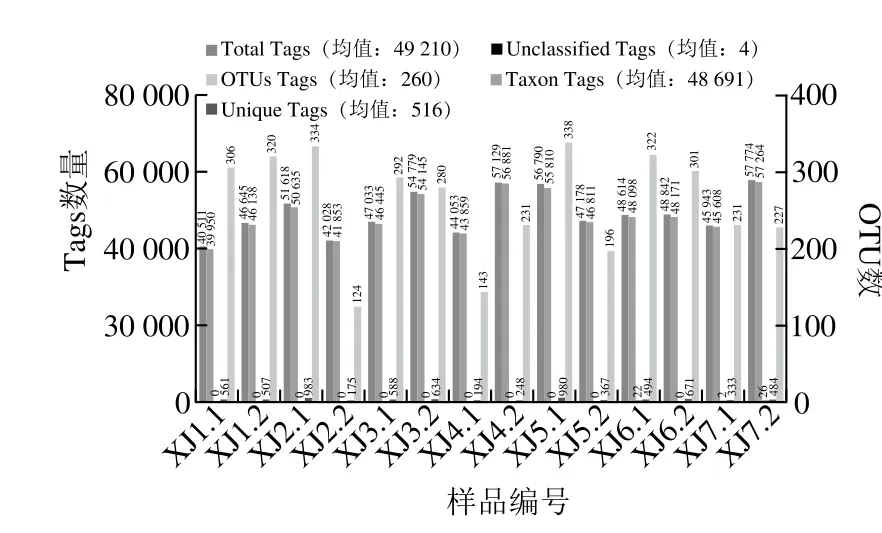
圖3 各樣品的OTUs聚類和注釋情況統計Fig. 3 Statistics of OTUs clustering and taxonomic annotation for all samples
通過對V3~V4區域進行測序,所得到的14 個樣品的拼接序列總數是688 937 條,有效Tags數目達到98.94%,總檢測到OTUs數為3 645。每個樣品的有效序列數量和OTU數量如圖3所示。由圖3可以看出,不管是在先高溫后低溫發酵模式下,還是先低溫后高溫發酵模式下,自然發酵的豆瓣醬中微生物種類較多,物種豐富,這給豆瓣醬風味的形成奠定了基礎,但同時也可能存在安全隱患。

圖4 細菌群稀釋曲線Fig. 4 Rarefaction curves of bacterial colonies
從圖4可知,當測序量低于10 000時,每個樣品的OTU數目呈顯著上升的趨勢,說明在此測序量上樣品物種的多樣性較高,也就是說還有較多的物種沒有被檢測到。但測序數量逐漸增加時,各豆瓣醬樣品中細菌的OTU數目呈緩慢增加,最后在測序量達到40 000時達到一個較為飽和的狀態,說明在此測序量上細菌群落結構的相對可信度比較高,可以較為真實地反映出豆瓣醬發酵過程中的細菌群落。
2.3 不同發酵溫度模式下樣品細菌類群分析
在不同的發酵溫度模式下,不同發酵時期的樣品之間的群落差異相對較大,通過在目、科、屬水平上對細菌群落進行分析,從而了解不同時期豆瓣醬細菌群落之間的差異。

圖5 目水平上物種的相對豐度柱形圖Fig. 5 Relative abundance of bacterial species at the order level
由圖5可知,在先低溫后高溫發酵模式下,芽孢桿菌目(Bacillales)的相對豐度在發酵第10天達到了85.47%。隨著溫度的上升,芽孢桿菌目的相對豐度呈平緩的下降趨勢,與此同時,乳桿菌目(Lactobacillales)的相對豐度逐漸升高,達到了32.18%。而在先高溫后低溫發酵模式下,乳桿菌目的相對豐度隨著溫度的降低而呈現下降的趨勢,同時,腸桿菌目的相對豐度隨著溫度的變化逐漸升高至56.28%。假單胞菌目(Pseudomonadales)、放線菌目(Actinomycetales)、梭菌目(Clostridiales)、根瘤菌目(Rhizobiales)、立克次體目(Rickettsiales)也在樣品中存在。

圖6 科水平上物種的相對豐度柱形圖Fig. 6 Relative abundance of bacterial species at the family level
從圖6可知,隨著發酵溫度的逐漸上升,葡萄球菌科(Staphylococcaceae)在各樣品中的相對豐度逐漸降低。而腸桿菌科(Enterobacteriaceae)的相對豐度逐漸上升至17.71%。當溫度逐漸下降時,腸桿菌科的相對豐度上升至56.29%。每個樣品中還包括了腸球菌科(Enterococcus)、莫拉氏菌科(Moraxellaceae)、芽孢桿菌科(Bacillaceae)、明串珠菌科(Leuconostocaceae)、棒狀桿菌科(Corynebacteriaceae)、乳酸桿菌科(Lactobacillaceae)、毛螺旋菌科(Lachnospiraceae)、生絲微菌科(Hyphomicrobiaceae)。
由圖7可知,在2 種發酵模式中,隨著溫度的上升,葡萄球菌屬(Staphylococcus)的相對豐度呈下降趨勢,但在先低溫后高溫的發酵模式下葡萄球菌屬下降趨勢更明顯。而腸球菌屬(Enterococcus)的相對豐度逐漸上升至28.54%。當溫度逐漸下降時,歐文氏菌屬(Erwinia)的相對豐度逐漸上升。腸球菌屬、歐文氏菌屬、不動桿菌屬(Acinetobacter)、芽孢桿菌屬(Bacillus)、腸桿菌屬(Enterobacter)、棒桿菌屬(Corynebacterium)均在各樣品中存在相應的豐度。
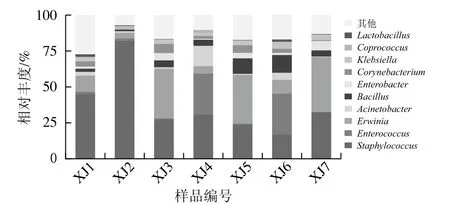
圖7 屬水平上物種的相對豐度柱形圖Fig. 7 Relative abundance of bacterial species at the genus level

圖8 多樣品中特定物種分類樹Fig. 8 Classification tree of bacterial species in multiple samples
通過圖8可知,在不同發酵溫度模式下,不同發酵時期的豆瓣醬中細菌的菌種在門水平上主要分為3 種,即厚壁菌門(Phylum Firmicutes)、放線菌門(Actinobacteria)和變形菌門(Proteobacteria),其相對豐度分別占細菌的62.61%、3.86%和33.53%。厚壁菌門又包括了芽孢桿菌綱和梭菌綱2 類,相對豐度分別為62.12%和0.49%。一類是梭菌綱、梭菌目、毛螺菌科、糞球菌屬。而另一類是芽孢桿菌綱包括了芽孢桿菌目和乳桿菌目,其相對豐度分別為50.85%和11.28%。乳桿菌目又包括了腸球菌科、腸球菌和乳桿菌科、乳桿菌屬、瑞特乳酸菌(Lactobacillus reuteri)。同時,在芽孢桿菌目中葡萄球菌科、葡萄球菌屬、松鼠葡萄球菌(Staphylococcus sciuri)也占有一定的比例,而另一類則為芽孢桿菌科、芽孢桿菌屬、克勞氏芽孢桿菌(Bacillus clausii)、黏瓊脂芽孢桿菌(Paenibacillus polymyxa)。在放線菌門中的菌種為放線菌綱、放線菌目、棒狀桿菌科、棒狀桿菌屬。而在變形菌門、γ-變形菌綱中,包括了2 類菌種,分別為腸桿菌目、腸桿菌科、克雷白氏桿菌屬(Klebsiella)、歐文桿菌屬、腸桿菌屬和假單胞菌目、莫拉菌科、不動桿菌屬、約氏不動桿菌(Acinetobacter johnsonii)。
從圖8可以看出,在先低溫后高溫的發酵模式中,不同發酵時期豆瓣醬中放線菌的比例要小于先高溫后低溫的發酵模式的,而在發酵后期,豆瓣醬中腸球菌、糞球菌屬以及不動桿菌屬的相對豐度的比例要大于先高溫后低溫的發酵模式的菌種的比例。在發酵中期,發酵溫度達到了腸球菌、糞球菌屬以及不動桿菌屬的適宜溫度,其相對豐度比例也就達到了最高,同時,腸桿菌的比例在先高溫后低溫模式發酵后期達到最多,這是由于此時的發酵溫度最適宜腸桿菌的生長。
2.4 2 種發酵模式下發酵豆瓣醬細菌菌落的特征分析
PCoA是用來研究數據之間的差異性或相似性的一種可視化方法,通過分析PCoA可以觀察出豆瓣醬中菌落個體或群體之間的差異。每一個點代表一個豆瓣醬樣本,同一個分組的樣本用相同的顏色來表示,2 個樣本的群落構成差異越小在圖上反映出來就是兩點之間的距離越近。

圖9 基于Weighted Unifrac距離PCoAFig. 9 PCoA based on Weighted Unifrac distance
從圖9可知,在先高溫后低溫發酵模式下樣品XJ3和XJ5距離最近,說明這2 個樣品的群落構成差異較小,其微生物種類的相似性較高。同時,每組之內的2 個重復能夠聚在一起,說明這幾組樣品內重復性好,群落結構存在一致性。在先低溫后高溫發酵模式下,XJ2與其他樣品的距離較遠,說明這組樣品與其他樣品的群落構成具有較大的差異。樣品XJ4和XJ6均在一個象限內,所以其細菌菌落具有一定的相似性。
Alpha多樣性用于分析樣品內的微生物群落多樣性,通過對單個樣品的多樣性進行分析可以反映出樣品內的微生物群落的多樣性和豐富度[24-30]。一般來說,在97%以上的序列一致性下聚類成為一個OTU的序列被認為可能是源自于同一個種的序列。因此,對不同樣品在97%一致性閾值下的Alpha多樣性分析指數進行統計如下(均一化時選取的數據量:臨界值為39 950)。
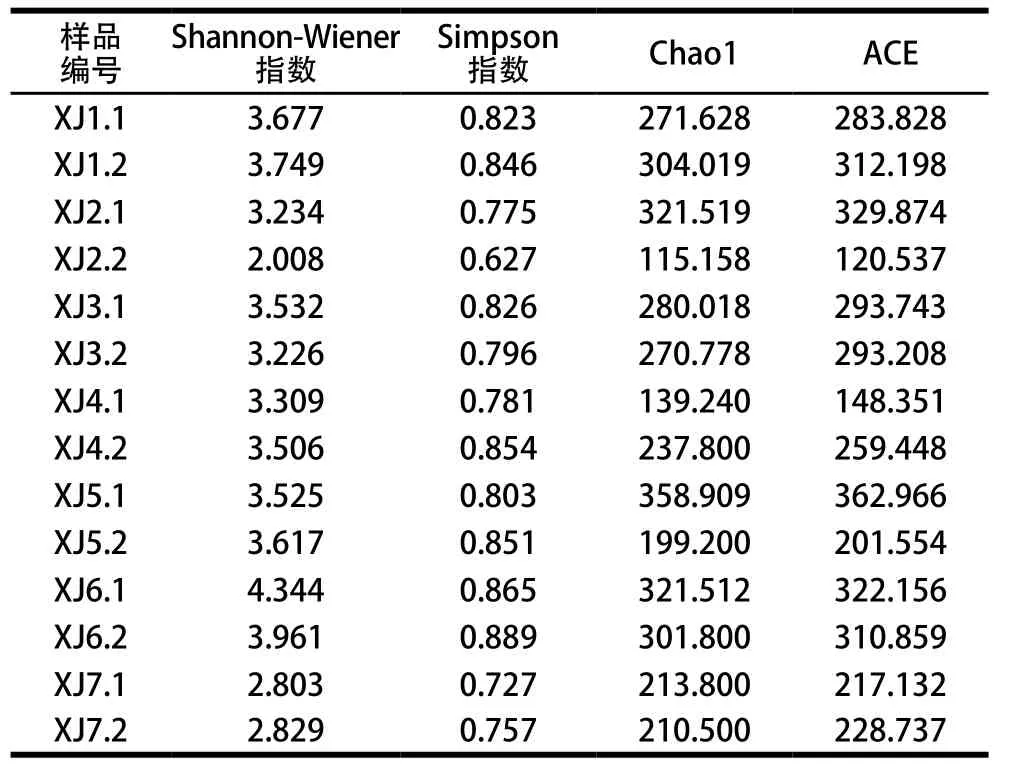
表2 Alpha指數統計Table 2 Alpha index statistics
從表2可知,在先低溫后高溫發酵模式中,樣品物種總數是呈上升趨勢,在發酵至第30天時,其物種總數達到最高,Chao1值為311.656。同時,其群落多樣性也升高,Shannon-Wiener值由發酵10d的2.621升至4.153,由此可見在發酵末期豆瓣醬樣品細菌的物種豐富度和群落多樣性均高于發酵前期及發酵中期。
在先高溫后低溫發酵模式中,樣品物種總數在發酵初期(0~10 d)呈上升趨勢,Chao1值由287.824上升至325.398。但是,樣品群落多樣性逐漸降低,Shannon-Wiener值由最初的3.713降至3.379。當樣品發酵至中期(10~20 d)時,樣品物種總數逐漸降低,但其群落多樣性逐漸升高至3.571。隨后發酵至末期(20~30 d),樣品物種總數逐漸下降至212.150,群落多樣性也逐漸下降至2.816。
2.5 發酵豆瓣醬細菌菌落聚類分析
通過對不同發酵溫度模式下不同發酵時期的豆瓣醬樣品進行聚類分析,并將聚類結果與各樣品在門水平上的物種相對豐度整合展示,從而了解不同發酵時期豆瓣醬樣品間的相似性。

圖10 基于Weighted Unifrac距離的UPGMA聚類樹(先高溫后低溫)Fig. 10 UPGMA clustering tree based on Weighted Unifrac distance
由圖10可知,XJ3和XJ5處于同一個分支下,表明豆瓣醬中的細菌在這2 個時期間的相似度較高,同時,XJ7與XJ3、XJ5又處于同一分支下,即在先高溫后低溫發酵模式中,不同發酵時間所發酵的豆瓣醬中的細菌均具有一定的相似性。從圖10可以看出,在這3 個發酵時期豆瓣醬細菌中的優勢菌落均為厚壁菌門和變形菌門,其次為藍藻細菌。但在發酵后期,即XJ7中,藍藻細菌的相對豐度有所減少。在先低溫后高溫發酵模式中,XJ4和XJ6處于同一個分支下,其中的優勢菌落均為厚壁菌門,XJ1與XJ4和XJ6處于同一個分支下,但又與XJ2具有一定的距離,優勢菌種為厚壁菌門,但其相對豐度與XJ4和XJ6相比有所減少,而變形菌門的相對豐度有所增加。XJ2與XJ4和XJ6具有一定得距離,說明在整個發酵過程中,發酵初期與發酵中、后期的菌落種群的相似性略低,其優勢菌種是厚壁菌門,但其相對豐度要高于其他發酵時期。
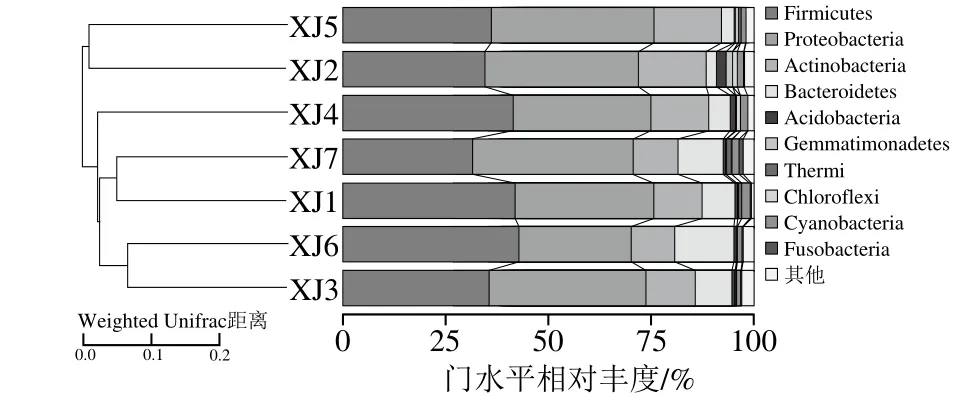
圖11 基于Unweighted Unifrac距離的UPGMA聚類樹(先低溫后高溫)Fig. 11 UPGMA clustering tree based on Unweighted Unifrac distance
由圖11可知,XJ2和XJ5處于同一分支下,說明在先低溫后高溫發酵模式下發酵初期的菌落種群和在先低溫后高溫發酵發酵模式下發酵中期的菌落種群具有一定的相似性。其中的優勢菌種均為厚壁菌門。XJ3和XJ6處于同一分支下,說明這2 個階段的菌落種群具有一定的相似性,其優勢菌種為厚壁菌門,其次是變形菌門、擬桿菌門和放線菌。在先高溫后低溫發酵模式中,XJ1和XJ7處于同一分支下,說明這2 個階段的菌落種群具有一定的相似性,而與MJ3、MJ5在聚類樹上有一定得距離,說明在此發酵階段,發酵后期與發酵初、中期的細菌菌落種群具有一定的差異性。而在先低溫后高溫發酵模式下,各發酵階段的細菌菌落種群均具有一定的差異性。
3 結 論
通對不同發酵溫度模式下不同發酵時期的豆瓣醬樣品進行DNA提取、PCR擴增,運用通高通量測序技術過對不同發酵模式下不同發酵時期的豆瓣醬細菌進行了微生物多樣性分析。研究了2 種發酵模式下豆瓣醬物種的豐富度及其類群分析,發現在先低溫后高溫發酵模式中,豆瓣醬細菌的物種豐富度相對高于傳統發酵模式下的菌種的豐富度。
通過DNA提取,PCR擴增以及高通量測序技術對不同溫度發酵模式下的豆瓣醬中的細菌進行多樣性分析,得出了其中門綱目科屬中最大豐度排名前10的物種在各樣品中的分布情況。了解了主要物種在各樣品中的分布情況,發現樣品間的優勢物種和各樣品中優勢物種間的差異。結果表明:先低溫后高溫發酵模式下樣品得到了2 081 個OTU,而在先高溫后低溫模式中為1 870 個OTU。2 種發酵模式中的優勢門均為厚壁菌門,其相對豐度值分別為72.24%(先低溫后高溫)和43.84%(先高溫后低溫);此外,在各樣品中還發現了放線菌門、擬桿菌門、泉古菌門、酸桿菌門、綠彎菌門、芽單胞菌門等。優勢屬為葡萄球菌屬,其相對豐度值分別為44.13%和32.52%。同時,腸球菌屬、歐文氏菌屬、不動桿菌屬、芽孢桿菌屬、腸桿菌屬、棒桿菌屬均在各樣品中存在相應的豐度。先低溫后高溫發酵模式下細菌物種的豐富度和多樣性普遍高于先高溫后低溫發酵模式的。但是,在樣品物種分析中發現較為優勢的物種包括了葡萄球菌屬、腸桿菌屬、變形菌屬,這可能會對本研究中的發酵豆瓣醬安全性產生一定的影響。
[1] 高秀芝, 王小芬, 李獻梅, 等. 傳統發酵豆醬發酵過程中養分動態及細菌多樣性[J]. 微生物學通報, 2008, 35(5): 748-753. DOI:10.3969/ j.issn.0253-2654.2008.05.018.
[2] 高秀芝, 王小芬, 劉慧, 等. PCR-DGGE分析天源醬園豆醬發酵過程中微生物多樣性[J]. 食品科學, 2011, 32(1): 112-114.
[3] 羅惠波, 黃治國, 李浩, 等. 濃香型大曲真核微生物群落的PCRSSCP解析[J]. 中國釀造, 2009, 28(8): 42-44.
[4] 李曉然, 李潔, 劉曉峰, 等. 利用高通量測序分析云南豆豉中細菌群落多樣性[J]. 食品與生物技術學報, 2014, 33(2): 137-142.
[5] CHIU C M, LIN F M, CHANG T H, et al. Clinical detection of human probiotics and human pathogenic bacteria by using a novel highthroughput platform based on next generation sequencing[J]. Journal of Clinical Bioinformatics, 2014, 4(1): 1. DOI:10.1186/2043-9113-4-1.
[6] 王紹祥, 楊洲祥, 孫真, 等. 高通量測序技術在水環境微生物群落多樣性中的應用[J]. 化學通報, 2014, 77(3): 196-201.
[7] KEMP M, JENSEN K H, DARGIS R, et al. Routine ribosomal PCR and DNA sequencing for detection and identification of bacteria[J]. Future Microbiology, 2010, 5(7): 1101-1107. DOI:10.2217/fmb.10.59.
[8] 杜連起. 風味醬類生產技術[M]. 北京: 化學工業出版社, 2006: 1-6; 66-67.
[9] 丁祖志. 原料預處理工藝對蠶豆醬品質的影響[D]. 無錫: 江南大學, 2011.
[10] 趙建新. 傳統豆醬發酵過程分析與控制發酵研究[D]. 無錫: 江南大學, 2011.
[11] 張琦, 汪先丁, 楊虎, 等. 郫縣豆瓣自然發酵過程中細菌群落結構的變化[J]. 食品與發酵科技, 2010, 46(6): 16-18. DOI:10.3969/ j.issn.1674-506X.2010.06.005.
[12] 燕平梅, 馬雁飛, 倪玲. 發酵食品中微生物多樣性研究方法進展[J]. 中國釀造, 2011, 30(2): 12-14. DOI:10.3969/ j.issn.0254-5071.2011.02.004.
[13] 王洪媛, 管華詩, 江曉路. 微生物生態學中分子生物學方法及T-RFLP技術研究[J]. 中國生物工程雜志, 2004, 24(8): 42-47. DOI:10.3969/j.issn.1671-8135.2004.08.010.
[14] ZHAO J X, DAI X J, LIU X M, et al. Changes in microbial community during Chinese traditional soybean paste fermentation[J]. International Journal of Food Science and Technology, 2009, 44(12): 2526-2530. DOI:10.1111/j.1365-2621.2009.02079.x.
[15] SULTAN M, SCHULZ M H, RICHARD H, et al. A global view of geneactivity and alternative splicing by deep sequencing of the human transcriptome[J]. Science, 2008, 321: 956-960. DOI:10.1126/ science.1160342.
[16] SCHUSTER S C. Next-generation sequencing transforms today’s biology[J]. Nature Methods, 2008, 5(1): 16-18. DOI:10.1038/ nmeth1156.
[17] PALLEN M J, LOMAN N J, PENN C W. High-throughput sequencing and clinical micro biology: progress, opportunities and challenges[J]. Current Opinion in Microbiology, 2010, 13(5): 625-631. DOI:10.1016/ j.mib.2010.08.003.
[18] OROS-SICHLER M, SMALLA K. Semi-nested PCR approach to amplify large 18S rRNA gene fragments for PCR-DGGE analysis of soil fungal communities[M]//STANNARD E. Fungal Biology. New York: Springer, 2013: 289-298. DOI:10.1007/978-1-4614-2356-0_23.
[19] STOECK T, BEHNKE A, CHRISTEN R, et al. Massively parallel tag sequencing reveals the complexity of anaerobic marine protistan communities[J]. BMC Biology, 2009, 7: 72. DOI:10.1186/1741-7007-7-72.
[20] 布仁其其格, 高雅罕, 任秀娟, 等. 不同發酵時期酸馬奶細菌群落結構[J]. 食品科學, 2016, 37(11): 108-113. DOI:10.7506/spkx1002-6630-201611019.
[21] 陳浩. 傳統發酵豆制品中微生物多樣性的研究[D]. 無錫: 江南大學, 2011.
[22] 陳延濤. 發酵乳和豆豉中微生物菌群DGGE分析及益生作用研究[D].南昌: 南昌大學, 2013.
[23] 裴樂樂, 羅青春, 孟霞, 等. 不同原料四川發酵泡菜的細菌多樣性分析[J]. 中國調味品, 2016, 41(2): 39-43. DOI:10.3969/ j.issn.1000-9973.2016.02.008.
[24] 徐鈜繡, 姜麗晶, 李少能, 等. 南大西洋深海熱液區可培養硫氧化微生物多樣性及其硫氧化特性[J]. 微生物學報, 2016, 56(1): 100-106. DOI:10.13343/j.cnki.wsxb.20150160.
[25] 卡依爾·玉素甫, 謝仁娜依·甫拉提, 瑪麗帕·吐拉洪, 等. Ugan古河道胡楊可培養內生細菌的多樣性[J]. 微生物學報, 2011, 51(2): 65-70.
[26] 冀錦華, 王小兵, 孟建宇, 等. 大興安嶺森林表層土壤真菌多樣性的分析[J]. 北方農業學報, 2016, 44(3): 5-10. DOI:10.3969/ j.issn.2096-1197.2016.03.02.
[27] 秦楠, 栗東芳, 楊瑞馥. 高通量測序技術及其在微生物學研究中的應用[J]. 微生物學報, 2011, 51(4): 445-457.
[28] 蔣厚陽, 陳芝蘭, 趙國華, 等. PCR-DGGE法分析西藏傳統發酵乳制品中乳酸菌的多樣性[J]. 食品科學, 2014, 35(1): 167-174. DOI:10.7506/spkx1002-6630-201401033.
[29] 李燕. 黃山臭鱖魚發酵過程中微生物多樣性的研究[D]. 杭州: 浙江工商大學, 2014.
[30] 李宗軍, 江漢湖. 中國傳統酸肉發酵過程中微生物的消長變化[J]. 微生物學通報, 2004, 31(4): 9-13. DOI:10.3969/ j.issn.0253-2654.2004.04.003.
Bacterial Diversity during Natural Fermentation of Soybean Paste under Variable Temperature Conditions
ZHOU Hongli1,2, LI Sha1, ZHANG Ling1, JIANG Liwen1,2, TAN Xinghe1,2,*
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Provincial Key Laboratory of Food Science and Biotechnology, Changsha 410128, China)
The diversity of the bacterial community in soybean paste fermented under variable temperatures was analyzed by DNA extraction, PCR amplification and high-throughput sequencing technology. The results showed a total of 2081 and 1 870 operational taxonomic units (OTU) were obtained from the samples fermented at low temperature first and then high temperature (mode 1) or at high temperature first and then low temperature (mode 2), respectively. Firmicutes was the most dominant phylum for both fermentation modes with an abundance value of 72.24% and 43.84%, respectively. Staphylococcus was the most dominant genus with an abundance value of 44.13% and 32.52% for modes 1 and 2, respectively. The bacterial diversity and abundance of mode 1 were generally higher than those of mode 2.
fermentation mode; soybean paste; bacteria; diversity
10.7506/spkx1002-6630-201714018
TS201.3
A
1002-6630(2017)14-0120-07
周紅麗, 李莎, 張靈, 等. 變溫發酵模式下豆瓣醬自然發酵過程中細菌多樣性研究[J]. 食品科學, 2017, 38(14): 120-126.
DOI:10.7506/spkx1002-6630-201714018. http://www.spkx.net.cn
ZHOU Hongli, LI Sha, ZHANG Ling, et al. Bacterial diversity during natural fermentation of soybean paste under variable temperature conditions[J]. Food Science, 2017, 38(14): 120-126. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714018. http://www.spkx.net.cn
2016-09-14
湖南省教育廳重點項目(14A072);湖南農業大學1515團隊項目
周紅麗(1972—),女,副教授,博士,研究方向為農副產品綜合利用研究、發酵食品研究與開發。
E-mail:xuanxuan310@126.com
*通信作者:譚興和(1959—),男,教授,博士,研究方向為農產品加工與貯藏工程、食品安全。E-mail:xinghetan@163.com

