紫花苜蓿葉蛋白制備抗氧化肽酶解條件優化及氨基酸組成分析
劉 龍,張 煒*,陳元濤,劉海彬,張 琪,高中超,雷 蕾
(青海師范大學化學化工學院,青海 西寧 810008)
紫花苜蓿葉蛋白制備抗氧化肽酶解條件優化及氨基酸組成分析
劉 龍,張 煒*,陳元濤,劉海彬,張 琪,高中超,雷 蕾
(青海師范大學化學化工學院,青海 西寧 810008)
為開發利用苜蓿葉蛋白資源,以紫花苜蓿葉蛋白為原料,利用堿性蛋白酶酶解制備抗氧化肽。在單因素試驗基礎上,以抗氧化活性為指標,選取酶解時間、堿性蛋白酶用量、酶解溫度和pH值為考察因素。采用響應面試驗優化,其最佳酶解條件為酶解時間240 min、堿性蛋白酶用量4.80%、酶解溫度60 ℃、pH 11.60,在此條件下清除率達到64.25%。用制備色譜純化并收集抗氧化性最強的抗氧化肽組分,表明純化后的抗氧化肽具有更強的抗氧化活性。用高效液相色譜測定純化后抗氧化肽的氨基酸組成,其組成為天冬氨酸(Asp)、甘氨酸(Gly)、組氨酸(His)、酪氨酸(Tyr)、纈氨酸(Val)、亮氨酸(Leu)、苯丙氨酸(Phe)、色氨酸(Trp)和賴氨酸(Lys)。
苜蓿葉蛋白;酶解條件優化;抗氧化肽純化;氨基酸組成;清除率;響應面
自由基是生物體新陳代謝過程中產生的一類帶有一個或幾個不配對電子的分子或原子,其化學性質相當活躍并具有高度的氧化活性[1]。研究發現,氧化作用會引起一系列的生物學反應,導致分子、細胞和組織結構的破壞,造成功能損傷,引起心臟病、癌癥和衰老等疾病[2-3]。高活性抗氧化劑的攝入是清除體內過量自由基的一種有效方法。抗氧化劑按其來源不同可分為人工合成抗氧化劑與天然抗氧化劑2 種,但人工合成抗氧化劑因其明顯的毒副作用和安全性問題而受到使用限制[4-5],因此尋找高抗氧化活性的天然成分已成為功能食品領域的研究熱點,抗氧化肽為其典型代表。
抗氧化肽是生物活性肽的一種,具有抑制、延緩脂質氧化,保護人體組織器官免受自由基侵害的作用。它除自身具有營養功能特性外,還具有高安全性、強抗氧化性和易被吸收等特點[6-7],因此在食品、制藥和化妝品等行業中具有極大的潛在利用價值[8]。目前,抗氧化肽主要是通過酶法、發酵法等手段從天然動植物蛋白質中獲得,且已從大豆蛋白、小麥胚芽蛋白、玉米蛋白、花生蛋白、菜籽蛋白等[9]原料中制備出了抗氧化肽。
紫花苜蓿(Medicago sativa L.)為豆科苜蓿屬多年生草本植物,具有產草量高、抗逆性強等特點,素以“牧草之王”著稱[10],我國種植面積居世界第5位。 紫花苜蓿葉含有32%~65%的粗蛋白和40%~40.6%的人體必需氨基酸[11],蛋白質含量豐富、氨基酸種類齊全,營養價值高于大豆、花生餅,非常符合聯合國糧農組織/世界衛生組織的規定標準[12-13],更重要的是紫花苜蓿葉蛋白還含有豐富的抗氧化活性成分[14-15],是制取抗氧化肽的理想材料。
目前,國內外對苜蓿葉蛋白的研究與開發主要停留在提取和營養源水平上,對其抗氧化肽制備及純化分析的研究報道卻很少,且謝正軍等[16]研究發現堿性蛋白酶更適合紫花苜蓿葉蛋白抗氧化肽的水解制備,因此,本研究以紫花苜蓿葉蛋白為原料,采用堿性蛋白酶酶解紫花苜蓿葉蛋白制備抗氧化肽,以1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率為指標,在單因素試驗的基礎上,通過響應面法對酶解條件進行優化,制備色譜純化以獲得抗氧化活性較高的抗氧化肽,并對抗氧化肽的成分進行分析。為紫花苜蓿葉蛋白資源的開發利用和精深加工提供實驗依據和技術參考。
1 材料與方法
1.1 材料與試劑
紫花苜蓿葉蛋白粉由本實驗室泡沫分離提純制備[17];堿性蛋白酶(100 000 U/g) 江蘇銳陽生物科技有限公司;DPPH(分析純) 上海源葉生物科技有限公司;無水乙醇、氯化鈉、氫氧化鈉、鹽酸、三氯乙酸等(均為分析純) 天津市凱信化學工業有限公司。
1.2 儀器與設備
PB-10(數顯)pH計 賽多利斯科學儀器(北京)有限公司;TU-1901雙光束紫外-可見分光光度計 北京普析通用儀器有限責任公司;制備色譜(DAC-HB50動態壓縮柱) 江蘇漢邦科技有限公司;20AT高效液相色譜儀(配二極管陣列檢測器、Inertsustain C18(50 mm×4.6 mm,5 μm)) 日本島津公司。
1.3 方法
1.3.1 紫花苜蓿葉蛋白抗氧化肽的制備
將紫花苜蓿葉蛋白粉配制成質量分數為20%的反應體系,在溫度為50 ℃水浴中預熱處理30 min。處理后調節至實驗設定的酶解溫度和酶解pH值。隨著酶解反應的進行,酶解液的pH值逐漸下降,滴加0.5 mol/L NaOH溶液保持pH值不變,到達實驗設定酶解時間后,將酶解液放入95 ℃沸水中保持5 min滅酶活性,取出冷卻。
1.3.2 DPPH自由基清除率的測定
各取4.0 mL酶解液,依次加入4.0 mL質量分數為16%的三氯乙酸溶液離心分離10 min,各取1.0 mL上清液加蒸餾水定容到100.0 mL,取上述溶液4.0 mL依次與1.0 mL質量濃度為0.025 g/L的DPPH無水乙醇溶液室溫避光反應20 min,在517 nm波長處測吸光度。另取5.0 mL待測樣品避光反應20 min,在517 nm波長處測吸光度;以1.0 mL 0.025 g/L DPPH無水乙醇溶液和4.0 mL蒸餾水反應作為參比,按式(1)計算待測樣品的DPPH自由基清除率[18-19]:

式中:AX為樣品加DPPH無水乙醇溶液的吸光度;AX0為樣品本底吸光度;A0為蒸餾水加DPPH無水乙醇溶液的吸光度。
1.3.3 紫花苜蓿葉蛋白抗氧化肽制備的單因素試驗
以酶解時間240 min、酶解溫度55 ℃、酶解pH 12.0、堿性蛋白酶用量4%為基本條件,固定其他條件不變,設置酶解溫度35、40、45、50、55、60 ℃;酶解時間20、40、60、90、120、150、180、210、240 min;堿性蛋白酶用量1%、2%、3%、4%、5%、6%;酶解pH 8.0、9.0、10.0、11.0、12.0、13.0。以DPPH自由基清除率為指標進行優選試驗。
1.3.4 紫花苜蓿葉蛋白抗氧化肽制備響應面試驗
利用響應面軟件Design-Expert 8.0.6,根據Box-Behnken試驗設計原理,在單因素試驗基礎上,以DPPH自由基清除率為響應值,選擇單因素較優因素及水平進行響應面試驗設計,探究紫花苜蓿葉蛋白抗氧化肽制備的最佳工藝條件組合,因素與水平設計如表1所示。

表1 響應面試驗因素與水平Table 1 Factors and their levels used in response surface analysis
1.3.5 多肽含量的測定
在苜蓿葉蛋白酶解液中加入等體積的16%三氯乙酸溶液,在35 ℃的水浴中反應5 min,然后在高速離心機上離心30 min,取上清液作為待測樣,取1.00 mL的樣品,每個試管中加入堿性銅試劑1.00 mL,混勻,在35 ℃的水浴中反應5 min,冷卻至常溫,再迅速加入Folin-酚試劑4.00 mL,混勻,在55 ℃水浴中反應10 min,冷卻至常溫,以1.00 mL蒸餾水+1.00 mL堿性銅試劑+ 4.00 mL Folin-酚試劑的反應液為空白,在762 nm波長處測定吸光度,以此表示多肽含量。
1.3.6 水解度的測定
取待測液1.00 mL,加入5.00 mL的考馬斯亮藍溶液,混勻后,常溫放置5 min,然后在595 nm波長處進行吸光度測定,空白組以等體積的蒸餾水替待測液。按式(2)計算苜蓿葉蛋白的水解度[20]:
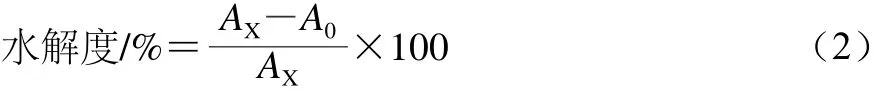
式中:AX為蛋白質溶液水解前的吸光度;A0為蛋白質溶液水解后的吸光度。
1.3.7 抗氧化肽的純化[21-22]
將苜蓿葉蛋白酶解液加入等體積16%的三氯乙酸溶液,在35 ℃的水浴中反應5 min,然后在高速離心機上離心30 min,取上清液,用0.45 μm的TPEF濾膜過濾,將過濾液取2.5 mL注入制備色譜中分離純化。
制備色譜條件:色譜柱:C18(250 nm×12 mm, 10 μm);流動相:V(0.1%三氟乙酸)∶V(乙腈)= 80∶20,等度洗脫;流速10.0 mL/min;柱溫25 ℃;進樣量2.5 mL;檢測波長214 nm。
1.3.8 多肽的水解
取10 mL樣品加入到20 mL的酸解液(V(三氟乙酸)∶V(6 mol/L HCl)=1∶2),在酸液中加入0.2%的苯酚)中[20,23],放入水解瓶中,充入氮氣,密封,放入160 ℃水解60 min。打開水解瓶,用0.1 mol/L的鹽酸定容到10.00 mL。
1.3.9 氨基酸組成分析
氨基酸的柱前衍生:分別準確移取標準品溶液、多肽水解液和水各200 μL,0.1 mol/L的異硫氰酸苯酯的乙腈溶液100 μL,1 mol/L的三乙胺的乙腈溶液100 μL,混勻,室溫放置30 min,加入正己烷400 μL,充分振搖混勻后,靜置10 min,吸取下層溶液,用0.45 μm濾膜濾過,即得標準品、多肽水解液和空白的衍生化溶液[23]。
分析色譜條件:色譜柱:C18(250 nm×4.6mm, 5 μm);流動相:A相0.1 mol/L的乙酸鈉(pH值調至6.5)-乙腈(97∶3,V/V),B相乙腈-水(4∶1,V/V);流速1.0 mL/min;柱溫40 ℃;進樣量20 μL;檢測波長254 nm。進行梯度洗脫[20],梯度洗脫見表2。

表2 液相色譜梯度洗脫Table 2 Gradient elution program for LC analysis
2 結果與分析
2.1 水解度、多肽含量與DPPH自由基清除率的關系

圖1 清除率與酶解時間的關系圖Fig. 1 Effect of hydrolysis time on DPPH scavenging activity of hydrolysates

圖2 多肽含量與酶解時間的關系Fig. 2 Effect of hydrolysis time on polypeptide content of hydrolysates
從圖1可以看出,清除率隨酶解時間的延長而增大,在240 min時達到最大值,從圖2可以看出,多肽含量也隨酶解時間延長而逐漸增大,在120 min時達到最大值,由圖1及圖2能看出,多肽含量和清除率不完全呈正比,這是因為絕大部分具有生理活性的多肽主要是一些分子質量較小的肽段[24],因此不能以多肽含量的大小來衡量紫花苜蓿葉蛋白多肽的抗氧化性。
圖3顯示,水解度隨酶解時間延長逐漸增大,在240 min達到最大值后無明顯變化。對比圖1說明水解度與自由基清除能力之間并不存在線性關系,這是因為制備抗氧化肽的目的是盡可能多地獲得功能性多肽,而水解度過大可能會產生過多不具抗氧化性的游離氨基酸和寡肽,抗氧化多肽含量下降[25-26]。

圖3 水解度與酶解時間的關系Fig. 3 Relationship between degree of hydrolysis and hydrolysis time
2.2 單因素試驗結果
2.2.1 酶解時間的影響
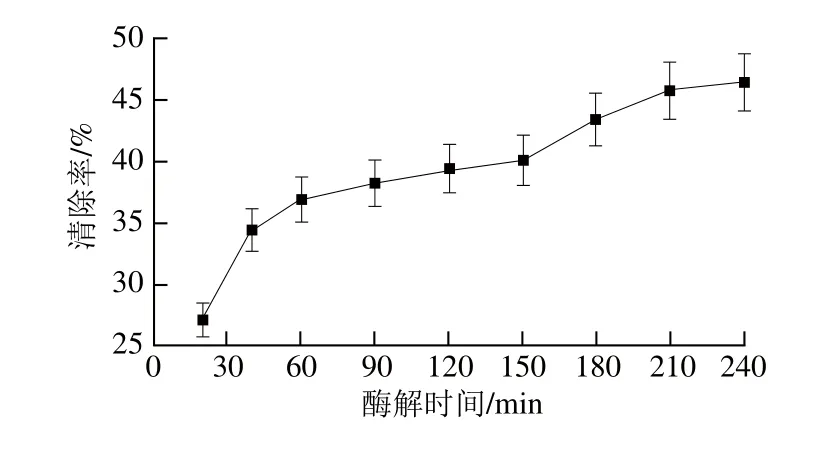
圖4 酶解時間對紫花苜蓿葉蛋白抗氧化肽制備的影響Fig. 4 Effect of hydrolysis time on DPPH scavenging activity of hydrolysates
由圖4可以看出,隨著酶解時間的延長,清除率逐漸增大,但上升速率逐漸趨緩。這是因為酶解反應之初酶解程度較低肽鏈過長,具有抗氧化活性的氨基酸殘基不能暴露出來,顯示不出抗氧化活性。隨著反應進行,當酶解到一定程度后,紫花苜蓿葉蛋白大部分已經酶解,氨基酸殘基完全暴露[27]。這時抗氧化能力隨時間變化趨于穩定,再延長反應時間也不能達到更好的酶解效果,因此選用酶解時間240 min作為下一步研究條件。
2.2.2 酶解溫度的影響

圖5 酶解溫度對紫花苜蓿葉蛋白抗氧化肽制備的影響Fig. 5 Effect of hydrolysis temperature on DPPH scavenging activity of hydrolysates
由圖5可以看出,清除率先隨酶解溫度的升高而增大,達到最大值后,清除率隨溫度的升高而減小。這是因為酶解反應之初溫度較低,隨著溫度的升高,反應速率加快,清除率逐漸增大。但溫度升高到一定程度后,酶蛋白會逐漸變性而失活,引起酶反應速率下降,導致清除率下降,因此選用溫度55 ℃作為下一步研究條件。
2.2.3 堿性蛋白酶用量的影響
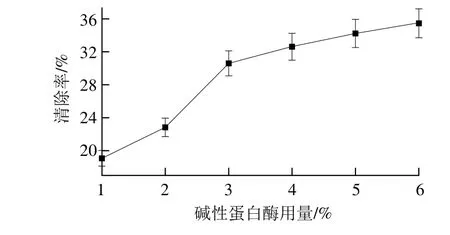
圖6 堿性蛋白酶用量對紫花苜蓿葉蛋白抗氧化肽制備的影響Fig. 6 Effect of alkaline protease concentration on DPPH scavenging activity of hydrolysates
由圖6可以看出,清除率隨堿性蛋白酶用量的增大而增大,但上升速率逐漸趨緩,這是因為在一定底物用量條件下,酶量較低時,清除率隨酶解速率上升明顯。隨著加酶量的逐漸加大,反應體系中酶的用量升高,堿性蛋白酶可能被飽和,導致盡管酶量成倍增加,清除率卻僅有少許的上升[28],因此選用堿性蛋白酶用量4%作為下一步研究條件。
2.2.4 酶解pH值對紫花苜蓿葉蛋白抗氧化肽制備的影響

圖7 酶解pH值對紫花苜蓿葉蛋白抗氧化肽制備的影響Fig. 7 Effect of pH on DPPH scavenging activity of hydrolysates
由圖7可以看出,清除率隨pH值升高而增大,達到最大值后開始減小,這是因為在pH值較小時,酶活性被抑制,清除率小。隨著pH值的逐漸增大,逐漸接近酶的最適pH值范圍,當反應體系pH值達到12.0時清除率最大,這是因為酶的催化作用只有在特定的pH值條件下,才能保持最大催化活性的酶構象[29],因此選用pH 12.0作為下一步研究條件。
2.3 響應面試驗結果
2.3.1 響應面試驗設計與結果
進行四因素三水平試驗設計,共29 個試驗,試驗設計及結果如3表所示。
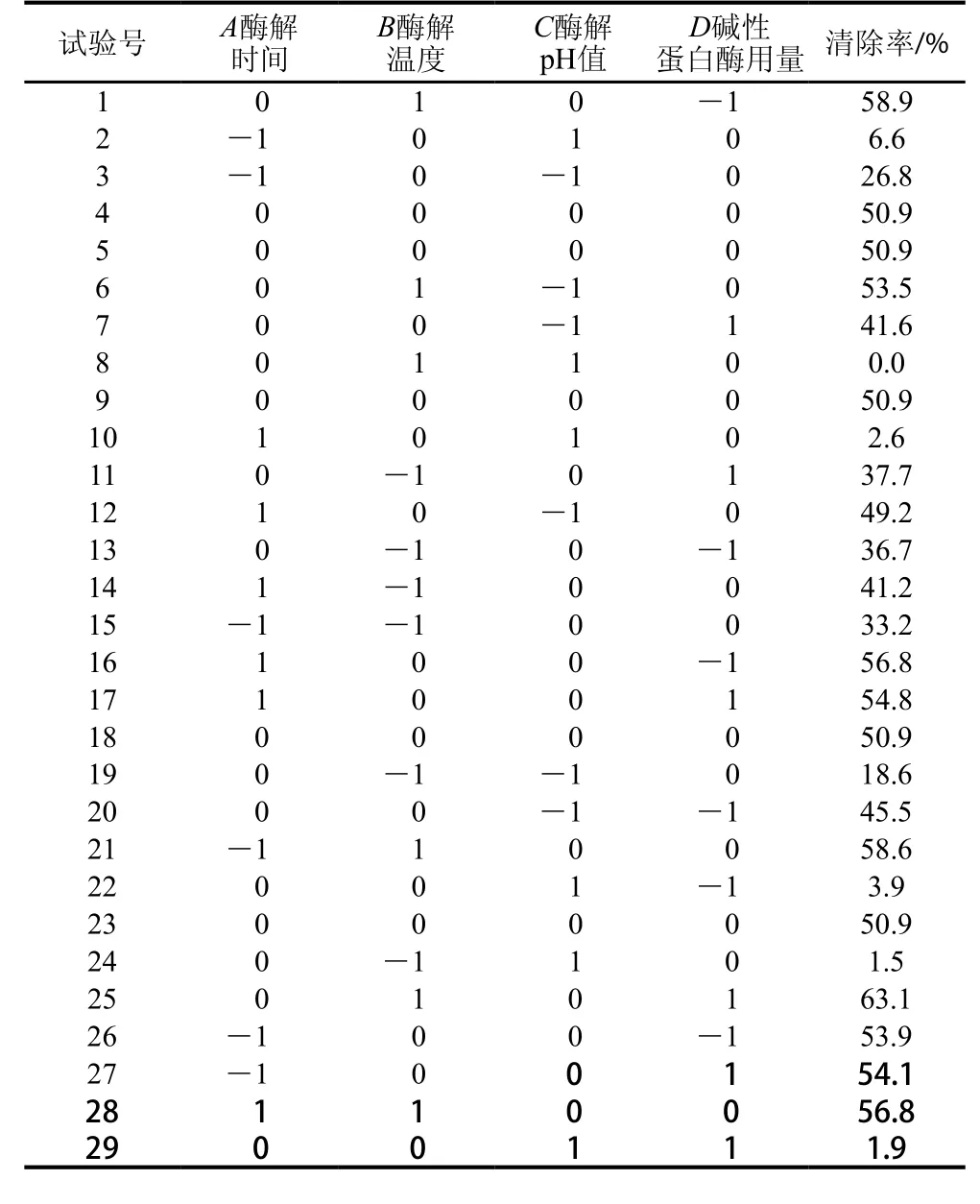
表3 苜蓿葉蛋白水解的響應面試驗設計與結果Table 3 Response surface design with experimental results
運用Design-Expert軟件進行擬合,苜蓿葉蛋白酶解液清除率的響應值經回歸擬合后,得到的最優方程為:清除率/%=0.51+0.024A+0.10B-0.18C-003D-0.024AB-0.066AC-0.091BC-0.038B2-0.30C2+ 0.023D2。對該回歸模型進行差異顯著性檢驗及方差分析,其結果如表4所示。

表4 響應面試驗方差分析Table 4 Analysis of variance of quadratic polynomial equation
由表4可知,模型P值小于0.000 1,說明所建立的模型極顯著。其因變量和全體自變量之間的線性關系顯著(R2=99.05%),說明響應值的變化有99.05%來源于所選變量,即所選的4 個因素基本上決定了苜蓿蛋白水解效率。因此,該回歸方程對試驗擬合情況較好,可以較好地描述各因素與響應值之間的真實關系。A、B、C、AC、BC、B2、C2和D2項的影響顯著;F值越大,因素對響應值的影響越大,影響因素的順序:酶解pH值>酶解溫度>酶解時間>堿性蛋白酶用量。
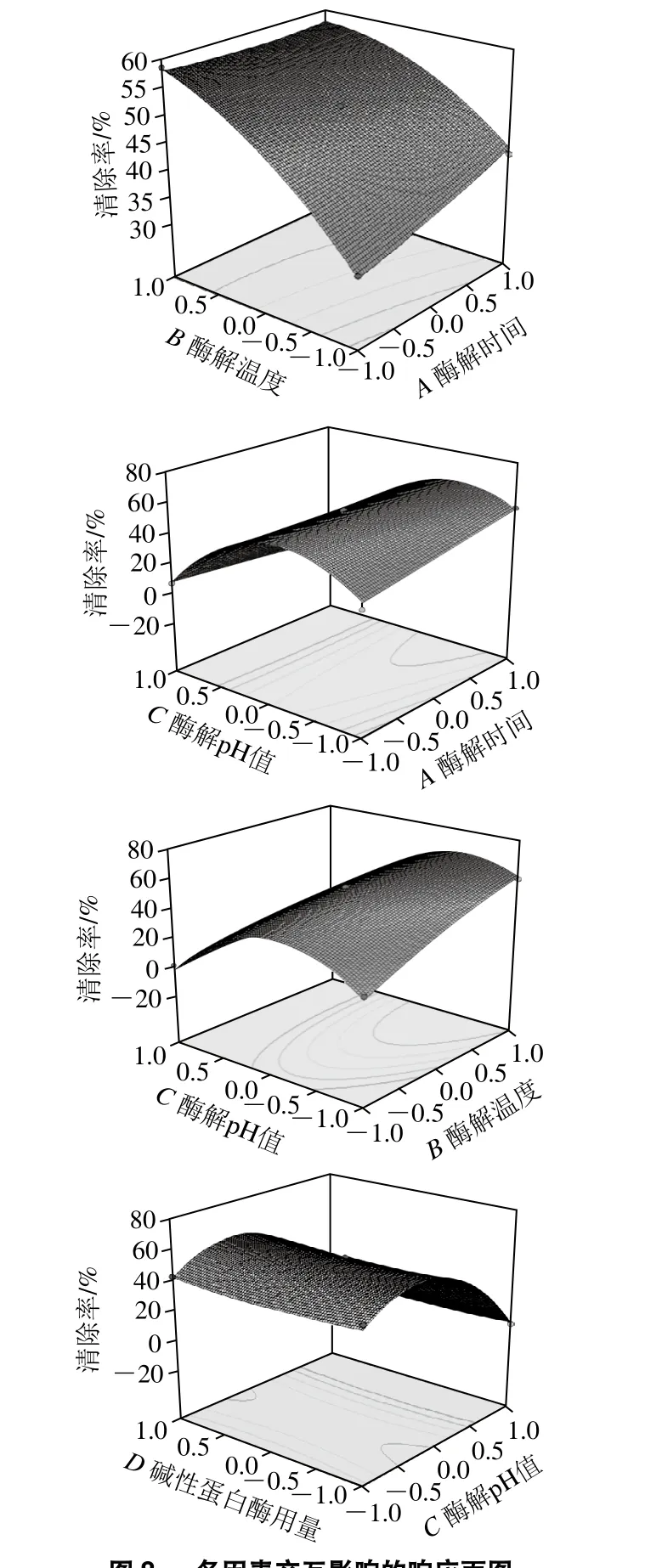
圖8 各因素交互影響的響應面圖Fig. 8 Response surface plots showing the effects of various factors on DPPH scavenging activity of hydrolysates
選擇4 個交互作用的響應面作為代表,如圖8所示,隨著酶解溫度和酶解時間水平的增加,酶解多肽對DPPH自由基的清除率逐漸增加,且酶解溫度的影響明顯強于酶解時間的影響;隨著酶解pH值水平的增加,酶解多肽對DPPH自由基的清除率先增加后降低;隨著堿性蛋白酶用量的增加,酶解多肽對DPPH自由基的清除率基本不變,這是由于酶解溫度、酶解時間和酶解pH值對DPPH自由基清除率的影響明顯強于堿性蛋白酶用量(3%~5%)的影響[30]。因素影響作用的大小與方差分析的結論一致。
2.3.2 模型驗證
為了驗證所建立模型的可信度,利用Design-Expert軟件,選出紫花苜蓿葉蛋白水解最佳預測優化工藝為酶解時間248 min、酶解溫度60 ℃、堿性蛋白酶用量4.85%、酶解pH 11.60,其清除率為65.10%。考慮到實際操作,對選出的優化數據進行相應的調整,其驗證工藝為:酶解時間240 min、酶解溫度60 ℃、堿性蛋白酶用量4.80%、酶解pH 11.60。在此條件下,清除率為64.25%,與模型預測清除率基本相符,說明模型符合紫花苜蓿葉蛋白的水解工藝。
2.4 抗氧化肽的純化
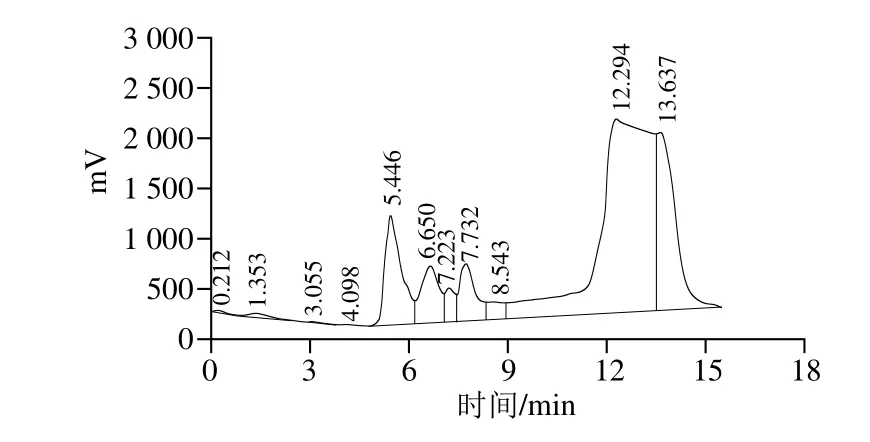
圖9 制備色譜純化高效液相色譜圖Fig. 9 Chromatogram of antioxidant peptide purified by preparative HPLC
將苜蓿葉蛋白酶解液按照1.3.8節中的方法進行分離純化,如圖9所示,收集各個峰的流動相,將各個峰收集的流動相進行多肽含量和對DPPH自由基清除率進行比較,發現最后的一個峰(保留時間12~15 min)的抗氧化性最強。取相同體積最后一個峰收集的流動相和苜蓿蛋白酶解液,然后分別進行多肽含量和DPPH自由基清除率測定,其中流動相多肽的吸光度和苜蓿葉蛋白酶解液的吸光度分別為0.024和0.253,清除率分別為40.43%、43.52%,在清除率基本一樣的情況下,流動相多肽的吸光度(即含量)更小,所以制備色譜純化后的抗氧化肽具有更強的抗氧化能力。
2.5 抗氧化肽氨基酸成分分析
將制備色譜純化好的抗氧化肽按照1.3.8節方法進行水解。將水解得到的氨基酸和氨基酸標準品分別進行柱前衍生,按照1.3.9節分析色譜條件進行梯度洗脫,用高效液相色譜測定抗氧化肽的氨基酸組成。

圖10 氨基酸的高效液相圖譜Fig. 10 High performance liquid chromatogram of amino acids
由圖10可以看出,抗氧化肽組成中含有的氨基酸有天冬氨酸(Asp)、甘氨酸(Gly)、組氨酸(His)、酪氨酸(Tyr)、纈氨酸(Val)、亮氨酸(Leu)、苯丙氨酸(Phe)、色氨酸(Trp)和賴氨酸(Lys)。
3 結 論
通過響應面優化苜蓿葉蛋白水解的工藝,其最優工藝為酶解時間240 min、堿性蛋白酶用量4.80%、酶解溫度60 ℃、pH 11.60,在此條件下清除率達到64.25%。對比制備色譜純化前后的抗氧化肽對DPPH自由基的清除能力,發現純化后的抗氧化肽具有更強的抗氧化能力。此外,用高效液相色譜測定了純化后具有高抗氧化活性肽的氨基酸組成,為紫花苜蓿葉蛋白資源的開發利用和精深加工提供實驗依據和技術參考。
[1] YING L, HUANG L, TIAN G. An improved method for the quantitative determination of uronic acid[J]. Chinese Traditional & Herbal Drugs, 1999, 30(11): 817-819. DOI:10.7501/ j.issn.0253-2670.1999.11.007.
[2] 張吳, 任發政. 天然抗氧化肽的研究進展[J]. 食品科學, 2008, 29(4): 443-447. DOI:10.3321/j.issn:1002-6630.2008.04.100.
[3] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: a review[J]. Peptides, 2010, 31(10): 1949-1956. DOI:10.1016/j.peptides.2010.06.020.
[4] ZHANG T, LI Y, MIAO M, et al. Purification and characterisation of a new antioxidant peptide from chickpea (Cicer arietium L.) protein hydrolysates[J]. Food Chemistry, 2011, 128(1): 28-33. DOI:10.1016/ j.foodchem.2011.02.072.
[5] 陳寧, 孫一, 劉淑瑩. 核桃蛋白酶解物的制備及抗氧化活性[J]. 高等學校化學學報, 2013, 34(1): 72-76. DOI:10.7503/cjcu20120277.
[6] 李京京, 孫文佳, 閔偉紅. 長白山榛子抗氧化肽制備及其活性研究[J]. 食品研究與開發, 2016, 37(10): 1-5. DOI:10.3969/ j.issn.1005-6521.2016.10.001.
[7] 吳定, 孫嘉文, 黃卉卉, 等. 固定化堿性蛋白酶制備麥胚抗氧化肽條件優化[J]. 中國糧油學報, 2016, 31(7): 114-119. DOI:10.3969/ j.issn.1003-0174.2016.07.021.
[8] ANTOLOVICH M, PRENZLER P D, PATSALIDES E, et al. Methods for testing antioxidant activity[J]. Analyst, 2002, 127(1): 183-198. DOI:10.1039/b009171p.
[9] 張海濤, 祝其鋒, 莫麗兒, 等. H2O2對HL-60細胞DNA中8-羥基鳥嘌呤含量影響的研究[J]. 癌變·畸變·突變, 2000, 12(1): 12. DOI:10.3969/j.issn.1004-616X.2000.01.004.
[10] 顧有方, 陳會良, 劉德義, 等. 自由基的生理和病理作用[J]. 動物醫學進展, 2005, 26(1): 94-97. DOI:10.3969/ j.issn.1007-5038.2005.01.029.
[11] 曲敏, 楊大鵬, 梁金鐘, 等. 嗜酸乳桿菌發酵制備苜蓿葉蛋白的研究[J].食品科學, 2011, 32(19): 152-156.
[12] HIRANO R, SASAMOTO W, MATSUMOTO A, et al. Antioxidant ability of various flavonoids against DPPH radicals and LDL oxidation[J]. Journal of Nutritional Science & Vitaminology, 2001, 47(5): 357-362. DOI:10.3177/jnsv.47.357.
[13] FASAKIN E A. Nutrient quality of leaf protein concentrates produced from water fern (Azolla africana, Desv) and duckweed (Spirodela polyrrhiza, L. Schleiden)[J]. Bioresource Technology, 1999, 69(2): 185-187. DOI:10.1016/S0960-8524(98)00123-0.
[14] 唐麗, 魯燕舞, 崔瑾. 光質對苜蓿芽苗菜營養品質和抗氧化特性的影響[J]. 食品科學, 2014, 35(13): 32-36. DOI:10.7506/spkx1002-6630-201413006.
[15] 王靜, 馮娜娜, 王丹, 等. UV-B輻射對紫花苜蓿幼苗品質和抗氧化性的影響[J]. 食品科技, 2016, 41(6): 56-60. DOI:10.13684/j.cnki. spkj.2016.06.014.
[16] 謝正軍, 金征宇. 苜蓿葉蛋白抗氧化肽水解用酶的篩選研究[J]. 食品科學, 2007, 28(7): 342-346. DOI:10.3321/j.issn:1002-6630.2007.07.080. g/10.317.7/jnsv.47.357.
[17] LIU H, ZHANG W, CHEN Y, et al. Technology optimization of Medicago sativa leaf protein separation with foam fractionation[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016. DOI:10.11975/j.issn.1002-6819.2016.09.038.
[18] 趙東升, 馬曉麗, 李新霞, 等. 柱前衍生-高效液相色譜法同時測定可食藥用蔥屬植物中18 種游離氨基酸含量[J]. 藥物分析雜志, 2013(6): 963-968. DOI:10.16155/j.0254-1793.2013.06.006.
[19] 秦垂新, 姚松君, 唐青濤, 等. 抗氧化肽及其化學活性測定方法的研究概述[J]. 食品工業科技, 2014, 35(1): 394-400. DOI:10.13386/ j.issn1002-0306.2014.01.050.
[20] 田洪斌, 趙可意, 孫佳玲. 氨基酸分析法測定復方骨肽注射液中多肽含量[J]. 中國藥事, 2011, 25(8): 816-820. DOI:10.16153/j.1002-7777.2011.08.018.
[21] 耿娟, 王艷玲, 陳麗穎, 等. 反相液相色譜在多肽及蛋白質分離分析中的應用[J]. 廣東農業科學, 2006(12): 133-135. DOI:10.16768/ j.issn.1004-874x.2006.12.048.
[22] 朱曉囡, 蘇志國. 反相液相色譜在蛋白質及多肽分離分析中的應用[J]. 分析化學, 2004, 32(2): 248-254. DOI:10.3321/ j.issn:0253-3820.2004.02.030.
[23] 呂艷, 馮鳳琴. 反相高效液相色譜定量分析多肽中的氨基酸組成[J]. 浙江農業科學, 2006(2): 211-214. DOI:10.16178/ j.issn.0528-9017.2006.02.040.
[24] 馬井喜, 孫永杰, 馮印, 等. 鯉魚肽的酶法制備工藝及其抗氧化性[J].食品科學, 2013, 34(1): 225-229.
[25] 黃明, 王璐莎. 動物蛋白源抗氧化肽的研究進展[J]. 中國農業科學, 2013, 46(22): 4763-4773. DOI:10.3864/j.issn.0578-1752.2013.22.014.
[26] 李俐樺, 殷鐘意, 鄭旭煦. 糯米糠抗氧化肽的制備工藝及自由基清除能力研究[J]. 食品工業科技, 2015, 36(4): 251-254. DOI:10.13386/ j.issn1002-0306.2015.04.046.
[27] 劉英麗, 張慧娟, 王靜, 等. 酶解花生粕制備抗氧化肽工藝研究[J].中國食品學報, 2014, 14(8): 62-68. DOI:10.16429/j.1009-7848.2014.08.008.
[28] 范三紅, 胡雅喃, 何亞. 響應面法優化菊芋渣酶解制備抗氧化肽工藝[J]. 食品科學, 2015, 36(8): 49-53. DOI:10.7506/spkx1002-6630-201508009.
[29] 付剛, 李誠, 馬長中, 等. 豬骨抗氧化肽的酶解制備研究[J].現代食品科技, 2006, 22(3): 136-138. DOI:10.13982/ j.mfst.1673-9078.2006.03.045.
[30] LI X L, WEI Z, CHEN Y T, et al. Optimization of a foam separation process for acid fraction gum from flax seeds by response surface methodology[J]. Separation Science & Technology, 2015, 50(12): 1906-1913. DOI:10.1080/01496395.2015.1014055.
Optimization of Enzymatic Hydrolysis Conditions for the Preparation of Antioxidant Peptides and Amino Acid Composition Analysis from Alfalfa Leaf Protein
LIU Long, ZHANG Wei*, CHEN Yuantao, LIU Haibin, ZHANG Qi, GAO Zhongchao, LEI Lei
(School of Chemistry and Chemical Engineering, Qinghai Normal University, Xining 810008, China)
In order to develop and utilize alfalfa leaves as a good resource of protein, antioxidant peptides were prepared from alfalfa leaf protein by alkaline protease hydrolysis. Through one-factors-at-a-time experiments, hydrolysis time, enzyme concentration, hydrolysis temperature and pH were selected as independent variables for further optimization using response surface methodology, and the response variable was antioxidant activity. The optimum conditions that provided the maximum percentage scavenging of DPPH radical of 64.25% were found to be hydrolysis time of 240 minutes, enzyme concentration of 4.80%, hydrolysis temperature of 60 ℃ and pH of 11.60. Then the most potent antioxidant peptide was purified and collected by preparative liquid chromatography, having stronger antioxidant activity than the crude hydrolysate. The amino acid composition of the antioxidant peptide was determined by high performance chromatography (HPLC) to consist of Asp, Gly, His, Tyr, Val, Leu, Phe, Trp and Lys.
alfalfa leaf protein; optimization of enzymatic hydrolysis conditions; antioxidant peptide purification; amino acid composition; percentage scavenging; response surface methodology
10.7506/spkx1002-6630-201714041
TS201.1
A
1002-6630(2017)14-0263-07
劉龍, 張煒, 陳元濤, 等. 紫花苜蓿葉蛋白制備抗氧化肽酶解條件優化及氨基酸組成分析[J]. 食品科學, 2017, 38(14): 263-269.
10.7506/spkx1002-6630-201714041. http://www.spkx.net.cn
LIU Long, ZHANG Wei, CHEN Yuantao, et al. Optimization of enzymatic hydrolysis conditions for the preparation of antioxidant peptides and amino acid composition analysis from alfalfa leaf protein[J]. Food Science, 2017, 38(14): 263-269. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714041. http://www.spkx.net.cn
2017-04-14
青海省基礎研究計劃項目(2017-ZJ-712)
劉龍(1989—),男,碩士研究生,研究方向為天然產物分離與提取。E-mail:906297945@qq.com
*通信作者:張煒(1972—),女,教授,碩士,研究方向為天然產物分離與提取。E-mail:zhangwei@qhnu.edu.cn

