芒硝法生產硫酸鉀分析計算
欽 賀,楊雯雯
(國投新疆羅布泊鉀鹽有限責任公司, 新疆哈密市 839000)
芒硝法生產硫酸鉀分析計算
欽 賀,楊雯雯
(國投新疆羅布泊鉀鹽有限責任公司, 新疆哈密市 839000)
通過相圖分析確定以芒硝及氯化鉀為原料,采用芒硝法制取硫酸鉀,并詳細介紹了3種基本工藝流程及條件,包括一步法制取硫酸鉀,二步法制取硫酸鉀不回收母液,二步法制取硫酸鉀回收母液。利用Na+、K+//Cl-、SO42--H2O四元體系25℃相圖,定量計算制取硫酸鉀、鉀芒硝過程,以及用水分解鉀芒硝析出硫酸鉀的過程。
芒硝;氯化鉀;相圖分析;硫酸鉀;鉀芒硝
芒硝法生產硫酸鉀工藝是以芒硝和氯化鉀為原料,經過復分解反應制取硫酸鉀。該方法的理論基礎是Na+、K+//Cl-、SO42--H2O四元體系25℃相圖(見圖1)。用氯化鉀和芒硝制取硫酸鉀的工藝流程有:一步法制取硫酸鉀;二步法制取硫酸鉀不回收母液;回收母液,冷凍回收芒硝法等。回收母液,冷凍回收芒硝法法生產硫酸鉀是利用兩段轉化、一次蒸發來完成硫酸鉀及副產品工業鹽的生產,其主要原料是芒硝、氯化鉀、水,整個系統封閉循環。進入系統的水主要有二轉化加入的工藝水、原料芒硝帶入的結晶水;流出系統的水主要是蒸餾水。只有二者達到平衡整個系統才能穩定運行。筆者研究該工藝時將芒硝中的結晶水歸類為外加水,方便流程計算和指導生產。通過3種不同工藝流程理論分析,明確最佳反應路線及物料間的配比計算,進一步鞏固分析相圖的理論基礎,為實際生產提供技術支撐。
1 相圖理論分析
相圖分析表明,為了最大限度制取產品,應使系統控制在對產品之外的其他固相剛飽和而未析出時為最佳,為了提高產品的回收率,相圖中代表產品產量的杠桿臂長度與液相量的比值應盡可能大。析出產品后的母液中,含產品鹽元素離子越少越好,或者是含另一種產品鹽越多越好,這就表明反應進行的更完全。故分析工藝路線時K2SO4損失于液相中的量越少,回收率越高。
一步法反應生產硫酸鉀過程中,首先物料A(氯化鈉)與B(芒硝)轉化生成產品D(硫酸鉀)和母液E,故DE線段與AB線段的交點可以保證產品D的產率最高,所以將物料A和物料B加水按照一定的比例配制O點進行轉化,可以得到物料D和母液E。因為母液E點位于共飽點上,根據作圖指數反算離子組分計算,母液F、V、K、H同理,得出的離子組分數據見表1。
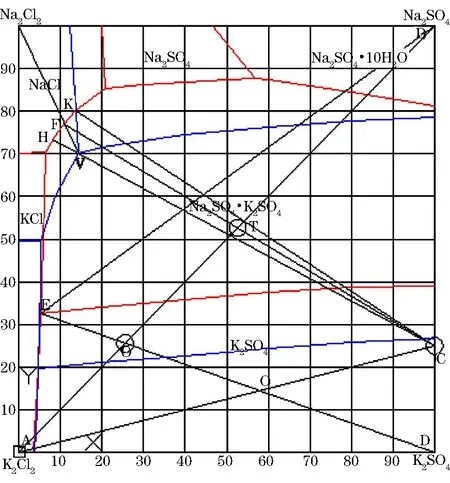
圖1 Na+、K+//Cl-、-H2O四元體系25℃、100℃相圖
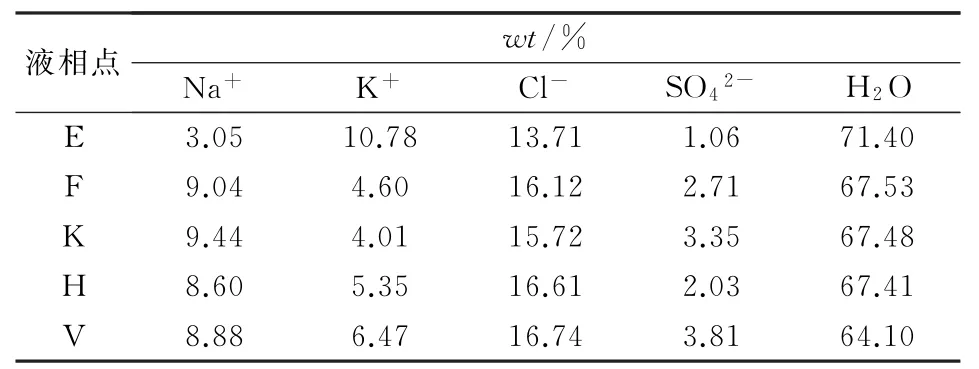
表1 母液點離子組分
二步法制取硫酸鉀不回收母液,主要先通過生成中間產物鉀芒硝,然后利用鉀芒硝和氯化鉀反應得到硫酸鉀產品。在確定此方法時,理論依據是OE、O′E線段代表硫酸鉀比例,從圖1中可以看出O′E線段距離明顯大于OE線段距離,故二步法必然大于一步法的硫酸鉀產率。首先物料A和物料B按照一定的比例配制系統點T,轉化生成物料C和母液F,其次將物料C和物料A混合配制O′點,轉化生成產品D和母液E。
二步法制取硫酸鉀回收母液,該方法是以二步法生產硫酸鉀為依托,回收母液主要是可以充分回收鉀資源,降低生產成本。根據上述內容可知,產生了母液E和母液F,分析相圖可以得知在母液E中加入一定比例的物料B轉化可以生成母液H、K、F。由于母液F位于該100℃相圖體系的不飽和區域,所以處理母液F時可以將溫度升高至100℃,轉化析出氯化鈉和母液V,此時母液V又位于該25℃相圖體系的不飽和區域,將母液V進行25℃降溫處理,可以得到中間產物C和母液H,將母液H和母液K混合至母液F處,這樣可以使母液在系統內實現循環,故母液E和物料B混合產生母液K點最為合適。
2 結果與討論
2.1 一步法制取硫酸鉀
KCl+Na2SO4+H2O→K2SO4+母液E,在相圖上表示,其過程為A+B→D+E。假設100gKCl與xgNa2SO4及加入yg水生成mgK2SO4和ng母液E(E點),則可得到一步法物料平衡式(見表2)。
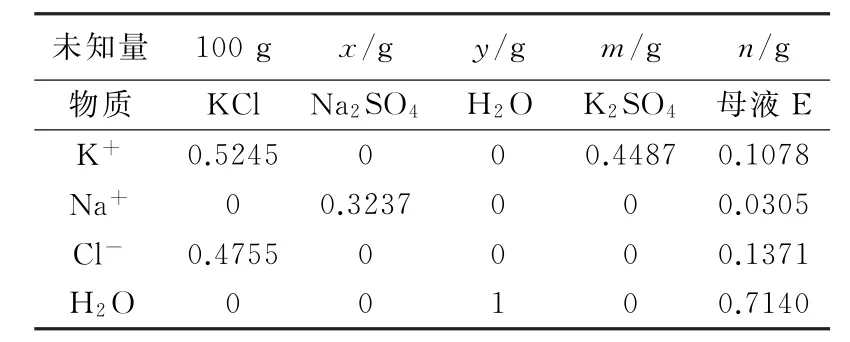
表2 一步法物料平衡式
解方程得到x=38.53g,y=247.63g,m=39.33g,n=346.83g。
由分析結果可知,一步法生產硫酸鉀使用100g KCl時,需要38.53gNa2SO4在加入247.63g水轉化可以得到39.33gK2SO4和346.83g母液E。
故一步法生產硫酸鉀產率γ%=39.33× 0.4487/100×0.5245=33.65%
2.2 二步法制取硫酸鉀不回收母液
二步法制取硫酸鉀通過鉀芒硝為中間產物,然后以鉀芒硝和氯化鉀為原料生產硫酸鉀,反應基本原理為:
假設100gKCl與xgNa2SO4及加入yg水生成mgNa2SO4·3K2SO4和ng母液F,則可得到二步法物料平衡式(見表3)。
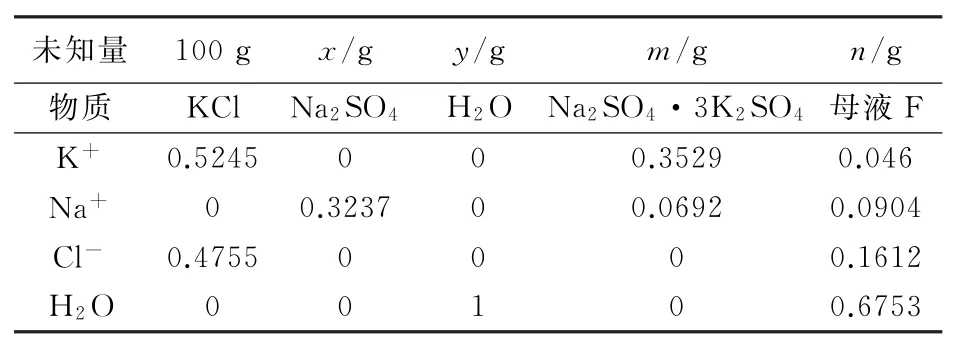
表3 二步法制取鉀芒硝物料平衡式
解方程得到x=105.93g,y=199.23g,m=110.18g,n=294.98g。
由分析結果可知,生產中間產物鉀芒硝使用100gKCl時,需要105.93gNa2SO4再加入199.23 g水轉化可以得到110.18gNa2SO4·3K2SO4和294.98g母液F。
故生產鉀芒硝產率γ%=110.18×0.3529/100 ×0.5245=74.13%
根據得到的鉀芒硝,計算加入xgKCl和yg水生成mgK2SO4和ng母液E,可得到平衡方程式(見表4)。
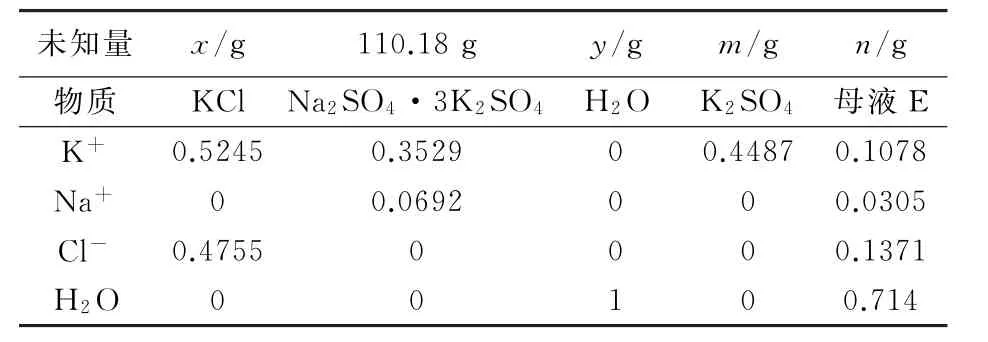
表4 二步法得到硫酸鉀物料平衡式
解方程得到x=70.33g,y=175.97g,m=112.55g,n=243.93g。
由分析結果可知110.18gNa2SO4·3K2SO4,需要再加入70.33gKCl和175.97gH2O轉化得到112.55gK2SO4和243.93g母液E。
綜合兩個歩驟可以得出硫酸鉀產率γ%=112.55×0.4487/170.33×0.5245=56.53%
2.3 二步法制取硫酸鉀回收母液
當回收母液E時,加入一定量的物料B時,導致溶液不飽和,此時需要先失去部分水才可以生成鉀芒硝。故反應原理為母液E+Na2SO4→Na2SO4·3K2SO4+母液K+H2O↑。
根據2.2節中得到的母液E量,計算加入xgNa2SO4生成ygNa2SO4·3K2SO4和mg母液K,蒸發水量為ng可得到平衡方程式(見表5)。
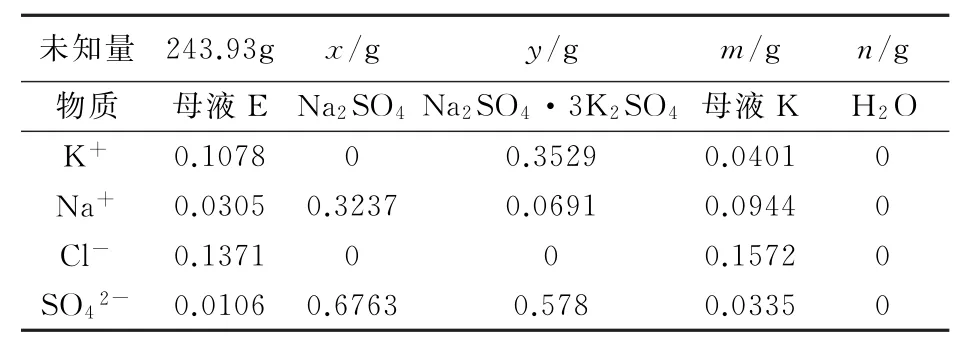
表5 回收母液E物料平衡式
解方程得到x=49.74g,y=50.34g,m=212.74g,n=30.59g
回收母液F時,母液F點在25℃的共飽點上,但100℃時該溶液變為氯化鈉相區的不飽和溶液,經過蒸發析鹽,得到母液V和氯化鈉。
反應基本原理為:母液F(100℃)→NaCl+母液V+H2O↑,母液F升溫物料平衡見表6。
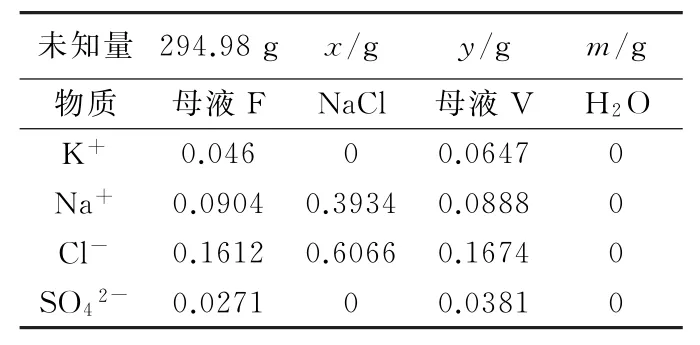
表6 母液F升溫物料平衡
解方程得到x=20.44g,y=209.72g,m=64.81g。
產生的母液V由100℃的共飽點變為25℃鉀芒硝相區飽和溶液,加入定量的水轉化可以得到鉀芒硝和母液H。
反應基本原理為:母液V(25℃)+H2O→Na2SO4·3K2SO4+母液H,母液V降溫物料平衡見表7。
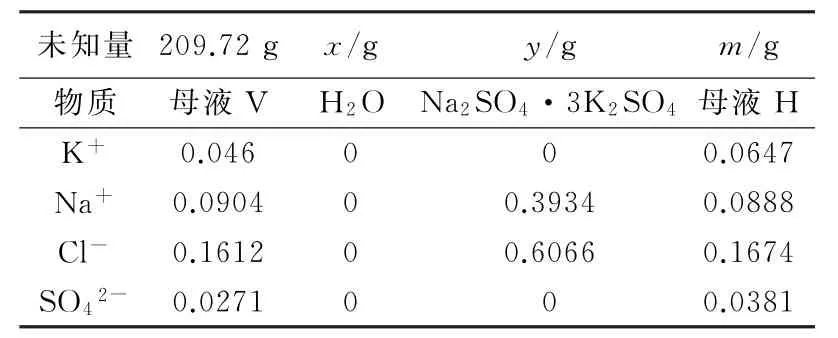
表7 母液V降溫物料平衡
解方程得到x=8.05g,y=6.41g,m=211.36g。
此時通過相圖配比分析母液點H/母液點K=0.91/1可以配至母液點F,產生母液H有211.36g,母液K有212.74g,但是需要母液H有193.59g,剩余母液H有17.77g。母液K與母液H混合至母液F,這樣可以將母液一直循環在系統內,鉀資源得到充分回收利用。按照此工藝點的控制幾乎可以回收所有的母液。并得到鉀芒硝56.75g和20.44g附加產品氯化鈉。
綜合以上歩驟可以得出硫酸鉀鉀產率:
γ%=(112.55×0.4487+56.75×0.3529)/ 170.33×0.5245=78.95%
3 結 論
(1)根據以上理論計算分析、工藝流程的選取并結合現場經驗,繪制了二步法回收母液制取硫酸鉀數字工藝流程(見圖2)。
(2)芒硝法生產硫酸鉀,造成系統水不平衡的因素較多,有其先天性,也受轉化溫度、配料點的選擇、蒸發終點的控制、原料結晶水、工藝水等影響,在生產實踐中,控制加水量是十分關鍵,它直接影響鉀離子的回收率。
(3)文中所采用的原料A和原料B是純物質,實際生產中是含有雜質。故在設計工藝流程時,要加入氯化鉀和芒硝的提純過程。然后依據提純后原料的組成進行相圖分析,方法和文中計算分析方法一致。
[1]李 臻,牛自得,王宗玉,等.利用不純凈氯化鉀和芒硝制取硫酸鉀工藝的研究[J].海湖鹽與化工,27(2).
[2]牛自得,程芳琴.水鹽體系相圖及其應用[M].天津大學出版社,2002(5):121-122.
[3]M.M.維克托洛夫.無機物工藝學圖解計算[M].北京:中國工業出版社,1964(2):419-426.
[4]張玉翠.芒硝法生產硫酸鉀水平衡問題討論[J].無機鹽工業, 2012(3):44-3.
[5]孫培霞.芒硝法生產配料點的確定及配料計算[J].無機鹽工業,2000(9):32-5.
[6]趙曉霞,賀春寶.芒硝法生產過程中水平衡的研究[J].無機鹽工業,2001(5):33-3.
[7]張玉翠,焦臨德.芒硝法生產硫酸鉀中的鹽質淺析[J].鹽業與化工,2011(11):40-6.
[8]李 浩,唐中凡,劉傳福,等.新疆羅布泊鹽湖鹵水資源綜合開發研究[J].地球學報,2008,29(4):517-524.
2017-05-03)
欽 賀(1989-),男,江蘇徐州人,助理工程師,主要從事鹽類礦物加工工程研究,Email:594413865@qq.com。

