擬康寧木霉T-51幾丁質酶活性及內切幾丁質酶基因克隆與分析
尤佳琪, 李國慶
(華中農業大學作物病害監測和安全控制湖北省重點實驗室, 武漢 430070)
?
擬康寧木霉T-51幾丁質酶活性及內切幾丁質酶基因克隆與分析
尤佳琪, 李國慶*
(華中農業大學作物病害監測和安全控制湖北省重點實驗室, 武漢 430070)
木霉是一類重要的生防真菌,木霉產生的幾丁質酶在其生物防治的重寄生過程中起著重要作用。擬康寧木霉TrichodermakoningiopsisT-51是一株對番茄灰霉病有生防潛力的木霉菌株,本文測定了T-51菌株產生幾丁質酶的活性,結果表明T-51在PDB中液體培養以及與灰霉病菌在PDA上對峙培養時產生的幾丁質酶活性顯著受到灰霉病菌的誘導。采用RACE技術首次克隆了擬康寧木霉T-51中一個幾丁質酶基因Tkchit42,全長為1 817 bp,包含4個外顯子和3個內含子。預測該基因有一個1 275 bp的開放閱讀框,編碼424個氨基酸,預測的蛋白總分子量為46.378 kDa,預測的等電點(pI)為5.16,與T.koningii中42 kDa內切幾丁質酶的氨基酸序列相似性達到99%。
幾丁質酶; 擬康寧木霉; 基因克隆; 序列分析
果蔬灰霉病是我國保護地果蔬生產中最主要的病害之一[1],在保護地果蔬生產中造成巨大的產量損失。灰霉病菌對化學農藥極易產生抗藥性[2],而且化學農藥所引起的農藥殘留和環境污染等問題也受到人們的重視,因此,生物防治作為一種可替代的灰霉病防治措施,逐漸得到了植物保護研究者的關注。
木霉是一類具有廣譜生防效果的生防真菌,對包括灰霉病在內的許多植物真菌病害都有生防作用。木霉對植物真菌病害的生防機制是多樣的,包括對病原菌營養競爭、重寄生、抗生作用以及通過誘導植物抗性防治病害[3-4]。木霉的重寄生作用過程中,分泌真菌細胞壁水解酶是極其重要的[5]。幾丁質是僅次于纖維素的自然界中第二大有機的可再生資源,也是真菌細胞壁骨架的主要成分[6],分泌幾丁質酶能夠幫助木霉降解寄主真菌的細胞壁,幫助木霉寄生寄主真菌。幾丁質酶家族十分龐大,可分為內切幾丁質酶、外切幾丁質酶、β-N-乙酰氨基葡糖苷酶和殼二糖酶等[7],這些酶共同作用將幾丁質逐步降解為單糖。許多研究表明,木霉產生的幾丁質酶活性受到病原菌細胞壁的誘導[8],在重寄生過程中幾丁質酶基因的表達也有顯著的上調[9]。擬康寧木霉T-51是本實驗室分離篩選得到的生防木霉菌株,前期的研究結果表明T-51對灰霉病菌有很強的重寄生能力,并且可以有效抑制灰霉病菌在植物殘體上產孢,還有產生抗真菌物質、促進植物生長、誘導植物抗性等作用,對番茄灰霉病表現出很好的生防潛力[10]。然而,目前世界上對于擬康寧木霉生物防治的研究極少,對擬康寧木霉生物防治的分子機制暫無報道。
1 材料與方法
1.1 菌株來源
擬康寧木霉Trichodermakoningiopsis菌株T-51由本實驗室分離自湖北省武漢市油菜田土壤中。
灰葡萄孢Botrytiscinerea菌株RoseBC-3由本實驗室分離自月季灰霉病殘體上。
1.2 主要試劑
TRIzol?Reagent (InvitrogenTM, USA)、pMD18-T、rTaqDNA聚合酶、dNTP混合物、 5′-Full RACE試劑盒和3′-Full RACE 試劑盒等均購于TaKaRa公司(中國大連);DNA凝膠回收試劑盒購于Axygen Scientific;粉狀幾丁質購于Sigma公司,并且根據任莉[11]的方法制成膠態幾丁質。1% DMAB(對二甲氨基苯甲醛):10 g DMAB溶于100 mL含有12%濃鹽酸的冰醋酸溶液中,待完全溶解后置于4℃下貯存備用,使用時用冰醋酸稀釋10倍。
1.3 粗酶液的制備
1.3.1 液體培養
灰霉病菌菌株RoseBC-3菌絲塊接種在鋪有玻璃紙的PDA平板上生長,菌落長滿后,將菌絲刮下,加液氮研磨成粉,按1%(W/V)比例加入PDB培養基中,在80℃水浴鍋中水浴4 h后,用雙層濾紙過濾,121℃蒸汽滅菌,即為Bc-PDB。取3 mL Bc-PDB或PDB在20 mL的玻璃搖菌瓶中,每瓶加入一個直徑5 mm的木霉T-51生長2 d的新鮮菌絲塊,在25℃搖床中150 r/min搖培3 d。取搖培上清液為粗酶液。
1.3.2 對峙培養
將灰霉病菌菌株RoseBC-3和擬康寧木霉菌株T-51的菌絲塊分別接種在PDA平板的兩端,兩個菌絲塊相距7 cm,或者在PDA平板上單獨接種灰霉或單獨接種木霉。將接種后的PDA平板放在20℃下培養7 d,互作區域的粗酶液浸提方法參考任莉[11],將對峙培養的平板中灰霉病菌和木霉菌落重疊區域(即為木霉與灰霉病菌的互作區,簡稱為T+B)或單獨灰霉病菌(B only)或單獨木霉(T only)菌落下的PDA培養基切下,搗碎,按照2∶1(W/V)的比例在ddH2O中浸提過夜,然后取上清液作為粗酶液。
1.4 幾丁質酶活力測定
幾丁質酶的測定方法參考任莉[11],吸取0.5 mL 粗酶液或PDB(空白對照)于5 mL的離心管中,加入0.5 mL膠態幾丁質。將離心管置于37℃水浴中反應4 h。然后以8 000 r/min的速度離心5 min終止酶促反應。吸取0.5 mL上清液于一支潔凈離心管中,加入0.1 mL濃度為0.8 mol/L 四硼酸鉀溶液(pH 9.1)。搖勻后,沸水浴中反應3 min,迅速用冰水冷卻至室溫。再加入3 mL 制備好的1%對二甲氨基苯甲醛(DMAB)試劑,并在37℃下保溫20 min,自來水中冷卻至室溫。測定各反應體系在585 nm下的吸光值。以N-乙酰氨基葡萄糖做標準曲線,在上述酶促反應體系中,定義1 mL酶液每小時釋放出1 μmol的N-乙酰氨基葡萄糖定義為一個酶活力單位(U),計算各粗酶液中的幾丁質酶活力。
1.5 核酸提取
將生長旺盛的擬康寧木霉T-51菌絲接種到鋪有玻璃紙的固體PDA平板上,置于20℃下培養3 d后收集菌絲。分別使用CTAB法和TRIzol法提取菌絲總DNA和總RNA[12]。
1.6 PCR擴增
本研究所使用的引物序列見表1,其中P1-F/R引物參考伊洪偉[13]克隆長枝木霉中幾丁質酶基因的PCR引物,其余引物是本研究中設計,由北京奧科鼎盛生物科技有限公司合成。
首先以擬康寧木霉T-51的基因組DNA為模板,用P1F和P1R引物(表1)進行擴增,PCR擴增體系(50 μL):DNA (1 μg/μL) 1 μL,10 × PCR buffer 5 μL,dNTP mix (2.5 mmol/L each) 1 μL, P1-F (20 μmol/L) 1 μL, P1-R (20 μmol/L) 1 μL,rTaqDNA polymerase 0.5 μL,ddH2O 40.5 μL。PCR反應程序為:94℃ 預變性30 s; 94℃ 30 s, 55℃ 30 s, 72℃ 2 min(35個循環);72℃ 10 min,16℃ 5 min。基因末端序列的克隆使用5′ RACE和 3′ RACE的方法,根據已經測序獲得的序列設計了引物Tk-5′-GSP Outer、Tk-5′-GSP Inner、Tk-3′-GSP Inner及Tk-3′-GSP Outer(表1),根據試劑盒說明書進行擴增。
表1 本文使用的PCR擴增引物序列
Table 1 The sequences of PCR primers used in this study

引物名稱Primername引物序列(5'-3')Sequence(5'-3')P1-FATGTTGGGTTTCCTCGGAAAATCCP1-RCTAGTTGAGACCGCTTCGGATGTTTk-5'-GSPOuterCTGGGTGTCATCGGAAGGGTACTTk-5'-GSPInnerAGCCACCGATAGAAAGCATAACCTk-3'-GSPInnerACGGTATCTGGGACTACAAGGTk-3'-GSPOuterTGGGAGTACCCTTCCGATGA
1.7 擴增產物的純化、連接、轉化及測序
擴增后的產物用1%瓊脂糖凝膠電泳檢測,切下目的片段,使用DNA 凝膠回收試劑盒進行純化,然后連接pMD18-T載體,轉化大腸桿菌DH5α,篩選陽性轉化子測序。測序由北京奧科鼎盛生物科技有限公司完成。
1.8 序列分析
核酸序列在NCBI(http:∥www.ncbi.nlm.nih.gov/blast)上進行同源性檢索,使用DNAMAN軟件對序列進行拼接,并將核苷酸序列翻譯為氨基酸,使用BioEdit分析軟件對基因的核苷酸序列進行堿基成分和氨基酸組成分析。使用NCBI的ORF Finder分析序列的保守結構域。使用SignalP工具(http:∥www.cbs.dtu.dk/services/SignalP)中預測氨基酸序列的信號肽,通過TargetP工具(http:∥www.cbs.dtu.dk/services/TargetP/)進行蛋白亞細胞定位的預測,用SWISS-MODEL工具(http:∥www.swissmodel.expasy.org/) 預測蛋白的三維模型。使用MEGA軟件(NJ法, 重復運算1 000次)構建與同源基因序列的系統發育樹。
2 結果與分析
2.1 幾丁質酶活性
T-51在Bc-PDB和PDB中的幾丁質酶活性測定結果如圖1,T-51在Bc-PDB中培養產生的幾丁質酶活性(12.85±4.85 U/mL)顯著高于(P<0.05)在PDB中培養產生的幾丁質酶活性(9.36±0.61 U/mL)。T-51和灰霉病菌對峙培養過程中的幾丁質酶活性測定結果如圖2,在T-51與RoseBC-3的互作區域(T+B)中的幾丁質酶活性(32.67±10.27 U/mL)顯著高于(P<0.05)單獨培養木霉(T only)(11.71±1.72 U/mL)或者單獨培養灰霉病菌(B only)(9.99±1.68 U/mL)所產生的幾丁質酶活性。這表明灰霉病菌會誘導擬康寧木霉T-51產生幾丁質酶,特別是在T-51重寄生灰霉病菌菌落的過程中,幾丁質酶活性顯著上升,這表明幾丁質酶可能在木霉的重寄生過程中起著重要的作用。
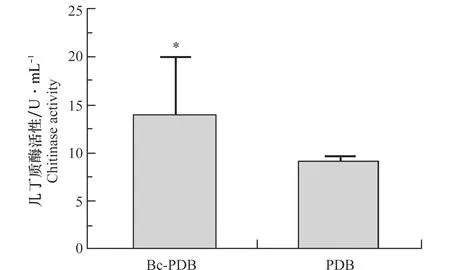
圖1 擬康寧木霉T-51在Bc-PDB與PDB中產生的幾丁質酶活性Fig.1 Chitinase activity of Trichoderma koningiopsis T-51 in Bc-PDB and PDB
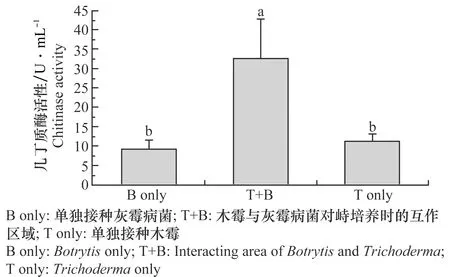
圖2 擬康寧木霉T-51與灰霉病菌對峙培養時產生的幾丁質酶活性Fig.2 Chitinase activity in dual culture of Trichoderma koningiopsis T-51 and Botrytis on PDA
2.2 擬康寧木霉T-51幾丁質酶基因的克隆及序列分析
通過P1-F/R引物的擴增兩株擬康寧木霉T-51的基因組DNA得到1 400 bp左右的條帶,如圖3a。該目的條帶測序結果得到1 470 bp的序列。這段序列經過NCBI中比對,發現與許多木霉屬其他種的內切幾丁質酶基因有很高的同源性,其中與其近緣種康寧木霉T.koningii中編碼42 kDa內切幾丁質酶基因的核苷酸序列同源性達到97%,因此將這個基因命名為Tkchit42。然后根據這段序列設計了特異性引物進行末端序列的克隆。通過對cDNA的巢式PCR分別擴增5′端(圖3b)和3′端(圖3c),均得到約600 bp的條帶。測序后的序列使用DNAMAN軟件進行拼接得到了該基因的全長序列。Tkchit42基因序列在GenBank中的登錄號為KU140672。

圖3 Tkchit42基因的PCR及RACE擴增電泳圖Fig.3 Amplification of Tkchit42 by using PCR and RACE
序列分析的結果表明,該基因全長共1 817 bp(不含polyA),其中5′端非編碼區有135 bp,3′端非編碼區有212 bp。包含4個外顯子和3個內含子,內含子大小分別為57、70、68 bp。外顯子組成一個長1 275 bp的開放閱讀框,起始密碼子為ATG,終止密碼子為TAA(圖4),Tkchit42基因全長堿基組成:G+C=49.26%,A+T=50.74%。

圖4 Tkchit42基因全長結構示意圖Fig.4 Structure of Tkchit42 gene
2.3Tkchit42基因編碼的氨基酸序列分析
Tkchit42基因編碼424個氨基酸(圖5),其中絲氨酸含量最高(10.82%),半胱氨酸含量最低(0.24%)。預測的蛋白總分子量為46.378 kDa,預測的等電點(pI)為5.16。氨基酸序列在NCBI上預測到內切幾丁質酶的保守結構域,屬于GH18-幾丁質酶超家族,有幾丁質酶的活性位點。根據SignalP 4.0預測,在氨基酸序列前端存在信號肽,最可能的剪切位點是在27~28位:VAA-KD。使用Target P預測蛋白亞細胞器定位,預測結果表明該蛋白最有可能定位在胞外,是分泌蛋白。使用SWISS-MODEL在線預測了Tkchit42編碼的蛋白三維結構的絲帶模型,如圖6。
2.4 同源性及分子進化分析
將Tkchit42編碼的氨基酸在NCBI數據庫中比對發現,其序列與多種木霉屬真菌中42 kDa內切幾丁質酶或幾丁質酶基因的氨基酸序列相似性都達到85%以上,其中與T.koningii相似性達到99%(表2)。利用MEGA軟件建立Tkchit42編碼的氨基酸序列及其他木霉中的同源氨基酸序列的系統進化樹,如圖7。
3 結論與討論
幾丁質酶在木霉與寄主真菌互作的過程中十分重要,其中的β-N-乙酰氨基葡糖苷酶NAG1在木霉識別寄主真菌的過程中起到關鍵作用[14]。木霉與寄主真菌還未接觸的時候,木霉通過分泌少量的β-N-乙酰氨基葡糖苷酶來識別寄主真菌,當識別反應成功后,便在短時間內大量分泌幾丁質酶來降解寄主真菌的細胞壁[15-16],降解寄主細胞壁后產生的小分子產物反饋給木霉后又能激活包括幾丁質酶基因在內的重寄生相關基因的表達上調,進一步分泌更多的細胞壁水解酶類,最終導致寄主真菌細胞壁裂解,細胞死亡[17]。已有研究表明木霉的幾丁質酶等細胞壁水解酶類的活性受到寄主真菌細胞壁的誘導[8],例如哈茨木霉產生的幾丁質酶受到灰霉病菌細胞壁的誘導[18]。本文的研究結果表明擬康寧木霉T-51在PDB搖培中產生幾丁質酶的活性受到灰霉病菌的誘導,在擬康寧木霉T-51對灰霉病菌對峙培養時的互作區幾丁質酶活性也顯著升高,這意味著幾丁質酶在T-51在對灰霉病菌的生物防治過程中可能起著重要作用。本實驗室前期的研究表明,擬康寧木霉T-51對番茄灰霉病有著很好的生防潛力,并且對多種其他植物病原真菌菌落有重寄生能力。因此有必要對擬康寧木霉中生防相關的分子機制進行深入的研究。
本研究首次克隆了擬康寧木霉中的一個幾丁質酶基因Tkchit42。在木霉中存在多種幾丁質酶,在重寄生的過程中起著不同的作用,這些幾丁質酶在木霉不同的種之間都存在差異。目前報道木霉中的內切幾丁質酶的分子量主要為33、37 kDa以及42 kDa等[19],同源性分析表明Tkchit42的序列與編碼42 kDa的內切幾丁質酶基因的序列較為相近,根據本研究克隆的幾丁質酶基因Tkchit42核酸序列預測其編碼蛋白的分子量為46 kDa。胡仕鳳等[15]通過比對分析17種木霉的42 kDa幾丁質酶具有信號肽,序列為其N端的22個氨基酸殘基,序列通常為“MLGFLGKSVALLAALQATLTSA”,本研究中Tkchit42編碼的前22個氨基酸序列與之相同,而且Tkchit42也預測到了信號肽。

圖5 Tkchit42基因預測的開放閱讀框序列及氨基酸序列Fig.5 Predicted ORF and amino acid sequence of Tkchit42
圖6 Tkchit42編碼蛋白的三級結構絲帶模型的預測Fig.6 The 3D structure prediction of the protein encoded by Tkchit42
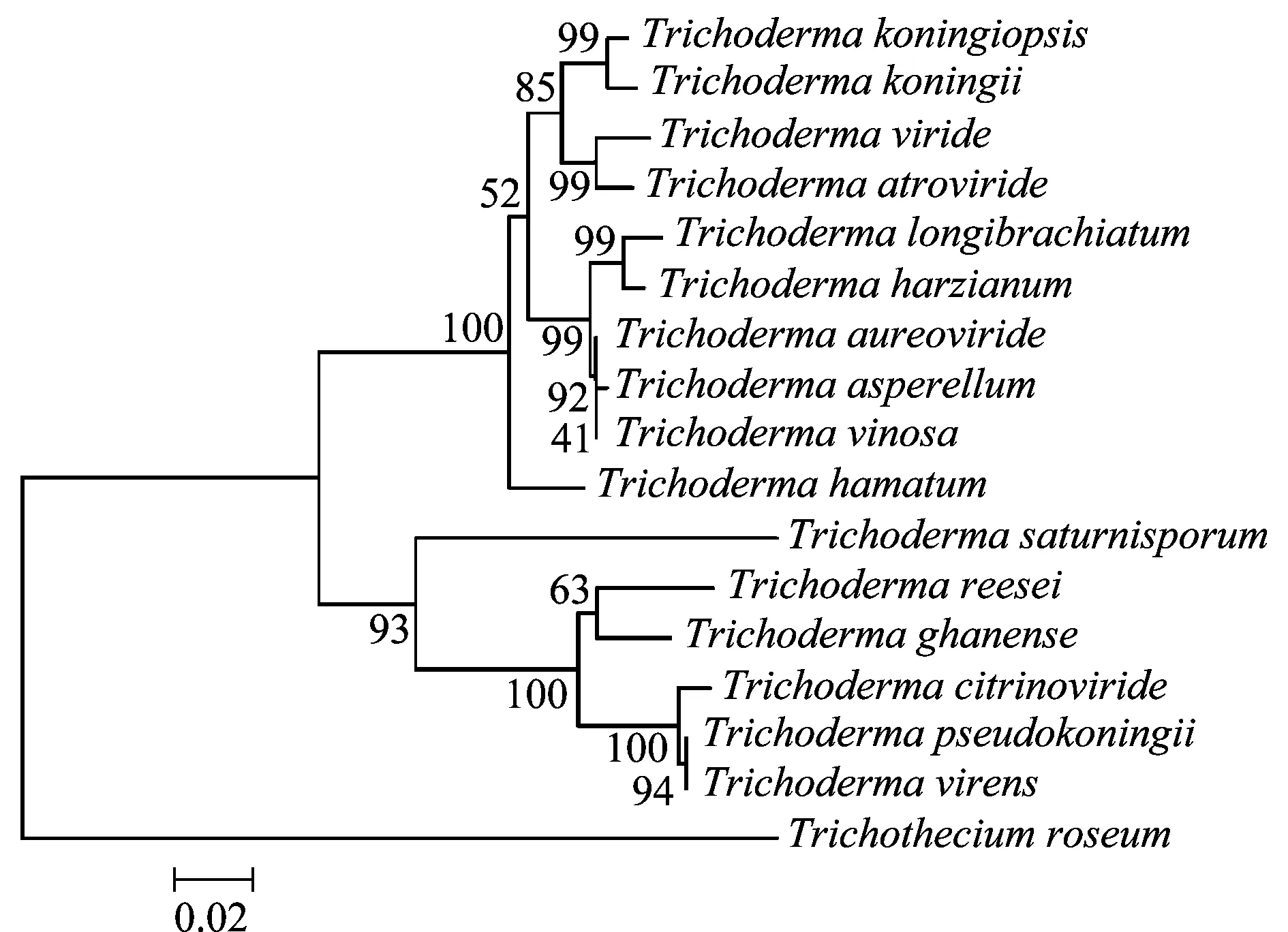
圖7 基于Tkchit42推導的氨基酸序列與其他木霉幾丁質酶氨基酸序列的系統進化樹Fig.7 Phylogenetic tree of the predicted amino acid sequences of Tkchit42

GenBank登錄號GenBankaccessionnumber基因編碼產物Encodedproduct物種名Species氨基酸序列相似性/%Identityofaminoacidsequencegi|6630936|gb|AAF19612.1|42kDa內切幾丁質酶康寧木霉Trichodermakoningii99gi|226596953|gb|ACO72604.1|幾丁質酶深綠木霉T.atroviride97gi|6630948|gb|AAF19618.1|42kDa內切幾丁質酶綠色木霉T.viride96gi|56967602|gb|AAW31950.1|42kDa內切幾丁質酶黃綠木霉T.aureoviride96gi|297573457|gb|ADI46579.1|CHI42幾丁質酶棘胞木霉T.asperellum95gi|6630962|gb|AAF19625.1|42kDa內切幾丁質酶酒色木霉T.vinosum95gi|88191681|gb|ABD42921.1|內切幾丁質酶長枝木霉T.longibrachiatum94gi|74049056|gb|AAZ95174.1|內切幾丁質酶哈茨木霉T.harzianum94gi|2738109|gb|AAC60385.1|內切幾丁質酶鉤狀木霉T.hamatum94gi|294992331|gb|ADF57309.1|幾丁質酶chi18-5加納木霉T.ghanense85gi|13516885|dbj|BAB40594.1|內切幾丁質酶假康寧木霉T.pseudokoningii85gi|13516873|dbj|BAB40588.1|內切幾丁質酶e-G2綠木霉T.virens85gi|294992333|gb|ADF57310.1|幾丁質酶chi18-5橘綠木霉T.citrinoviride84gi|589112229|ref|XP_006968137.1|幾丁質酶里氏木霉T.reesei83gi|284451278|gb|ADB89220.1|42kDa內切幾丁質酶土星孢木霉T.saturnisporum81gi|317134350|gb|ADV02751.1|幾丁質酶粉紅單端孢霉Trichotheciumroseum71
幾丁質酶有著廣泛的應用前景。幾丁質被幾丁質酶降解后的產物(幾丁寡糖、殼聚糖和N-乙酰氨基葡萄糖)具有抗菌及抗腫瘤等活性[20]。木霉中的幾丁質酶基因轉入水稻[21]、煙草[8]、蘋果[8]、棉花[22]等植物,能夠誘導植物對一些病原真菌產生抗性。哈茨木霉產生的幾丁質酶粗提物能夠抑制灰霉病菌菌絲生長和孢子萌發,并且抑制番茄灰霉病的發生[23]。本研究結果表明擬康寧木霉T-51產生的幾丁質酶可能在生防過程中起著重要的作用,因此將來有必要對擬康寧木霉T-51的幾丁質酶等生防相關的酶類進行更深入的研究,探究其在灰霉病防治中的作用。
[1] Dean R, Kan J A L V, Pretorius Z A, et al. The top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13(4):414-430.
[2] Williamson B, Tudzynski B, Tudzynski P, et al.Botrytiscinerea: the cause of grey mould disease [J]. Molecular Plant Pathology, 2007, 8(5): 561-580.
[3] Harman G E.Overview of mechanisms and uses ofTrichodermaspp.[J].Phytopathology, 2006, 96(2): 190-194.
[4] Benitez T, Rincon A M, Limon M C, et al. Biocontrol mechanisms ofTrichodermastrains [J]. International Microbiology, 2004, 7(4): 249-260.
[5] 葉小波, 曾千春, 蔣細良. 木霉菌重寄生過程中的酶學研究進展[J]. 中國生物防治學報, 2009, 25(3):276-280.
[6] Li Duochuan.Review of fungal chitinases[J]. Mycopathologia, 2006, 161(6): 345-360.
[7] Gokul B, Lee J H, Song K B, et al. Characterization and applications of chitinases fromTrichodermaharzianum-A review [J]. Bioprocess & Biosystems Engineering, 2000, 23(6):691-694.
[8] 徐同, 柳良好. 木霉幾丁質酶及其對植物病原真菌的拮抗作用[J]. 植物病理學報, 2002, 32(2):97-102.
[9] Steindorff A S, Ramada M H S, Coelho A S G, et al. Identification of mycoparasitism-related genes against the phytopathogenSclerotiniasclerotiorum, through transcriptome and expression profile analysis inTrichodermaharzianum[J]. BMC Genomics, 2014, 15(1):1-14.
[10]You Jiaqi, Zhang Jing, Wu Mingde, et al. Multiple criteria-based screening ofTrichodermaisolates for biological control ofBotrytiscinereaon tomato [J]. Biological Control, 2016, 101: 31-38.
[11]任莉. 重寄生真菌盾殼霉降解草酸毒素及其引起的生防效應研究[D]. 武漢:華中農業大學,2008.
[12]曾麗梅. 盾殼霉草酸脫羧酶基因的克隆、功能驗證及生防作用研究[D]. 武漢:華中農業大學,2013.
[13]伊洪偉. 長枝木霉菌幾丁質酶基因克隆和抑菌活性物質結構鑒定[D]. 哈爾濱:東北林業大學,2012.
[14]Gruber S, Seidl-Seiboth V.Self versus non-self: fungal cell wall degradation inTrichoderma[J]. Microbiology, 2012, 158(1):26-34.
[15]Haran S, Schickler H, Oppenheim A, et al. Differential expression ofTrichodermaharzianumchitinases during mycoparasitism [J]. Phytopathology, 1996, 86(9):980-985.
[16]Inbar J, Chet I. The role of recognition in the induction of specific chitinases during mycoparasitism byTrichodermaharzianum[J]. Microbiology, 1995,141(11):2823-2829.
[17]Vinale F, Sivasithamparam K, Ghisalberti E L, et al.Trichoderma-plant-pathogen interactions [J]. Soil Biology and Biochemistry, 2008,40(1):1-10.
[18]趙亞玲, 惠有為, 趙健, 等. 低溫木霉對灰霉的拮抗作用[J]. 應用化工, 2010, 39(9):1303-1305.
[19]胡仕鳳, 高必達, 陳捷. 木霉幾丁質酶及其基因的研究進展[J]. 中國生物防治, 2008, 24(4):369-375.
[20]陳少波, 吳根福. 幾丁質酶研究進展[J]. 科技通報, 2004, 20(3):258-262.
[21]柳良好, 徐同. 哈茨木霉幾丁質酶誘導及其對水稻紋枯病菌的拮抗作用[J]. 植物病理學報, 2003, 33(4):359-363.
[22]李莉. 轉木霉幾丁質酶基因棉花的抗病性檢測及鑒定[D]. 烏魯木齊:新疆農業大學, 2005.
[23]楊春林, 席亞東, 謝華蓉, 等. 哈茨木霉Th-30幾丁質酶的生產條件及對灰霉病菌的拮抗作用[J]. 植物保護學報, 2009, 36(4):295-300.
(責任編輯:田 喆)
Chitinase activity and endo-chitinase gene cloning and sequence analysis ofTrichodermakoningiopsisT-51
You Jiaqi, Li Guoqing
(KeyLaboratoryofCropDiseaseMonitoring&SafetyControlofHubeiProvince,HuazhongAgriculturalUniversity,Wuhan430070,China)
TrichodermakoningiopsisT-51 is a potential biological control agent againstBotrytiscinerea. In this study, chitinase activity of T-51 was significantly induced byB.cinereain both liquid PDB medium and the interacting area withB.cinereacolony on PDA medium. An endo-chitinase geneTkchit42 was cloned fromT.koningiopsisT-51. The full length ofTkchit42 was 1 817 bp, encoding an endo-chitinase protein containing 424 amino acid residues. The predicted protein molecular weight was 46.378 kDa. TheTkchit42 amino acid sequence BLAST showed 99% similarity with that of a 42 kDa endo-chitinase ofT.koningii. For our knowledge, this is the first report of chitinase gene cloned fromT.koningiopsis.
chitinase;Trichodermakoningiopsis; gene cloning; sequence analysis

研究報告ResearchReports
2016-08-17
2016-12-19
公益性行業(農業)科研專項(201303025)
S 476
A
10.3969/j.issn.0529-1542.2017.04.004
* 通信作者 E-mail: guoqingli@mail.hzau.edu.cn

