人工接種CGMMV的增殖及其對西瓜光合作用的影響
王艷紅, 陳 平, 王聰慧, 毛 赫, 張孝宗, 李立梅*
(1.黑龍江八一農墾大學生命科學技術學院, 大慶 163319; 2. 吉林省林業科學研究院, 長春 130033)
?
人工接種CGMMV的增殖及其對西瓜光合作用的影響
王艷紅1, 陳 平2, 王聰慧2, 毛 赫2, 張孝宗1, 李立梅2*
(1.黑龍江八一農墾大學生命科學技術學院, 大慶 163319; 2. 吉林省林業科學研究院, 長春 130033)
為明確西瓜感染黃瓜綠斑駁花葉病毒CGMMV后病毒的增殖過程及其對光合作用的影響,本研究以遼寧省田間主栽西瓜品種‘京欣’為試材,測定了人工接種CGMMV后,西瓜植株體內病毒含量、光合色素、光合作用相關指標以及參與光合作用的關鍵酶活性的變化,結果顯示:接種3 d后,即可檢測到病毒,24 d植株內病毒含量達最高;葉綠素a、葉綠素b及類胡蘿卜素的含量均有所降低,葉綠素a在9 d后均低于健康對照,而葉綠素b和類胡蘿卜素在15 d后明顯低于健康對照,第18天時,健康對照的葉綠素b含量達接種處理的1.33倍;ALA脫水酶活性除第15天與對照無顯著差異外,整個測定期間均低于健康對照,21 d時健康對照的ALA脫水酶的活性達29.9 U/h,為接種處理的2.18倍;PEP羧化酶的活性顯著低于健康對照,測定期間接種處理的PEP羧化酶活性變化不大;乙醇酸氧化酶活性明顯升高,測定期間其活性均顯著高于健康對照;西瓜葉片的光合速率、氣孔導度和蒸騰速率均遠小于健康對照,而細胞間隙CO2濃度卻比對照高,本研究為揭示西瓜感染CGMMV后的光合作用變化規律奠定了基礎。
西瓜; 黃瓜綠斑駁花葉病毒; 病毒增殖; 光合作用
黃瓜綠斑駁花葉病毒Cucumbergreenmottlemosaicvirus(CGMMV)2006年被列為中華人民共和國進境植物檢疫性有害生物[1]。西瓜感染該病毒后,果實內部嚴重變色或腐爛,果肉纖維化,水漬狀,并伴有酸化、腐敗,俗稱西瓜倒瓤病,嚴重時西瓜喪失食用價值,給世界各地的西瓜產業帶來巨大經濟損失[2-6],至今尚無有效的防治手段。因此,黃瓜綠斑駁花葉病毒的致病機理是目前西瓜生產中亟待解決的問題。現階段相關的研究報道較少,主要集中在西瓜感病后其品質、糖分代謝及相關酶活性的研究[7-9]。
光合作用是通過合成一些有機化合物將光能轉變為化學能的過程,是綠色植物一個特殊的和最基本的生命過程,是決定產量和品質的主要因素。葉綠素實際上存在于所有能進行光合作用的生物體中,是植物進行光合作用的色素。光合速率是衡量寄主光合作用的一個重要指標,相關研究表明病毒侵染植物后其植株的光合速率明顯下降,葉綠素含量降低,葉綠體超微結構受到明顯的破壞,光合磷酸化作用減弱,氣孔導度、蒸騰速率都出現了不同程度的降低,而細胞間CO2濃度有所升高[10-16]。因此,病毒脅迫如何影響植株內部的生理活性進而抑制光合作用始終是致病機理研究的重點。本文以遼寧省主栽品種‘京欣’為試材,測定了西瓜感染CGMMV后,病毒的積累及西瓜光合色素、光合作用相關指標及參與光合作用的關鍵酶活性的改變,以期明確西瓜感染該病毒后對光合作用的影響,為揭示CGMMV的致病機理提供理論依據和參考指標。
1 材料與方法
1.1 材料
1.1.1 供試植物
砧木:葫蘆Lagenariasiceraria(Molina) Standl.(品種:‘不死鳥’);接穗:西瓜Citrulluslanatus(Thunb.) Matsum.etNakai(品種:‘京欣’)。
1.1.2 供試毒原
黃瓜綠斑駁花葉病毒(CGMMV),采自遼寧省蓋縣,由本實驗室純化并繁殖保存在無蟲溫室中的葫蘆上。
1.1.3 CGMMV抗體和病毒陽性質控物
CGMMV抗體和陽性質控物均購于美國Agdia公司,陽性質控物的病毒濃度8.25 mg/mL。
1.2 方法
1.2.1 處理方法
采用常規汁液摩擦法接種 CGMMV,于西瓜3片真葉期接種,以接種PBS緩沖液為對照,每處理50株,3 次重復。分別于接種0、3、6、9、12、15、18、21、24、27 d測定光合作用相關指標,同時取每株西瓜下部葉片,混合后,按每份0.5 g稱取,保存于-80℃冰箱備用,用于測定病毒含量,每處理3次重復。接種CGMMV的西瓜植株于成熟期觀察西瓜果實倒瓤情況。
1.2.2 病情指數調查
參考蘇小記等[17]的方法,略有改動。調查標準:0級,無任何癥狀;1級,心葉明脈,輕微花葉;2級,心葉及少數葉片花葉;3級,葉片皺縮、畸形;4級,嚴重花葉,多數葉片皺縮畸形; 5級,全株發病,病葉嚴重畸形,植株嚴重矮化,莖部有褐色壞死斑。接種后每天觀察西瓜長勢,并調查記錄病情指數。
1.2.3 病毒含量測定
利用雙抗夾心法(DAS-ELISA)進行病毒含量檢測。以該病毒陽性質控物為標準液,稀釋不同的倍數后,以病毒濃度為橫坐標,A450為縱坐標,作標準曲線,并根據樣品的A450值計算待測樣品病毒含量。
病毒濃度(mg/mL)=(A260×稀釋倍數)/E
式中,E為消光系數,為在波長260 nm、懸浮液濃度為0.1%(1 mg/mL)及光程為1 cm時的光吸收值。CGMMV的E=3.1,A260/A280=1.71。
1.2.4 葉綠素含量的測定
采用丙酮法進行測定[18]:
(1) 準確稱取洗凈且吸干表面水分的葉片0.5 g,剪碎后放入研缽中。
(2) 加5 mL 80%丙酮,少許CaCO3和石英砂研磨到溶液變綠,組織變白,暗處靜止3~5 min后,過濾到50 mL容量瓶中。再加80%丙酮繼續研磨到組織完全變白。連同殘渣一并倒入漏斗的濾紙上,用吸管吸取80%丙酮沿濾紙的周圍洗脫色素,最后定容。
(3) 色素提取液倒入光徑為1 cm的比色杯中,將波長分別調到663 nm和645 nm處,以80%丙酮調零,測定兩波長處的光密度值。
(4) 將測得的光密度值代入下面公式,計算出提取液中葉綠素a、葉綠素b和總葉綠素的濃度。
結果計算:CA=12.7A663-2.59A645;
CB=22.9A645-4.67A663。
1.2.5 類胡蘿卜素含量的測定
準確稱取0.5 g樣品,放入試管內,加入20 mL石油醚∶丙酮(1∶1)浸提液,加塞放置搖床(100 r/min)上暗處浸提6 h,提取后的溶液在450 nm處測定吸光值[6]。
結果計算:類胡蘿卜素含量(mg/100 g)=A450×V(石油醚體積)
1.2.6 氨基乙酰丙酸脫水酶(ALA脫水酶)活性測定
Ehrlich 試劑的配制:2 g 對二甲氨基苯甲醛溶解于50 mL HCl中,蒸餾水定容至100 mL。
粗酶液的提取[19]:準確稱取0.5 g樣品,加入內含0.1 mmol/L DTT的0.05 mol/L Tris-HCl緩沖液(pH8.2)中,研磨至勻漿,15 000 g離心15 min,上清液用于酶活性測定。
酶活性的測定[7]:反應體系含0.5 mL酶粗提液,2 mL內含0.1 mmol/L DTT 的0.05 mol/L Tris-HCl緩沖液(pH8.2),0.02 mol/L MgCl237℃水浴2.5 h,用0.3 mL 3 mol/L三氯乙酸終止反應,2 000 g離心15 min后,取2 mL上清液,加入2 mL Ehrlich 試劑,室溫靜置15 min后。測定555 nm處的吸光值,酶活性以37℃下每2.5 h形成的PBG為一個酶活單位。
1.2.7 磷酸烯醇式丙酮酸羧化酶(PEP羧化酶)活性測定
酶的提取[19]:葉片用提取緩沖液(0.1 mol/L pH8.3 Tris-H2SO4緩沖液,內含7 mmol/L巰基乙醇,1 mmol/L EDTA,5%甘油)以1∶4(W/V)搗碎提取,4層紗布去粗殘渣,濾液以5 000 r/min 離心20 min,上清液進行硫酸銨分部沉淀,收集30%~55%的硫酸銨飽和度沉淀物,用5 mL提取緩沖液重新懸浮,置于透析袋(D27 mm)中透析8 h,脫鹽后的酶提取液用于酶活性分析,所有操作均在冰浴下進行。
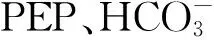
反應系統含有下列成分:酶反應緩沖液為0.1 mol/L Tris-H2SO4緩沖液(pH 9.2),總體積3 mL內含MgCl210 μmol、NaHCO310 μmol、磷酸烯醇式丙酮酸4 μmol,NADH 0.3 mg,過量的蘋果酸脫氫酶,適量酶液。
1.2.8 乙醇酸氧化酶活性的測定
酶粗提液的制備[19]:將西瓜葉片在-80℃深度冷凍,加入5 mL 0.1 mol/L磷酸氫二鈉緩沖液(pH8.0)混合,冰浴研磨至勻漿,濾液用冷的10%乙酸溶液調整到pH5.3,12 000 g冷凍離心除去沉淀。上清液立即用0.1 mol/L NaOH調整pH6.5。上清液進行硫酸銨分部,取25%~45%(NH4)2SO4飽和度的酶蛋白沉淀,并重新溶解于15 mL 0.1 mol/L磷酸鉀緩沖液(pH8.3)中,整個操作在0~4℃低溫下進行。
酶活性測定[19]:測定乙醛酸苯腙的形成。在光徑為1.0 cm 的比色杯中加入2 mL 0.1 mol/L磷酸鉀緩沖液(pH8.3),0.1 mL 0.1 mol/L半胱氨酸鹽酸鹽(使用當天制備),0.1 mL 0.1 mol/L鹽酸化苯肼和0.5 mL 0.5 mol/L乙醇酸鈉,反應在25℃下進行,由加入適量的酶液(使最終體積為3.0 mL)開始。用紫外分光光度計在324 nm處記錄光密度的變化。以每分鐘增加1.0光密度為1個酶活單位。比活為每mg蛋白的酶活性。
1.2.9 光合作用指標的測定
采用便攜式 LI-6400 型光合檢測系統(美國LI-COR公司)進行活體測定。采用夜視模式,光照強度為 1 000 lx,光合測定的指標為凈光合速率(Pn)、細胞間隙 CO2濃度(Ci)和氣孔導度(Gs)。光合測定時,環境條件是室內 CO2濃度 (272±0.5) μmol/mol,葉溫(TL)為 (19.5±0.5)℃,相對濕度(RH)為 60%±2%,室內溫度為 (18.4±0.5)℃,大氣壓為 100.8 kPa。
2 結果與分析
2.1 西瓜苗感染CGMMV后病情指數
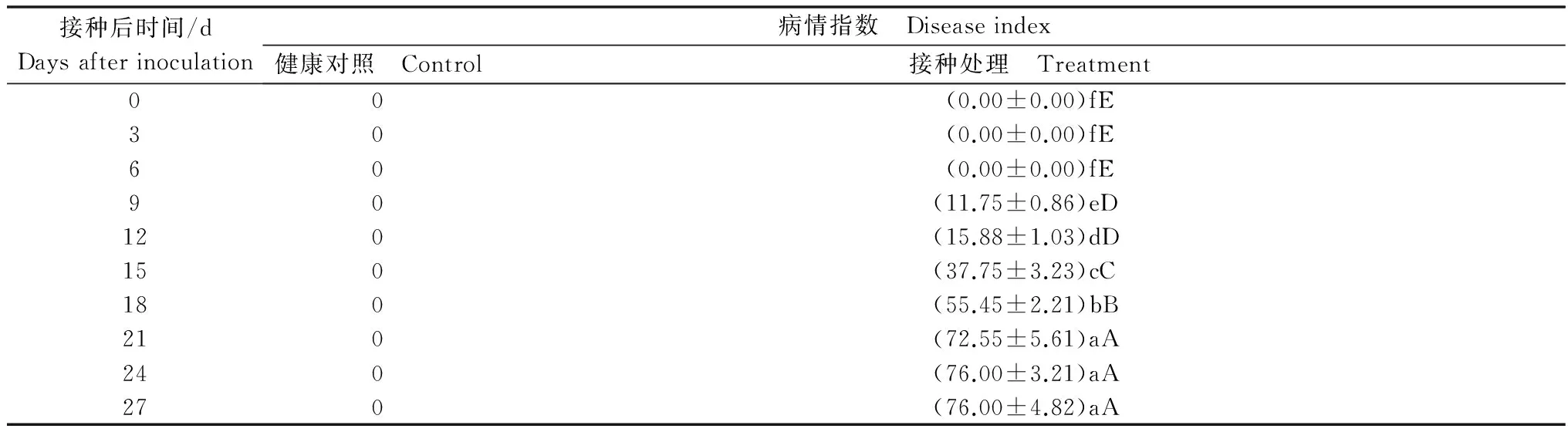
病情指數調查結果表明,接種后9 d植株開始出現明脈癥狀,18 d后病情迅速發展,出現明顯花葉現象,21 d后病情基本穩定,病情繼續發展的趨勢不明顯(表1)。
2.2 西瓜苗接種CGMMV后不同時間的病毒含量變化
2.2.1 病毒濃度檢測標準曲線
圖1為病毒含量計算標準曲線,其相關性達到0.986 6,相關性較高,因此可用于病毒含量的計算。
表1 接種CGMMV后西瓜苗病情指數1)
Table 1 Disease indexes of watermelon seedlings after inoculated by CGMMV
接種后時間/dDaysafterinoculation病情指數 Diseaseindex健康對照 Control接種處理 Treatment00(0.00±0.00)fE30(0.00±0.00)fE60(0.00±0.00)fE90(11.75±0.86)eD120(15.88±1.03)dD150(37.75±3.23)cC180(55.45±2.21)bB210(72.55±5.61)aA240(76.00±3.21)aA270(76.00±4.82)aA
1) 同列數據后,不同大小寫字母分別表示經Duncan’s 新復極差測驗,在P=0.01和P=0.05 水平上差異顯著。下同。 Values followed by the same capital letters and small letters in the same column indicate no significant difference atP=0. 01 andP=0.05 according to Duncan’ s New Multiple Range Test. The same below.
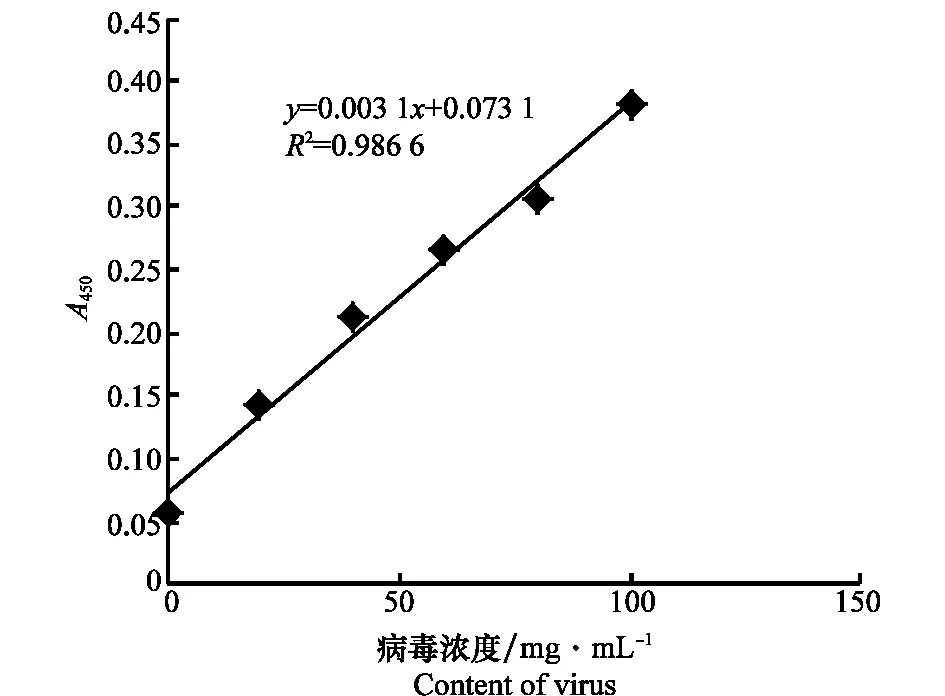
圖1 病毒含量標準曲線Fig.1 Standard curve of virus content
2.2.2 溫室西瓜苗感染CGMMV后體內病毒含量變化
于接種后不同時間取樣測定西瓜苗體內CGMMV含量的變化,結果表明(圖2):27 d內健康對照均未檢測到病毒,接種第3天西瓜苗就可以通過血清學檢測到該病毒,接種21 d后寄主植物體內病毒含量劇增,24 d時西瓜苗CGMMV含量最高,之后略有下降,這正與該病害病情發展基本對應。
2.3 西瓜感染CGMMV后對其葉綠素含量的影響
由圖3可知,隨著西瓜的生長,健康對照葉綠素a含量逐漸增加,18 d時葉綠素a含量最高,隨后葉綠素a含量有所降低。而接種處理后的西瓜幼苗體內的葉綠素a含量,在測定時間內第9天后均低于健康對照。在測定期間,0~12 d對照與接種處理間葉綠素b含量無明顯差別,15 d后健康對照葉綠素b含量增加,而接種處理葉綠素b含量降低,第18天時,健康對照的葉綠素b含量達接種處理的1.33倍(圖4)。無論葉綠素a、葉綠素b在接種后第9天其含量均低于健康對照。
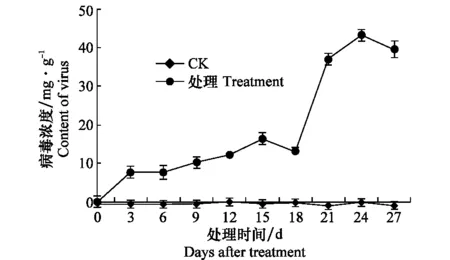
圖2 接種CGMMV后西瓜苗病毒含量隨時間的變化Fig.2 Change of virus contents in watermelon seedlings after inoculation with CGMMV
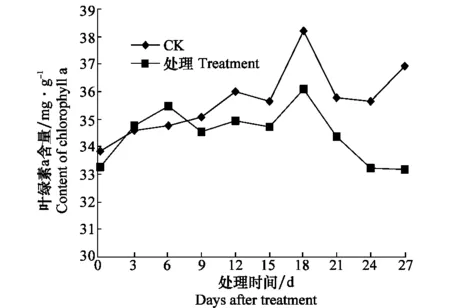
圖3 感染CGMMV后西瓜苗葉綠素a含量的變化Fig.3 Contents of chlorophyll a in watermelon seedlings inoculated with CGMMV
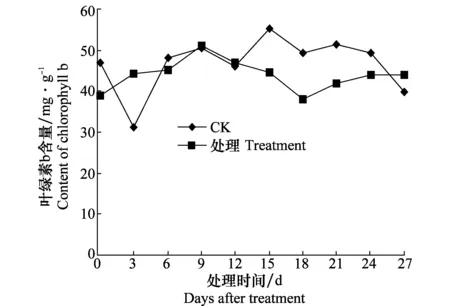
圖4 感染CGMMV后西瓜苗葉綠素b含量的變化Fig.4 Contents of chlorophyll b in watermelon seedlings inoculated with CGMMV
2.4 西瓜感染CGMMV后對類胡蘿卜素含量的影響
健康對照類胡蘿卜素含量在測定期間,21 d 達到最高后又下降,而接種處理后的西瓜苗體內類胡蘿卜素含量在0~9 d內與對照無明顯差異,但15 d后,在測定期間均低于對照(圖5)。
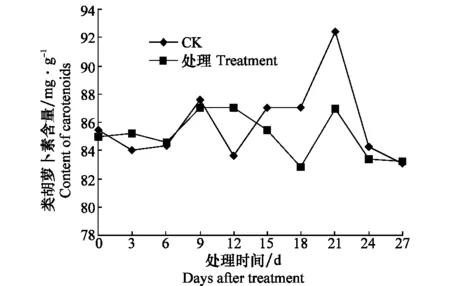
圖5 感染CGMMV后西瓜苗體內類胡蘿卜素含量的變化Fig.5 Contents of carotenoids in watermelon inoculated with CGMMV
2.5 西瓜感染CGMMV后對ALA脫水酶活性的影響
健康對照的ALA脫水酶活性前期6 d出現活性高峰后,迅速降低,15d后活性又上升,而接種處理后的西瓜幼苗,ALA脫水酶活性除第15天與健康對照無顯著差異外,整個測定期間均低于健康對照,21 d健康對照的ALA脫水酶的活性達29.9 U/h,為接種處理的2.18倍(圖6)。
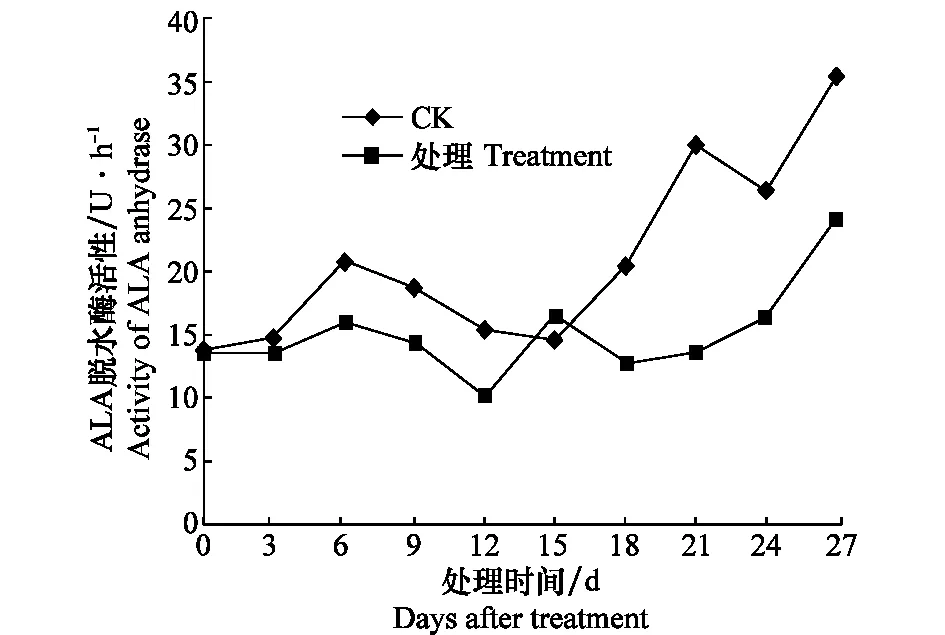
圖6 感染CGMMV后西瓜苗ALA脫水酶活性的變化Fig.6 Activities of ALA anhydrase in watermelon seedlings inoculated with CGMMV
2.6 西瓜感染CGMMV后對磷酸烯醇式丙酮酸羧化酶(PEP羧化酶)活性的影響
健康對照的PEP羧化酶的活性測定期間0~15 d內變化不明顯,在18 d時活性達到最高,18~24 d其活性基本保持不變,隨后下降。而接種處理后PEP羧化酶的活性顯著低于健康對照,且整個測定期間其活性變化不大(圖7)。
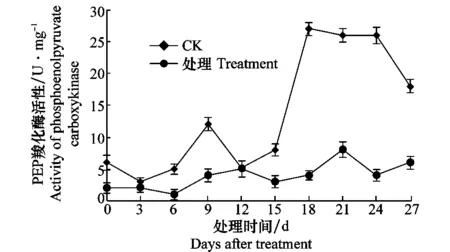
圖7 感染CGMMV后西瓜苗PEP羧化酶活性的變化Fig.7 Activities of phosphoenolpyruvate carboxykinase in watermelon seedlings inoculated with CGMMV
2.7 西瓜感染CGMMV后對乙醇酸氧化酶活性的影響
接種CGMMV后西瓜苗乙醇酸氧化酶活性明顯升高,整個測定期間,其活性均明顯高于健康對照,且健康對照與接種處理均于第9天達活性高峰(圖8)。
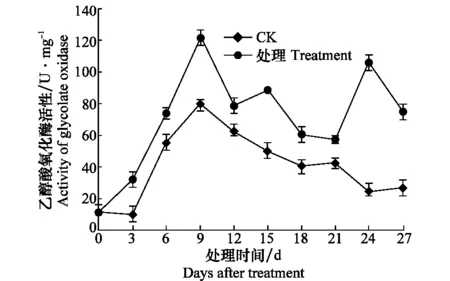
圖8 感染CGMMV后西瓜苗乙醇酸氧化酶活性的變化Fig.8 Activities of glycolate oxidase in watermelon seedlings inoculated with CGMMV
2.8 西瓜感染CGMMV后光合指標的變化
在相同的光照、溫度、濕度和大氣壓力條件下,測定了接種CGMMV后對西瓜幼苗的光合速率、蒸騰速率、氣孔導度和胞間CO2濃度等一系列光合指標。
測定結果見表2:接種CGMMV后,西瓜葉片的光合速率、氣孔導度和蒸騰速率均遠遠小于健康對照,而細胞間隙CO2濃度卻比對照高,這說明病毒侵染后西瓜的葉綠體受到了破壞,葉綠素合成受阻,西瓜葉片的氣孔關閉,阻礙了氣體交換,從而導致了西瓜的凈光合速率的下降。同時病毒侵染后期也使葉片的蒸騰速率下降,但蒸騰速率下降的幅度小于光合速率下降的幅度,表明西瓜苗的光合組織受到了破壞,胞間CO2不能被利用,從而使得胞間CO2濃度增加。同時蒸騰速率作為葉片水分交換的參數,它的下降反映了感病葉片存在著組織損傷和功能的衰退。
表2 西瓜感染CGMMV后對其光合指標的影響1)
Table 2 Photosynthetic indexes in watermelon seedlings inoculated with CGMMV
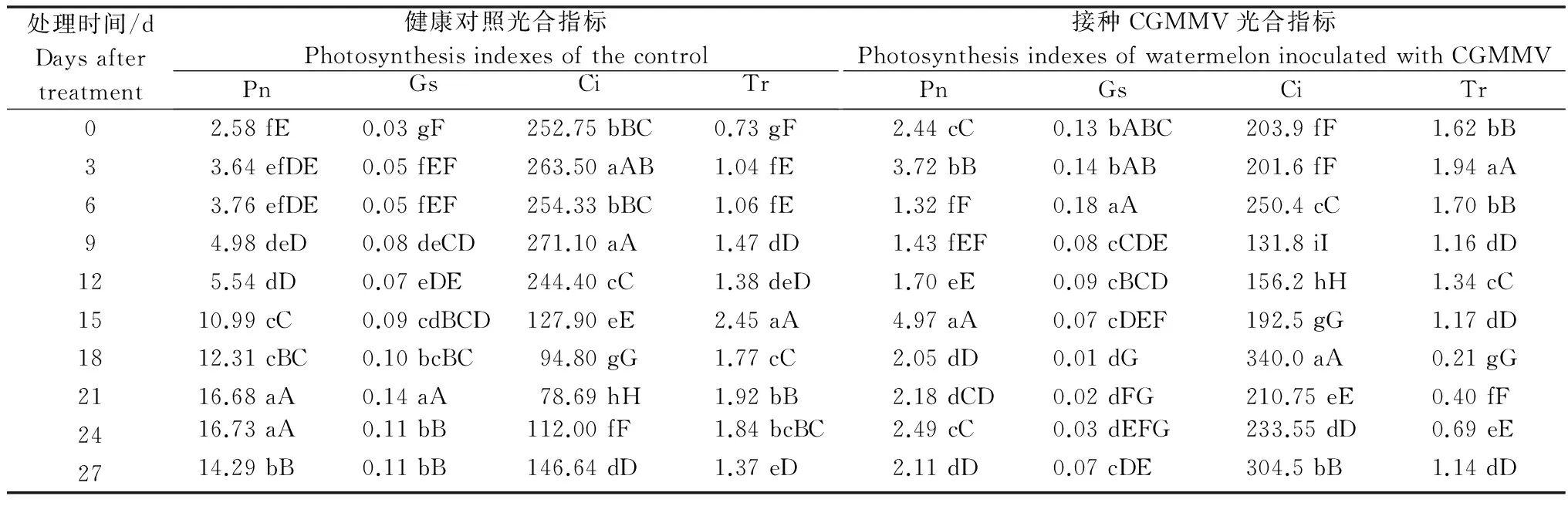
處理時間/dDaysaftertreatment健康對照光合指標PhotosynthesisindexesofthecontrolPnGsCiTr接種CGMMV光合指標PhotosynthesisindexesofwatermeloninoculatedwithCGMMVPnGsCiTr02.58fE 0.03gF 252.75bBC0.73gF2.44cC0.13bABC203.9fF1.62bB33.64efDE0.05fEF263.50aAB1.04fE3.72bB0.14bAB201.6fF1.94aA63.76efDE0.05fEF254.33bBC1.06fE1.32fF0.18aA250.4cC1.70bB94.98deD0.08deCD271.10aA1.47dD1.43fEF0.08cCDE131.8iI1.16dD125.54dD0.07eDE244.40cC1.38deD1.70eE0.09cBCD156.2hH1.34cC1510.99cC0.09cdBCD127.90eE2.45aA4.97aA0.07cDEF192.5gG1.17dD1812.31cBC0.10bcBC94.80gG1.77cC2.05dD0.01dG340.0aA0.21gG2116.68aA0.14aA78.69hH1.92bB2.18dCD0.02dFG210.75eE0.40fF2416.73aA0.11bB112.00fF1.84bcBC2.49cC0.03dEFG233.55dD0.69eE2714.29bB0.11bB146.64dD1.37eD2.11dD0.07cDE304.5bB1.14dD
1) Pn,凈光合速率(μmol·m-2·s-1);Gs,氣孔導度(mmol·m-2·s-1);Ci,胞間CO2濃度(μL·L-1);Tr,蒸騰速率(mol·m-2·s-1)。 Pn,photosynthesis (μmol·m-2·s-1);Gs,stomatal conductance (mmol·m-2·s-1);Ci,intracellular concentration of CO2(μL·L-1);Tr,transpiration rate (mol·m-2·s-1).
2.9 健瓜成熟及病瓜倒瓤過程觀察
西瓜果實生長狀況見圖9,正常西瓜在授粉后21 d時果肉呈粉色,28 d時西瓜成熟良好,生產上可以選擇在這一時期采摘,而35 d時,西瓜完全成熟,此時期西瓜口味更好。而接種病毒處理的西瓜果實在授粉后21 d時西瓜果實種子周圍出現顏色明顯發紅的水漬狀,28 d時病組織脫水,種子周圍凹陷,果肉呈纖維化,35 d時果肉組織嚴重纖維化形成空腔,有明顯腐爛、酸化等氣味,“倒瓤”現象嚴重。

圖9 健瓜成熟度及病瓜倒瓤程度Fig.9 Healthy watermelon maturity and blood-flesh of watermelon
3 結論與討論
測定結果表明,采用摩擦法對西瓜接種CGMMV 3 d后即可在樣品中檢測到病毒的存在,21 d時病毒含量驟增,24 d達到最高,之后略有下降,這與裘維蕃的報道基本吻合,即接種3周左右,寄主體內病毒含量最高,而后會出現病毒增殖衰退現象[20]。
光合作用是植物生長的生理基礎,反映植株的生長勢和抗逆性。西瓜感染CGMMV后,其光合色素、光合作用指標及參與光合作用的關鍵酶活性均受到影響。據報道,寄主植物受病毒侵染后葉綠素和類胡蘿卜素的形成會受到強烈抑制,光合速率降低,呼吸強度上升,甚至葉綠體解體[21-27]。植物進行光合作用的能量主要來源于光合色素捕獲的光能,所以光合色素含量的高低與光合功能密切相關[28]。光合色素中葉綠素 a 是光反應的中心色素分子,而葉綠素 b 是捕光色素分子。類胡蘿卜素一方面是光合色素,吸收光能并傳遞給反應中心,參與光合作用;另一方面又是細胞內源抗氧化劑,能夠吸收剩余光能,淬滅活性氧,防止細胞膜脂過氧化[29]。本研究發現,西瓜感染CGMMV后,葉綠素a、葉綠素b以及類胡蘿卜素含量均有不同程度的降低,說明CGMMV不僅使光合色素的合成受阻,同時可能促進光合色素的降解。其主要原因可能是西瓜感染CGMMV后,導致葉綠素分解酶活性上升,使葉綠素轉化為葉綠素酯和葉綠素醇,因此葉綠素含量降低[26]; 也有可能是CGMMV侵染破壞葉綠體結構和功能,導致葉綠素含量下降。CGMMV侵染導致光合色素含量降低,在一定程度上減少西瓜植株的有效光合面積,限制碳素同化能力,從而抑制光合作用。同時,由于類胡蘿卜素含量下降,減弱對活性氧的猝滅,導致細胞內積累較多的活性氧自由基,破壞葉綠體膜結構,加速葉綠素降解,從而降低光合作用中光能的吸收和傳遞[30]。
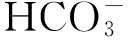
CGMMV侵染后西瓜葉片的光合速率、氣孔導度和蒸騰速率均遠遠小于健康對照,細胞間隙CO2濃度卻比對照高,表明CGMMV侵染后西瓜葉綠素合成受阻,西瓜葉片的氣孔關閉,阻礙了氣體交換,從而導致了西瓜的凈光合速率的下降。
綜上,西瓜感染CGMMV后,光合色素、光合作用關鍵酶均受到了不同程度的破壞,阻礙了西瓜光合作用的正常進行,光合作用是提供植物生長能量的源,因此西瓜的生長受到嚴重影響。
[1] 農業部.中華人民共和國農業部第788 號公告[EB].2006-12-21.
[2] Hollings M, Komuro Y, Tochihara H.Cucumbergreenmottlemosaicvirus[M]. Descriptions of Plant Virus Kew:CMI / AAB, 1975:154.
[3] Shahwan I M, Abdalla O A.A strain ofCucumbergreenmottlemosaicvirus(CGMMV) from bottle gourd in Saudi Arabia [J].Journal of Phytopathology, 1992, 134(2):152-156.
[4] 周玲玲, 吳元華, 趙秀香, 等.黃瓜綠斑駁花葉病毒生物學特性及對西瓜產量和質量的影響[J]. 沈陽農業大學學報, 2008, 39(4):417-422.
[5] Chen M J, Wang S M. A strain ofCucumbergreenmottlevirusin bottle gourd in Taiwan [M]// Plant virus disease of horticultural crop in tropics and subtropics. Food Fertilizer Technology Center for Asian and Pacific Region. Taiwan: Book Series, 1986, 33: 38-42.
[6] Choi Gugseoun, Choi G S.Occurrence of two Tobamovirus diseases in cucurbits and control measures in Korea [J]. Plant Pathology Journal, 2001, 17(5):243-248.
[7] 李立梅, 吳元華, 趙秀香, 等.西瓜感染黃瓜綠斑駁花葉病毒后糖的變化與倒瓤關系的研究[J].植物病理學報,2011,41(3):319-323.
[8] 李立梅,吳元華,趙秀香,等. 黃瓜綠斑駁花葉病毒對西瓜產量、品質及種子帶毒的影響[J]. 植物保護,2010,36(6):82-86.
[9] 李立梅, 陳越渠, 李曉冬, 等. 人工接種CGMMV后與西瓜倒瓤相關部分生理指標的研究[J].植物病理學報,2015,45(5):461-467.
[10]楊志曉, 丁燕芳, 張小全,等. 赤星病脅迫對不同抗性煙草品種光合作用和葉綠素熒光特性的影響[J].生態學報,2015,35(12): 4146-4154.
[11]彭晏輝,雷娟麗,黃黎鋒,等.馬鈴薯Y病毒侵染對葉綠體超微結構、光合和熒光參數的影響[J].植物病理學報,2004,34(1):32-36.
[12]郭興啟,溫孚江, 朱漢城. 馬鈴薯Y病毒(PVY)的侵染對煙草葉片光合作用的影響[J]. 浙江大學學報(農業與生命科學版), 2000,26(1):75-78.
[13]洪健,徐穎,徐正. 植物病毒感染寄主葉綠體的形態結構變化[J]. 電子顯微學報, 2000, 19(3):335-336.
[14]Doke L. Incorporation of14CO2into free and bound amino acids in tobacco leaves infected withTobaccomasaicvirus[J].Phytopathology, 1972,73:215-226.
[15]David M M, Coelho D, Barrote I. Leaf age effects on photosynthetic activity and sugar accumulation in droughted and rewateredLupinusalbusplants[J].Australian Journal of Plant Physiology, 1998, 25:299-306.
[16]Funayama S,Sonoike K,Terashima I. Photosynthetic properties of leaves ofEupatoriummakinoiinfected by a geminivirus[J].Photosynthesis Research,1997,53: 253-261.
[17]蘇小記, 賈麗娜, 王亞紅, 等. 2.0%氨基寡糖素水劑防治西瓜病毒病藥效試驗[J]. 陜西農業科學,2004(4):8-9
[18]郝建軍, 劉延吉. 植物生理學實驗技術[M].沈陽:遼寧科學技術出版社, 2001.
[19]薛應龍. 植物生理學實驗手冊[M].上海:上海科學技術出版社.1985.
[20]裘維蕃. 植物病毒學(修訂版)[M].北京:農業出版社, 1984:253-270.
[21]洪健,徐穎,黎軍英,等.蕪菁花葉病毒(TuMV)侵染對寄主植物光合作用的影響[J].電子顯微學報,2002,21(2):110-113.
[22]王春梅,施定基,朱水芳,等.黃瓜花葉病毒對煙草葉片和葉綠體光合活性的影響[J].植物學報, 2000,42(4):355-392.
[23]沈喜, 李紅玉. 病毒侵染后植物葉綠體光合作用變化的分子機制[J].2003,33(4): 289-291.
[24]Roger D A, Corbett M K. Reduced photosynthesis in tobacco plant infected withTobaccoringspotvirus[J]. Phytopathology,1965, 55: 370-371.
[25]Hall A E, Loomis R S.An explanation for the difference in photosynthetic capabilities of healthy and beet yellows virus-infected sugar beets(BetavulgarisL.)[J]. Plant Physiology, 1972, 50: 576-580.
[26]李燕宏,洪健,謝禮,等. 蠶豆萎蔫病毒2 號分離物侵染對蠶豆葉片光合活性和葉綠體超微結構的影響[J]. 植物生理與分子生物學學報,2006,32(4): 490-496.
[27]宋麗麗, 郭延平, 徐凱, 等. 溫州蜜柑葉片光合作用光抑制的保護機理[J]. 應用生態學報,2003,14(1): 47-50.
[28]Li X G,Meng Q W,Jiang G Q,et al. The susceptibility of cucumber and sweet pepper to chilling under low irradiance is related to energy dissipation and water-water cycle [J].Photosynthetica,2003,41(2): 259-265.
[29]Willekens H,van Camp W,van Montagu M,et al. Ozone,sulfurdioxide,and ultraviolet B have similar effects on mRNA accumulation of antioxidant genes inNicotianaplumbaginifoliaL. [J].Plant Physiology,1994,106(3): 1007-1014.
[30]Sakaki T,Kondo N,Sugahra K.Breakdown of photosynthetic pigment and lipids in spinach leaves with ozone fumigation: Role of active oxygen [J].Physiologia Plantarum,1983,59(1): 28-34.
[31]潘瑞志. 植物生理學[M]. 北京:高等教育出版社,2001.
(責任編輯:田 喆)
Studies on viral multiplication and its effect on photosynthesis of the watermelon inoculated byCucumbergreenmottlemosaicvirus
Wang Yanhong1, Chen Ping2, Wang Conghui2, Mao He2, Zhang Xiaozong1, Li Limei2
(1.CollegeofLifeScienceandTechnology,HeilongjiangBayiAgriculturalUniversity,Daqing163319,China; 2.JilinAcademyofForestrySciences,Changchun130033,China)
Studies were conducted with the watermelon cultivar ‘Jingxin’ in Liaoning Province. In order to reveal the viral multiplication process after watermelon was inoculated byCucumbergreenmottlemosaicvirus(CGMMV) and its influence on photosynthesis, some physiological and biochemical indexes such as concentration of virus and photosynthetic pigment, activity of key enzymes and related physiological indexes were studied. The results indicated that the virus was detected on the 3rd day after watermelons were inoculated by CGMMV, and the concentration of virus was highest on the 24th day. Meanwhile the concentrations of chlorophyll a,chlorophyll b and carotenoids were significantly lower than those of the control. The concentration of chlorophyll a was lower than that of healthy control after 9 days. The concentration of chlorophyll b and carotenoids were significantly decreased on the 15th day. On the 18th day, the concentration of chlorophyll b was equivalent to 1.33 times of the control. In this study, the activity of ALA anhydrase was tested. It was 29.9 U/h, much higher than that of the control and equivalent to 2.18 times on the 21st day. The tests showed that the activity of phosphoenolpyruvate carboxykinase was significantly lower than that of the control, but the activity of glycolate oxidase was higher than that of the control during the experimental period. The photosynthesis (Pn), stomatal conductance (Gs) and transpiration rate (Tr) of watermelon leaves were lower than those of the control, while the concentration of CO2in the cells was higher than that of the control. This research established foundation for revealing the change in photosynthesis after watermelon was inoculated by CGMMV.
watermelon;Cucumbergreenmottlemosaicvirus; viral multiplication; photosynthesis
2016-10-24
2016-12-22
遼寧省科技攻關項目(2006215003);黑龍江省大學生創業實踐項目(201610223064)
S 436.5
A
10.3969/j.issn.0529-1542.2017.04.005
* 通信作者 E-mail: lilimei19820406@163.com

