同步脫氮除磷系統中兩種顏色好氧顆粒污泥的微生物群落特征
樊曉燕, 高景峰*, 王時杰, 張麗芳, 張樹軍, 高永青, 張 帥
1.城鎮污水深度處理與資源化利用技術國家工程實驗室, 北京工業大學環境與能源工程學院, 北京 100124 2.北京城市排水集團有限責任公司科技研發中心, 北京 100124
同步脫氮除磷系統中兩種顏色好氧顆粒污泥的微生物群落特征
樊曉燕1, 高景峰1*, 王時杰1, 張麗芳1, 張樹軍2, 高永青2, 張 帥2
1.城鎮污水深度處理與資源化利用技術國家工程實驗室, 北京工業大學環境與能源工程學院, 北京 100124 2.北京城市排水集團有限責任公司科技研發中心, 北京 100124
為研究同步脫氮除磷系統中出現的WG(白色好氧顆粒污泥)外形特點及微生物群落特征,探究其成因,利用SEM(掃描電子顯微鏡)表征了系統中的WG與YG(黃色好氧顆粒污泥)的微觀形態,并采用Illumina HiSeq 2500高通量測序平臺對兩種好氧顆粒污泥中細菌與真菌的群落組成進行研究. 結果表明:WG結構疏松外形不規則,顆粒表面分布大量桿菌;而YG飽滿緊實輪廓清晰,顆粒表面分布大量球菌. WG與YG的細菌群落組成相似,但真菌組成差異較大. 與YG相比,WG具有更高的細菌和真菌多樣性. 變形菌門(Proteobacteria)和擬桿菌門(Bacteroidetes)為WG和YG中的細菌優勢門,其在WG中的相對豐度分別為68.85%和26.61%,在YG中的相對豐度分別為82.52%和12.30%.Candidatuscompetibacter、Candidatusaccumulibacter和Chiayiivirga為WG中的優勢屬,相對豐度分別為22.13%、8.95%和7.37%;Candidatuscompetibacter、Chiayiivirga和Xanthomonas為YG中的優勢屬,相對豐度分別為47.94%、6.95%和7.06%. 子囊菌門(Ascomycota)和Rozellomycota分別為WG與YG中真菌優勢門,其在兩個樣品中的相對豐度分別為50.10%和81.77%. 在屬水平,WG中存在大量青霉屬(Penicillium)和假絲酵母屬(Candida)等絲狀真菌,為WG的形成提供了框架. 研究顯示,當YG破碎成為小菌膠團后,附著在真菌框架上,造成了WG的快速形成,同時WG中Candidatuscompetibacter的相對豐度較低,使其外形疏松、透光性較好,呈現出白色.
白色好氧顆粒污泥; 黃色好氧顆粒污泥; 高通量測序; 細菌群落組成; 真菌群落組成
自20世紀90年代被首次報道以來,好氧顆粒污泥工藝一直被認為是一種高效、前景廣闊的處理工藝[1]. 2005年,荷蘭代爾伏特理工大學與DHV公司率先推出了以好氧顆粒污泥中試為基礎的Nereda?工藝. 自2008年第一座采用Nereda?工藝的市政污水處理廠——南非Gansbaai污水處理廠投入運行以來,全球已有30多座采用該工藝的污水廠投入運行或建設.
與普通的活性污泥相比,好氧顆粒污泥具有污泥密度大、生物量高、沉降性能好、抗沖擊負荷等優點,因其結構對溶解氧的傳質限制,從而有利于在單污泥系統中實現SNPR(simultaneous nitrogen and phosphorus removal,同步脫氮除磷)[2]. 利用好氧顆粒污泥實現SNPR一直是研究熱點. WEI等[3- 5]對SNPR中NP的去除效果、機理以及脫氮除磷相關微生物進行了研究. 同時,分子生物學方法也被應用于研究好氧顆粒污泥微生物群落結構. Weissbrodt等[6]應用T-RFLP技術研究了污泥好氧顆粒化過程中微生物群落結構的變化. WANG等[7]應用PCR-DGGE技術研究了好氧顆粒污泥啟動階段氨氧化微生物的群落結構. 但是,這些傳統的分子生物學方法由于PCR偏差和通量低等特點,存在一定限制.
隨著高通量測序技術的出現,由于其具有通量高、周期短、價格低等優點,其在環境微生物研究領域得到了廣泛的應用. 同時,高通量測序技術也被應用于顆粒污泥的研究中. HE等[8- 9]利用高通量測序技術研究了污泥好氧顆粒化過程中微生物群落結構的變化,分析了特定微生物與污泥顆粒化的關系. 在以往的研究中,基于不同水質、不同底物濃度和不同運行方式進行好氧顆粒污泥的培養,雖然得到的好氧顆粒污泥顏色各異,但同一反應器中的好氧顆粒污泥顏色較為統一[6- 9]. 而在該研究中,已培養出YG(yellow aerobic granular sludge,黃色好氧顆粒污泥)的反應器中,階段性出現了一種WG(white aerobic granular sludge,白色好氧顆粒污泥),二者形態差別明顯,WG的出現未對系統的SNPR效果產生影響,這種現象在之前的研究中鮮有報道. 因此,該研究以WG與YG為研究對象,利用SEM(scanning electronic microscopy,掃描電子顯微鏡)和Illumina HiSeq高通量測序技術,對二者的微觀形態特點和細菌與真菌群落組成進行了研究,并從微生態的角度探討了WG的形成機理,以期為好氧顆粒污泥反應器的應用提供理論基礎.
1 材料與方法
1.1 試驗裝置

注:1—原水箱;2—進水泵;3—止回閥;4—空氣壓縮機;5—氣體流量計;6—曝氣盤;7—外加碳源水箱;8—蠕動泵;9—液位計;10—電動攪拌器;11—加熱裝置;12—電動閥;13—時控開關;14—SBR.圖1 SBR裝置Fig.1 The schematic diagram of SBR
SBR材質為有機玻璃,總體積為85 L,直徑30 cm,高120 cm,有效容積65 L,排水比為12(見圖1). 反應器底部設曝氣盤,采用空氣壓縮機供氣,由氣體流量計控制曝氣量. 反應器運行各階段由時控開關控制,每個周期分為進水(10 min)、厭氧攪拌(60 min)、曝氣(180 min)、沉淀、排水(10 min)、閑置6個階段. 其中沉淀時間由最初的15 min逐漸縮減至5 min,閑置時間隨每天運行的周期數而改變. 外加碳源由蠕動泵加入到反應器中. 反應器設保溫加熱裝置,控制溫度在20~25 ℃.
1.2 接種污泥和試驗用水
接種污泥取自北京市吳家村再生水廠,試驗用水為生活污水,ρ(CODCr)、ρ(TN)、ρ(NH4+-N)、ρ(NO2--N)、ρ(NO3--N)、ρ(PO43--P)分別為102.3~160.1、37.5~52.2、30.2~45.3、0.1~0.3、0.1~2.4、2.5~6.8 mgL. 由于所用生活污水ρ(CODCr)較低,因此,在進水中投加碳源,使進水ρ(CODCr)維持在400 mgL左右. 外加碳源由乙酸鈉與丙酸鈉混合配置而成. 此外,在進水中補充氮與磷,使進水中ρ(NH4+-N) 與ρ(PO43--P)分別維持在60和8 mgL左右.
1.3 試驗樣品
采用逐步縮短沉淀時間的方法培養好氧顆粒污泥,反應器在運行40 d后形成好氧顆粒污泥,污泥粒徑由種泥的124.0 μm(D50,下同)增至283.5 μm,運行130 d后達到764.2 μm. 系統運行到第270天時,反應器內出現大量WG,與原有YG混合存在3~4周后逐漸消失. 在此期間,系統TN和PO43--P的去除率保持穩定,分別在65%與95%以上,好氧顆粒污泥沉降性能未受影響. 為了研究系統中WG的出現原因,以及WG與YG的微生物群落特性,取第270天時的污泥樣品進行后續研究分析.
1.4 分析項目及方法
常規分析項目ρ(CODCr)、ρ(TN)、ρ(NH4+-N)、ρ(NO2--N)、ρ(NO3--N)、ρ(PO43--P)等均采用國家標準方法[10]測定.ρ(DO)、pH采用WTW Multi 3400(WTW Laborprodukte,GER)便攜分析儀測定. WG與YG的表面形態采用Olympus BX5152(OLYMPUS,JPN)光學顯微鏡觀察,微觀形態使用Hitachi S- 3400N(HITACHI,JPN)掃描電子顯微鏡表征. 好氧顆粒污泥粒徑分布使用Microtrac S3500(Microtrac Inc,USA)激光粒度分析儀測定.
1.5 DNA提取與高通量測序分析
挑選出樣品中WG與YG,經過真空凍干后碾碎提取DNA. 使用Fast DNA? Spin kit for soil(Qiagen,CA,USA)DNA試劑盒提取樣品DNA,采用NanoDrop ND- 1000 Spectrophotometer (Thermo Fisher Scientific, USA)測定提取DNA的濃度和質量. DNA樣品送往北京諾禾致源生物信息科技有限公司進行高通量測序,測序平臺為Illumina HiSeq 2500. 測序內容為細菌16S rRNA V4區,引物為515F(5′-GTGCCAGCMGC CGCGGTAA- 3′)和806R(5′- GGACTACHVGGGTW TCTAAT- 3′),真菌為ITS區,引物為ITS5- 1737F(5′-GGAAGTAAAAGTCGTAACAAGG- 3′)和ITS2- 2043R(5′-GCTGCGTTCTTCATCGATGC- 3′). 原始測序數據經過篩選去除低質量序列和嵌合體后,得到有效的序列. 為保證不同樣品在相同的測序深度下進行比較,對序列進行均一化處理. 之后,使用QIIME[11]進行后續分析. 采用RDP分類方法劃分OTUs(操作分類單元),相似度設置為97%. 細菌OTUs的物種注釋采用Silva數據庫,真菌OTUs的物種注釋采用Unite數據庫,得到對應的物種信息后進行多樣性及微生物群落結構分析.
2 結果與討論
2.1 WG與YG外觀形態
圖2(a)為WG與YG相機拍攝圖. 從圖2(a)可見,WG形態松散,邊緣不規則,而YG形態較為規則、飽滿. 圖2(b)(c)為WG與YG的顯微鏡拍攝圖,WG〔見圖2(b)〕不夠緊實,容易破碎;而YG〔見圖2(c)〕邊界清晰且飽滿緊實.

圖2 WG與YG泥外觀形態Fig.2 Morphology of WG and YG
由WG與YG的SEM圖(見圖3)可見,WG經脫水處理后呈扁平狀,表面存在大量褶皺,說明其內部結構疏松. 進一步放大觀察,可以發現WG表面存在大量桿菌〔見圖3(d)〕,其分布較為松散. YG外部輪廓更加清晰〔見圖3(e)〕,表面存在明顯的凹陷與空隙,放大后,可以觀察到顆粒表面分布著大量球菌〔見圖3(h)〕,這些球菌被一層粘稠狀物質所覆蓋粘連,這種黏稠狀物質可能為細菌代謝產生的EPS(extracellular polymeric substances,胞外聚合物),其有利于微生物的凝聚并形成堅實的好氧顆粒污泥[12]. 綜上,WG與YG在表面及微觀形態上都存在較大區別,WG結構松散,而YG飽滿緊實.

注:(a)~(d)為WG; (e)~(h)為YG.圖3 好氧顆粒污泥SEM照片Fig.3 SEM of aerobic granular sludge
2.2 WG與YG細菌群落差異
2.2.1 細菌多樣性差異
WG與YG進行細菌16S rRNA V4區高通量測序后共產生118 401條有效序列,經均一化后,每個樣品的有效序列數為 49 020 條. 在97%的相似度下,WG與YG共得到 1 028 個OTUs. 樣品稀缺性曲線如圖4(a)所示,兩條曲線都趨于平坦,表明測序結果涵蓋了樣品中絕大多數微生物信息. 其中,WG的OTUs數為948,YG的OTUs數為878,可以看出WG中的微生物種類較多. 圖4(b)為Venn圖,其中WG與YG共有的OTUs數為798,比例高達77.63%,表明WG在細菌群落組成上與YG存在較大的相似性,WG獨有的OTUs占總數的14.59%,要略大于YG的7.78%.

圖4 細菌群落稀缺性曲線和Venn圖Fig.4 Rarefaction curve and venn diagram of bacterial community
表1為WG和YG的α多樣性指數表. Chao1豐富度指數與Shannon-Wiener、Simpson多樣性指數可反映出樣品中微生物的豐富度與多樣性. WG的Chao1指數為 1 070.825,大于YG的 1 012.459,說明WG中細菌種類更加豐富. WG的Shannon-Wiener、Simpson多樣性指數分別為6.427和0.962,大于YG的5.124和0.890,說明WG中微生物多樣性較高.
2.2.2 細菌群落組成差異

表1 細菌群落α多樣性指數
對樣品OTUs代表序列進行物種注釋,并將樣品的有效序列劃分到不同的分類水平(從門到屬). 該研究共得到22門、56綱、102目、204科和358屬. 兩種好氧顆粒污泥中相對豐度>1%的門如圖5(a)所示. 變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)以及放線菌門(Actinobacteria)為兩樣品的優勢門,其在WG中的相對豐度為68.85%、26.61%和3.62%;在YG中為82.52%、12.30%和1.62%. 從門水平上看出,WG中的優勢門與YG相同,在相對豐度上差異較小.
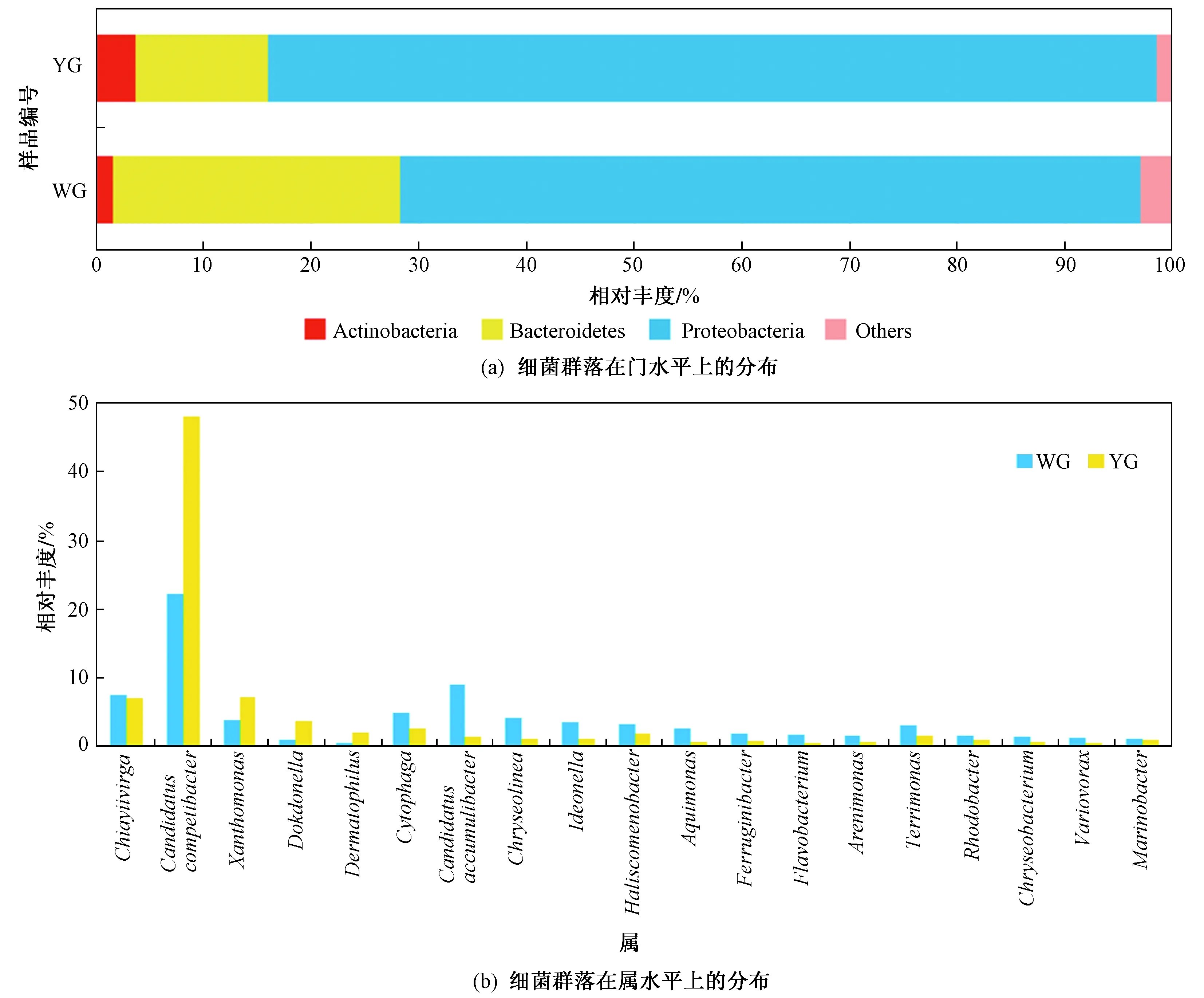
圖5 WG和YG上細菌群落的分布Fig.5 Distribution of bacterial community of WG and YG
在屬水平,進一步篩選相對豐度大于1%的屬(主要屬)進行分析,結果見圖5(b). 在WG和YG中分別發現了17和11個主要屬,其總的相對分度分別為82.30%和74.65%. 其中,Candidatuscompetibacter是WG和YG中最為優勢的屬,其在兩個樣品中的相對豐度分別為22.13%和47.94%. 此外,Candidatusaccumulibacter和Chiayiivirga為WG中的第二大和第三大主要屬,其相對豐度分別為8.95%和7.37%.Chiayiivirga和黃桿菌屬(Xanthomonas)為YG中的主要屬,相對豐度分別為6.95%和7.06%. 在WG和YG中都有各自相對豐度較高的屬. 噬細胞菌屬(Cytophaga)、Candidatusaccumulibacter、Chryseolinea和Ideonella等屬的相對豐度在WG中較高,而Candidatuscompetibacter、黃桿菌屬(Xanthomonas)、Dokdonella和潛蚤屬(Dermatophilus)在YG中的相對豐度較高. 此外,WG中屬的分布與YG存在相似性,YG中相對豐度較高的屬,同樣存在于WG中,且含量較高,如Candidatuscompetibacter、Xanthomonas、Chiayiivirga等屬,WG中也不存在獨有且相對豐度較高的屬,表明WG可能由破碎的YG生長形成.
2.3 WG與YG真菌群落差異
2.3.1 真菌多樣性差異
WG與YG真菌ITS區高通量測序共產生 78 973 條有效序列,經均一化處理后,每個樣品的有效序列數為 24 528 條. 在97%的相似度下,共得到618個OTUs,其中WG中有551個,YG中有287個. 樣品稀釋性曲線如圖6(a)所示,其中兩條曲線最終都趨于平坦,說明測序結果能夠覆蓋大部分的真菌多樣性. 利用QIIME分析兩樣品OTUs的α多樣性,結果如表2所示. WG的Chao1指數為599.725,遠大于YG的343.231,Shannon-Wiener和Simpson多樣性指數(5.390和0.913)也明顯大于YG(1.874和0.396),說明WG中真菌多樣性遠高于YG. 圖6(b)為真菌OTUs的Venn圖. 兩種好氧顆粒污泥共享的OTUs占總數的35.60%,WG單獨擁有的OTUs占總數的53.56%,遠大于YG的10.84%,說明WG與YG在真菌群落結構上存在較為明顯的差別.
2.3.2 真菌群落組成差異

圖6 真菌群落稀缺性曲線和Venn圖Fig.6 Rarefaction curve and venn diagram of fungal community

圖7 WG和YG上真菌群落的分布Fig.7 Distribution of fungal community of WG and YG

樣品OTUsChao1Shannon?WienerSimpsonCoverageWG551599725539009130997YG287343231187403960996
真菌門水平分布如圖7(a)所示. 兩種好氧顆粒污泥中共存在11個門,WG中子囊菌門(Ascomycota)、Rozellomycota和壺菌門(Chytridiomycota)的相對豐度較高,分別為50.10%、25.93%和6.01%;YG中Rozellomycota和子囊菌門(Ascomycota)的相對豐度較高,分別為81.77%和6.95%. 從門水平上看,WG與YG在真菌群落結構上存在較大差異,相比于YG,WG中子囊菌門的相對豐度較高,子囊菌門是真菌中最大的類群,其物種廣泛分布在陸地和水環境中[13],表明WG的特殊形態可能與進水中所攜帶的真菌有關. 而YG中優勢門(Rozellomycota)單一且相對豐度較高,其在WG中也大量存在,證明WG可能是由破碎的YG生長形成.
進一步對WG與YG中子囊菌門(Ascomycota)的真菌群落在目水平上的構成進行分析,結果如圖7(b) 所示. 經對比后發現,WG中格孢腔目(Pleosporales)、散囊菌目(Eurotiales)和酵母目(Saccharomycetales)真菌的相對豐度(20.10%、11.32%和10.31%)遠高于YG(5.30%、0.93%和0.07%). 格孢腔目(Pleosporales)真菌外形多為桿狀或絲狀[14]. 散囊菌目(Eurotiales)下的青霉屬(Penicillium)真菌,以及酵母目(Saccharomycetales)下的假絲酵母屬(Candida)真菌都具有絲狀結構. 青霉屬(Penicillium)和假絲酵母屬(Candida)在WG中的相對豐度分別為10.53%和8.68%,在YG中的相對豐度分別為0.79%和0.04%. 這些絲狀或桿狀真菌在WG中的相對豐度很高,可能有利于WG的形成.
2.4 WG形成機理探究
Beun等[15]在研究污泥好氧顆粒化過程中提出了真菌假說,認為真菌菌絲在水力剪切作用下相互纏繞并起到框架作用,其有利于細菌附著生長形成好氧顆粒污泥. WG與YG在真菌群落組成上存在較大差異,子囊菌門(Ascomycota)在WG(50.10%)中的相對豐度遠高于YG(6.95%),其中格孢腔目(Pleosporales)以及青霉屬(Penicillium)和假絲酵母屬(Candida)都具有絲狀結構,并且在WG中的含量較高,說明絲狀真菌可能相互纏繞形成了框架,有助于形成WG. 而在YG中,相對豐度最高的為Rozellomycota(81.77%)門真菌;根據目前的研究,Rozellomycota門下發現的真菌多以寄生的方式存在于水霉或變形蟲細胞核內,并不具有絲狀結構[16- 17],說明YG中可能不具有絲狀真菌構成的框架. WG與YG的細菌群落組成存在相似性,變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)和放線菌門(Actinobacteria)均為兩樣品的優勢門,并且相對豐度相差較小,說明WG的形成與YG存在一定關系. 該研究中WG出現在好氧顆粒污泥系統的成熟階段,因此,可能由于系統中YG破碎形成小菌膠團后,這些小菌膠團附著在絲狀真菌纏繞形成的框架上,快速生長形成了WG.
Yilmaz等[18- 20]研究表明,在具有脫氮除磷功能的好氧顆粒污泥反應器中,厭氧好氧交替的運行條件,以及丙酸鹽作為碳源時,都有利于Candidatuscompetibacter的快速生長和富集. 并且有研究指出,Candidatuscompetibacter可能會分泌胞外多糖形成EPS,有助于微生物團聚形成緊實的好氧顆粒污泥[21]. HUANG等[22- 23]將好氧顆粒污泥切片,并采用SEM觀測發現,好氧顆粒污泥中大多數細菌都分布在邊緣部位,而核心部位主要由無機沉淀構成. Meyer等[24]采用熒光原位雜交等手段發現,在富集Candidatuscompetibacter的好氧顆粒污泥中,其主要集中分布于好氧顆粒污泥表層,而核心部位活性微生物較少. 該研究采用厭氧好氧交替運行方式培養好氧顆粒污泥,并且外加碳源中含有丙酸鈉,通過高通量測序發現,YG中富集有大量的Candidatuscompetibacter,其相對豐度為47.94%,可能造成YG團聚地更加緊實且內部活性微生物較少,這些原因可能導致YG透光性較差,呈現出棕黃色. 而WG由于形成時間較短,Candidatuscompetibacter在其中的相對豐度遠低于WG,并且其內部可能為絲狀真菌構成的骨架,因此形態更為疏松,可能使WG具有更好的透光性,因此呈現出白色;同時疏松的形態會使微生物與污水中底物和氧的接觸更加充分,也可能使WG中微生物多樣性更加豐富.
該研究中出現的WG在3~4周后逐漸消失,可能由于其結構松散,在曝氣或攪拌過程中破碎,或逐漸生長轉變成了YG. Barr等[25]在培養除磷好氧顆粒污泥的初期,反應器中也出現了WG與YG混合存在的現象,之后隨著系統中污泥混合、破碎、生長,WG最終消失.
3 結論
a) 從外形上看,WG形態不規則,結構疏松容易破碎,脫水后,顆粒表面存在大量褶皺并分布有大量桿菌. YG輪廓清晰,飽滿緊實,顆粒表面分布有大量球菌.
b) WG與YG在細菌群落結構上存在一定相似性,變形菌門(Proteobacteria)和擬桿菌門(Bacteroidetes)為WG和YG中的細菌優勢門,其在WG中的相對豐度分別為68.85%和26.61%,在YG中的相對豐度分別為82.52%和12.30%.Candidatuscompetibacter、Candidatusaccumulibacter和Chiayiivirga為WG中的優勢屬,相對豐度分別為22.13%、8.95%、7.37%;Candidatuscompetibacter、Chiayiivirga和Xanthomonas為YG中的優勢屬,相對豐度分別為47.94%、6.95%、7.06%.子囊菌門(Ascomycota)和Rozellomycota分別為WG與YG中真菌優勢門,其在兩個樣品中的相對豐度分別為50.10%和81.77%.
c) WG可能由破碎的YG生長形成,當其破碎形成小菌膠團后,這些小菌膠團附著在青霉屬(Penicillium)和假絲酵母屬(Candida)等絲狀真菌組成的框架上,快速生長形成了WG. 相較于YG,WG中Candidatuscompetibacter含量較低,并且存在大量絲狀真菌,使其外形疏松、透光性較好,呈現出白色.
[1] MORGENROTH E,SHERDEN T,VAN LOOSDRECHT M C M,etal.Aerobic granulation sludge in a sequencing batch reactor[J].Water Research,1997,12(31):3191- 3194.
[2] DE KREUK M K,HEIJNEN J J,VAN LOOSDRECHT M C M.Simultaneous COD,nitrogen,and phosphate removal by aerobic granular sludge[J].Biotechnology and Bioengineering,2005,90(6):761- 769.
[3] WEI Dong,SHI Li,YAN Tao,etal.Aerobic granules formation and simultaneous nitrogen and phosphorus removal treating high strength ammonia wastewater in sequencing batch reactor[J].Bioresource Technology,2014,171:211- 216.
[4] 劉小英,林慧,馬兆瑞,等.同步脫氮除磷顆粒污泥硝化反硝化特性試驗研究[J].環境科學,2014,35(1):214- 220. LIU Xiaoying,LIN Hui,MA Zhaorui,etal.Characteristics of nitrification and denitrification for simultaneous nitrogen and phosphorus removal by granular sludge[J].Environmental Science,2014,35(1):214- 220.
[5] 高景峰,陳冉妮,蘇凱,等.同步脫氮除磷好氧顆粒污泥形成與反應機制的研究[J].環境科學,2010,31(4):1021- 1029. GAO Jingfeng,CHEN Ranni,SU Kai,etal.Formation and reaction mechanism of simultaneous nitrogen and phosphorus removal by aerobic granular sludge[J].Environmental Science,2010,31(4):1021- 1029.
[6] WEISSBRODT D G,LOCHMATTER S,EBRAHIMI S,etal.Bacterial selection during the formation of early-stage aerobic granules in wastewater treatment systems operated under wash-out dynamics[J].Frontiers in Microbiology,2012.doi:10.3389/fmicb.2012.00332.
[7] WANG Feng,XIA Siqing,LIU Yi,etal.Community analysis of ammonia and nitrite oxidizers in start-up of aerobic granular sludge reactor[J].Journal of Environmental Sciences,2007,19(8):996- 1002.
[8] HE Qiulai,ZHOU Jun,WANG Hongyu,etal.Microbial population dynamics during sludge granulation in an A/O/A sequencing batch reactor[J].Bioresource Technology,2016,214:1- 8.
[9] LV Yi,WAN Chunli,LEE Duujong,etal.Microbial communities of aerobic granules:granulation mechanisms[J].Bioresource Technology,2014,169:344- 351.
[10] 國家環境保護總局.水和廢水監測分析方法[M].2版.北京:中國環境科學出版社,2002.
[11] CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,etal.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335- 336.
[12] 蔡春光,劉軍深,蔡偉民.胞外多聚物在好氧顆粒化中的作用機理[J].中國環境科學,2004,24(5):112- 115. CAI Chunguang,LIU Junshen,CAI Weimin.Action mechanism of extracelluar polymers on the aerobic granulation[J].China Environmental Science,2004,24(5):112- 115.
[13] SCHOCH C L,SUNG G H,TRIPPE K,etal.The ascomycota tree of life:a phylum-wide phylogeny clarifies the origin and evolution of fundamental reproductive and ecological traits[J].Systematic Biology,2009,58(2):224- 239.
[14] ZHANG Ying,CROUS P W,SCHOCH C L,etal.Pleosporales[J].Fungal Diversity,2012,53(1):1- 221.
[15] BEUN J J,HENDRIKS A,VAN LOOSDRECHT M C M,etal.Aerobic granulation in a sequencing batch reactor[J].Water Research,1999,33(10):2283- 2290.
[16] CORSARO D,WALOCHNIK J,VENDITTI D,etal.Microsporidia-like parasites of amoebae belong to the early fungal lineage Rozellomycota[J].Parasitology Research,2014,113(5):1909- 1918.
[17] CORSARO D,WALOCHNIK J,VENDITTI D,etal.Rediscovery of nucleophaga amoebae,a novel member of the Rozellomycota[J].Parasitology Research,2014,113(12):4491- 4498.
[18] YILMAZ G,LEMAIRE R,KELLER J,etal.Simultaneous nitrification,denitrification,and phosphorus removal from nutrient-rich industrial wastewater using granular sludge[J].Biotechnology and Bioengineering,2008,100(3):529- 541.
[19] LEMAIRE R,YUAN Zhiguo,BLACKALL L L,etal.Microbial distribution ofAccumulibacterspp.andCompetibacterspp.in aerobic granules from a lab-scale biological nutrient removal system[J].Environmental Microbiology,2008,10(2):354- 363.
[20] CAI Wei,HUANG Wenli,LI Huifang,etal.Acetate favors more phosphorus accumulation into aerobic granular sludge than propionate during the treatment of synthetic fermentation liquor[J].Bioresource Technology,2016,214:596- 603.
[21] SEVIOUR T W,LAMBERT L K,PIJUAN M,etal.Selectively inducing the synthesis of a key structural exopolysaccharide in aerobic granules by enriching for Candidatus “Competibacterphosphatis”[J].Applied Microbiology and Biotechnology,2011,92(6):1297- 1305.
[22] HUANG Wenli,CAI Wei,HUANG He,etal.Identification of inorganic and organic species of phosphorus and its bio-availability in nitrifying aerobic granular sludge[J].Water Research,2015,68:423- 431.
[23] LI Wenwei,ZHANG Hailing,SHENG Guoping,etal.Roles of extracellular polymeric substances in enhanced biological phosphorus removal process[J].Water Research,2015,86:85- 95.
[24] MEYER R L,SAUNDERS A M,ZENG R J,etal.Microscale structure and function of anaerobic-aerobic granules containing glycogen accumulating organisms[J].FEMS Microbiology Ecology,2003,45(3):253- 261.
[25] BARR J J,COOK A E,BOND P L.Granule formation mechanisms within an aerobic wastewater system for phosphorus removal[J].Applied and Environmental Microbiology,2010,76(22):7588- 7597.
White and Yellow Aerobic Granular Sludge Microbial Structures Appearing in a Simultaneous Nitrogen and Phosphorus Removal System Using High-Throughput Sequencing
FAN Xiaoyan1, GAO Jingfeng1*, WANG Shijie1, ZHANG Lifang1, ZHANG Shujun2, GAO Yongqing2, ZHANG Shuai2
1.National Engineering Laboratory for Advanced Municipal Wastewater Treatment and Reuse Technology, Beijing University of Technology College Environmental and Energy Engineering, Beijing 100124, China 2.Beijing Drainage Group Co. Ltd Technology R & D Center, Beijing 100124, China
In a simultaneous nitrogen and phosphorus removal system, both white and yellow aerobic granular sludge (WG and YG) appeared. Scanning electron microscopy (SEM) was used to observe the micro-morphology of WG and YG. Illumina HiSeq 2500 platform was applied to investigate their bacterial and fungal communities, and to explore the reasons for the formation of WG. WG was loose and irregular, while YG was compact and regular. The results of SEM indicated that bacillus and coccus were dominant on the surface of WG and YG, respectively. The bacterial community of WG and YG was similar, while their fungal community was significantly different. The α-diversity of WG was higher than that of YG. Proteobacteria and Bacteroidetes were the dominant phyla in WG and YG. Their relative abundances in WG were 68.85% and 26.61%, respectively. For YG, their relative abundances were 82.52% and 12.30%, respectively.Candidatuscompetibacter(22.13%),Candidatusaccumulibacter(8.95%) andChiayiivirga(7.37%) dominated in WG.Candidatuscompetibacter(47.94%),Chiayiivirga(6.95%) andXanthomonas(7.06%) were the dominant genera in YG. Ascomycota and Rozellomycota were the main fungal phyla in WG and YG, with relative abundances of 50.10% and 81.77%, respectively.PenicilliumandCandidawere the dominant filamentous fungi in WG. When YG disintegrated into small zoogloea, it attached to the framework of filamentous fungi and grew rapidly, which might be a reason for the formation of WG. The low relative abundance ofCandidatuscompetibactermight be a reason for the loose shape of WG.
white aerobic granular sludge; yellow aerobic granular sludge; high-throughput sequencing; bacterial community composition; fungal community composition
2017-01-20
2017-04-20
國家自然科學基金項目(51378027,51578015);北京市自然科學基金項目(8162010)
樊曉燕(1988-),女,河南三門峽人,fanxiaoyan0229@163.com.
*責任作者,高景峰(1974-),男,黑龍江海倫人,教授,博士,博導,主要從事水污染控制研究,gao.jingfeng@bjut.edu.cn
X172
1001- 6929(2017)08- 1287- 08
A
10.13198j.issn.1001- 6929.2017.02.41
樊曉燕,高景峰,王時杰,等.同步脫氮除磷系統中兩種顏色好氧顆粒污泥的微生物群落特征[J].環境科學研究,2017,30(8):1287- 1294.
FAN Xiaoyan,GAO Jingfeng,WANG Shijie,etal.White and yellow aerobic granular sludge microbial structures appearing in a simultaneous nitrogen and phosphorus removal system using high-throughput sequencing[J].Research of Environmental Sciences,2017,30(8):1287- 1294.

