兩種工藝條件下工業(yè)硫酸分解氯化鉀制備硫酸氫鉀的研究
唐 浩,汪朝強(qiáng),唐 輝
(1.昆明理工大學(xué)化學(xué)工程學(xué)院,云南昆明650000;2.云南云天化股份有限公司)
兩種工藝條件下工業(yè)硫酸分解氯化鉀制備硫酸氫鉀的研究
唐 浩1,2,汪朝強(qiáng)1,2,唐 輝1
(1.昆明理工大學(xué)化學(xué)工程學(xué)院,云南昆明650000;2.云南云天化股份有限公司)
硫酸分解氯化鉀制備硫酸氫鉀可在水相和無(wú)水相中反應(yīng)進(jìn)行。分別探討了工業(yè)硫酸在兩種工藝條件下,反應(yīng)溫度、原料物質(zhì)的量比、反應(yīng)時(shí)間以及硫酸濃度對(duì)產(chǎn)品硫酸氫鉀的影響。通過(guò)單因素實(shí)驗(yàn)和正交實(shí)驗(yàn),得到水相最優(yōu)工藝條件:反應(yīng)溫度為90℃、硫酸與氯化鉀物質(zhì)的量比為1.2∶1、反應(yīng)時(shí)間為60 min、硫酸濃度為80%(質(zhì)量分?jǐn)?shù),下同),在此條件下轉(zhuǎn)化率可達(dá)98.64%;無(wú)水相最優(yōu)工藝條件:反應(yīng)溫度為80℃、硫酸與氯化鉀物質(zhì)的量比為1.1∶1、反應(yīng)時(shí)間為60 min、硫酸濃度為70%,此時(shí)轉(zhuǎn)化率可達(dá)92%。
工業(yè)硫酸;氯化鉀;硫酸氫鉀
硫酸氫鉀既是一種優(yōu)質(zhì)的鉀肥,也是一種有效的農(nóng)藥殺蟲(chóng)劑。目前,其在有機(jī)行業(yè)中常用作優(yōu)質(zhì)催化劑[1],在無(wú)機(jī)肥料行業(yè)還作為許多復(fù)合肥料的中間品受到越來(lái)越多的關(guān)注。硫酸氫鉀的主要工業(yè)生產(chǎn)方法:1)采用硫酸鉀為原料,在水中加熱溶解后,加入適量的硫酸,經(jīng)冷卻、結(jié)晶、抽濾和干燥即得到產(chǎn)品;2)氯化鉀和硫酸反應(yīng)生成硫酸氫鉀,加熱蒸出氯化氫副產(chǎn)鹽酸得到產(chǎn)品。第一種方法以硫酸鉀為原料,但中國(guó)硫酸鉀生產(chǎn)能力不高,目前主要靠進(jìn)口[2],而且價(jià)格較貴。因此,本實(shí)驗(yàn)采用第二種制備硫酸氫鉀的方法,并對(duì)水相和無(wú)水相兩種工藝條件做了分析對(duì)比。
1 實(shí)驗(yàn)
1.1 實(shí)驗(yàn)原料
氯化鉀為分析純,工業(yè)濃硫酸(Fe質(zhì)量分?jǐn)?shù)為0.000 4%),實(shí)驗(yàn)用水均為去離子水。
1.2 實(shí)驗(yàn)裝置(圖1)
1.3 分析方法
K+、H+、Cl-、SO42-分別采用四苯硼酸鈉滴定法[3-5]、氫氧化鈉滴定法、硝酸銀滴定法和氯化鋇沉淀法測(cè)定。
1.4 單因素實(shí)驗(yàn)
氯化鉀和硫酸的反應(yīng)屬于非均相反應(yīng)。在反應(yīng)過(guò)程中,隨著HCl氣體被不斷吸收除去,KHSO4則不斷生成。本實(shí)驗(yàn)探討了水相和無(wú)水相條件下溫度、配料比、反應(yīng)時(shí)間、濃硫酸濃度等因素對(duì)反應(yīng)的影響。
1.4.1 反應(yīng)溫度
加入0.4 mol氯化鉀于三口燒瓶中加熱至實(shí)驗(yàn)溫度(水相加入100 mL水溶解KCl),在濃硫酸與氯化鉀物質(zhì)的量比為1.2∶1、反應(yīng)時(shí)間為60 min、濃硫酸濃度為75%(質(zhì)量分?jǐn)?shù),下同)的條件下,考察了反應(yīng)溫度對(duì)水相和無(wú)水相轉(zhuǎn)化率及各固相質(zhì)量分?jǐn)?shù)的影響,結(jié)果見(jiàn)圖2。由圖2a可見(jiàn),水相的轉(zhuǎn)化率先升高后降低,在溫度為85℃時(shí)達(dá)到最大值,此時(shí)對(duì)應(yīng)的固相組成中KHSO4的質(zhì)量分?jǐn)?shù)也最高,所以選擇85℃為適宜的水相反應(yīng)溫度。由圖2b可見(jiàn),無(wú)水相中轉(zhuǎn)化率持續(xù)上升,當(dāng)溫度超過(guò)85℃后增漲幅度不大,考慮到節(jié)能要求,選擇85℃作為無(wú)水相反應(yīng)溫度。通過(guò)比較可知,水相中的KCl轉(zhuǎn)化率明顯高于無(wú)水相,并且產(chǎn)品純度也是前者更好。
1.4.2 配料比
加入0.4 mol氯化鉀于三口燒瓶中加熱至實(shí)驗(yàn)溫度(水相加入100 mL水溶解KCl),在反應(yīng)溫度為85℃、反應(yīng)時(shí)間為60 min、濃硫酸濃度為75%的條件下,考察了物質(zhì)的量比(硫酸與氯化鉀物質(zhì)的量比,下同)對(duì)水相和無(wú)水相轉(zhuǎn)化率及各固相質(zhì)量分?jǐn)?shù)的影響,結(jié)果見(jiàn)圖3。由圖3可見(jiàn),二者的轉(zhuǎn)化率都是先升高后降低,在物質(zhì)的量比為1.2∶1時(shí),轉(zhuǎn)化率均達(dá)到最大值,此時(shí)固相組成KHSO4的質(zhì)量分?jǐn)?shù)也較高,因此選擇原料物質(zhì)的量比1.2∶1對(duì)反應(yīng)較為有利。通過(guò)比較可知,隨著物質(zhì)的量比越來(lái)越大,固相中的產(chǎn)品KHSO4的質(zhì)量分?jǐn)?shù)在物質(zhì)的量比超過(guò)1.2∶1后急劇下降,固相變成了硫酸含量較大的濕渣體系,不符合工業(yè)生產(chǎn)要求。總的來(lái)說(shuō),水相各項(xiàng)指標(biāo)優(yōu)于無(wú)水相。
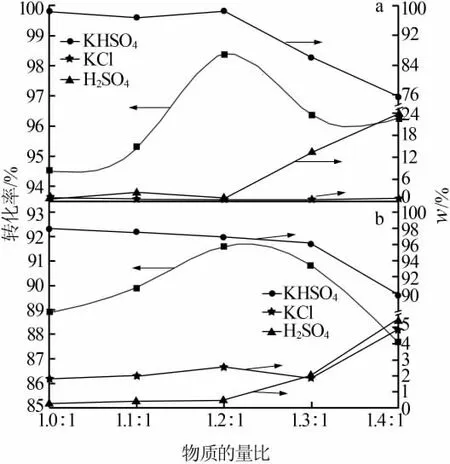
圖3 物質(zhì)的量比對(duì)水相(a)和無(wú)水相(b)轉(zhuǎn)化率及固相組成的影響
1.4.3 反應(yīng)時(shí)間
加入0.4 mol氯化鉀于三口燒瓶中加熱至實(shí)驗(yàn)溫度(水相加入100 mL水溶解KCl),在反應(yīng)溫度為85℃、物質(zhì)的量比為1.2∶1、濃硫酸濃度為75%的條件下,考察了反應(yīng)時(shí)間對(duì)水相和無(wú)水相轉(zhuǎn)化率及各固相質(zhì)量分?jǐn)?shù)的影響,結(jié)果見(jiàn)圖4。由圖4可知,二者的轉(zhuǎn)化率均呈現(xiàn)逐漸增大的趨勢(shì)。隨著反應(yīng)時(shí)間的延長(zhǎng),反應(yīng)60 min后對(duì)轉(zhuǎn)化率的提升和固相的組成影響不是太明顯,故反應(yīng)時(shí)間選擇60 min即可。單就時(shí)間因素來(lái)看,對(duì)二者的影響程度大致相似,并且水相轉(zhuǎn)化率和固相純度優(yōu)于無(wú)水相。
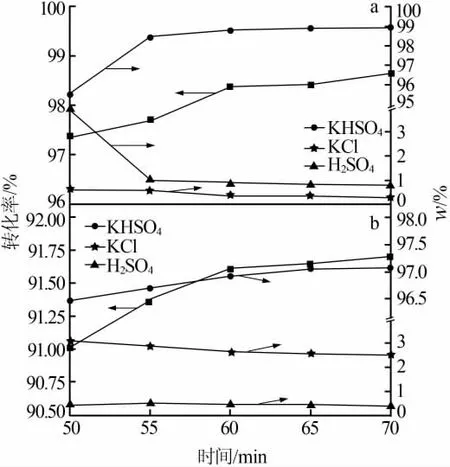
圖4 反應(yīng)時(shí)間對(duì)水相(a)和無(wú)水相(b)轉(zhuǎn)化率及固相組成的影響
1.4.4 硫酸濃度
加入0.4 mol氯化鉀于三口燒瓶中加熱至實(shí)驗(yàn)溫度(水相加入100 mL水溶解KCl),在反應(yīng)溫度為85℃、物質(zhì)的量比為1.2∶1、反應(yīng)時(shí)間為60 min的條件下,考察了硫酸濃度對(duì)轉(zhuǎn)化率及各固相質(zhì)量分?jǐn)?shù)的影響,結(jié)果見(jiàn)圖5。由圖5可見(jiàn),二者在硫酸濃度因素下,呈現(xiàn)出不同的變化趨勢(shì)。水相中轉(zhuǎn)化率隨著硫酸濃度的增加而持續(xù)上升,無(wú)水相中轉(zhuǎn)化率隨著硫酸濃度的增加而持續(xù)下降。二者反應(yīng)體系的不同是造成上述差別的主要原因:水相中由于水的參與,硫酸濃度的增加,硫酸在此體系中與氯化鉀的接觸機(jī)會(huì)增加,使得轉(zhuǎn)化率上升;無(wú)水相中,硫酸濃度的增加減少了稀釋水的量,會(huì)導(dǎo)致反應(yīng)物之間接觸機(jī)率下降,反應(yīng)物更為濃稠,不利于反應(yīng)的進(jìn)行。所以,水相選擇硫酸質(zhì)量分?jǐn)?shù)為85%較為適宜,而無(wú)水相中選擇65%較為適宜。
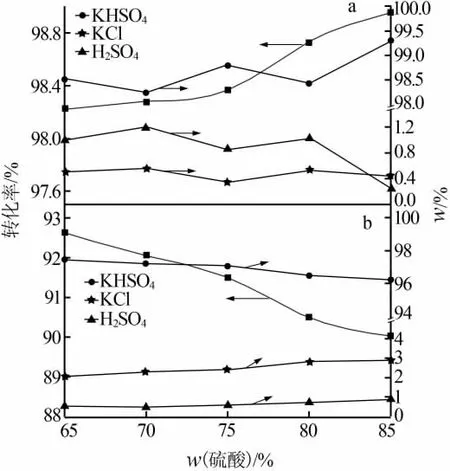
圖5 硫酸濃度對(duì)水相(a)和無(wú)水相(b)轉(zhuǎn)化率及固相組成的影響
1.5 正交實(shí)驗(yàn)
在上述單因素的基礎(chǔ)上,為更一步確定反應(yīng)因素之間的影響優(yōu)先級(jí)以及確定反應(yīng)最優(yōu)工藝條件,分別進(jìn)行水相和無(wú)水相正交實(shí)驗(yàn)。影響實(shí)驗(yàn)指標(biāo)的主要因素有反應(yīng)溫度、原料物質(zhì)的量比、反應(yīng)時(shí)間以及濃硫酸濃度。故選擇正交表L9(34)進(jìn)行實(shí)驗(yàn)設(shè)計(jì)和直觀分析。水相和無(wú)水相正交表分別見(jiàn)表1~4。
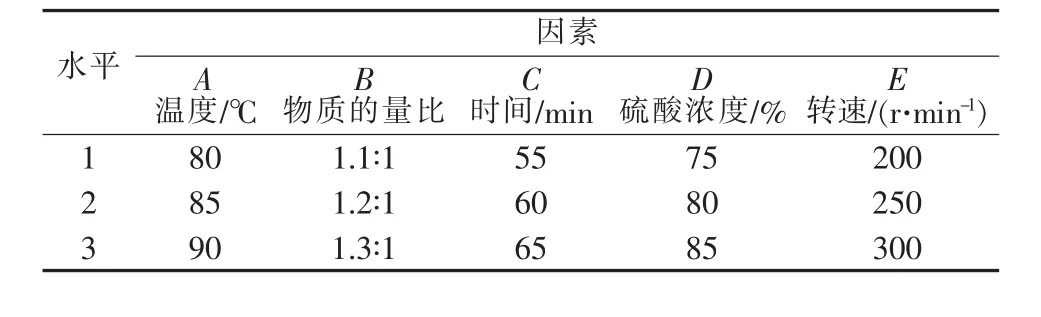
表1 水相正交試驗(yàn)因素、水平表

表2 水相正交實(shí)驗(yàn)結(jié)果及分析
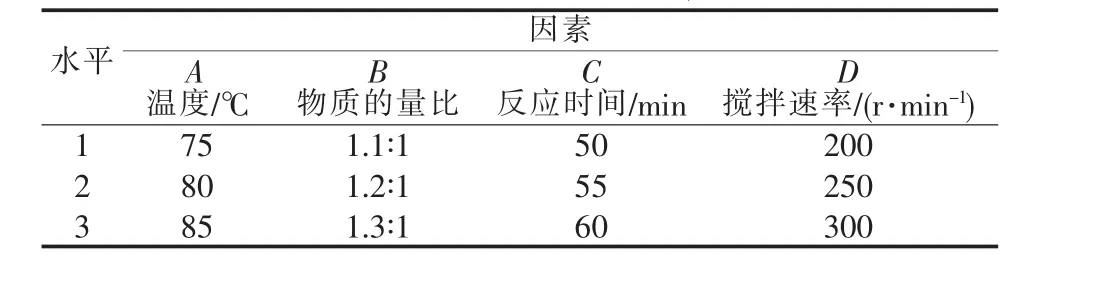
表3 無(wú)水相正交實(shí)驗(yàn)因素、水平表
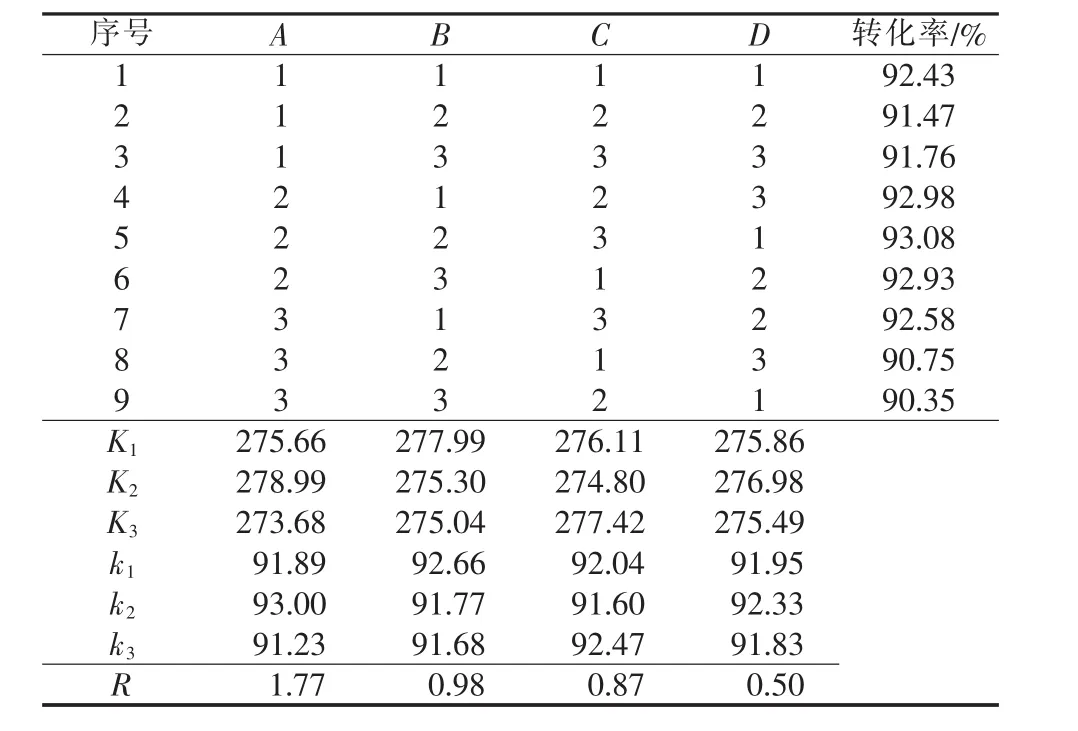
表4 無(wú)水相正交實(shí)驗(yàn)結(jié)果及分析
通過(guò)正交實(shí)驗(yàn),得到水相最優(yōu)工藝生產(chǎn)條件:反應(yīng)溫度為90℃、原料物質(zhì)的量比為1.2∶1、反應(yīng)時(shí)間為60 min、硫酸濃度為80%;無(wú)水相最優(yōu)工藝生產(chǎn)條件:反應(yīng)溫度為80℃、原料物質(zhì)的量比為1.1∶1、反應(yīng)時(shí)間為60 min,硫酸濃度為70%。二者的影響因素優(yōu)先次序均為反應(yīng)溫度>原料配比>反應(yīng)時(shí)間>硫酸濃度。
對(duì)最優(yōu)工藝條件分別做了5組重復(fù)性實(shí)驗(yàn),結(jié)果表明:水相在最優(yōu)條件下轉(zhuǎn)化率約為98.60%,此時(shí)固相中KHSO4質(zhì)量分?jǐn)?shù)約為98.38%,KCl質(zhì)量分?jǐn)?shù)約為0.54%,H2SO4質(zhì)量分?jǐn)?shù)約為1.07%;無(wú)水相在最優(yōu)條件下的轉(zhuǎn)化率約為91.93%,此時(shí)固相中KHSO4質(zhì)量分?jǐn)?shù)約為97.50%,KCl質(zhì)量分?jǐn)?shù)約為2.37%,H2SO4質(zhì)量分?jǐn)?shù)約為0.12%。
2 結(jié)論
通過(guò)單因素實(shí)驗(yàn)和正交實(shí)驗(yàn)得到水相和無(wú)水相的最優(yōu)工藝條件。從兩種實(shí)驗(yàn)條件下硫酸與氯化鉀反應(yīng)制備硫酸氫鉀的工藝研究可以看出,相較于無(wú)水相,水相生產(chǎn)中得到的產(chǎn)品質(zhì)量較高,轉(zhuǎn)化率更高,原料的利用率更好。無(wú)水相反應(yīng)時(shí)反應(yīng)物之間比較黏稠,生成的硫酸氫鉀易包裹在未反應(yīng)的氯化鉀上面,阻止了反應(yīng)物之間接觸,使得反應(yīng)轉(zhuǎn)化率較低,并且得到固相易成球狀小顆粒。因此,建議采用水相生產(chǎn)硫酸氫鉀,所得產(chǎn)品質(zhì)量?jī)?yōu)于以往文獻(xiàn)報(bào)道[6-9],符合無(wú)氯化肥的標(biāo)準(zhǔn),濾液可以回收到下一步冷卻結(jié)晶過(guò)濾步驟中重復(fù)利用,提高原料利用率。
[1] 蔡小華,陳學(xué)勇.催化劑硫酸氫鉀的合成進(jìn)展[J].應(yīng)用化工,2007,36(12):1229-1232.
[2] 陳代偉,郭亞飛,鄧天龍.硫酸鉀生產(chǎn)工藝研究現(xiàn)狀[J].無(wú)機(jī)鹽工業(yè),2010,42(4):4-7.
[3] 于發(fā)蓮.復(fù)混肥料中鉀含量測(cè)定——四苯硼酸鉀重量法[J].江西化工,2010(2):54-56.
[4] 唐海英.鉀肥中鉀含量的測(cè)定[J].中國(guó)石油和化工標(biāo)準(zhǔn)與質(zhì)量,2014(4):26.
[5] 司學(xué)兵,高云龍.四苯硼酸鈉重量法測(cè)鉀含量方法的改進(jìn)[J].化學(xué)工程師,2002,28(1):7-8.
[6] Tomaszewska M,覵apin A.The influence of feed temperature and composition on the conversion of KCl into KHSO4,in a membrane reactor combined with direct contact membrane distillation[J]. Separation&Purification Technology,2012,100(44):59-65.
[7] Tomaszewska M,Mientka A.Conversion of KCl into KHSO4in a membrane reactor:long-term experiments[J].Desalination,2009,245(1):647-656.
[8] 曹吉林,譚朝陽(yáng).氯化鉀硫酸轉(zhuǎn)化法制硫酸氫鉀的研究[J].化工科技,2000,8(6):26-28.
[9] 苗俊艷.脲硫酸分解氯化鉀工藝過(guò)程研究[D].鄭州:鄭州大學(xué),2014.
聯(lián)系方式:364891153@qq.com
Experimental study on preparation of potassium bisulfate by decomposition of potassium chloride with industrial sulfuric acid under two kinds of conditions
Tang Hao1,2,Wang Chaoqiang1,2,Tang Hui1
(1.School of Chemical Engineering,Kunming University of Science and Technology,Kunming 650000,China;2.Y unnan Y untianhua Co.,Ltd.)
Sulfuric acid decomposition of potassium chloride to prepare potassium bisulfate can be conducted in aqueous phase and anhydrous phase.The influences of temperature,amount of substance ratio,reaction time,and sulfuric acid concentration on the potassium bisulfate product under two kinds of conditions were investigated.Through single factor experiment and orthogonal experiment,the optimum conditions of aqueous phase were:reaction temperature of 90℃,amount of substance ratio of sulfuric acid to potassium of 1.2∶1,reaction time of 60 min,and concentration of sulfuric acid of 80%(mass fraction,same below)and theconversion was 98.64%under those conditions.And the optimum conditions of anhydrous phase were:reaction temperature of 80℃,amount of substance ratio of sulfuric acid to potassium of 1.1∶1,reaction time of 60 min,and concentration of sulfuric acid of 70%.Then the conversion was 92%.
industrial sulfuric acid;potassium chloride;potassium bisulfate
TQ131.13
A
1006-4990(2017)08-0041-03
2017-02-13
唐浩(1991— ),男,碩士研究生,主要研究方向?yàn)榱谆ぁ?/p>

