復分解法硫酸鉀生產(chǎn)工藝中硫酸鉀和硫酸銨的三元相圖研究
袁 宸,吳文華,石 冰
(上海化工研究院有限公司 上海 200062)
復分解法硫酸鉀生產(chǎn)工藝中硫酸鉀和硫酸銨的三元相圖研究
袁 宸,吳文華,石 冰
(上海化工研究院有限公司 上海 200062)
為了研究復分解法硫酸鉀生產(chǎn)工藝的反應原理,建立了相圖測試平臺,確定了體系平衡時間,標定了平臺測試精度。基于測試平臺,測試和繪制了30 ℃和60 ℃下硫酸鉀和硫酸銨的三元體系相圖,并對飽和液相線進行擬合計算。確定硫酸鉀與硫酸銨在相圖中不存在三相點和單鹽結晶區(qū),而是形成了組分連續(xù)的硫酸鉀銨固溶體結晶區(qū),從理論上揭示了復分解法硫酸鉀生產(chǎn)工藝不能在一步反應過程中生成完全純凈的硫酸鉀產(chǎn)品。
硫酸鉀;硫酸銨;三元相圖;復分解法;固溶體
硫酸鉀是一種非常優(yōu)質的鉀肥品種,除了含有作物所需的鉀元素外,其所含的硫元素也是對作物非常有益的中量營養(yǎng)元素。另外,硫酸鉀不含氯,對忌氯作物,如煙草、西瓜、茶葉、柑桔、葡萄等非常適用[1]。
硫酸鉀的生產(chǎn)工藝很多,在20世紀80年代,國外已經(jīng)發(fā)展出了諸多成熟工藝[2]。雖然我國硫酸鉀生產(chǎn)技術的開發(fā)起步較晚,但經(jīng)過追趕和發(fā)展,目前已形成五大類工藝體系[3- 4],即硫酸法制取硫酸鉀技術(曼海姆法[5]、締置法)、復分解法制取硫酸鉀技術(硫酸銨法、硫酸鈣法、芒硝法、硫酸亞鐵法)、海水或鹵水制取硫酸鉀技術、固體鉀礦提取法制取硫酸鉀技術、離子交換法制取硫酸鉀技術。
在諸多的硫酸鉀生產(chǎn)工藝中,上海化工研究院早在1985年就開發(fā)并掌握了以硫酸銨和氯化鉀為原料,采用復分解法生產(chǎn)硫酸鉀產(chǎn)品的工藝生產(chǎn)技術,并在蘇州吳縣投產(chǎn)了1套3 000 t/a的中試生產(chǎn)裝置。為使所開發(fā)的工藝更為成熟,在工藝的連續(xù)化、操作的簡易程度和硫酸鉀的轉化率等方面有所突破,并為年產(chǎn)萬噸級硫酸鉀生產(chǎn)裝置的開發(fā)和設計奠定基礎,上海化工研究院于1994年對氯化鉀與硫酸銨復分解法制硫酸鉀又進行了進一步的實驗室試驗,系統(tǒng)探索了各種因素對轉化反應的影響,確定了適宜的工藝條件[6],并技術轉讓建設了多套5 000~10 000 t/a生產(chǎn)裝置。1998年5月,上海化工研究院又將此項生產(chǎn)技術轉讓給山東省淄博市新華制藥廠,建成1套以硫酸銨溶液為原料的15 kt/a硫酸鉀生產(chǎn)裝置[7]。自2014年以來,硫酸鉀生產(chǎn)技術不斷受到肥料生產(chǎn)企業(yè)追捧,上海化工研究院又陸續(xù)轉讓了多套硫酸鉀生產(chǎn)工藝,積累了一定的工程經(jīng)驗。由于該硫酸鉀生產(chǎn)技術開發(fā)較早,盡管相比其他生產(chǎn)工藝具有獨特的優(yōu)勢,但也存在一定的缺陷,其中所生產(chǎn)的硫酸鉀產(chǎn)品只能達到農(nóng)用合格品的水平,給企業(yè)外銷構成了一定的困難。基于以上考慮,對硫酸鉀產(chǎn)品質量和復分解生產(chǎn)工藝進行深入的理論研究和探索非常必要。
1 試驗內(nèi)容
1.1 試劑和儀器
試驗用水為去離子水;試驗所用試劑為硫酸鉀和硫酸銨,均為分析純(AR)。主要試驗儀器:低溫恒溫反應浴,DFY- 20/30°,控溫范圍-30~100 ℃,控溫精度±0.1 ℃,帶磁力攪拌;標準水銀溫度計(二等),0~50 ℃和50~100 ℃各1根。
1.2 試驗方法
采用單變線法兩邊夾擊的方法測定飽和液相線和可能的共飽和點,結合濕渣法測定和計算對應的液相和固相組分,即:取一定量的硫酸鉀、硫酸銨和去離子水配置待測體系溶液于燒瓶中,用溫度計套管和玻璃塞完全密封燒瓶,然后置于恒溫反應浴中開啟磁力攪拌持續(xù)攪拌2 h后,對液相和濕渣取樣分析。
1.3 分析方法
通過化學分析方法間接測定液相和固相中的氧化鉀含量和氮含量,即分別采用四苯硼酸鉀重量法和蒸餾后滴定法測定鉀含量和氮含量,然后經(jīng)過計算得到硫酸鉀、硫酸銨和水分含量,確定液相和固相組分。
2 試驗結果和討論
2.1 平衡時間的確定
在平衡時間分別為2,4和6 h下測定硫酸鉀溶解度(在100 g水中的溶解量,下同),結果如圖1所示。
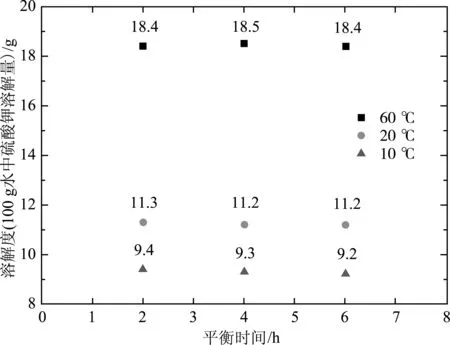
圖1 硫酸鉀溶解度與平衡時間的關系
從圖1可看出,平衡時間超過2 h后,硫酸鉀溶解度隨平衡時間的變化不大,已經(jīng)達到了溶解平衡。考慮到硫酸銨的溶解度比硫酸鉀更大、溶解速度更快,所以對于硫酸鉀銨三元體系,在10~60 ℃范圍內(nèi)封閉攪拌2 h能夠達到熱力學平衡。
2.2 相圖平臺測試精度
硫酸鉀和硫酸銨的溶解度測試結果與文獻資料數(shù)據(jù)的對比如表1所示。
從表1硫酸鉀數(shù)據(jù)可看出:硫酸鉀溶解度測試結果與文獻資料1的數(shù)據(jù)相比,除10 ℃時的誤差在-8.1%(本身存在矛盾)之外,其余數(shù)據(jù)的最大誤差為3.0%;測試結果與文獻資料2的數(shù)據(jù)相比,除50 ℃無參考數(shù)據(jù)外,最大誤差為1.9%。從表1硫酸銨數(shù)據(jù)可看出:硫酸銨溶解度測試結果與文獻資料1相比,最大誤差為1.1%;與文獻資料2相比,除50 ℃無參考數(shù)據(jù)外,最大誤差為1.2%。經(jīng)綜合判斷,本試驗設計的相圖測試平臺可用于測定硫酸鉀銨三元體系的溶解度并繪制相圖,整體誤差在±3.0%以內(nèi)。
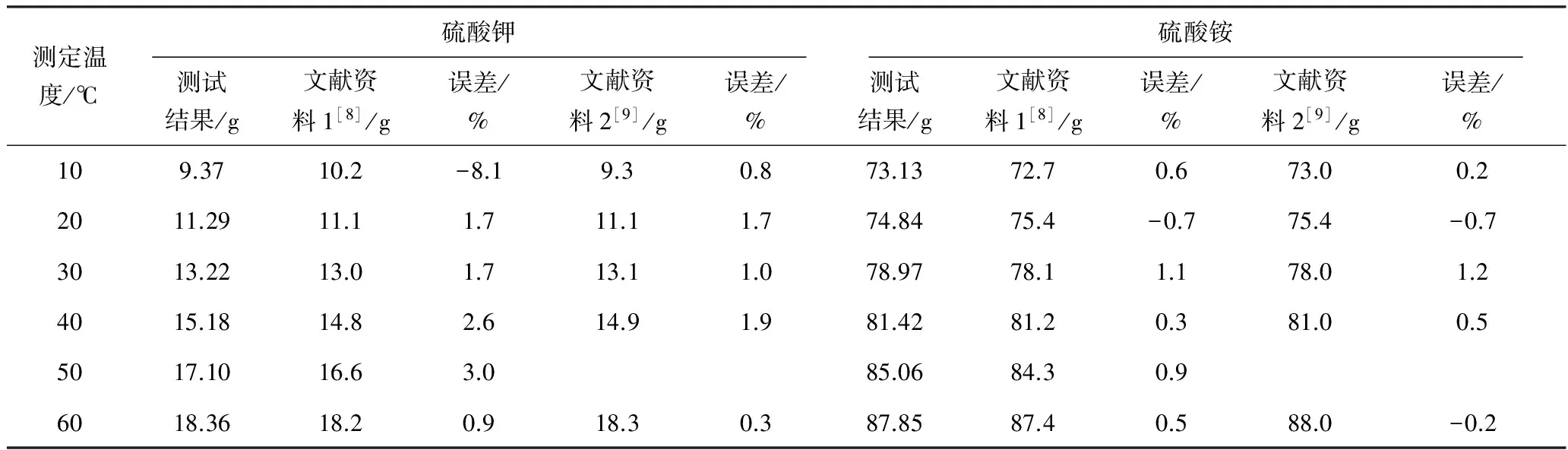
表1 硫酸鉀溶解度測試結果與文獻資料數(shù)據(jù)的對比
2.3 30 ℃下硫酸鉀銨液相線測定和擬合計算
30 ℃下硫酸鉀銨三元體系飽和溶液液相組成和擬合計算結果見表2(AS表示硫酸銨,SOP表示硫酸鉀,下同)。
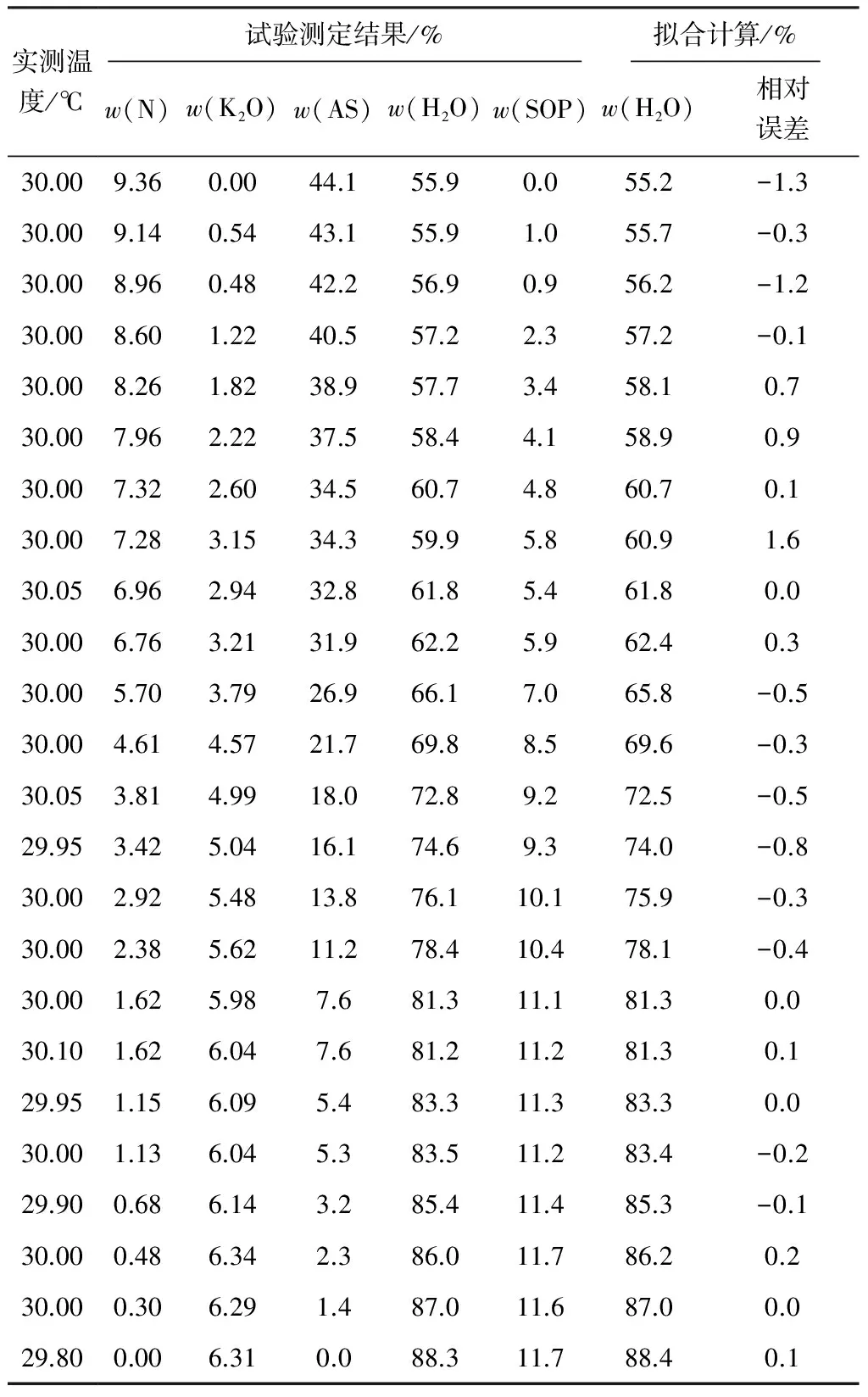
表2 30 ℃下硫酸鉀銨三元體系飽和溶液液相組成和擬合計算結果
對測定的飽和液相線數(shù)據(jù)進行擬合計算,得到的擬合公式:w(H2O)=0.508·w(AS)2-0.977·w(AS)+0.884,相關系數(shù)R2=0.999,相對最大誤差為1.6%。
2.4 30 ℃硫酸鉀銨三元相圖
在30 ℃下測定的硫酸鉀銨三元體系的液相和固相數(shù)據(jù)見表3,繪制的硫酸鉀銨三元相圖(30 ℃)見圖2。
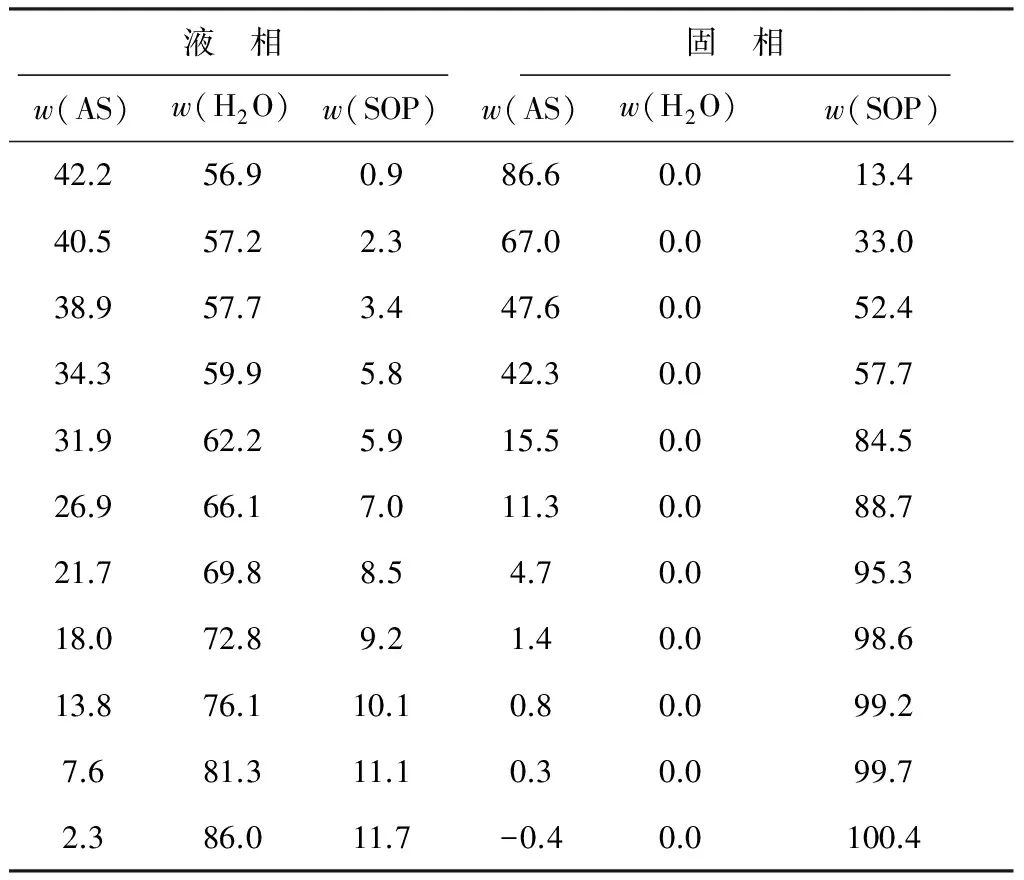
表3 30 ℃下測定的硫酸鉀銨三元體系的液相和固相數(shù)據(jù) %
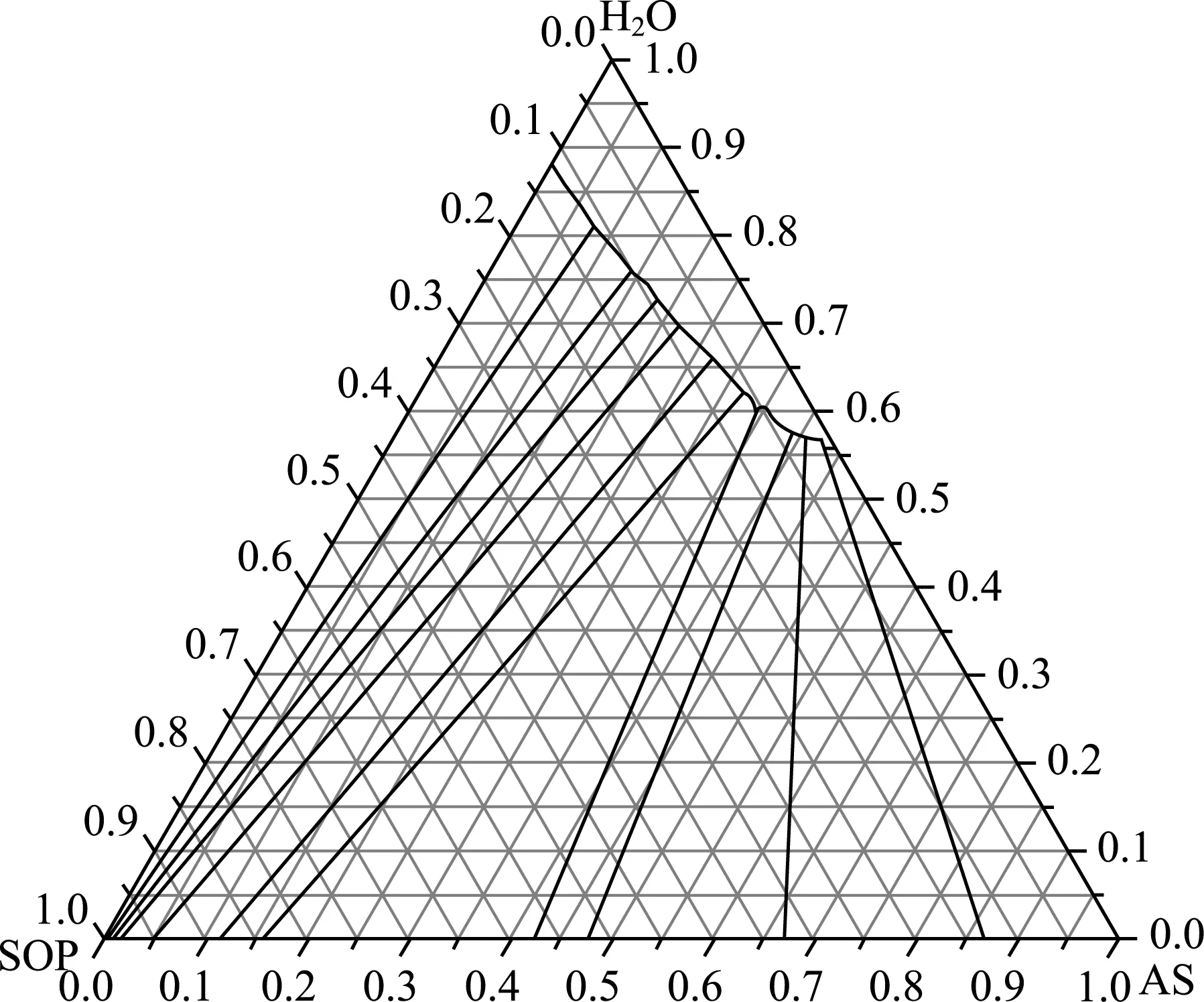
圖2 硫酸鉀銨三元相圖(30 ℃)
通過相圖繪制發(fā)現(xiàn)不存在飽和液相線交點或拐點,也不存在純組分固相區(qū)。這說明在30 ℃的條件下,不存在傳統(tǒng)三元體系中的三相點,且硫酸鉀與硫酸銨形成了一種組分連續(xù)變化的固溶體。
2.5 60 ℃下硫酸鉀銨液相線測定和擬合計算
60 ℃下硫酸鉀銨三元體系飽和溶液液相組成和擬合計算結果見表4。
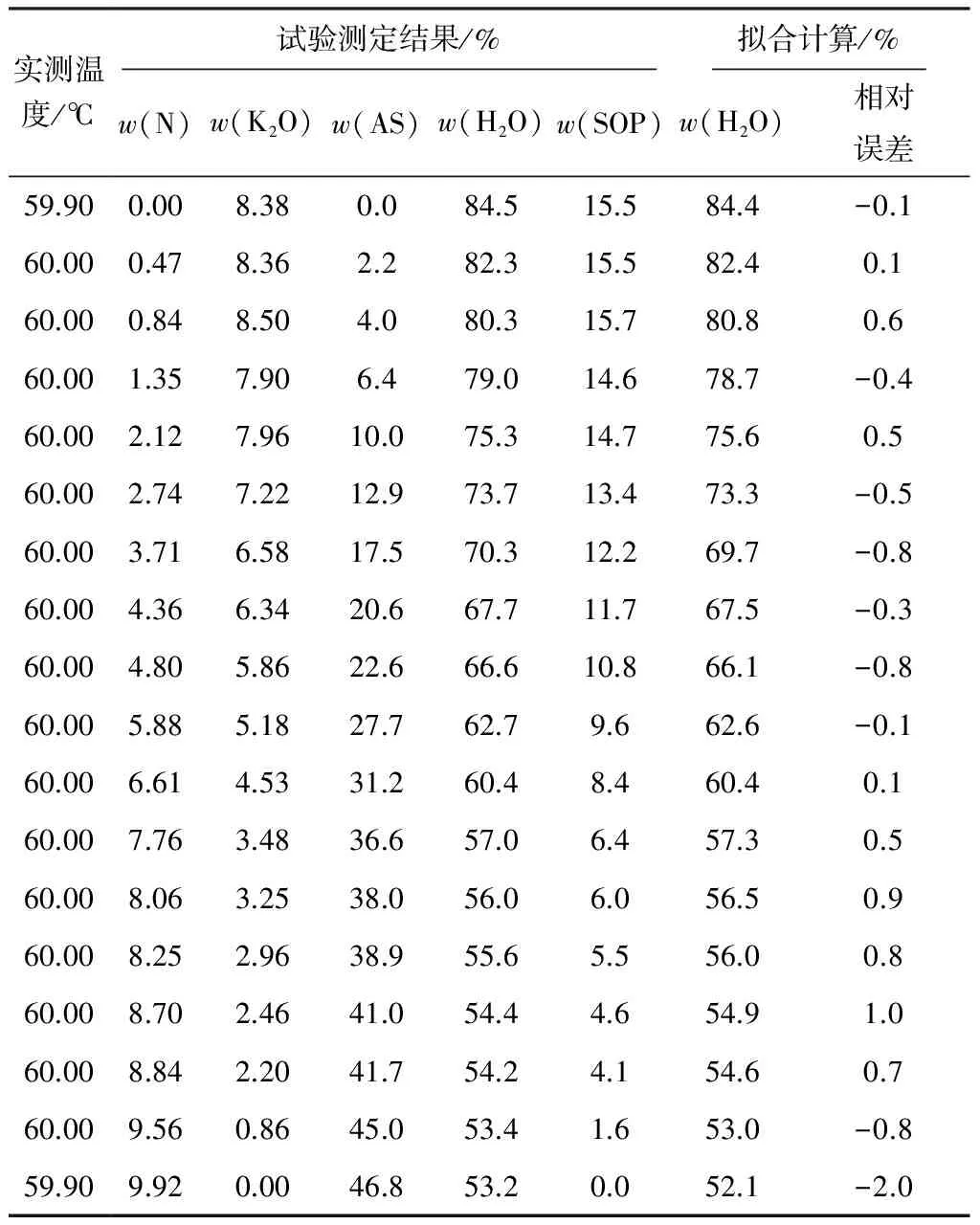
表4 60 ℃下硫酸鉀銨三元體系飽和溶液液相組成和擬合計算結果
對測定的飽和液相線數(shù)據(jù)進行擬合計算,得到的擬合公式:w(H2O)=0.506·w(AS)2-0.926·w(AS)+0.844,相關系數(shù)R2=0.998,相對最大誤差為-2.0%。
3.6 60 ℃硫酸鉀銨三元相圖
在60 ℃下測定的硫酸鉀銨三元體系的液相和固相數(shù)據(jù)見表5,繪制的硫酸鉀銨三元相圖(60 ℃)見圖3。
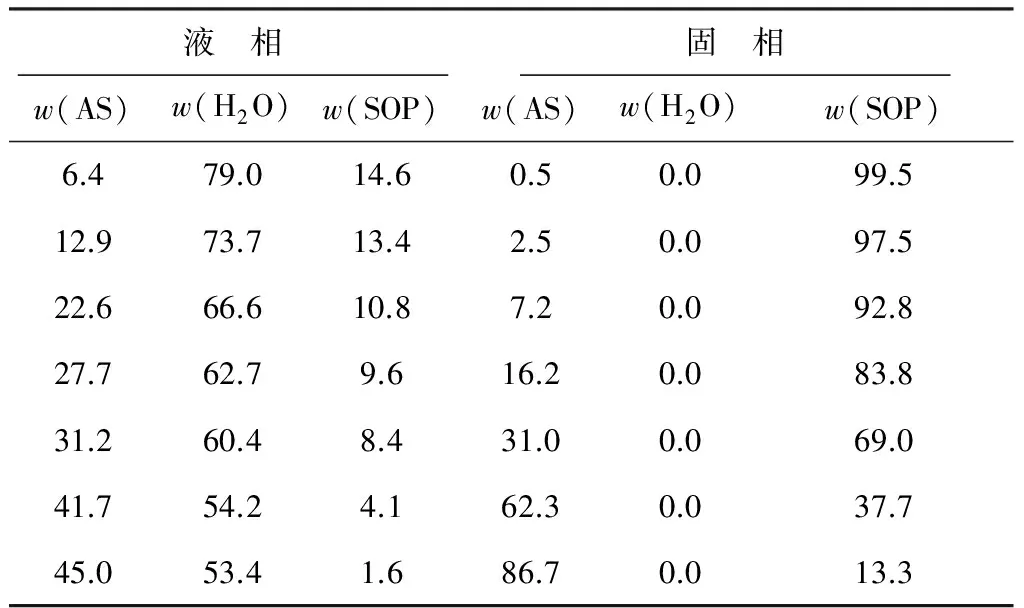
表5 60 ℃下測定的硫酸鉀銨三元體系的液相和固相數(shù)據(jù)%
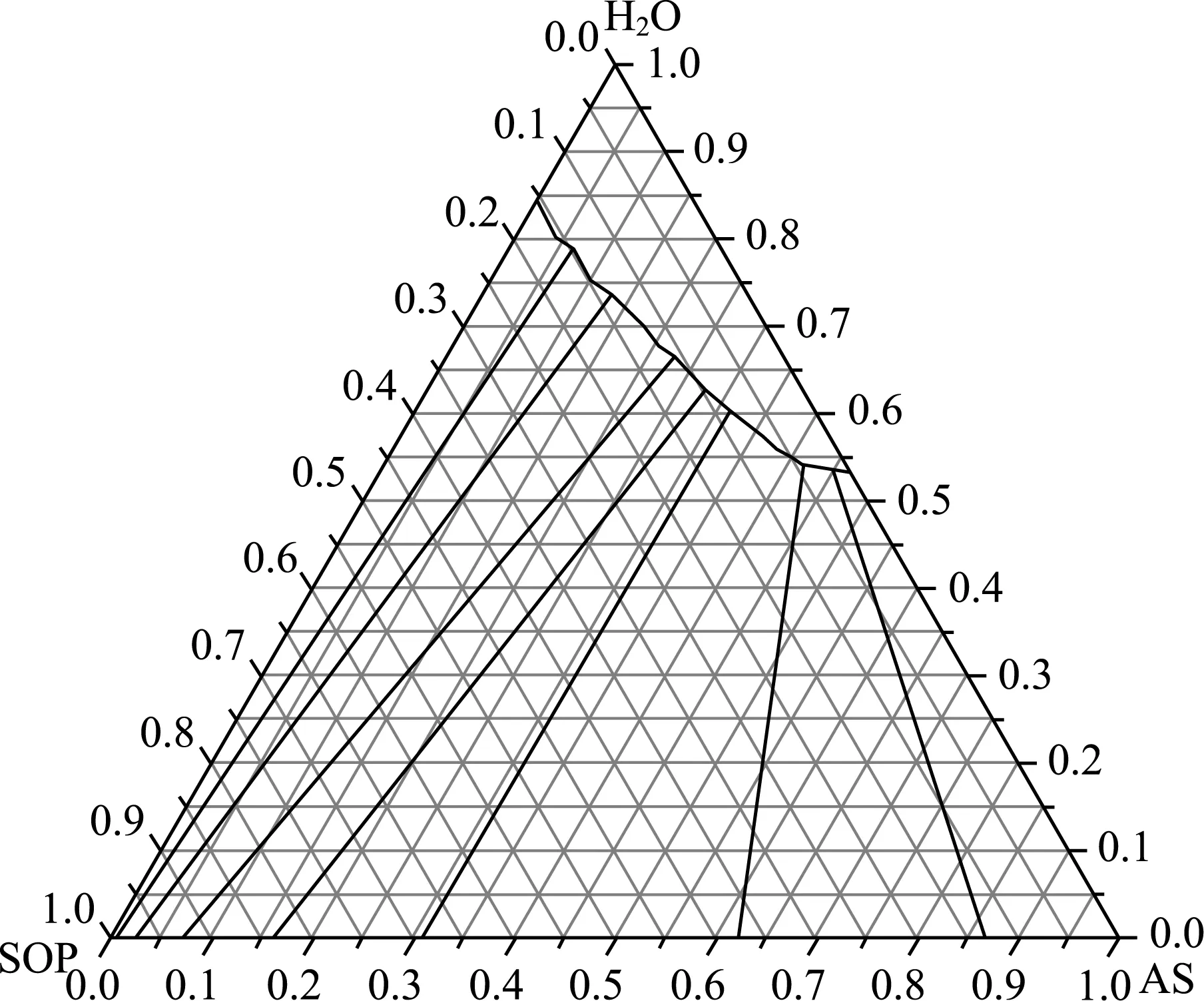
圖3 硫酸鉀銨三元相圖(60 ℃)
由圖3可知,與30 ℃情況一樣,在60 ℃條件下也不存在傳統(tǒng)三元體系中的三相點,硫酸鉀和硫酸銨也形成了一種組分連續(xù)變化的固溶體。
4 結語
(1)對于硫酸鉀銨三元體系,試驗確定在10~60 ℃范圍內(nèi)封閉攪拌2 h能夠達到溶解平衡。
(2)試驗中設計的相圖測試平臺可用于測定硫酸鉀銨三元體系的溶解度并繪制相圖,整體誤差在±3.0%以內(nèi)。
(3)繪制30 ℃和60 ℃硫酸鉀銨三元相圖,精確測定30 ℃和60 ℃飽和液相線數(shù)據(jù),得到可用于相圖計算的擬合經(jīng)驗公式。
(4)確定了在硫酸鉀銨三元體系中不存在三相點和單鹽結晶區(qū),飽和液相線下是一個組分連續(xù)變化的硫酸鉀銨固溶體結晶區(qū),證實了復分解生產(chǎn)工藝無法在一步反應過程中生成完全純凈的硫酸鉀產(chǎn)品。
[1] 何紅麗.我國硫酸工業(yè)的現(xiàn)狀及未來發(fā)展展望[J].鹽湖研究,2002(3):61- 71.
[2] 蔡文江.國內(nèi)硫酸鉀生產(chǎn)現(xiàn)狀及展望[J].化工時刊,1995(5):19- 21.
[3] 陳代偉,郭亞飛,鄧天龍.硫酸鉀生產(chǎn)工藝研究現(xiàn)狀[J].無機鹽工業(yè),2014(4):4- 7.
[4] 楊榮華,張恭孝.硫酸鉀的生產(chǎn)方法研究進展及方向[J].無機鹽工業(yè),2008(9):8- 10.
[5] 王惠媛,許松林.硫酸鉀生產(chǎn)技術現(xiàn)狀[J].化肥工業(yè),2005(1):29- 31.
[6] 祝延令,趙繼善,梁濟,等.氯化鉀-硫酸銨復分解法制備硫酸鉀新工藝試驗研究[J].化肥工業(yè),2000(4):22- 28.
[7] 祝延令,趙繼善,梁濟.青崗鉀肥廠試車小結[J].化肥工業(yè),1997(5):36- 38.
[8] 劉光啟,馬連湘,劉杰.化學化工物性數(shù)據(jù)手冊:無機卷[M].北京:化學工業(yè)出版社,2002:423.
[9] MULLIN J W. Crystallization[M]. 4th ed. Oxford:Butterworth Heinemann,2001:501.
StudyofTernaryPhaseDiagramofPotassiumSulfateandAmmoniumSulfateintheProcessofPotassiumSulfateProductionbyDoubleDecompositionProcess
YUAN Chen, WU Wenhua, SHI Bing
(Shanghai Research Institute of Chemical Industry Co., Ltd., Shanghai 200062, China)
In order to study the reaction mechanism of production of K2SO4by double decomposition process, a phase diagram test system is established and its equilibrium time and measuring accuracy are determined. By this system, ternary phase diagram of K2SO4and (NH4)2SO4at temperatures of 30 ℃ and 60 ℃ are measured and completed, and saturated liquid phase lines and their fitting calculation are figured out. It is found that K2SO4and (NH4)2SO4do not have triple-point and crystalline region of pure salt in their ternary phase diagram, there is only a component- continuous solid solution crystalline region formed. It has revealed theoretically that pure K2SO4cannot be produced in one- step reaction by double decomposition process.
potassium sulfate; ammonium sulfate; ternary phase diagram, double decomposition method; solid solution
袁宸,男,工程碩士,工程師,主要從事化肥工藝和工程研發(fā);meteorcheny@hotmail.com
TQ443.2
:A
:1006- 7779(2017)03- 0072- 05
2016- 10- 17)

