土荊芥揮發(fā)油化感脅迫對(duì)土壤胞外酶活性和微生物多樣性的影響
王亞男,李睿玉,朱曉換,馬丹煒,張 紅
四川師范大學(xué)生命科學(xué)學(xué)院, 成都 610101
土荊芥揮發(fā)油化感脅迫對(duì)土壤胞外酶活性和微生物多樣性的影響
王亞男*,李睿玉,朱曉換,馬丹煒,張 紅
四川師范大學(xué)生命科學(xué)學(xué)院, 成都 610101
入侵植物釋放的化感物質(zhì)可改變土壤理化性狀和微生物群落結(jié)構(gòu),通過與土壤微生物的互作抑制本土植物生長。為了進(jìn)一步詮釋土荊芥化感作用機(jī)制,采用溫室培養(yǎng)瓶法,探討了其揮發(fā)油對(duì)土壤胞外酶活性和微生物多樣性的影響。結(jié)果表明:土荊芥揮發(fā)油不同程度降低了脲酶、酸性磷酸酶、蔗糖酶和硝酸還原酶的活性(P<0.05);較高劑量的揮發(fā)油處理組顯著促進(jìn)了過氧化氫酶活性(P<0.05)。處理初期揮發(fā)油對(duì)土壤胞外酶活性影響較大,但隨著處理時(shí)間延長,其影響逐漸減弱;處理16 d后,較高劑量(20 μL和50 μL)的揮發(fā)油處理組細(xì)菌數(shù)量顯著高于對(duì)照(P<0.05)。揮發(fā)油對(duì)土壤放線菌數(shù)量的影響表現(xiàn)為低劑量促進(jìn),高劑量抑制的效應(yīng);PCR-DGGE分析表明,隨著揮發(fā)油處理劑量增加和處理時(shí)間延長,土壤中細(xì)菌和真菌的Shannon-wiener多樣性指數(shù)和豐富度指數(shù)均增大。結(jié)論:土荊芥揮發(fā)油可改變土壤微生物群落結(jié)構(gòu)和胞外酶活性,增加土壤微生物多樣性。
土荊芥;揮發(fā)油;化感脅迫;土壤胞外酶;土壤微生物多樣性
Callaway 和Ridenour 提出的“新武器”假說(novel weapons hypothesis,NWH)認(rèn)為,外來物種會(huì)通過揮發(fā)、根系分泌、殘株分解、淋溶等途徑向周圍環(huán)境釋放化感物質(zhì)抑制本地植物生長,從而在群落中取得優(yōu)勢(shì)地位[1- 2]。這些化感物質(zhì)主要包括酚類、黃酮類、萜類和生物堿類等[3]。化感物質(zhì)對(duì)本土植物的細(xì)胞分裂、植物激素產(chǎn)生、細(xì)胞膜的通透性、礦物質(zhì)的攝取、光合作用、呼吸作用、蛋白質(zhì)合成、固氮作用和特定酶活性等均具有較大的影響[4- 6]。化感物質(zhì)絕大多數(shù)最終會(huì)進(jìn)入土壤中[7-8],改變土壤微生物種類組成[9]和土壤生物群落結(jié)構(gòu),影響土壤微生物的活動(dòng)和土壤酶活性[10- 12],改變土壤理化性狀[13],影響土壤營養(yǎng)元素循環(huán),從而為自身的入侵創(chuàng)造有利條件[14-15]。在入侵植物釋放的化感物質(zhì)中,揮發(fā)性萜類占有較大的比例,這些揮發(fā)性萜類物質(zhì)可以土壤為載體,改變土壤微生物群落的結(jié)構(gòu),進(jìn)而抑制本地植物的生長[16],如三裂葉豚草(Ambrosiatrifida)以單萜類物質(zhì)為主的植物揮發(fā)物經(jīng)土壤作用于其他植物和土壤微生物,改變了后者的生長發(fā)育[7]。
土荊芥(Chenopodiumambrosioides)為藜科藜屬一年生或多年生草本植物,原產(chǎn)美洲,現(xiàn)廣布于世界熱帶及溫帶地區(qū),目前已成為我國危害極嚴(yán)重的外來入侵物種[17-18]。土荊芥全株富含揮發(fā)油,其根系分泌和凋落物腐解均能將揮發(fā)油釋放到土壤中,影響土壤環(huán)境。本研究室及其他研究者已經(jīng)證明,化感作用是土荊芥成功入侵的機(jī)制之一。土荊芥釋放的揮發(fā)油影響受體植物根細(xì)胞的有絲分裂過程,誘導(dǎo)根細(xì)胞發(fā)生氧化損傷,甚至凋亡,從而抑制受體植物的生長發(fā)育[18- 21]。前期的研究大部分主要關(guān)注土荊芥對(duì)植物的影響,很少有人關(guān)注土荊芥對(duì)土壤的影響及其二者之間的互作。近期本研究室通過盆栽試驗(yàn)發(fā)現(xiàn)[22],土荊芥在其營養(yǎng)期階段通過降低土壤營養(yǎng)水平,使土壤質(zhì)量趨于貧瘠化而不利于周圍植物生長,果期可增加土壤胞外酶活性和土壤微生物數(shù)量,從而為其繁殖創(chuàng)造條件。這種土壤特性的變化是否與土荊芥的化感作用相關(guān)卻不得而知,因此,本研究以土荊芥揮發(fā)油為材料,采用溫室培養(yǎng)瓶試驗(yàn)法,探討土荊芥化感作用對(duì)土壤胞外酶活性和微生物多樣性的影響,為進(jìn)一步揭示土荊芥化感作用機(jī)制提供理論依據(jù)。
1 材料與方法
1.1 供試材料
本研究所用土荊芥植株采自2014年10月,為成熟期。采用水蒸汽蒸餾法提取土荊芥全株(包括地上部分和地下部分)揮發(fā)油,產(chǎn)率約0.8%,無水Na2SO4干燥后4 ℃保存?zhèn)溆肹20]。GC-MS分析表明其主要成分為對(duì)聚傘花素(1- isopropyl- 4-m ethylbenzene)和α-萜品烯(α-terpinene),含量分別為16.9%和13.5%[23]。
供試土壤為土荊芥入侵地廣泛分布的紫色土,采自四川師范大學(xué)成龍校區(qū)(30°56′N,104°20′E)第三實(shí)驗(yàn)大樓附近(未生長過土荊芥)。土壤中有機(jī)質(zhì)含量為4.90 g/kg,總氮含量0.61 g/kg,總磷含量0.34 g/kg,總鉀含量13.46 g/kg。將土壤搗碎,過1.0 mm 篩子,儲(chǔ)存?zhèn)溆谩?/p>
1.2 化感作用處理
稱取50 g土壤置于玻璃培養(yǎng)瓶(底部直徑6 cm,高9 cm)中,加入10 mL蒸餾水,蓋上蓋子,置于25 ℃培養(yǎng)室預(yù)培養(yǎng)24 h。預(yù)培養(yǎng)結(jié)束后,分別將0,2.5,5,10,20 μL和50 μL(預(yù)實(shí)驗(yàn)中按有效劑量來確定)揮發(fā)油滴加到培養(yǎng)瓶的土壤中,混勻,并立即旋緊蓋子。分別置于25℃培養(yǎng)室處理1 、2、4 、8、16 d和32 d后收集土壤,將每處理土樣分成2份,1份4 ℃保存用于基因組DNA的提取,另1份用于測(cè)定可培養(yǎng)微生物的數(shù)量和土壤酶活性,其中,可培養(yǎng)微生物和過氧化氫酶在取樣當(dāng)天取鮮土測(cè)定,剩余部分土樣風(fēng)干后保存,用于脲酶、蔗糖酶、酸性磷酸酶和硝酸還原酶活性的測(cè)定。每處理時(shí)間、每處理劑量各設(shè)置3個(gè)重復(fù)。
本研究分別用F、A、B、C、D和E代表揮發(fā)油處理劑量0,2.5,5,10,20 μL和50 μL,用1F 、1A、1B、1C、1D、1E分別代表處理時(shí)間為1 d的不同劑量揮發(fā)油處理組,以此類推。
1.3 土壤酶活性測(cè)定方法
土壤酶活的測(cè)定參考文獻(xiàn)[22]。脲酶活性用苯酚鈉比色法測(cè)定;蔗糖酶活性采用3,5-二硝基水楊酸比色法測(cè)定;酸性磷酸酶活性采用對(duì)硝基苯磷酸二鈉比色法。硝酸還原酶活性測(cè)定采用2,4-二硝基酚比色法;過氧化氫酶活性測(cè)定采用過氧化氫-硫酸鈦比色法。
1.4 土壤微生物數(shù)量的測(cè)定
稀釋平板計(jì)數(shù)法測(cè)定根際土壤中細(xì)菌、放線菌和真菌的數(shù)量。細(xì)菌采用牛肉膏蛋白胨瓊脂培養(yǎng)基37 ℃培養(yǎng)2 d,放線菌采用高氏1 號(hào)瓊脂培養(yǎng)基28 ℃下培養(yǎng)7 d,真菌采用馬丁氏培養(yǎng)基28 ℃培養(yǎng)3 d。統(tǒng)計(jì)菌落數(shù)量并計(jì)算每克干土中的微生物數(shù)量(CFU/g 干土)。
1.5 土壤微生物多樣性分析(DGGE)
土壤微生物總DNA的提取:挑選土荊芥揮發(fā)油對(duì)土壤酶活性和微生物影響較大且具有代表性的處理組進(jìn)行PCR-DGGE試驗(yàn)分析。處理時(shí)間選取處理1、8 d和32 d。揮發(fā)油劑量選取0、5、20 μL和50 μL,分別用F、B、D和E表示。土壤樣品基因組 DNA 的提取用試劑盒(莊盟超純土壤基因組DNA快速提取試劑盒),提取后的 DNA 在 0.8% 的瓊脂糖凝膠上電泳檢測(cè)合格后 -20℃保存。
16S rDNA V3 可變區(qū)的擴(kuò)增:16S rDNA V3區(qū)擴(kuò)增引物[24]序列分別是:534r:5′-ATTACCGCGGCTGCTGG- 3′ 和341f:5′-(GC) -CCTACGGGAGGCAGCAG- 3′。由生工生物工程(上海)股份有限公司合成。PCR反應(yīng)條件為94 ℃預(yù)變性5 min;94 ℃變性30 s,68 ℃退火30 s (每個(gè)循環(huán)降低 1 ℃),72 ℃ 延伸 1 min,10 個(gè)循環(huán);94℃ 變性30 s,58 ℃ 退火30 s, 72 ℃ 延伸 1 min,20 個(gè)循環(huán),最后72 ℃ 延伸 10 min。產(chǎn)物長度為233 bp。PCR 反應(yīng)在美國Bio-Rad的基因擴(kuò)增儀(S1000 Thermal Cycler)上進(jìn)行。擴(kuò)增產(chǎn)物用 0. 8%的瓊脂糖電泳進(jìn)行檢測(cè)。
真菌18S rDNA的擴(kuò)增:真菌擴(kuò)增18S rDNA 間隔區(qū),引物[25]序列分別為:5′-GTAGTCATATGCTTGTCTC- 3′和5′-(GC) -ATTCCCCGTTACCCGTTG- 3′。PCR 反應(yīng)條件為 94 ℃預(yù)變性5 min;94 ℃變性1 min,62 ℃退火30 s (每個(gè)循環(huán)降低 1 ℃),72 ℃ 延伸 1 min,10 個(gè)循環(huán);94 ℃ 變性1 min,52 ℃ 退火30 s, 72 ℃ 延伸 1 min,20 個(gè)循環(huán),最后72 ℃ 延伸 10 min。產(chǎn)物長度為350 bp。
PCR 產(chǎn)物 DGGE 條件:細(xì)菌 16S rDNA 和真菌 18S rDNA 擴(kuò)增產(chǎn)物均經(jīng)過瓊脂糖凝膠 DNA 回收試劑盒(北京莊盟國際生物基因科技有限公司)純化。8% 聚丙烯酰胺凝膠,變性劑濃度為 30%—60%(100% 的變性劑溶液中有40% 的甲酰胺和42% 的尿素)。80 V 恒定電壓、60 ℃下持續(xù)電泳12 h。真菌 PCR產(chǎn)物采用 7%的聚丙烯酰胺凝膠,變性梯度為15%—50%,電壓50 V,60 ℃下持續(xù)電泳16 h。電泳結(jié)束后,0.2% AgNO3染色,用Bio-rad GelDoc XR System 凝膠成像系統(tǒng)拍照。
DGGE遺傳圖譜條帶用Quantity One 4.6.2軟件(Bio-Rad) 進(jìn)行處理,測(cè)得條帶的相對(duì)亮度即為該基因型的相對(duì)多度(Pi)。用UPGMA 法對(duì)進(jìn)行聚類分析,并采用Shannon-Wiener多樣性指數(shù)、豐富度(Margalef Index)和Pielou均勻度指數(shù)(Pielou Index)等指標(biāo)計(jì)算各土壤樣品生物群落的多樣性[26]。
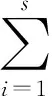
EH=H/Hmax=H/(lnS)
式中,H為Shannon-Wiener指數(shù),EH為均勻度指數(shù),ni是第i條條帶的多度,N為樣品中所有條帶的總多度;Hmax=lnS,S為群落豐富度即樣品中的總的條帶數(shù)。H最小值為 0,最大值為 lnS。
1.6 數(shù)據(jù)處理統(tǒng)計(jì)
土壤酶活性和微生物數(shù)量的數(shù)據(jù)用 SPSS 17.0軟件進(jìn)行單因素方差分析,用 Duncan 新復(fù)極差法進(jìn)行差異顯著性檢驗(yàn)(P< 0.05)。
2 結(jié)果與分析
2.1 土荊芥揮發(fā)油對(duì)土壤胞外酶活性的影響
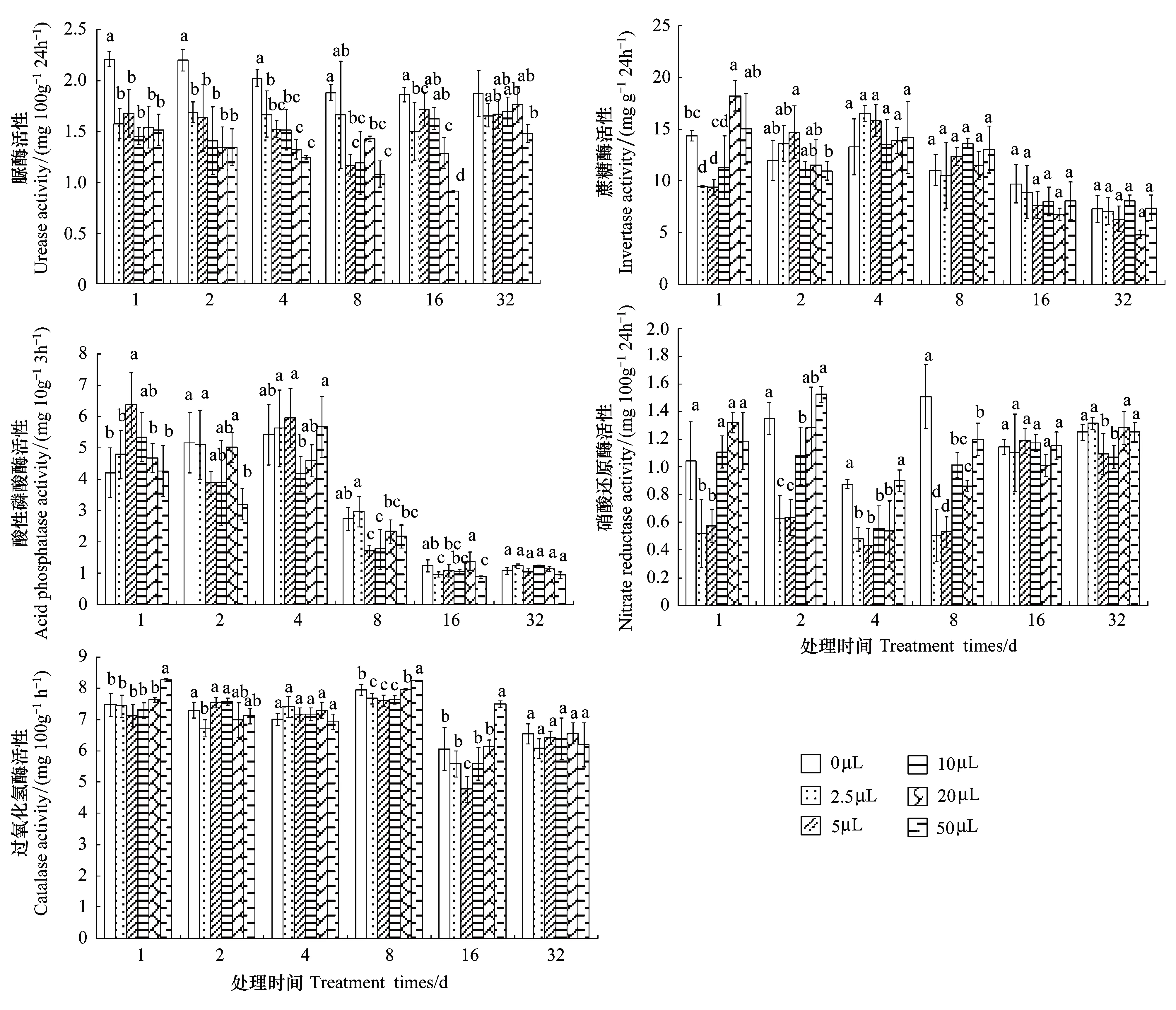
圖1 土荊芥揮發(fā)油化感脅迫對(duì)土壤胞外酶活性的影響Fig.1 Allelopathy effect of volatile oil from Chenopodium ambrosioides on soil extracellular enzyme activity圖1中不同的小寫字母代表同一處理時(shí)間各揮發(fā)油處理組間的差異顯著水平(P<0.05)
土荊芥揮發(fā)油對(duì)土壤胞外酶活性的影響如圖1所示,處理初期,揮發(fā)油對(duì)土壤酶活性影響較大,隨著處理時(shí)間延長,影響逐漸減弱。土荊芥揮發(fā)油處理可降低土壤中脲酶的活性。處理16 d時(shí),抑制效應(yīng)達(dá)到最大,對(duì)照組的脲酶活性是50 μL處理組活性的2.04倍;揮發(fā)油對(duì)土壤蔗糖酶的影響表現(xiàn)在處理初期,處理1 d后,較低劑量(2.5、5 μL)的揮發(fā)油顯著抑制了蔗糖酶活性(P<0.05);揮發(fā)油對(duì)酸性磷酸酶活性的影響表現(xiàn)為處理1 d后,5 μL揮發(fā)油處理顯著增加了酶活性(P<0.05)。處理2 d后,50 μL 揮發(fā)油處理顯著降低了酶活性(P<0.05)。處理32 d后,揮發(fā)油處理組酶活性水平趨于對(duì)照組;揮發(fā)油對(duì)土壤硝酸還原酶活性的影響表現(xiàn)為抑制作用;處理8 d后,各揮發(fā)油處理組均抑制了硝酸還原酶活性(P<0.05)。較高劑量組揮發(fā)油增加了過氧化氫酶的活性,處理8 d和16 d組中,低劑量組揮發(fā)油降低了過氧化氫酶活性(P<0.05)。
2.2 土荊芥揮發(fā)油對(duì)土壤中可培養(yǎng)微生物數(shù)量的影響
較高劑量土荊芥揮發(fā)油(10、20 μL和50 μL)經(jīng)處理土壤8 d、16 d、32 d后只有1種酵母菌生長,幾乎無霉菌生長,可能本研究的處理方法抑制了一些好氧微生物的生長。
揮發(fā)油處理增加了土壤中細(xì)菌的數(shù)量(圖2);隨著處理時(shí)間的增加,促進(jìn)作用逐漸增強(qiáng),處理16 d后,揮發(fā)油對(duì)細(xì)菌的影響達(dá)到最大。其中 50 μL的揮發(fā)油組細(xì)菌數(shù)量顯著高于對(duì)照(P<0.05),為對(duì)照的14.88倍。
揮發(fā)油處理對(duì)土壤中放線菌數(shù)量的影響(圖3)表現(xiàn)為,處理1、4 d和16 d組中,較低劑量的揮發(fā)油增加了放線菌的數(shù)量,較高劑量的揮發(fā)油減少了放線菌的數(shù)量(P<0.05)。處理32 d后,較高劑量的揮發(fā)油增加了放線菌的數(shù)量(P<0.05)。

圖2 土荊芥揮發(fā)油化感脅迫對(duì)土壤可培養(yǎng)細(xì)菌數(shù)量的影響 Fig.2 Allelopathy effect of volatile oil from Chenopodium ambrosioides on cultural soil bacteria quantity
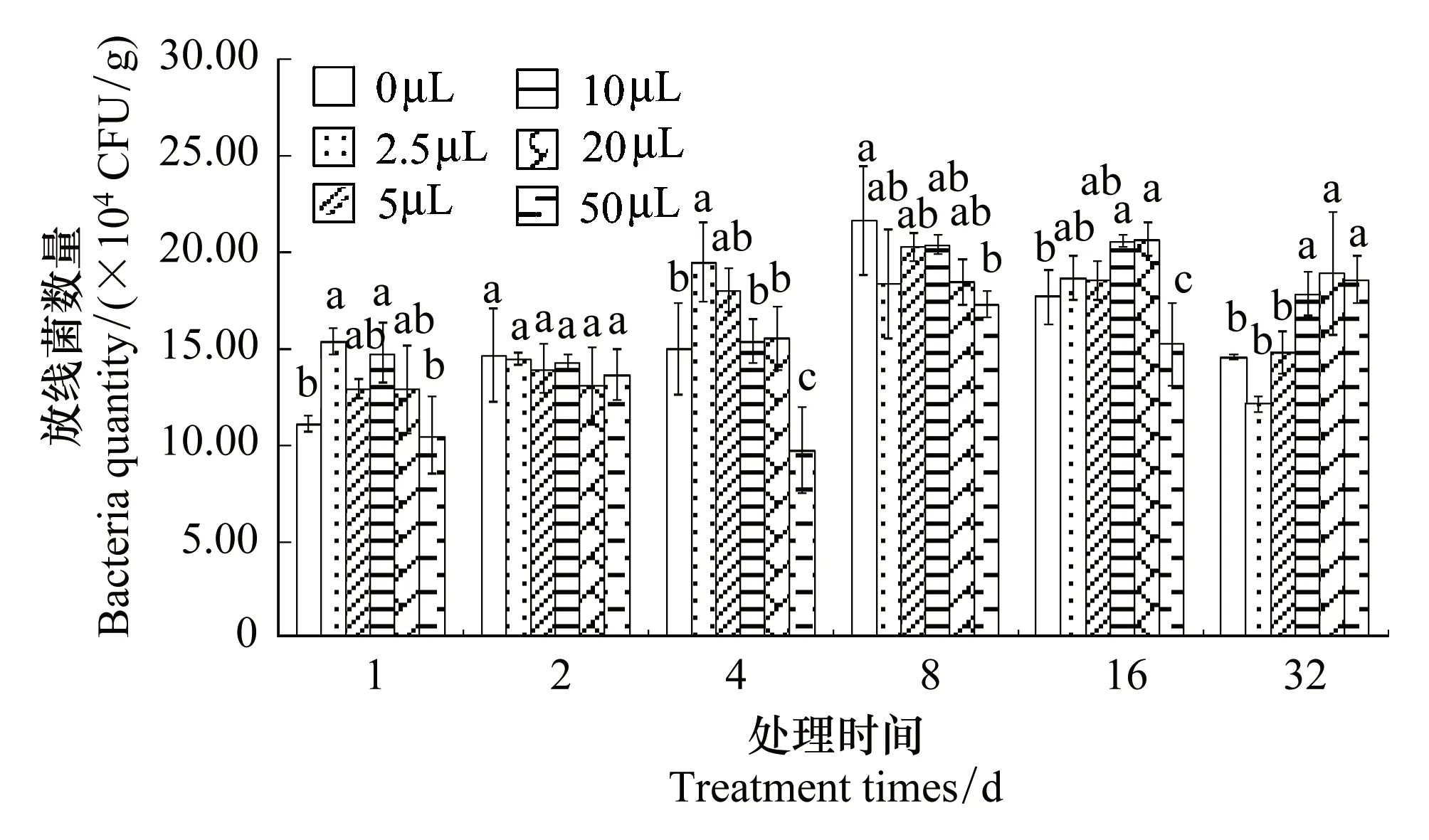
圖3 土荊芥揮發(fā)油化感脅迫對(duì)土壤可培養(yǎng)放線菌數(shù)量的影響 Fig.3 Allelopathy effect of volatile oil from Chenopodium ambrosioides on cultural soil actinomycetes quantity
2.3 土荊芥揮發(fā)油對(duì)土壤中微生物多樣性的影響
16S rDNA的PCR-DGGE電泳圖譜分析表明,隨著揮發(fā)油劑量增加以及處理時(shí)間的延長,土壤細(xì)菌的Shannon-Wiener指數(shù)和豐富度指數(shù)均增大,而均勻度指數(shù)均變化不大(表1)。其中,不同處理時(shí)間的50 μL分析選取處理時(shí)間為1、8 d和32 d,揮發(fā)油劑量選取0,5, 20 μL和50 μL,用F、B、D和E分別代替揮發(fā)油處理組(1E、8E和32E)的Shannon-Wiener指數(shù)和豐富度指數(shù)分別為相同處理時(shí)間中的最大值,且32E處理組為所有處理組中最大值。不同處理組的DGGE圖譜條帶隨揮發(fā)油劑量增加和處理時(shí)間的增長,出現(xiàn)了一些新的條帶(文中未附圖)。各處理組結(jié)果聚類分析(圖4)表明,最長的處理時(shí)間所有處理組(32B、32D、32E和32F)和最大揮發(fā)油劑量的處理組(1E和8E)被歸為一大類,屬于細(xì)菌群落多樣性較高的一大類。其余的處理組被歸為一大類。在處理時(shí)間較短的1 d和8 d處理組中,低劑量揮發(fā)油處理的1B和8B組細(xì)菌群落相似性度達(dá)到0.95。8F和1F、8D、1B、8B 4個(gè)處理組的相似度為0.70。

表1 土荊芥揮發(fā)油對(duì)土壤中微生物多樣性影響
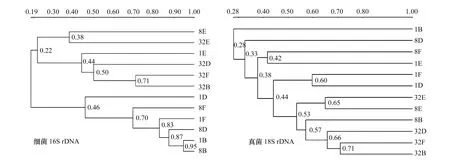
圖4 土荊芥揮發(fā)油處理土壤樣品中細(xì)菌16S rDNA和真菌18S rDNA的聚類分析圖Fig.4 Clustering analysis of 16S rDNA genge and 18S rDNA genge of soil treated with volatile oil from Chenopodium ambrosioides
土荊芥揮發(fā)油可增加土壤真菌多樣性,并表現(xiàn)出處理劑量和處理時(shí)間雙重效應(yīng)。其中,50 μL揮發(fā)油處理8 d時(shí),土壤真菌群落的Shannon -Wiener指數(shù)和豐富度指數(shù)均為最大值(表1)。聚類分析結(jié)果表明,32F、32D和32B處理組的相似度為0.66,其余處理組的相似性較低(圖4)。
3 討論
3.1 土荊芥揮發(fā)油的化感脅迫對(duì)土壤胞外酶活的影響
土壤胞外酶主要來源于根系分泌物、土壤微生物活動(dòng)、動(dòng)植物殘?bào)w分解釋放、土壤動(dòng)物區(qū)系釋放等[27]。土壤胞外酶是“植物-土壤酶-土壤養(yǎng)分”系統(tǒng)的聯(lián)系紐帶,可影響土壤養(yǎng)分循環(huán)[28]。土壤胞外酶在植物入侵過程中起著重要作用[29],入侵植物可通過釋放化感物質(zhì)影響土壤胞外酶活性從而影響土壤養(yǎng)分,使土壤環(huán)境變得不利于周圍植物的生長,從而壓制、排擠周圍對(duì)營養(yǎng)水平要求較高的植物[22]。本研究結(jié)果表明,土荊芥揮發(fā)油影響了土壤胞外酶活性。在處理初期影響較大,隨著處理時(shí)間增長,其影響逐漸減弱。推測(cè)其原因是隨著處理時(shí)間延長,土壤中微生物的活動(dòng)降解了部分化感物質(zhì)從而逐漸減弱了化感脅迫。張建[30]和解開治[31]在土壤加入環(huán)境激素類物質(zhì)后,隨脅迫時(shí)間延長,土壤酶活性也逐漸恢復(fù),與本研究結(jié)果類似。
土壤中蔗糖酶可較好反應(yīng)土壤生物活性狀態(tài),磷酸酶可催化有機(jī)磷類化合物轉(zhuǎn)為有效態(tài)磷,脲酶和硝酸還原酶可影響土壤的氮代謝,而過氧化氫酶則可反應(yīng)土壤生態(tài)環(huán)境脅迫程度[31]。入侵植物對(duì)土壤酶活性的影響隨植物種類而異。一年蓬(AnnualFleabane)在其入侵過程中顯著增加了土壤脲酶、酸性磷酸酶和轉(zhuǎn)化酶活性,加拿大蓬(ErigeronCanadensis)則減少了這3種酶活性[32];黃頂菊(Flaveriabidenti) 提高了土壤脲酶和磷酸酶活性[33];紫莖澤蘭(Ageratinaadenophora)和飛機(jī)草(Eupatoriumodoratum)可增加根際土壤脲酶、蔗糖酶和過氧化氫酶活性[29];火炬樹(Rhustyphina)單優(yōu)林型中土壤脲酶、過氧化氫酶活性增強(qiáng),磷酸酶活性降低[34];土荊芥生長過程中,根際土壤的硝酸還原酶活性在營養(yǎng)期和果期顯著升高,脲酶活性在營養(yǎng)期降低,蔗糖酶、酸性磷酸酶和過氧化氫酶的活性在營養(yǎng)期和果期差異不大[22]。本研究中,土荊芥揮發(fā)油不同程度降低了脲酶、酸性磷酸酶、蔗糖和硝酸還原酶的活性,較高劑量的揮發(fā)油處理組顯著促進(jìn)了過氧化氫酶活性。這種差異可能與不同入侵植物釋放的化感物質(zhì)不同有關(guān),從而對(duì)根際土壤胞外酶活性造成不同影響[31,33]。如葉陳英等[35]研究表明水稻根系酚酸類化感物質(zhì)可使土壤脲酶活性提高了 1.58—2.66 倍,蔗糖酶活性提高了2.08—3.20 倍;李慶凱等[36]研究表明羥基苯甲酸、肉桂酸均不同程度降低了花生(Arachishypogaea)根部土壤脲酶、蔗糖酶、磷酸酶活性。本研究的結(jié)果顯示土荊芥釋放的化感物質(zhì)可降低與土壤肥力相關(guān)的土壤酶胞外酶活性。
3.2 土荊芥揮發(fā)油的化感脅迫對(duì)土壤微生物的影響
外來入侵植物與土壤之間的相互作用是影響其入侵力和生態(tài)系統(tǒng)可入侵性的一個(gè)重要方面[34]。入侵植物改變了土壤微生物群落的結(jié)構(gòu)和功能,這種變化反過來又會(huì)對(duì)入侵植物的生長和競(jìng)爭(zhēng)產(chǎn)生反饋。入侵植物的這種土壤微生物學(xué)機(jī)制逐漸成為研究熱點(diǎn)[37- 38]。隨著火炬樹水浸液濃度的增加,細(xì)菌和真菌的數(shù)量增多[8]。紫莖澤蘭根區(qū)土壤的3種酚酸類物質(zhì)在較低濃度(50—150 mg/L)下對(duì)5種土傳性病菌有顯著的抑制作用[39]。加拿大一枝黃花(Solidagocanadensis)的根系分泌物增加了土壤中的亞硝酸細(xì)菌、好氣性自生固氮菌、硫化細(xì)菌、氨化細(xì)菌和好氣性纖維素分解菌的數(shù)量,減少了反硝化細(xì)菌、嫌氣性纖維素分解菌和反硫化細(xì)菌數(shù)量[40]。桉樹可通過酸化土壤、積累酚類化合物而改變土壤微生物群落結(jié)構(gòu)[41]。以上均說明入侵植物釋放的化感物質(zhì)改變了土壤中微生物數(shù)量和多樣性。本課題組前期研究表明,在隨著土荊芥生長進(jìn)程其根際土壤中微生物數(shù)量增加[22]。土荊芥全株富含揮發(fā)油,這些揮發(fā)油可通過多條途徑進(jìn)入土壤。在本研究中,在土荊芥揮發(fā)油作用下,土壤可培養(yǎng)細(xì)菌數(shù)量明顯增加,土壤放線菌則表現(xiàn)為“低劑量促進(jìn)、高劑量抑制”,表明不同劑量揮發(fā)油均可刺激土壤細(xì)菌的活動(dòng),而放線菌則對(duì)高劑量揮發(fā)油脅迫耐受性較差;16S rDNA DGGE圖譜中,揮發(fā)油處理組的擴(kuò)增條帶數(shù)多于對(duì)照,而18S rDNA的 DGGE圖譜中,隨著揮發(fā)油劑量的增加和處理時(shí)間的延長,出現(xiàn)了新的特征條帶,原有的某些條帶則減弱甚至消失;揮發(fā)油處理后,土壤中細(xì)菌和真菌的Shannon -Wiener指數(shù)和豐富度指數(shù)均顯著增加,且具有時(shí)間-劑量效應(yīng)。UPGMA聚類分析表明,揮發(fā)油改變土壤中細(xì)菌和真菌的群落組成。因此,土荊芥揮發(fā)油的化感效應(yīng)改變土壤微生物多樣性。
在本研究的可培養(yǎng)微生物檢測(cè)試驗(yàn)中,在較高劑量土荊芥揮發(fā)油(10、20 μL和50 μL)處理8、16、32 d后僅檢測(cè)到1種酵母菌,未檢測(cè)到霉菌。這可能是多數(shù)真菌為嚴(yán)格的好氧菌,而本研究試驗(yàn)期間為了確保處理劑量的恒定采用了較為密閉的處理法形成了相對(duì)缺氧的環(huán)境,因而抑制了好氧真菌的生長。同時(shí),本研究室前期研究表明,土荊芥揮發(fā)油對(duì)植物致病真菌具有一定的抑制作用[42]。也有可能是較高劑量揮發(fā)油抑制了待測(cè)土壤中的真菌生長,具體原因尚待進(jìn)一步通過試驗(yàn)加以驗(yàn)證。另外,本研究中設(shè)置的土荊芥揮發(fā)油處理劑量為具有生態(tài)毒效應(yīng)的劑量。實(shí)際上,在野外條件下,土壤中的土荊芥揮發(fā)油含量會(huì)受多種因素的綜合影響而發(fā)生變化。因此,后續(xù)的研究有必要對(duì)土荊芥根際揮發(fā)油含量、土壤微生物群落組成做動(dòng)態(tài)跟蹤研究和相關(guān)性分析,這樣才能揭示土荊芥與土壤微生物之間的互作關(guān)系。
在研究方法上,傳統(tǒng)土壤酶活性測(cè)定所用的比色法精準(zhǔn)度不高,操作繁瑣而且耗時(shí)較長。目前新型的熒光分析技術(shù)是以熒光團(tuán)標(biāo)記底物作為探針,通過熒光強(qiáng)度的變化來反映酶活性,具有靈敏度高、耗時(shí)短、式樣量少等優(yōu)點(diǎn)[43]。在微生物多樣性分析方面,基于 PCR技術(shù)的DGGE獲得的微生物DNA通常低于100條,檢測(cè)限低、工作量大。特別對(duì)于土壤中數(shù)量少,但具有重要功能的土壤微生物群區(qū)系的檢測(cè)則具有較大的局限性。而當(dāng)前主流的高通量測(cè)序技術(shù)能夠較為全面和準(zhǔn)確的反映土壤微生物群落結(jié)構(gòu),尤其能客觀地反映其中低豐度的重要功能微生物[44]。因此后續(xù)研究中應(yīng)更多采用這些研究方法以提高檢測(cè)精度。
4 結(jié)論
土荊芥揮發(fā)油的化感脅迫改變了土壤中脲酶、蔗糖酶、酸性磷酸酶、硝酸還原酶和過氧化氫酶的活性,增加了土壤中可培養(yǎng)細(xì)菌和放線菌的數(shù)量,提高了細(xì)菌和真菌多樣性,改變了細(xì)菌和真菌的群落結(jié)構(gòu)。
[1] Callaway R M, Aschehoug E T. Invasive plants versus their new and old neighbors: a mechanism for exotic invasion. Science, 2000, 290(5491): 521- 523.
[2] Scognamiglio M, D′Abrosca B, Esposito A, Fiorentino A. Metabolomics: an unexplored tool for allelopathy studies. Journal of Allelochemical Interactions, 2015, 1(1): 9- 21.
[3] Yang R Y, Mei L X, Tang J J, Chen X. Allelopathic effects of invasiveSolidagocanadensisL. on germination and growth of native Chinese plant species. Allelopathy Journal, 2007, 19(1): 241- 248.
[4] El-Gawad A M A, Mashaly I A, Ziada M E A, Deweeb M R. Phytotoxicity of three Plantago species on germination and seedling growth of hairy beggarticks (BidenspilosaL.). Egyptian Journal of Basic and Applied Sciences, 2015, 2(4): 303- 309.
[6] Gulzar A, Siddiqui M B. Allelopathic effect ofCalotropisprocera(Ait.)R.Br. on growth and antioxidant activity ofBrassicaoleraceavar. botrytis. Journal of the Saudi Society of Agricultural Sciences, 2016, doi: 10.1016/j.jssas.2015.12.003
[7] 王朋, 王瑩, 孔垂華. 植物揮發(fā)性單萜經(jīng)土壤載體的化感作用——以三裂葉豚草(AmbrosiatrifidaL.)為例. 生態(tài)學(xué)報(bào), 2008, 28(1): 62- 68.
[8] 侯玉平, 柳林, 王信, 閆曉宇, 門航, 李偉杰, 徐維明. 外來植物火炬樹水浸液對(duì)土壤微生態(tài)系統(tǒng)的化感作用. 生態(tài)學(xué)報(bào), 2013, 33(13): 4041- 4049.
[9] Niu H B, Liu W X, Wan F H, Liu B. An invasive aster (Ageratinaadenophora) invades and dominates forest understories in China: altered soil microbial communities facilitate the invader and inhibit natives. Plant and Soil, 2007, 294(1/2): 73- 85.
[10] Li Y P, Feng Y L, Chen Y J, Tian Y H. Soil microbes alleviate allelopathy of invasive plants. Science Bulletin, 2015, 60(12): 1083- 1091.
[11] Si C C, Liu X Y, Wang C Y, Wang L, Dai Z C, Qi S S, Du D L. Different degrees of plant invasion significantly affect the richness of the soil fungal community. PLoS One, 2013, 8(12): e85490.
[12] Song K, Lee J, Cha C J, Kang H. Effects ofPhragmitesinvasion on soil microbial activity and structure in a brackish marsh. Plant and Soil, 2015, 392(1/2): 45- 56.
[13] Inderjit, Wardle D A, Karban R, Callaway R M. The ecosystem and evolutionary contexts of allelopathy. Trends in Ecology & Evolution, 2011, 26(12): 655- 662.
[14] Laungani R, Knops J M H. Species-driven changes in nitrogen cycling can provide a mechanism for plant invasions. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12400- 12405.
[15] Shannon S, Flory S L, Reynolds H. Competitive context alters plant-soil feedback in an experimental woodland community. Oecologia, 2012, 169(1): 235- 243.
[16] Inderjit I. Soil microorganisms: An important determinant of allelopathic activity. Plant and Soil, 2005, 274(1/2): 227- 236.
[17] 中華人民共和國環(huán)境保護(hù)部. 關(guān)于發(fā)布中國第二批外來入侵物種名單的通知. [2010-01- 07]. http://www.mep.gov.cn/gkml/hbb/bwj/201001/t20100126_184831.htm.
[18] 胡忠良, 王亞男, 馬丹煒, 陳斌, 何亞強(qiáng), 周健. 玉米根邊緣細(xì)胞exDNA和胞外蛋白對(duì)土荊芥化感脅迫的緩解效應(yīng). 中國農(nóng)業(yè)科學(xué), 2015, (10): 1962- 1970.
[19] 劉長坤, 鄧洪平, 尹燦. 土荊芥水浸提液對(duì)小麥和水稻的生長及抗氧化酶活性的影響. 貴州農(nóng)業(yè)科學(xué), 2010, 38(4): 39- 42.
[20] 王晶蓉, 馬丹煒, 唐林. 土荊芥揮發(fā)油化感作用的初步研究. 西南農(nóng)業(yè)學(xué)報(bào), 2009, 22(3): 777- 780.
[21] 胡琬君, 馬丹煒, 王亞男, 張紅, 李群. 土荊芥揮發(fā)油對(duì)蠶豆根尖細(xì)胞的化感潛力. 生態(tài)學(xué)報(bào), 2011, 31(13): 3684- 3690.
[22] 李睿玉, 王煜, 王亞男, 何兵, 張紅, 馬丹煒. 土荊芥不同發(fā)育期根際土壤養(yǎng)分、酶活及微生物數(shù)量的變化. 生態(tài)環(huán)境學(xué)報(bào), 2014, 23(9): 1526- 1530.
[23] Wang Y N, Wu J L, Ma D W, Li J, Zhang D Y. Anticancer effects ofChenopodiumambrosiodesL. essential oil on human breast cancer mcf- 7 cells in vitro. Tropical Journal of Pharmaceutical Research, 2015, 14(10): 1813- 1820.
[24] Muyzer G, De Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA. Applied and Environmental Microbiology, 1993, 59(3): 695- 700.
[25] May L A, Smiley B, Schmidt M G. Comparative denaturing gradient gel electrophoresis analysis of fungal communities associated with whole plant corn silage. Canadian Journal of Microbiology, 2001, 47(9): 829- 841.
[26] 陳法霖, 張凱, 鄭華, 林學(xué)強(qiáng), 歐陽志云, 屠乃美. PCR-DGGE技術(shù)解析針葉和闊葉凋落物混合分解對(duì)土壤微生物群落結(jié)構(gòu)的影響. 應(yīng)用與環(huán)境生物學(xué)報(bào), 2011, 17(2): 145- 150.
[27] Ferreira V, Larraaga A, Gulis V, Basaguren A, Elosegi A, Graca M A S, Pozo J. The effects of eucalypt plantations on plant litter decomposition and macroinvertebrate communities in Iberian streams. Forest Ecology and Management, 2015, 335: 129- 138.
[28] Chang E H, Chiu C Y. Changes in soil microbial community structure and activity in a cedar plantation invaded by moso bamboo. Applied Soil Ecology, 2015, 91: 1- 7.
[29] 張海霞. 不同入侵植物對(duì)本土植物根際土壤酶活性及微生物數(shù)量的影響. 廣東農(nóng)業(yè)科學(xué), 2014, 41(21): 61- 66.
[30] 張建, 石義靜, 崔寅, 謝慧君, 王文興. 土壤中鄰苯二甲酸酯類物質(zhì)的降解及其對(duì)土壤酶活性的影響. 環(huán)境科學(xué), 2010, 31(12): 3056- 3061.
[31] 解開治, 徐培智, 楊少海, 張發(fā)寶, 唐拴虎, 顧文杰, 蔣瑞萍. 雙酚A對(duì)稻田土壤細(xì)菌群落特征及土壤酶活的影響. 環(huán)境科學(xué)研究, 2012, 25(2): 173- 178.
[32] 王從彥, 向繼剛, 杜道林. 2種入侵植物對(duì)根際土壤微生物種群及代謝的影響. 生態(tài)環(huán)境學(xué)報(bào), 2012, 21(7): 1247- 1251.
[33] 趙曉紅, 楊殿林, 王慧, 劉紅梅, 曲波, 皇甫超河. 黃頂菊入侵對(duì)不同地區(qū)土壤氮循環(huán)及微生物量的影響. 草業(yè)學(xué)報(bào), 2015, 24(2): 62- 69.
[34] 侯玉平, 柳林, 初航, 馬淑杰, 趙丹, 梁榮榮. 外來植物火炬樹(RhustyphinaL.)入侵對(duì)不同林型土壤性質(zhì)的影響. 生態(tài)學(xué)報(bào), 2015, 35(16): 5324- 5330.
[35] 葉陳英. 水稻根系酚酸類化感物質(zhì)分泌動(dòng)態(tài)及其對(duì)土壤生理生化特性的影響[D]. 福州: 福建農(nóng)林大學(xué), 2010.
[36] 李慶凱, 劉蘋, 唐朝輝, 趙海軍, 王江濤, 宋效宗, 楊力, 萬書波. 兩種酚酸類物質(zhì)對(duì)花生根部土壤養(yǎng)分、酶活性和產(chǎn)量的影響. 應(yīng)用生態(tài)學(xué)報(bào), 2016, 27(4): 1189- 1195
[37] Suding K N, Harpole W S, Fukami T, Kulmatiski A, MacDougall A S, Stein C, van der Putten W H. Consequences of plant-soil feedbacks in invasion. Journal of Ecology, 2013, 101(2): 298- 308.
[38] Medina-Villar S, Rodríguez-Echeverría S, Lorenzo P, Alonso A, Pérez-Corona E, Castro-Díez P. Impacts of the alien treesAilanthusaltissima(Mill.) Swingle andRobiniapseudoacaciaL. on soil nutrients and microbial communities. Soil Biology and Biochemistry, 2016, 96: 65- 73.
[39] 謝明惠, 任琴, 張青文, 劉小俠. 紫莖澤蘭根區(qū)土壤酚酸類物質(zhì)組成及其對(duì)土傳病菌的影響. 應(yīng)用生態(tài)學(xué)報(bào), 2010, 21(2): 306- 311.
[40] 沈荔花, 郭瓊霞, 林文雄, 陳穎, 黃振. 加拿大一枝黃花對(duì)土壤微生物區(qū)系的影響研究. 中國農(nóng)學(xué)通報(bào), 2007, 23(4): 323- 327
[41] Soumare A, Sall S N, Sanon A, Cissoko M, Hafidi M, Ndoye I, Duponnois R. Changes in Soil PH, Polyphenol Content and Microbial Community Mediated byEucalyptusCamaldulensis. Applied Ecology and Environmental Research, 2016, 14(3): 1- 19.
[42] 李元, 廖穎, 嚴(yán)偉, 馬丹煒. 四川土荊芥精油對(duì)植物病原真菌的抗菌活性. 生態(tài)環(huán)境學(xué)報(bào), 2010, 19(5): 1176- 1181.
[43] 邵文山, 李國旗. 土壤酶功能及測(cè)定方法研究進(jìn)展. 北方園藝, 2016, (9): 188- 193.
[44] 夏圍圍, 賈仲君. 高通量測(cè)序和DGGE分析土壤微生物群落的技術(shù)評(píng)價(jià). 微生物學(xué)報(bào), 2014, 54(12): 1489- 1499.
Allelochemical stress effects of volatile oils fromChenopodiumambrosioideson extracellular enzyme activities and soil microbial diversity
WANG Yanan*, LI Ruiyu, ZHU Xiaohuan, MA Danwei, ZHANG Hong
College of Life Science, Sichuan Normal University, Chengdu 610101, China
Interactions between invasive plants and soil microorganisms play a key role in the invasion process. Exotic plants often produce allelochemicals that inhibit the growth of native plants by inducing changes in the physical and chemical properties of the soil, as well as to the structure of the soil microbial community.Chenopodiumambrosioides, an annual or short-lived perennial herb within the family Chenopodiaceae native to Central and South America, poses a threat to ecosystem structure and function in China.C.ambrosioidesis rich in volatile oils, which are released into soils via root exudation and plant decomposition. Previous studies investigating the invasion mechanisms ofC.ambrosioidesfocused primarily on its impacts on the growth of native plants and neglected its potential influences on soil microbial structure. Here, we used the greenhouse flask method to study the effects of volatile oils produced byC.ambrosioideson soil microbial diversity and extracellular enzyme activities. The results indicated that volatile oils deriving fromC.ambrosioidesinhibited the activity of soil urease, acid phosphatase, invertase and nitrate reductase (P<0.05), and high doses of these volatile oils significantly enhanced the activity of catalase (P<0.05). Moreover, the volatile oils had a strong influence on soil enzyme activities during the early stages of treatment, but this effect diminished considerably over time. Bacterial abundance was significantly higher in treatment groups receiving high doses (20 μL and 50 μL) of volatile oils than in the control groups (P<0.05) after 16 days of treatment, indicating that the volatile oils greatly influenced soil microorganism diversity; for instance, Actinomycetes were abundant when exposed to only low doses of volatile oils, but their populations declined at higher doses. Both Shannon-Wiener and Margalef indices indicated that bacterial and fungal diversity increased with increasing volatile-oil dose and treatment time. In conclusion, volatile oils produced byC.ambrosioidesaltered the microbial community structure and extracellular enzyme activities in soils, and increased soil microbial diversity.
Chenopodiumambrosioides; volatile oil; allelochemical stress; soil extracellular enzyme; soil microbial community diversity
國家自然基金面上項(xiàng)目(31370549);四川省教育廳重點(diǎn)項(xiàng)目(16ZA0056,16ZB0058)
2016- 01- 21; 網(wǎng)絡(luò)出版日期:2017- 02- 23
10.5846/stxb201601210145
*通訊作者Corresponding author.E-mail: yanan.w@163.com
Wang Y N, Li R Y, Zhu X H, Ma D W, Zhang H.Allelochemical stress effects of volatile oils fromChenopodiumambrosioideson extracellular enzyme activities and soil microbial diversity.Acta Ecologica Sinica,2017,37(13):4318- 4326.

