MicroRNA?101通過靶向SOX9抑制人膠質母細胞瘤的增殖、遷移和侵襲
劉 楠,張 磊,6,王 震,成迎端,2,張鵬幸,王 欣,溫偉紅,楊宏偉,劉 輝,金衛林,張永生,涂艷陽,
(1第四軍醫大學唐都醫院實驗外科,陜西 西安710038;2北布倫瑞克醫院研究部,新澤西 美國 08902;3哈佛醫學院布萊根婦女醫院神經外科,波士頓美國02115;4第四軍醫大學免疫學教研室,陜西西安710032;5上海交通大學電子信息與電子工程學院,薄膜與微細技術教育部重點實驗室,儀器科學與工程中心,納米生物醫學與工程研究室,上海 200240;6西安兒童醫院矯形外科,陜西西安710003)
·論著·
MicroRNA?101通過靶向SOX9抑制人膠質母細胞瘤的增殖、遷移和侵襲
劉 楠1,張 磊1,6,王 震1,成迎端1,2,張鵬幸1,王 欣3,溫偉紅4,楊宏偉3,劉 輝1,金衛林5,張永生1,涂艷陽1,3
(1第四軍醫大學唐都醫院實驗外科,陜西 西安710038;2北布倫瑞克醫院研究部,新澤西 美國 08902;3哈佛醫學院布萊根婦女醫院神經外科,波士頓美國02115;4第四軍醫大學免疫學教研室,陜西西安710032;5上海交通大學電子信息與電子工程學院,薄膜與微細技術教育部重點實驗室,儀器科學與工程中心,納米生物醫學與工程研究室,上海 200240;6西安兒童醫院矯形外科,陜西西安710003)
多形性膠質母細胞瘤(GBM)起源于大腦皮質,是最常見的原發性惡性腫瘤.盡管當今的治療手段不斷進步,包括手術、放療、化療和光動力治療等,然而GBM患者的預后情況仍然較差.最近的研究表明,microRNA?101(miR?101)在人腫瘤中顯著下調,并與腫瘤細胞的增殖和腫瘤干細胞的自我更新有關.另外,miR?101在神經膠質瘤標本和細胞系中顯著下調,但膠質瘤中miR?101的這種下調現象的分子機制尚不明確.本研究發現miR?101可以通過靶向SOX9在體內和體外抑制膠質瘤細胞的增殖和侵襲.沉默SOX9對膠質瘤細胞的增殖和侵襲影響與miR?101類似.qRT?PCR和Western blot檢測發現在人神經膠質瘤細胞系U251MG和U87MG中miR?101與SOX9呈負相關,熒光素酶報告分析發現miR?101可以通過靶向SOX9的3'UTR區抑制SOX9的表達.研究結果表明miR?101通過靶向抑制SOX9的表達在體內和體外調節人神經膠質瘤的增殖、遷移和侵襲,說明miR?101是未來神經膠質瘤治療的潛在靶標.
miR?101;SOX9;侵襲;遷移;增殖
0 引言
神經膠質瘤是最常見的惡性腦瘤,通常來源于神經間質細胞,這些細胞可以形成星形細胞瘤、膠質母細胞瘤、髓母細胞瘤、室管膜瘤和少突神經膠質瘤[1].世界衛生組織WHO分類系統將神經膠質瘤分為四個級別,每個級別包含多種病理亞型[2].如今,手術、放療等傳統的膠質瘤治療方法的預后很差[3-7],導致膠質瘤患者的治愈率低,生存期短.膠質母細胞瘤患者的5年生存率低于5%,平均生存期僅14個月[8].
膠質母細胞瘤是最高級別的神經膠質瘤,對放療和化療的敏感性低,預后差且復發率高[9-11].當前,膠質母細胞瘤的國際標準治療是手術切除后采用替莫咗胺(TMZ)同步周期性化療[12-13].然而,由于膠質母細胞瘤對放療和化療具有強抵抗性,只有30%的患者的平均生存期可以超過2年,其中只有9.8%的患者能達到 5年[14].理論研究發現,微小 RNA(microRNA,miRNA)能夠抑制膠質瘤的生物功能,提高患者存活率.研究也表明,敲除miR?21能夠抑制膠質母細胞瘤(glioblastoma,GBM)的增殖和誘導膠質瘤細胞凋亡[15-16].這些發現為未來神經膠質瘤的臨床治療提供了新策略.
MicroRNA是一種內源性的單鏈小RNA(19~25 nt)[17],沒有開放閱讀框.作為非編碼的核苷酸,microRNA在許多重要的生命活動過程和疾病中起至關重要的作用[18].microRNA通過與3'非翻譯區配對在轉錄水平調節目標基因的表達[19].microRNA參與細胞增殖、分化、凋亡以及其他重要的生命活動,而上述功能與神經膠質瘤的發生和發展密切相關[20].例如,miR?21,miR?7,mir?128和miR?221/22與膠質瘤的惡性發展[21-22].有研究表明,miR?101在患者腫瘤樣本和細胞系中表達顯著下調,例如肺癌[28]、乳腺癌[29]、喉鱗狀細胞癌[30]、胚胎性橫紋肌肉瘤[31]和膠質母細胞瘤[32].本研究探討了miR?101在GBM中的功能.數據表明,miR?101通過靶向抑制SOX9的表達在體內和體外調節人神經膠質瘤的增殖、遷移和侵襲,同時證明了SOX9對膠質瘤的發生發展至關重要,這些結果闡明了SOX9在膠質瘤中的重要功能,同時表明miR?101是膠質瘤治療的新靶標.
1 材料和方法
1.1 組織標本和細胞培養人神經膠質瘤細胞系U251MG和U87MG于2012年購自中國科學院細胞庫,正常膠質細胞系A172、T98和HEB購自北京創聯生物科技公司(中國,北京).細胞系真實性均經過短串聯重復序列驗證.所有細胞均用高糖DMEM(In?vitrogen公司,美國),添加10%的胎牛血清(GIBCO公司,美國)、100單位/毫升的青霉素(NCPC公司,中國)和100 μg/mL的鏈霉素(NCPC公司,中國),培養環境為含5%二氧化碳的37°C細胞培養箱.人類神經膠質瘤組織標本收集自第四軍醫大學唐都醫院的25例患者.正常腦組織標本取自5位創傷性腦損傷的患者.本研究經過第四軍醫大學唐都醫院研究倫理委員會批準.本研究涉及的所有患者均已簽署知情同意書,所有標本均根據倫理和法律標準匿名處理.
1.2 總RNA提取和qRT?PCR通過實時熒光定量PCR(qRT?PCR)來檢測miR?101在神經膠質瘤細胞、神經膠質瘤組織和創傷性腦損傷組織中的表達水平.按照試劑盒操作規程使用Trizol(Invitrogen公司,美國)從凍存的組織樣品和細胞中抽提總RNA.RNA用不含RNase的DNase處理(羅氏公司,瑞士).然后使用BcaBest RNA PCR試劑盒(TAKAR公司,中國)合成cDNA.所有引物均由上海生工生物科技有限公司合成,熒光定量PCR使用SYBR底物,用iQ5實時PCR檢測系統(Bio?Rad公司)檢測信號.
1.3 載體構建與慢病毒感染構建miR?101過表達的引物由上海捷瑞生物工程有限公司合成,miR?101的正向 引 物為:CCTGAATTCATTCTAATTTAAT?TCAACTGG;反向引物為:TATGGATCCTCAGCACAA?CATGGCTGCAC,酶切位點分別是EcoR I和BamH I.通過EcoR I和BamH I將miR?101亞克隆到pCDH1載體上(Promega公司,美國).用表達miR?101的慢病毒以及陰性對照慢病毒(GenePharma公司,上海中國).感染并用5 μg/L的嘌呤霉素篩選10 d后,收集細胞并提取總RNA進行qRT?PCR表達分析.我們還構建了SOX9敲除的穩轉細胞系.SOX9的短發卡RNA(shRNA)和陰性對照慢病毒shRNA序列由上海吉瑪制藥技術有限公司(上海,中國)合成.慢病毒shRNA靶向序列分別是 shSOX9?1:GCATCCT?TCAATTTCTGTATA,sh?SOX9?2:CTCCACCTTCAC?CTACATGAA.干擾片段亞克隆到LV3慢病毒載體上,慢病毒產品也由上海吉瑪制藥技術有限公司(上海,中國)合成.利用PCR擴增包含miR?101結合序列的野生型SOX9的3'UTR序列為:5'?GAATTCT?CAGTGGCCAGGCCAACCTTC?3'和5'?CATATGAAAC?TGATCACATAACACAA?3',擴增產物亞克隆到PGL3?luc載體上(Promega公司,美國).將預測的miR?101靶向位點GUACUGU突變為GAUGACA.野生型SOX9的引物是5'?GAATTCTCAGTGGCCAGGCCAAC?CTTC?3'和5'?CATATGAAACTGATCACATAACACAA?3',突變體的引物是5'?ATATTTTTAGTATGATGACAG?TATGATTCAT?3'和5'?ATGAATCATACTGTCATCATA?CTAAAAATAT?3'.
1.4 MTT實驗MTT實驗步驟參照之前的報道[23].將1×104個細胞重懸在200 μL培養基中種到96孔板中.處理后,培養基換成200 μL含0.5 mg/mL MTT的DMEM/FBS,37°C孵育4 h.棄掉上清,細胞用200 μL DMSO 37°C裂解10 min.測量490 nm處的OD值(SpectraMax公司,美國).
1.5 細胞侵襲和遷移實驗用 250 μL無血清DMEM重懸2.5×105個細胞并種在24孔的transwell板的內室(Cornin公司,美國),transwell板預先涂上30 μL的基質膠(BD Biosciences,美國).transwell板的內室外部加入 600 μL的含 10%胎牛血清的DMEM.細胞在37°C遷移48 h(侵襲實驗)[24].然后,transwell板內室的細胞用棉簽擦掉,transwell板室底部的細胞用4%的多聚甲醛(Sigma?Aldrich公司)固定并用Hoechst染色.在顯微鏡下取五個不同的視野觀察并計數染色的細胞,每組實驗至少重復三次.遷移實驗與侵襲實驗類似,只是transwell板的內室不要基質膠包被,內室外的培養基為含2.5%胎牛血清的DMEM.細胞遷移時間為8 h.
1.6 劃痕實驗將細胞種在6孔板上培養至細胞完全匯合,然后用200 μL槍頭劃出一道均勻的劃痕.PBS洗兩次去除懸浮細胞,然后用含1%胎牛血清的DMEM培養細胞.分別在0 h,12 h,24 h觀察并在白光下拍照(尼康DS?5M相機).
1.7 免疫組織化學染色免疫組織化學(immunohis?tochemistry,IHC)中,8 μm的福爾馬林固定并用石蠟包被的腦組織切片先去蠟和水化.SOX9抗體(1∶100稀釋;Abcam 公司,美國)和 Ki67抗體(1∶100稀釋;羅氏公司;瑞士)4°C孵育過夜.一抗孵育完后,洗掉一抗,用生物素標記的二抗(1∶800)室溫孵育1 h.用蘇木精染細胞核.光學顯微鏡(1×200)拍照,每組樣品至少選五個不同視野用于統計.
1.8 Western blot用高氯化鉀裂解緩沖液裂解細胞(10 mmol/L Tris?HCl,pH=8.0,140 mmol/L氯化鈉,300 mmol/L氯化鉀,1 mmol/L EDTA,0.5%Triton X?100和0.5%鈉脫氧膽酸鹽).裂解液中添加1%的蛋白酶抑制劑(Roche公司).用BCA試劑盒測定蛋白濃度(Bio?Rad公司).Western blot的主要過程參照之前的報道[25].信號采集使用增強型化學發光試劑盒(GE healthcare公司,英國).
1.9 熒光報告酶實驗Hsa?miR?101載體 (吉瑪公司,上海)和 PGL3,PGL3?SOX9 3'UTR,PGL3?SOX9 3'?UTRmut質粒轉染進HEK293T細胞.轉染24 h后,收集并裂解細胞.采用雙熒光素報告酶分析系統檢測熒光素酶活性(Promega公司,美國).
1.10 動物實驗所有動物實驗均經過第四軍醫大學唐都醫院倫理委員會批準.無胸腺的裸鼠購自第四軍醫大學(陜西,中國),并在動物房標準條件下飼養.膠質瘤細胞裸鼠移植瘤實驗參照之前的報道[26],分別為miR?NC和miR?101兩組U87MG細胞進行移植.移植前裸鼠用10%水合氯醛麻醉,3.0×106的兩組細胞重懸在5 mL PBS中植入兩側來建立裸鼠皮下注射移植瘤模型.每天對裸鼠稱重.腫瘤體積通過測量腫瘤的長度(a)和(b)進行計算,腫瘤體積(V)計算公式為:V=ab2/2[27].
1.11 統計學分析采用 SPSS17.0統計學軟件(SPSS公司,美國)通過單邊非配對t檢驗對獨立樣本進行統計學分析.所有統計結果的定量分析均采用標準誤(±SEM)進行分析,并在圖中標注,P<0.05表示差異具有統計學意義.
2 結果
2.1 過表達miR?101抑制膠質瘤細胞體外的增殖、遷移和侵襲為了檢測miR?101在膠質瘤中的表達水平,本研究收集了20例臨床標本,包括10例四級標本,10例三級標本,10例二級標本,10例一級標本和4例腦損傷的正常大腦組織.數據表明,miR?101在膠質瘤組織中的表達水平遠低于正常腦組織的表達水平(圖1A),同時miR?101在U87MG,U251MG,A172和T98等膠質瘤細胞中的表達水平低于HEB細胞(圖1B).為了檢測miR?101在膠質瘤細胞中的功能,用miR?101慢病毒感染U87MG和U251MG細胞.感染miR?101慢病毒的U87MG和U251MG細胞能夠表達高水平的miR?101(圖1C).劃痕實驗檢測miR?101對膠質瘤細胞遷徙能力的影響,過表達miR?101的U87MG和U251MG膠質瘤細胞的遷徙速度相對于陰性對照明顯變慢(圖1D,E).此外,Transwell侵襲實驗表明過表達miR?101可以顯著抑制膠質瘤細胞的遷移和侵襲(圖1F~I).過表達miR?101的U87MG細胞侵襲能力只有對照細胞的大約八分之一,而遷移能力也只有對照的五分之二(圖1F,G).過表達miR?101的U251MG細胞侵襲能力只有對照細胞的大約九分之一,遷移能力也降到對照的五分之二(圖1H,I).MTT實驗檢測miR?101對膠質瘤細胞增殖的影響(圖1J,K),感染后24 h~96 h內,過表達miR?101的U87MG和U251MG細胞的增殖速度均顯著降低(P<0.05),說明miR?101能顯著抑制膠質瘤的增殖.

圖1 過表達miR?101抑制膠質瘤細胞體外的增殖、遷移和侵襲
2.2 過表達miR?101抑制膠質瘤腫瘤的體內生長為了明確miR?101在膠質瘤中的功能,本研究進一步檢測了過表達miR?101對膠質瘤腫瘤體內生長的影響.根據前期報道,本研究選擇U87MG細胞進行裸鼠移植腫瘤實驗[24].將3.0×106個miR?101?U87MG細胞和陰性對照細胞分別裸皮下注射裸鼠身體兩側.注射30 d后,結果顯示miR?101?U87MG細胞形成的腫瘤體積明顯小于NC?U87MG形成的腫瘤(每組五只裸鼠,P=2.89×10-3;圖2A~C).免疫組織化學染色結果顯示,miR?101?U87MG細胞形成的腫瘤中Ki67陽性細胞比例明顯小于NC?U87MG腫瘤(圖2D).因此,miR?101在體內體外均能抑制膠質瘤腫瘤的生長.
2.3 MiR?101在膠質母細胞瘤中直接靶向SOX9用生物信息學方法預測GBM中miR?101的潛在靶標.TargetScan軟件分析發現SOX9基因的3'UTR區域包含miR?101的結合位點(圖3A),并且SOX9在二級三級膠質瘤組織中的表達水平高于正常的大腦組織(圖3B).此外,qRT?PCR檢測發現裸鼠移植腫瘤中SOX9在miR?101?U87MG細胞中的表達明顯低于NC?U87MG細胞.說明SOX9可能是miR?101的靶標.為了明確miR?101和SOX9的調控關系,我們使用qRT?PCR和Western blot比較了miR?101或miR?control慢病毒感染膠質瘤細胞系中SOX9的表達水平.miR?101過表達細胞中SOX9的mRNA水平和蛋白水平都顯著下調(圖3C~E).本研究進一步構建了一個SOX9 3'UTR的熒光素酶報告質粒.研究發現轉染Luc?SOX9?UTR的細胞相比于miR?101靶向位點突變的SOX9 3'UTR質粒和陰性對照的熒光素酶活性顯著降低 (圖3C).以上結果表明在膠質瘤中SOX9是miR?101的直接靶標.進一步利用免疫熒光比較了miR?101和miR?control細胞中SOX9的表達.結果表明,過表達miR?101只改變SOX9的表達水平,不改變其定位(圖3E).
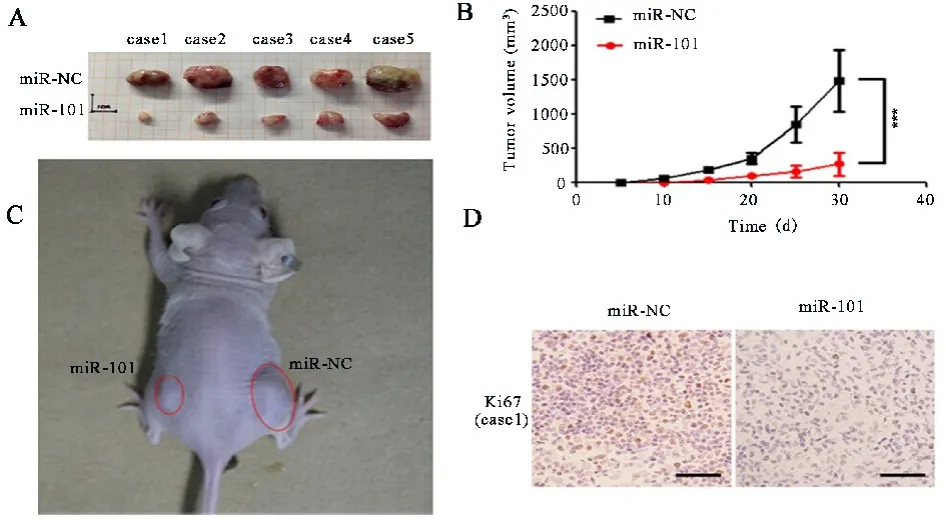
圖2 過表達miR?101抑制膠質瘤腫瘤的體內生長
2.4 SOX9在體內體外的抑癌功能為了進一步驗證SOX9和miR?101之間的靶向關系,本研究分析了SOX9在膠質瘤中的功能.利用兩條shRNA sh?SOX9?1和sh?SOX9?2在U87MG和U251MG細胞中沉默SOX9.結果表明,sh?hSOX9?1的效果更好(圖4A,B).然后利用MTT實驗、劃痕實驗和trans?well實驗檢測SOX9在膠質瘤細胞中的功能.用sh?hSOX9?1慢病毒感染U87MG和U251MG細胞.MTT實驗檢測SOX9對U251MG和U87MG細胞增殖的影響.感染后24~96 h,相對于對照組,SOX9敲除細胞的細胞增殖速度顯著減慢(P<0.05,圖4C,D).Trans?well檢測發現SOX9沉默后U87MG和U251MG細胞遷移和侵襲能力均受到抑制(圖4E~H).劃痕實驗檢測沉默SOX9對細胞遷徙能力的影響(圖4I,J),結果發現SOX9?KD?U251MG細胞SOX9?KD?U87MG細胞的遷徙能力相對各自對照細胞均顯著變慢.這些結果表明SOX9在體外和體內都是膠質瘤細胞增殖的必需因素.
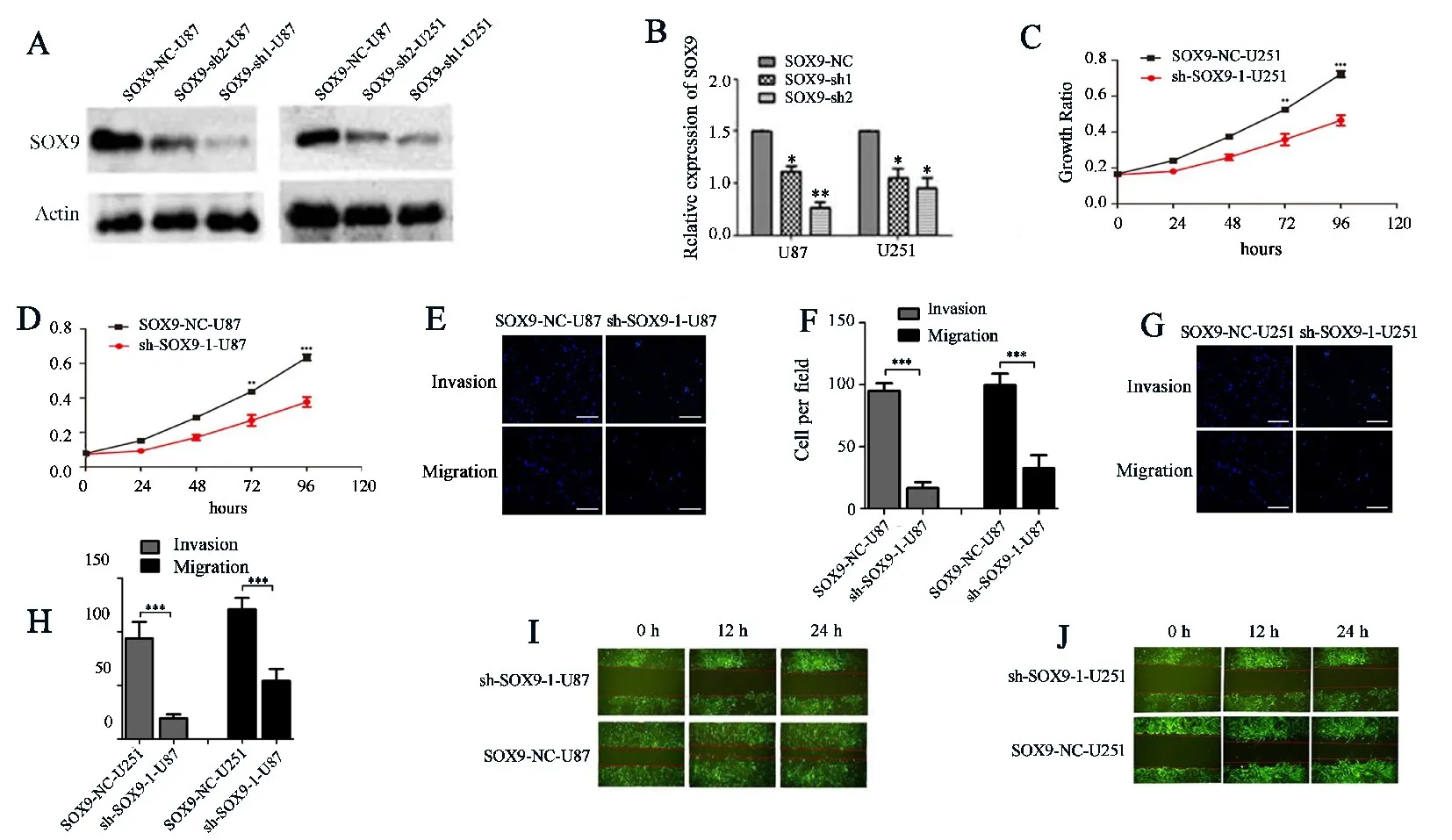
圖4 SOX9在體內體外均發揮抑癌功能
3 討論
神經膠質瘤是大腦最常見的原發性惡性腫瘤.盡管治療技術不斷進步,包括手術、放射治療、光動力治療、化療等,然而惡性神經膠質瘤的預后依舊很差,其高發病率和高死亡率促使人們不斷尋找新的治療策略.microRNA是一種內源性非編碼RNA,microRNA可以通過靶向目標基因的3'UTR區在轉錄后水平抑制基因的表達[33].在人類許多腫瘤內都發現microRNA的下調現象,如卵巢癌[34]、肺癌[35-36]、肝癌[37]、結腸癌[38-39]和GBM[40]等.microRNA的下調已經成為一個新的惡性腫瘤的特征,所以一些特定的microRNA具有成為腫瘤診斷和預后的生物標志物[41-45].miR?101在幾種人類腫瘤中都是下調的.研究表明,miR?101能夠通過抑制纖維母細胞和腫瘤細胞的相互作用和靶向 CXCL12抑制肺癌細胞的侵襲和增殖[27].miR?101在多種腫瘤中通過與CXCR7[29],CDK8[30],EZH2[31,47]和CPEB1[32]相互作用發揮生物功能.在GBM中,研究表明,miR?101可以通過靶向人Kruppel家族相關因子6在膠質瘤干細胞中起腫瘤抑制因子的作用[46].此外,miR?101可以逆轉膠質瘤細胞中LMO3啟動子的高甲基化[48].總之,miR?101是包括惡性神經膠質瘤在內的多種腫瘤的重要調控因子.值得注意的是,研究表明在肝癌中miR?101可以直接靶向SOX9,抑制SOX9相關的腫瘤功能,促進改善肝癌的預后[49].SOX9是一個高機動的轉錄因子,在胚胎形成、分化、腫瘤發生、侵襲和干細胞自我更新中都扮演重要角色[50-51].這些研究提示 SOX9可能參與miR?101的腫瘤抑制過程.因此本研究分析了膠質瘤中SOX9和miR?101的關系.數據表明miR?101可以通過直接靶向SOX9抑制膠質瘤細胞的增殖、遷移和侵襲.結果還表明,SOX9對于膠質瘤腫瘤發生在體外和體內的增殖必不可少.前期報道指出SOX9受到EGFR[52],Notch[53],SHH[54]的調控,同時 SOX9可以調控Akt[55],Wnt[56]和 BMI1[57]等信號通路.由此得出結論,miR?101和SOX9調控軸可以通過調控Akt、BMI1、Wnt信號通路調節惡性膠質瘤細胞的增殖、遷移和侵襲(圖5).本研究表明miR?101和SOX9是人神經膠質瘤的關鍵調節因子,并為未來膠質瘤的治療提供了新的治療靶點.
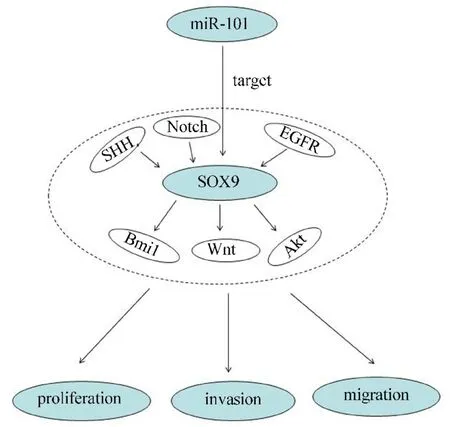
圖5 miR?101通過靶向SOX9抑制膠質瘤細胞的增殖、遷移和侵襲模式圖
[1]Buckner JC,Brown PD,O'Neill BP,et al.Central nervous system tumors[J].Mayo Clin Proc,2007,82(10):1271-1286.
[2]Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classifica?tion of tumours of the central nervous system[J].Aeta Neuro Pathol,2007,114(2):97-109.
[3]Mason WP,Caimcross JG.Drug Insight:temozolomide as a treatment for malignant glioma--impact of a recent trial[J].Nat Clin Pract Neurol,2005,1(2):88-95.
[4]Badiyan SN,Markovina S,Simpson JR,et al.Radiation therapy dose escalation for glioblastoma multiforme in the era of temozolomide[J].Int J Radiat Oncol Biol Phys,2014,90(4):877-885.
[5]Kleber S,Sancho?Martinez I,Wiestler B,et al.Yes and PI3K bind CD95 to signal invasion of glioblastoma[J].Cancer Cell,2008,13(3):235-248.
[6]Ohgaki H,Kleihues P.Population?based studies on incidence,sur?vival rates,and genetic alterations in astrocytic and oligodendroglial gliomas[J].J Neuropathol Exp Neurol,2005,64(6):479-489.
[7]Ohgaki H,Dessen P,Jourde B,et al.Genetic pathways to glioblas?toma:a population?based study[J].Cancer Res,2005,64(19):6892-6899.
[8]Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352(10):987-996.
[9]Singh SK,Clarke ID,Terasaki M,et al.Identification of a cancer stem cell in human brain tumors[J].Cancer Res,2003,63(18):5821-5828.
[10]Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells[J].Nature,2004,432(7015):396-301.
[11]Bao S,Wu Q,McLendon RE,et al.Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J].Nature,2006,444(7120):756-760.
[12]Hong B,Wiese B,Bremer M,et al.Multiple microsurgical resec?tions for repeated recurrence of glioblastoma multiforme[J].Am J Clin Oncol,2013,36(3):261-268.
[13]Bcker KP,Yu J.Status quo?standard?of?care medical and radiation therapy for glioblastoma[J].Cancer J,2012,18(1):12-19.
[14]Yaman E,Coskun U,Ozturk B,et al.Opportunistic cytomegalovirus infection in a patientreceiving temozolomide for treatment of malignant glioma[J].J Clin Neurosci,2009,16(4):591-592.
[15]Corsten MF,Miranda R,Kasmieh R,et al.MicroRNA?21 knockdown disrupts glioma growth in vivo and displays synergistic cytotoxicity with neural precursor cell delivered S?TRAIL in human gliomas[J].Cancer Res,2007,67(19):8994-9100.
[16]Gabriely G,Wurdinger T,Kesari S,et al.MicroRNA 21 promotes glioma invasion by targeting matrix metalloproteinase regulators[J].Mol Cell Biol,2008,28(17):5369-5380.
[17]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and func?tion[J].Cell,2004,116(2):281-297.
[18]Burnet NG,Lynch AG,Jefferies SJ,et al.High grade glioma:ima?ging combined with pathological grade defines management and pre?dicts prognosis[J].Radiother Oncol,2007,85(3):371-378.
[19]Liu X,Fortin K,Mourelatos Z.MicroRNAs:biogenesis and molecular functions[J].Brain Pathol,2008,18(1):113-121.
[20]Tavallaie R,De Almeida SR,Gooding JJ.Toward biosensors for the detection of circulating microRNA as a cancer biomarker:an overview of the challenges and successes[J].Wiley Interdiscip Rev Nanomed Nanobiotechnol,2015,7(4):580-592.
[21]Ohgaki H,Dessen P,Jourde B,et al.Genetic pathways to glioblas?toma:a population?based study[J].Cancer Res,2004,64(19):6892-6899.
[22]Furnari FB,Fenton T,Bachoo RM,et al.Malignant astrocytic glio?ma:genetics,biology,and paths to treatment[J].Genes Dev,2007,12(21):2683-2710.
[23]Han L,Zhang A,Wang H,et al.Tat?BMPs?PAMAM conjugates enhance therapeutic effect of small interference RNA on U251 glioma cells in vitro and in vivo[J].Hum Gene Ther,2010,21(4):417-426.
[24]Tu Y,Gao X,Li G,et al.MicroRNA?218 inhibits glioma invasion,migration,proliferation,and cancer stem?like cell self?renewal by targetingthe polycomb group gene Bmi1[J].Cancer Res,2013,73(19):6046-6055.
[25]Mi YJ,Hou B,Liao QM,et al.Amino?Nogo?A antagonizes reactive oxygen species generation and protects immature primary cortical neu?rons from oxidative toxicity[J].Cell Death Differ,2012,19(7):1175-1186.
[26]Cheng L,Wu Q,Guryanova OA,et al.Elevated invasive potential of glioblastoma stem cells[J].Biochem Biophys Res Commun,2011,406(4):643-648.
[27]Xia H,Yan Y,Hu M,et al.MiR?218 sensitizes glioma cells to apoptosis and inhibits tumorigenicity by regulating ECOP?mediated suppression of NF?kappaB activity[J].Neuro?oncology,2012,15(4):413-422.
[28]Zhang J,Liu J,Liu Y,et al.miR?101 represses lung cancer by inhibiting interaction of fibroblasts and cancer cells by down?regula?ting CXCL12[J].Biomed Pharmacother,2015,74:215-221.
[29]Li JT,Jia LT,Liu NN,et al.MiRNA?101 inhibits breast cancer growth and metastasis by targeting CX chemokine receptor 7[J].Oncotarget,2015,6(31):30818-30830.
[30]Li M,Tian L,Ren H,et al.MicroRNA?101 is a potential prognostic indicator of laryngeal squamous cell carcinoma and modulates CDK8[J].J Transl Med,2015,13:271.
[31]Vella S,Pomella S,Leoncini PP,et al.MicroRNA?101 is repressed by EZH2 and its restoration inhibits tumorigenic features in embryonal rhabdomyosarcoma[J].Clin Epigenetics,2015,7(1):82.
[32]Xiaoping L,Zhibin Y,Wenjuan L,et al.CPEB1,a histone?modi?fied hypomethylated gene,is regulated by miR?101 and involved in cell senescence in glioma[J].Cell Death Dis,2013,4:e675.
[33]Ambros V.microRNAs:tiny regulators with great potential[J].Cell,2001,107(7):823-826.
[34]Nam EJ,Yoon H,Kim SW,et al.MicroRNA expression profiles in serous ovarian carcinoma[J].Clin Cancer Res,2008,14(9):2690-2695.
[35]Zhu D,Chen H,Yang X,et al.Decreased microRNA?224 and its clinical significance in non?small cell lung cancer patients[J].Diagn Patho,2014,9(1):198.
[36]Yang Y,Meng H,Peng Q,et al.Downregulation of microRNA?21 expression restrains non?small cell lung cancer cell proliferation and migration through upregulation of programmed cell death[J].Cancer Gene Ther,2014,22(1):23-29.
[37]Yang N,Ekanem NR,Sakyi CA,et al.Hepatocellular carcinoma and microRNA:New perspectives on therapeutics and diagnostics[J].Adv Drug Deliv Rev,2015,81:62-74.
[38]Chen P,Wang BL,Pan BS,et al.MiR?1297 regulates the growth, migration and invasion of colorectal cancer cells by targeting cyclo?ox?ygenase?2[J].Asian Pac J Cancer Prev,2014,15(21):9185-9190.
[39]Zhou MK,Liu XJ,Zhao ZG,et al.MicroRNA?100 functions as a tumor suppressor by inhibiting Lgr5 expression in colon cancer cells[J].Mol Med Rep,2015,11(4):2947-2952.
[40]Turner JD,Williamson R,Almefty KK,et al.The many roles of microR?NAs in brain tumor biology[J].Neurosurg Focus,2010,28(1):E3.
[41]Yu SL,Chen HY,Chang GC,et al.MicroRNA signature predicts survival and relapse in lung cancer[J].Cancer Cell,2008,13(1):48-57.
[42]Shenouda SK,Alahari SK.MicroRNA function in cancer:oncogene or a tumor suppressor[J].Cancer Metastasis Rev,2009,28(3-4):369-378.
[43]Cho WC.MicroRNAs:potential biomarkers for cancer diagnosis,prognosis and targets for therapy[J].Int J Biochem Cell Biol,2010,42(8):1273-1281.
[44]Liu N,Tu Y.Systematic review of microRNAs and its therapeutic potential in glioma[J].Cancer Transl Med,2015,1(2):50-66.
[45]Zhang P,Pang X,Tu Y.Thioredoxin?interacting protein as a com?mon regulation target for multiple drugs in clinical therapy/applica?tion[J].Cancer Transl Med,2015,1(1):26-30.
[46]Yao YL,Ma J,Wang P,et al.miR?101 acts as a tumor suppressor by targeting krup pel?like factor 6 in glioblastom a stem cells[J].CNS Neurosci Ther,2015,21(1):40-51.
[47]Smits M,Nilsson J,Mir SE,et al.miR?101 is down?regulated in glioblastoma resulting in EZH2?induced proliferation,migration,and angiogenesis[J].Oncotarget,2010,1(8):710-720.
[48]Liu X,Lei Q,Yu Z,et al.MiR?101 reverses the hypomethylation of the LMO3 promoter in glioma cells[J].Oncotarget,2015,6(10):7930-7943.
[49]Zhang Y,Guo X,Xiong L,et al.MicroRNA?101 suppresses SOX9?dependent tumorigenicity and promotes favorable prognosis of human hepatocellular carcinoma[J].FEBS Lett,2012,586(24):4362-4370.
[50]Sekido R,Lovell?Badge R.Sex determination and SRY:down to a wink and a nudge[J].Trends Genet,2009,25(1):19-29.
[51]Larsimont JC,Youssef KK,Sánchez?Danés A,et al.Sox9 Controls Self?Renewal of Oncogene Targeted Cells and Links Tumor Initiation and Invasion[J].Cell Stem Cell,2015,17(1):60-73.
[52]Golding SE,Morgan RN,Adams BR,et al.Pro?survival AKT and ERK signaling from EGFR and mutant EGFRvIII enhances DNA double?strand break repair in human glioma cells[J].Cancer Biol Ther,2009,8(8):730-738.
[53]Wang J,Wakeman TP,Lathia JD,et al.Notch promotes radioresis?tance of glioma stem cells[J].Stem Cells,2010,28(1):17-28.
[54]Scott CE,Wynn SL,Sesay A,et al.SOX9 induces and maintains neural stem cells[J].Nat Neurosci,2010,13(10):1181-1189.
[55]Ikegami D,Akiyama H,Suzuki A,et al.Sox9 sustains chondrocyte survival and hypertrophy in part through Pik3ca?Akt pathways[J].Development,2011,138(8):1507-1519.
[56]Bastide P,Darido C,Pannequin J,et al.Sox9 regulates cell prolifer?ation and is required for Paneth cell differentiation in the intestinal epithelium[J].J Cell Biol,2007,178(4):635-648.
[57]Matheu A,Collado M,Wise C,et al.Oncogenicity of the develop?mental transcription factor Sox9[J].Cancer Res,2012,72(5):1301-1315.
MicroRNA?101 inhibits proliferation,migra?tion and invasion of human glioblastoma by targeting SOX9
LIU Nan1,ZHANG Lei1,6,WANG Zhen1,CHENG Ying?Duan1,2,ZHANG Peng?Xing1,WANG Xin3,WEN Wei?Hong4,YANG Hong?Wei3,LIU Hui1,JIN Wei?Lin5,ZHANG Yong?Sheng1,TU Yan?Yang1,3
1Department of Experimental Surgery,Tangdu Hospital,Fourth Military Medical University,Xi'an 710038,China;2Department of Research Office,Cipher Ground,North Brunswick,NJ 08902,USA;3Department of Neurosurgery, Brigham and Women's Hospital,Harvard Medical School,Boston,MA 02115,USA;4Department of Immunology,Fourth Military Medical University,Xi'an 710032,China;5Institute of Nano Biomedicine and Engi?neering,Department of Instrument Science and Engineering,Key Laboratory for Thin Film and Microfabrication Technology of Ministry of Education,School of Electronic Information and Elec?tronic Engineering, Shanghai Jiao Tong University, Shanghai 200240,China;6Department of Orthopedics,Xi'an Children's Hospital,Xi'an 710003,China
Glioblastoma multiforme(GBM)is the most common primary malignant tumors originating in the brain parenchyma.At present,GBM patients have a poor prognosis despite of the con?tinuous progress in therapeutic technologies including surgery,ra?diotherapy,photodynamic therapy,and chemotherapy.Recent studies revealed that miR?101 was remarkably down?regulated in kinds of human cancers and was associated with aggressive tumor cell proliferation and stem cell self?renewal.Data also showed that miR?101 was down?regulated in primary glioma samples and cell lines,but the underlying molecular mechanism of the deregulation of miR?101 in glioma remained largely unknown.In this study,we found that miR?101 could inhibit the proliferation and invasion of glioma cells both in vitro and in vivo by directly targeting SOX9[sex?determining region Y(SRY)?box 9 protein].Silencing of SOX9 exerted similar effects with miR?101 overexpression on glio?ma cells proliferation and invasion.Quantitative reverse transcrip?tion PCR and Western blotting analysis revealed a negative rela?tionship between miR?101 and SOX9 in human glioma U251MG and U87MG cells,and the luciferase assay indicated that miR?101 altered SOX9 expression by directly targeting on 3'UTR.Taken together,our findings suggest that miR?101 regulates glio?ma proliferation,migration and invasion via directly downregulat?ing SOX9 both in vitro and in vivo,and miR?101 may be a poten?tial therapeutic target for future glioma treatment.
miR?101;SOX9;invasion;migration;proliferation
R739.41
A
2095?6894(2017)07?37?07
2017-04-29;接受日期:2017-05-13
國家自然科學基金(81572983);陜西省社會發展科技攻關項目 (2015SF027);唐 都 醫 院 創 新 發 展 基 金 資 助 項 目(2016JCYJ013)
劉 楠.碩士.研究方向:膠質瘤基因治療.Tel:029?84778169 E?mail:liu_nanabc@126.com
涂艷陽.博士,副教授,副主任醫師.E?mail:tu.fmmu@gmail.com

