熊果酸和粉防己堿對腫瘤相關信號通路的互補抑制及其協同抗腫瘤增殖作用研究
石榮珍 李世發 高建莉
浙江中醫藥大學 杭州 310053
熊果酸和粉防己堿對腫瘤相關信號通路的互補抑制及其協同抗腫瘤增殖作用研究
石榮珍 李世發 高建莉
浙江中醫藥大學 杭州 310053
[目的]通過分析中藥活性成分對腫瘤相關的多條信號通路抑制作用的差異,研究對信號通路抑制作用存在互補現象的兩個化合物熊果酸(ursolic acid,UA)和粉防己堿(tetrandrine,Tet)協同抗腫瘤增殖的作用及其最優配比。[方法]運用多信號通路報告基因技術,研究5個具有抗腫瘤活性的化合物千金藤堿(cepharanthine,Cep)、Tet、18α-甘草酸(18α-glycyrrhetinic acid,18α-Gly)、UA、木犀草素(luteolin,Lut)對腫瘤相關的MAPK/ ERK、MAPK/JNK、NF-κB、Wnt、Notch、Cell Cycle、Myc/Max以及Hypoxia信號通路活化程度的影響;采用MTT法和結晶紫法研究由Cep、Tet、18α-Gly、UA、Lut組成的15個不同化合物組合對人腫瘤細胞MDA-MB-231、SW480、MG63、PC3、DU145、HCT116、143B、MDA-MB-468的抗增殖作用;運用兩藥相互作用指數(coefficient of drug interaction,CDI)法篩選存在協同增效作用的化合物組合;采用等效線法和合用指數(combination index,CI)法篩選該組合協同抗腫瘤細胞增殖的最優配比。[結果]信號通路報告基因實驗發現化合物組合UA+Tet對與腫瘤相關的8條信號通路活化的抑制作用存在互補,提示UA和Tet之間可能具有協同抗腫瘤細胞增殖作用。CDI法驗證后發現UA和Tet具有協同抗腫瘤細胞增殖作用。等效線法、CI法分析得出UA與Tet最佳濃度比為9:1。[結論]UA、Tet對8條腫瘤相關信號通路具有抑制互補作用,用MTT、結晶紫等不同方法證實二者協同抗增殖作用,并篩選出UA和Tet的最優配比,這為研發抗癌復方提供了新的思路。
協同作用;信號通路互補;UA;Tet;抗腫瘤;藥物組合;報告基因;最佳配比
多種藥物聯合作用是腫瘤治療的常見方法,可以增加藥物療效,降低藥物劑量,減少藥物毒性,并且可以盡可能防止耐藥性的產生[1-3]。研究表明,腫瘤的發生發展與相關信號通路的激活密切相關,MAPK/ ERK、MAPK/JNK、NF-κB、Wnt、Notch、Cell Cycle、Myc/ Max以及Hypoxia等信號通路均與腫瘤的發生發展密切相關[4-10]。有研究表明千金藤堿(cepharanthine,Cep)、粉防己堿(tetrandrine,Tet)、18α-甘草酸(18αglycyrrhetinic acid,18α-Gly)、熊果酸(ursolic acid,UA)、木犀草素(luteolin,Lut)均具有較強的抗腫瘤作用[10-17]。本研究擬采用報告基因檢測上述化合物對與腫瘤相關的8條信號通路活化的影響,并采用MTT法、結晶紫法結合等效線法、合用指數(combination index,CI)法、兩藥相互作用指數(coefficient of drug interaction,CDI)法分析和驗證對信號通路作用互補的化合物是否在抗腫瘤增殖中存在協同增效作用。
1 材料與方法
1.1 主要藥物、試劑及儀器 UA、Tet、Cep、18α-Gly、Lut均購自Sigma公司。DMEM培養基、胰蛋白酶(批號:2016030801,杭州吉諾生物醫藥技術有限公司);胎牛血清(FBS,批號:A66E00F,Gemini,美國);0.4%臺盼藍溶液(批號:20120906,Solarhio);噻唑藍(MTT,批號:MKBJ2415V,Sigma,美國);二甲基亞砜(DMSO,批號:SHBC2572V,Sigma,美國);結晶紫(批號:20090117,中國上海標本模型廠);乙酸(批號:20120920,杭州化學試劑有限公司);BioLuxRGaussia Luciferase Assay Kit(批號:0441111,New England Biolabs,美國)。培養板、培養皿(BD Falcon);超凈工作臺(型號:BJ-2CD,上海博迅實業有限公司,中國);熒光倒置顯微鏡(Olympus,型號:IX71型,日本);二氧化碳培養箱(Thermo Scientific,型號:Series 8000,美國);酶標儀(BioTek公司,型號:PowerWave HT340,美國);單管型多功能檢測儀(Promegal公司,型號:E6080,美國)。實驗采用的質粒pAmpho等由美國芝加哥大學何通川教授惠贈。
1.2 細胞株與細胞培養 人骨肉瘤細胞143B和MG63,人前列腺癌細胞DU145和PC3,人乳腺癌細胞MDA-MB-231和MDA-MB-468,人結腸癌細胞HCT116和SW480,人腎上皮細胞HEK293,小鼠乳腺癌細胞4T1細胞株均由ATCC(Manassas,VA)提供。上述細胞用DMEM完全培養基(含10%胎牛血清、青霉素1× 105U·L-1、鏈霉素100mg·L-1),在37°C、飽和濕度及5%CO2的細胞培養箱內培養,待細胞融合至85%時,用0.25%胰蛋白酶(含EDTA)消化,按1:4傳代,取對數生長期細胞用于實驗。整個實驗過程中用臺盼藍染色檢測細胞活性。
1.3 MTT法檢測不同化合物的細胞毒性作用 取對數生長期的MDA-MB-231、SW480、MG63、PC3、DU145、HCT116、143B、MDA-MB-468細胞,按細胞數1×104/ 100μL接種于96孔板內,培養24h之后,加入濃度分別為100μmol·L-1、50μmol·L-1、25μmol·L-1、12.5μmol· L-1、6.25μmol·L-1、3.125μmol·L-1、1.5625μmol·L-1的化合物進行處理,終體積為200μL/孔,同時設置對照組和空白組,每組3個復孔。培養48h后,每孔加入(5g· L-1)20μL MTT工作液,繼續培養4h,棄去孔內培養液,加入DMSO150μL,搖床震蕩10min,待沉淀物完全溶解后,用酶聯免疫檢測儀在波長570nm處讀取吸光度值,按公式計算細胞存活率。細胞存活率(%)=(給藥組OD值-空白組OD值)/(對照組OD值-空白組OD值)×100%。采用 SPSS19.0 probite法計算藥物半數致死率(IC50)。
1.4 多信號通路報告基因穩定細胞株的構建 為研究與腫瘤發生發展密切相關的8條不同的信號通路,分別構建了針對不同信號通路響應的報告基因質粒。具體步驟詳見課題組前期研究[13]。將攜帶不同信號通路的報告基因質粒的載體,與pAmpho質粒一起轉染至HEK293細胞內,36h后收集細胞培養液中相應的逆轉錄病毒,用其感染靶細胞HCT116。經過抗藥性篩選和克隆化培養,可以檢測出癌細胞熒光素酶的表達情況。若干代培養后,即成功構建了穩定的細胞株模型。
1.5 不同化合物對信號通路活化程度的研究 采用已構建的插入報告基因質粒的穩定細胞株,按細胞數2×104/孔接種于96孔板。根據前期研究及文獻資料[13]設濃度分別為1μmol·L-1、5μmol·L-1、10μmol·L-1的UA、Cep、18α-Gly組,濃度分別為 5μmol·L-1、25 μmol·L-1、50μmol·L-1的Tet、Lut組,以及溶劑對照,每孔終體積為200μL,每組設3復孔。培養2h后,每孔取50μL上清液用于熒光素酶活性的檢測。信號通路相對活化程度=給藥組熒光信號強度/對照組熒光信號強度×100%。熒光素濃度采用BioLuxRGaussia Luciferase Assay Kit檢測,具體步驟可見課題組前期研究[13]。
1.6 結晶紫法評價不同化合物配伍對細胞的抗增殖作用 根據1.3項實驗所得不同化合物的IC50,設計不同化合物配比試驗。課題組設計15個不同的藥物組合,分別為:(1)Cep單獨用藥組,(2)Cep:Tet=1:1組,(3)Cep:18α-Gly=1:1組,(4)Cep:UA=1:3組,(5)Cep: Lut=1:5組,(6)Tet單獨用藥組,(7)Tet:18α-Gly=1:1組,(8)Tet:UA=1:3組,(9)Tet:Lut=1:5組,(10)18α-Gly單獨用藥組,(11)18α-Gly:UA=1:2組,(12)18α-Gly:Lut=1:5組,(13)UA單獨用藥組,(14)UA:Lut=1: 2.5組,(15)Lut單獨用藥組。取對數生長期的143B細胞,5×104/孔接種于24孔培養板,培養24h。設溶劑對照組、空白組、不同濃度組,每組設3個復孔。給藥后培養48h,棄去培養液,每孔加入300μL 0.2%結晶紫染液,室溫染色30min后洗去染料,用20%的醋酸溶液溶解結晶,搖床振搖10min后,酶聯免疫檢測儀540nm波長下測各孔吸光度。按1.3所述公式計算細胞抑制率。
1.7 CI法、等效線法、CDI法篩選最佳組合和最優配比 設置空白對照組 (僅含等體積0.1%DMSO的培養液)、溶劑對照組(細胞+含等體積0.1%DMSO的培養液)、UA+Tet不同配比給藥組。根據本課題組預試驗結果,UA、Tet對小鼠4T1細胞的IC50值分別為42.93 μmol·L-1、22.93μmol·L-1。據此設計5個UA與Tet的不同配比組別,兩者比例分別為UA:Tet=9:1、3:1、1:1、1:3和1:9。每個組合中,UA和Tet在細胞培養液中對應的濃度分別為:UA90μmol·L-1、75μmol·L-1、50μmol·L-1、25μmol·L-1、10μmol·L-1;Tet 10μmol·L-1、25 μmol·L-1、50μmol·L-1、75μmol·L-1、90μmol·L-1。
1.7.1 CI法 根據公式計算CI,CI=D1/DX1+D2/DX2+ α(D1D2/DX1DX2)[18]。D1、D2為聯合用藥達到X效應時藥物1、藥物2的濃度,DX1、DX2為單獨用藥達到X效應時藥物1和藥物2的濃度,藥物作用機制不同時α=0。CI<1表示協同,CI=1表示相加,CI>1表示拮抗。信號通路研究表明UA、Tet為作用機制不同的藥物,故此處α=0。
1.7.2 等效線法 等效線法是用來確定藥物之間相互作用的另一種數學方法[19]。細胞協同作用的結果顯示為相加等效線。采用藥物單用和聯用時的IC50分別構建三條曲線:ModeⅠ,ModeⅡa,ModeⅡb,并在圖中標明不同組合作用時的數據點。ModeⅡa及ModeⅡb曲線之間為加和囊,數據點在加和囊中,表明藥物作用為相加,數據點在加和囊上側,表明藥物作用為拮抗,數據點在加和囊下側,表明藥物作用為增效[3]。
1.7.3 CDI法 根據公式計算CDI:CDI=AB/(A×B)[20]。AB為兩藥聯用時的細胞增殖率,A或B是各個藥物單用時的細胞增殖率。CDI<1時增效,CDI>1為拮抗,CDI<0.7時,藥物之間的作用為顯著增效。
1.8 統計學方法 采用統計分析軟件SPSS19.0進行統計學處理。連續型變量用均數±標準差 (means± SD)表示,分別采用單因素方差分析(one-way ANOVA)、兩兩比較的Student's t-test分析實驗結果,P<0.05為差異有統計學意義。
2 結果
2.1 候選化合物對8種人源腫瘤細胞增殖的影響MTT結果分析顯示,5個候選化合物能體外抑制多種人源腫瘤的生長,IC50結果見表1。
2.2 候選化合物對8條腫瘤相關信號通路活化的影響 對于Cep、UA、Tet、Lut、18α-Gly等5個化合物進行報告基因實驗,根據IC50確定給藥濃度。Cep、UA、18α-Gly最高濃度為10μmol·L-1,Lut、Tet最高濃度為50μmol·L-1。各個化合物最高濃度時信號通路激活程度的結果(表2),發現Cep對Notch、NF-κB、MAPK/ JNK、MAPK/ERK通路抑制率達50%以上;18α-Gly對Notch、Cell cycle通路有促進作用;UA對Cell cycle、Wnt、NF-κB、Hypoxia、MAPK/ERK通路抑制率達50%以上;Lut對Wnt、Hypoxia、MAPK/JNK、MAPK/ERK通路抑制率達50%以上;Tet對Notch、MAPK/JNK、Myc/ Max通路抑制率達50%以上。其中UA對Cell cycle、Wnt、NF-κB、Hypoxia、MAPK/ERK通路,Tet對Notch、 MAPK/JNK、Myc/Max通路抑制作用顯著,體現出對所有8條腫瘤相關的信號通路抑制作用的互補。
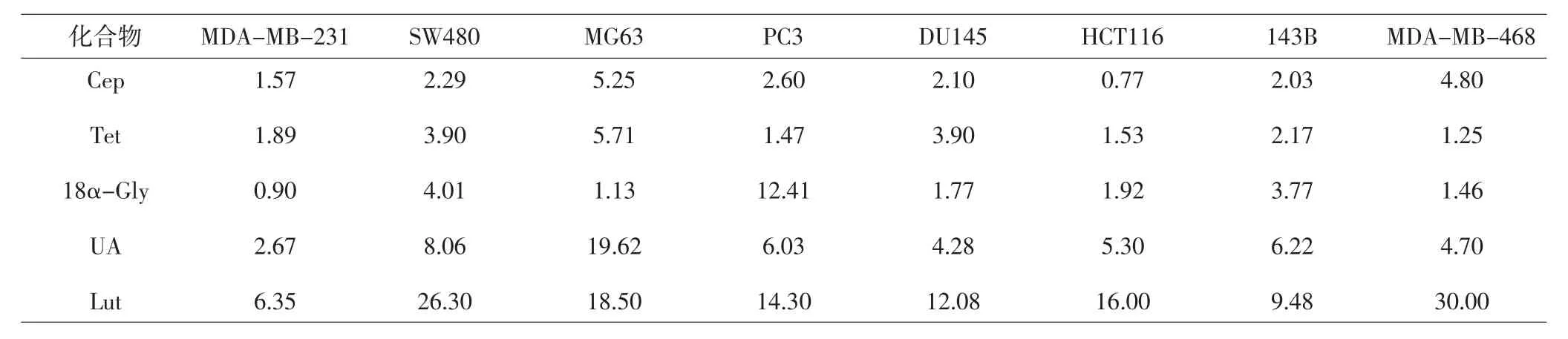
表1 5種候選化合物對8種人源腫瘤細胞的細胞毒性作用(IC50,μmol·L-1)Tab.1 Cytotoxic effects of 5 compounds in 8 human tumor cell lines(IC50,μmol·L-1)
2.3 CDI法驗證UA和Tet的協同作用 采用CDI法檢測1.6項下的15個化合物組合(UA、Tet、Cep、Lut、18α-Gly單獨或聯用)對143B的增殖抑制作用。發現15個組合CDI值在0.9±0.12到3.7±1.50之間。其中,Tet:UA為1:3時,CDI值<1,說明UA+Tet有協同抗腫瘤作用。其余各組CDI值均>1,說明存在拮抗作用。
2.4 UA和Tet最佳協同比例的篩選
表2 5種化合物對信號通路的激活程度(±S,%)Tab.2 The activation of signaling pathways for 5 compounds(±S,%)
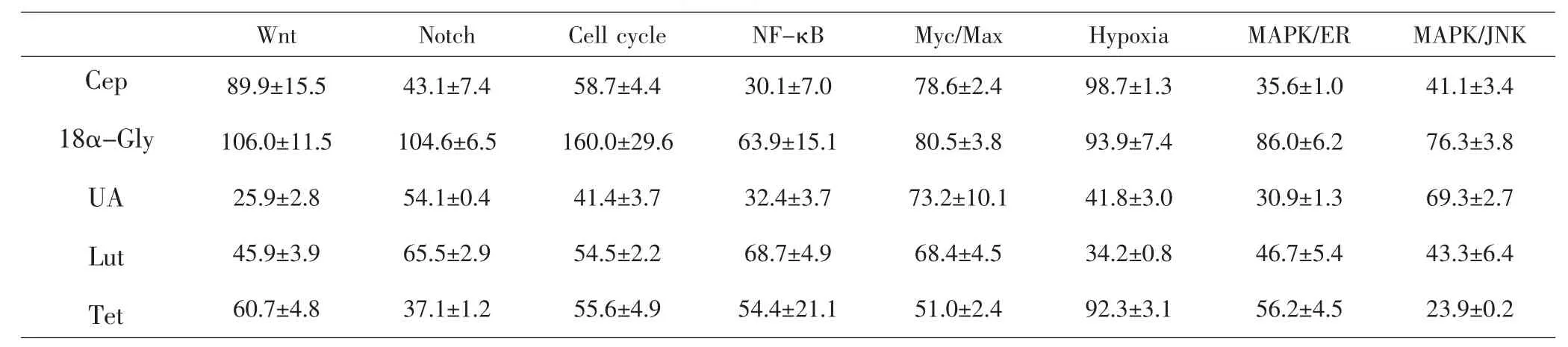
表2 5種化合物對信號通路的激活程度(±S,%)Tab.2 The activation of signaling pathways for 5 compounds(±S,%)
Wnt Notch Cell cycle NF-κB Myc/Max Hypoxia MAPK/ER MAPK/JNK Cep 18α-Gly UA Lut Tet 89.9±15.5 106.0±11.5 25.9±2.8 45.9±3.9 60.7±4.8 43.1±7.4 104.6±6.5 54.1±0.4 65.5±2.9 37.1±1.2 58.7±4.4 160.0±29.6 41.4±3.7 54.5±2.2 55.6±4.9 30.1±7.0 63.9±15.1 32.4±3.7 68.7±4.9 54.4±21.1 78.6±2.4 80.5±3.8 73.2±10.1 68.4±4.5 51.0±2.4 98.7±1.3 93.9±7.4 41.8±3.0 34.2±0.8 92.3±3.1 35.6±1.0 86.0±6.2 30.9±1.3 46.7±5.4 56.2±4.5 41.1±3.4 76.3±3.8 69.3±2.7 43.3±6.4 23.9±0.2
2.4.1 CI法 檢測UA:Tet=9:1、3:1、1:1、1:3、1:9時的CI值,結果表明,當UA:Tet=9:1時CI=0.36,增效作用最強。UA和Tet各比例聯合應用時的CI值見表3。
2.4.2 等效線法 采用經典isbologram法評價UA和Tet間的相互作用,結果顯示UA及Tet不同比例聯用數據點位于ModeⅠ下區域內,提示都具有較強的協同增效性。如圖1所示,UA:Tet=9:1時的數據點距離加和囊最遠,結合CI值分析表明UA:Tet=9:1聯用時具有最強的協同效應。
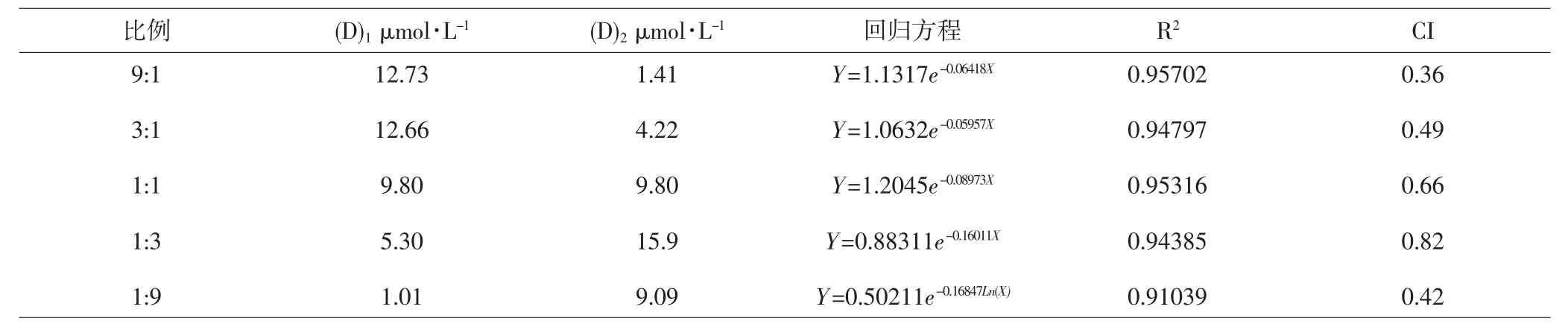
表3 UA和Tet不同比例聯用時的CI值Tab.3 CI values of different proportions for UA and Tet
3 討論
在腫瘤的發生發展中,Wnt、MAPK/JNK、MAPK/ ERK等不同的信號通路發揮了關鍵的作用。其中MAPK/ ERK、MAPK/JNK、Wnt、Notch、Cell Cycle、Myc/Max、NF-κB以及Hypoxia等8條信號通路與腫瘤關系密切,在不同腫瘤(如乳腺癌、結腸癌、卵巢癌和前列腺癌等)中發揮重要作用[4-10]。新藥的研究多針對單靶點和單通路,然而機體往往能調控信號通路之間的“此消彼長”,導致單靶點和單通路的作用在體內常常達不到預期,較易發生耐藥反應。基于上述認識,根據信號通路之間的互補作用設計抗腫瘤藥物的聯合應用方案,可能更有助于快速準確的篩選化療方案。
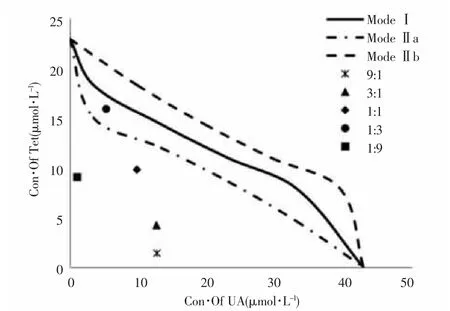
圖1 等效線法評價UA和Tet間的相互作用Fig.1 Evaluating the drug interaction between UA and Tet by isobologram method
本研究發現UA和Tet對8條腫瘤相關的信號通路的抑制有互補作用。課題組用多種方法進一步分析了這兩個藥物單獨和聯合應用時的抗腫瘤細胞增殖作用,研究發現與其它藥物組合相比,UA和Tet兩者協同作用時細胞的增殖率最低。UA屬三萜類化合物,近年來研究表明UA不僅對多種致癌、促癌物有抵抗作用,如鼻咽癌,胃癌,食管癌,肝癌,宮頸癌,肺癌,乳腺癌等[10,21-23]。課題組前期研究表明,UA能通過抑制乳腺癌缺氧及缺氧誘導的髓外造血延緩乳腺癌的肺轉移[10]。亦有研究表明UA可通過Wnt通路調控前列腺癌細胞的凋亡[24],與NF-κB信號通路密切相關[25];UA可抑制神經膠質瘤血管內皮細胞的產生,與MAPK/ERK、Myc/Max等信號通路表達相關[26]。Tet是從防己科植物的干燥塊根中提取的一種雙芐基異喹啉類生物堿。有研究結果表明Tet對乳腺癌,肝癌,胃癌,膀胱癌,結腸癌等具有明顯抑制作用[7,12,27-32]。本課題組之前的研究表明Tet可以通過Wnt信號傳導并抑制人結腸、直腸癌的腫瘤生長。也有研究表明Tet可以通過Notch信號通路抑制白血病細胞的凋亡[33],可以通過NF-κB、MAPK/JNK、MAPK/ERK等信號通路激活肝臟星狀細胞[34]。以上眾多相關報道結合本研究的結果表明UA對MAPK/ERK、Wnt、Cell Cycle、NF-κB以及Hypoxia通路有較強抑制作用,而Tet對MAPK/JNK、Notch以及Cell Cycle通路有較強抑制作用,兩者對與腫瘤相關的信號通路群具有互補抑制作用。
根據以上結果,課題組推測UA及Tet聯合應用時,對于腫瘤相關的信號通路可以發揮更全面的抑制作用,由此推測它們可能存在協同抗腫瘤作用。本研究進一步采用了CI法、等效線法、CDI法來分析化合物之間是否可能存在協同抗腫瘤作用并篩選其最優配比。結果顯示:UA和Tet協同作用可以在多個腫瘤細胞上發揮協同抗腫瘤細胞增殖的作用,且在UA: Tet=9:1時,具有最強的協同增效作用。本文通過對比較全面的信號通路活化作用進行分析,可以預測不同化合物之間的協同抗腫瘤作用。這種方法可以為抗腫瘤藥物組合的篩選和臨床化療方案的研究帶來很好的啟示,更好地指導臨床抗腫瘤用藥。
References:
[1]Xu H,Yu J,Sun Y,et al.Scutellaria barbata,D.Don extract synergizes the antitumor effects of low dose 5-fluorouracil through induction of apoptosis and metabolism [J].Phytomedicine International Journal of Phytotherapy &Phytopharmacology,2013,20(10):897-903.
[2]Baxevanis C N,Perez S A,Papamichail M.Combinatorial treatments including vaccines,chemotherapy and monoclonal antibodies for cancer therapy[J].Cancer Immunology,Immunotherapy,2009,58(3):317-324.
[3]Gao J L,He T C,Li Y B,et al.A traditional Chinese medicine formulation consisting of Rhizoma Corydalis and Rhizoma Curcumae exerts synergistic anti-tumor activity [J].Oncology Reports,2009,22(5):1077-1083.
[4]劉兆國,朱智杰,周梁,等.Notch信號通路與腫瘤研究[J].中國藥理學通報,2012,28(8):1045-1048. LIU Zhaoguo,ZHU Zhijie,ZHOU Liang,et al.On Notch signaling pathway and tumor[J].Chinese Pharmacological Bulletin,2012,28(8):1045-1048.
[5]郭建霞,張小云,趙春林,等.Wnt/β-catenin信號通路相關因子與結腸癌患者預后的相關性研究[J].河北醫藥,2016, 38(3):371-373. GUO Jianxia,ZHANG Xiaoyun,ZHAO Chunlin,et al. Correlation between Wnt/β-catenin signaling pathway and prognosis in patients with colon cancer[J].Hebei Medical Journal,2016,38(3):371-373.
[6]Bao R F,Shu Y J,Hu Y P,et al.miR-101 targeting ZFX suppressestumorproliferation and metastasisby regulating the MAPK/Erk and Smad pathways in gallbladder carcinoma[J].Oncotarget,2016,7(16):22339-22354. [7]He B C,Gao J L,Zhang B Q,et al.Tetrandrine inhibits Wnt/β-catenin signaling and suppresses tumor growth of human colorectal cancer[J].Molecular Pharmacology,2011,79(2):211-219.
[8]Olive P G.Neferine induces autophagy of human ovarian cancer cells via p38 MAPK/JNK activation[J].Tumor Biology,2016,37(7):8721-8729.
[9]Faria M,Matos P,Pereira T,et al.RAC1b overexpression stimulates proliferation and NF-κBmediated antiapoptotic signaling in thyroid cancer cells[J].Plos One,2017, 12(2):e0172689.
[10]Gao J L,Shui Y M,Jiang W,et al.Hypoxia pathway and hypoxia-mediated extensive extramedullary hematopoiesis are involved in ursolic acid's anti-metastatic effect in 4T1 tumor bearing mice[J].Oncotarget,2016,7(44): 71802-71816.
[11]Zhao Y,Gao J L,Ji J W,et al.Cytotoxicity enhancement in MDA-MB-231 cells by the combination treatment of tetrahydropalmatine and berberine derived from Corydalis yanhusuo W.T.Wang[J].Journal of Intercultural Ethnopharmacology,2014,3(2):68-72.
[12]Gao J L,Ji X,He T C,et al.Tetrandrine Suppresses Cancer Angiogenesis and Metastasis in 4T1 Tumor Bearing Mice[J].Evid Based Complement Alternat Med,2013, 2013:265061.
[13]高建莉,何通川,呂圭源.千金藤素對人結腸癌細胞HCT116裸鼠異體移植腫瘤模型腫瘤增殖的影響及機制初探[J].浙江中醫藥大學學報,2013,37(9):1055-1059. GAO Jianli,HE Tongchun,LV Guiyuan,et al.BioluminescentMonitoringthe Influence ofCepharanthine on Colon Cancer Growth in Mouse Xenograft Tumor Model [J].Journal of Zhejiang Chinese Medical University,2013, 37(9):1055-1059.
[14]De Angel R E,Smith S M,Glickman R D,et al.Antitumor effects of ursolic acid in a mouse model of postmenopausal breast cancer[J].Nutrition&Cancer,2010,62(8): 1074-1086.
[15]Lee E J,Oh S Y,Sung M K.Luteolin exerts anti-tumor activity through the suppression of epidermal growth factor receptor-mediated pathway in MDA-MB-231 ER-negative breast cancer cells[J].Food&Chemical Toxicology An International Journal Published for the British IndustrialBiologicalResearch Association,2012,50(11): 4136-4143.
[16]Pratheeshkumar P,Son Y O,Budhraja A,et al.Luteolin Inhibits Human Prostate Tumor Growth by Suppressing Vascular Endothelial Growth Factor Receptor 2-Mediated Angiogenesis[J].Plos One,2012,7(12):e52279.
[17]Lallemand B,Gelbcke M,Dubois J,et al.Structure-activity relationship analyses of glycyrrhetinic acid derivatives as anticancer agents[J].Mini Reviews in Medicinal Chemistry,2011,11(10):881-887.
[18]Wilmes A,Bargh K,Kelly C,et al.Peloruside A Synergizes with Other Microtubule Stabilizing Agents in Cultured Cancer Cell Lines[J].Molecular Pharmaceutics,2007, 4(2):269-280.
[19]Tallarida R J.An overview of drug combination analysis with isobolograms[J].Journal of Pharmacology&Experimental Therapeutics,2006,319(1):1-7.
[20]Tong W,Cui H,Nan M A,et al.Nicotinamide-mediated inhibition of SIRT1 deacetylase is associated with the viability of cancer cells exposed to antitumor agents and apoptosis[J].Oncology Letters,2013,6(2):600-604.
[21]徐新偉,郭玲玲,顧振綸,等.熊果酸對乳腺癌SK-BR-3細胞增殖和凋亡的影響[J].蘇州大學學報,2009,29(1):68-70. XU Xinwei,GUO Lingling,GU Zhenlun,et al.Effects of Ursolic Acid on Proliferation and Apoptosis of SK-BR-3 Cells[J].Journal of Suzhou University,2009,29(1):68-70. [22]Shyu M H,Kao T C,Yen G C.Oleanolic acid and ursolic acid induce apoptosis in HuH7 human hepatocellular carcinoma cells through a mitochondrial-dependent pathway and downregulation of XIAP[J].Journal of Agricultural&Food Chemistry,2010,58(10):6110-6118.
[23]唐丹,李劍萍,鄭錫鳳,等.熊果酸通過STAT3通路調控胃癌細胞增殖和凋亡[J].中國藥理學通報,2012,28(2):179-184. TANG Dan,LI Jianping,ZHENG Xifeng,et al.Regulatory effect of ursolic acid on proliferation and apoptosis of gastric cancer cells via STAT3 signaling pathway[J]. Chinese Pharmacological Bulletin,2012,28(2):179-184.
[24]Park J H,Kwon H Y,Sohn E J,et al.Inhibition of Wnt/β-catenin signaling mediates ursolic acid-induced apoptosis in PC-3 prostate cancer cells[J].Pharmacological Reports Pr,2013,65(5):1366-1374.
[25]Checker R,Sandur S K,Sharma D,et al.Potent antiinflammatory activity of ursolic acid,a triterpenoid antioxidant,is mediated through suppression of NF-κB,AP-1 and NF-AT[J].Plos One,2012,7(2):e31318.
[26]Ye L Q,Ye X F,Xu H.Mechanism of Ursolic Acid-Mediated Inhibition of Proliferation in Vascular Endothelial Glioaytoma[J].Tropical Journal of Pharmaceutical Research,2013,12(4):511-515.
[27]Xu W,Debeb B G,Lacerda L,et al.Tetrandrine,a Compound Common in Chinese TraditionalMedicine, Preferentially Kills Breast Cancer Tumor Initiating Cells (TICs)In Vitro[J].Cancers,2011,3(2):2274-2285.
[28]Qin R,Shen H,Cao Y,et al.Tetrandrine induces mitochondria-mediated apoptosis in human gastric cancer BGC-823 cells[J].Plos One,2013,8(10):e76486.
[29]Liu W,Zhang J,Ying C,et al.Tetrandrine Combined with Gemcitabine and Cisplatin for Patients with Advanced Non-Small Cell Lung Cancer Improve Efficacy[J]. International Journal of Biomedical Science Ijbs,2012,8 (1):28-35.
[30]胡釗,李永生,趙誠.粉防己堿聯合阿霉素對人膀胱癌BIU-87/ADM細胞裸鼠移植瘤抑瘤率影響的研究[J].現代泌尿生殖腫瘤雜志,2013,5(1):41-44. HU Zhao,LI Yongsheng,ZHAO Cheng.The study on human bladder cancer cell BIU-87/ADM nude mice xenografts inhibition rate effect by tetrandrine and adriamycin[J]. Journal of Contemporary Urologic&Reproductive Oncology,2013,5(1):41-44.
[31]李桃花,裴曉華.粉防己堿對人乳腺癌細胞MDA-MB-435S的作用[J].世界中西醫結合雜志,2015,10(7):934-936. LI Taohua,PEI Xiaohua.Effects of tetrandrine on human breast cancer cell line MDA-MB-435S[J].World Journal of Integrated Traditional and Western Medicine,2015,10 (7):934-936.
[32]Yu V W,Ho W S.Tetrandrine inhibits hepatocellular carcinoma cell growth through the caspase pathway and G2/M phase[J].Oncology Reports,2013,29(6):2205-2210.
[33]Liu T,Men Q,Wu G,et al.Tetrandrine induces autophagy and differentiation by activating ROS and Notch1 signaling in leukemia cells[J].Oncotarget,2015,6(10):7992-8006.
[34]Li X,Jin Q,Wu Y L,et al.Tetrandrine regulates hepatic stellate cell activation via TAK1 and NF-κB signaling [J].International Immunopharmacology,2016,36:263-270.
The Complement Inhibition of Ursolic Acid and Tetrandrine on Tumor Related Signaling Pathways and Their Synergistic Antitumor Proliferation Effects
SHI Rongzhen,LI Shifa,GAO Jianli Basic Medical College,Zhejiang Chinese Medical University,Hangzhou(310053),China
[Objective]This study was aimed to research the synergistic antitumor proliferation effects and their best proportion of ursolic acid(UA)and tetrandrine(Tet),a pair of compounds isolated from Chinese herbs which showed complement inhibition on the multiple signal pathways.[Methods]The reporter assays on tumor-related signal pathways for MAPK/ERK,MAPK/JNK,NF-κB,Wnt,Notch,Cell Cycle,Myc/Max and Hypoxia were used to study the effect of five different Chinese herbal compounds on tumor proliferation,it was concluded cepharanthine(Cep),Tet,18α-glycyrrhetinic acid(18α-Gly),UA and luteolin(Lut).MTT assay and crystal violet staining were used to study the antiproliferative effect of 15 different compounds for the tumor cells of MDAMB-231,SW480,MG63,PC3,DU145,HCT116,143B and MDA-MB-468,which is consisted with Cep,Tet,18α-Gly,UA and Lut for the 15 different compounds.Coefficient of drug interaction(CDI)method was used to detect the synergistic effect of the two compounds.Combination of index(CI)and isobologram method was used to screen the best ratio of compounds in their antiproliferative effects.[Results]The signal pathway reporter assay showed that UA and Tet could complementarily inhibit tumor-related signaling pathways.And the results also showed that UA and Tet could induce synergetic antitumor cell proliferation in vitro.Furthermore,the optimal ratio of UA and Tet was 9:1 by using isobologram and CI method.[Conclusion]UA and Tet can be inhibited and complemented by 8 tumor-related signaling pathways,and we used MTT assay and crystal violet staining or other methods to confirm the synergistic antitumor proliferation effects,furthermore,the optimal proportion for UA and Tet were screened,and it provided a new insight to develop new anticancer formula in research.
drug synergism;complement of signaling pathways;UA;Tet;ant-tumor;drug combination;reporter genes;optimal proportion
R331
A
1005-5509(2017)08-0652-06
10.16466/j.issn1005-5509.2017.08.003
2017-03-31)
國家自然科學基金面上項目(81473575);浙江省科學技術協會“育才工程”項目(2016YCGC002);浙江省科技計劃項目(2016C33085) Fund projects:National Natural Science Foundation of China(81473575);Young Talent Cultivation Project of Zhejiang Association for Science and Technology(2016YCGC002);Science and Technology Project of Zhejiang Province(2016C33085)
高建莉,E-mail:jianli-gao@qq.com

