不同減菌方式對灘羊肉制品貨架期的影響
牛佳+陳輝+羅瑞明


摘 要:以白切羊肉、涼手抓羊肉、椒鹽羊肝、醬羊肉和醬羊頭肉5 種寧夏特色灘羊肉制品為研究對象,經切割、分塊、煮制等過程得到羊肉系列制品,用保鮮盒包裝。實驗組的切割、包裝間采用無菌處理,包括紫外照射和空氣過濾裝置,并采用紫外照射對羊肉制品的加工包裝過程進行層層減菌處理;對照組1、2分別在正常環境下加工后進行微波殺菌和高壓滅菌,包裝好后置于0~5 ℃貯藏。在貯藏第0、7、14、21、28、35天時檢測各組樣品的菌落總數、pH值、總揮發性鹽基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸反應物(thiobarbituric acid reactive substance,TBARs)值及水分分布的變化。結果表明:在貯藏過程中,減菌處理的羊肉制品的各項理化指標均優于微波殺菌和高壓滅菌,說明采用柵欄技術的減菌處理方法是適用于低溫羊肉制品的最佳殺菌方式。經減菌處理的白切羊肉和涼手抓羊肉的貨架期為30 d,椒鹽羊肝的貨架期為28 d,醬羊肉和醬羊頭肉的貨架期為35 d。
關鍵詞:灘羊肉;柵欄技術;貨架期;菌落總數;總揮發性鹽基氮
Effect of Different Sterilization Methods on the Shelf Life of Mutton Products from Tan Sheep
NIU Jia, CHEN Hui, LUO Ruiming*
(College of Agriculture, Ningxia University, Yinchuan 750021, China)
Abstract: Boiled mutton, hand-grasped mutton, mutton liver with spiced salt, sauced mutton and sauced sheep head meat were made by segmentation, cutting and cooking and then stored in sealed polypropylene boxes. The experiment included two groups: the experimental group was subjected to aseptic segmentation and cutting through UV light exposure and by using an air filtration system, and sterilized by UV light to reduce bacterial populations during processing and packaging, while the control groups 1 and 2 were processed in normal environment and sterilized by microwave irradiation and autoclaving, respectively, and both were stored at 0–5 ℃ after packaging. After 0, 7, 14, 21, 28 and 35 days of storage, the total colony number, pH value, total volatile basic nitrogen (TVB-N) content, thiobarbituric acid reactive substance (TBARs) content and water distribution were measured on all samples. The physicochemical properties of the experimental group were better than those of the control groups. Thus, this study illustrated that sterilization using hurdle technology was the most suitable for low-temperature mutton products. The shelf life of boiled mutton and hand-grasped mutton in the experimental group was 30 days, that of mutton liver with spiced salt was 28 days, and that of sauced mutton and sauced sheep head meat was 35 days.
Key words: Tan sheep; hurdle technology; shelf life; total colony number; total volatile basic nitrogen (TVB-N)
DOI:10.7506/rlyj1001-8123-201707007
中圖分類號:TS251.1 文獻標志碼:A 文章編號:1001-8123(2017)07-0034-10
引文格式:
牛佳, 陳輝, 羅瑞明. 不同減菌方式對灘羊肉制品貨架期的影響[J]. 肉類研究, 2017, 31(7): 34-43. DOI:10.7506/rlyj1001-8123-201707007. http://www.rlyj.pub
NIU Jia, CHEN Hui, LUO Ruiming. Effect of different sterilization methods on the shelf life of mutton products from Tan sheep[J]. Meat Research, 2017, 31(7): 34-43. DOI:10.7506/rlyj1001-8123-201707007. http://www.rlyj.pubendprint
寧夏鹽池灘羊肉味道鮮美,最主要的原因是本地灘羊常吃野草,而這些野草中摻雜著許多種中草藥,最具代表性的有黃芪、苦豆子、甘草、苜蓿和鹽蒿等29 種,因此灘羊羊肉肉質細嫩、口感滑爽、不干不柴、脂肪分布均勻,吃起來不腥、不膻[1]。灘羊肉是一種高蛋白、低脂肪食品,含有大量維生素,且鈣、磷、鐵含量高于其他肉類,膽固醇含量低,能有效防止神經系統老化,具有促消化、明目、解毒、滋補等功效,是傳統的養生佳品。但鹽池灘羊肉目前主要以生鮮肉為主,市場上加工好的、開口即食的灘羊肉制品種類很少,其主要原因是傳統灘羊肉制品主要以堂食為主,貨架期較短。
肉類制品貨架期的長短主要與3 個因素有關,即微生物生長、脂肪氧化酸敗和肌紅蛋白變性。而低溫肉制品貨架期較短的主要原因是低溫肉制品熱加工溫度較低,不能殺滅所有微生物,且產品本身的水分活度和pH值均較高,貯存、銷售等環節的溫度較高時就會引起細菌的生長和繁殖,導致產品腐敗變質[2]。本研究在前期危害分析與關鍵控制點(hazard analysis and critical control point,HACCP)體系的基礎上,引入柵欄技術來針對性地控制產品從原料到成品整個生產過程中的關鍵控制點,不僅可以達到不使用防腐劑即可使產品獲得理想貨架期的目的,還能夠提高產品品質和食用安全性[3]。通過對比經不同方式殺菌(減菌處理、微波殺菌和高壓滅菌)的灘羊肉制品在低溫貯藏期間菌落總數、pH值、總揮發性鹽基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸反應物(thiobarbituric acid reactive substance,TBARs)值及水分分布的變化,判斷減菌處理低溫灘羊肉制品的貨架期。旨在將味道鮮美、營養價值高的鹽池灘羊肉制成食用方便、貨架期長的寧夏特色灘羊肉制品,讓更多的人品嘗到地道的寧夏傳統特色美味。
1 材料與方法
1.1 材料與試劑
新鮮鹽池灘羊(整只) 寧夏回族自治區鹽池縣大夏牧場清真食品有限公司;食鹽、味精、花椒、八角、香葉、干辣椒、大蔥、生姜、蒜、食品級PP密封保鮮盒寧夏新華百貨超市寧陽店。
平板計數瓊脂(plate count agar,PCA)培養基、卵黃瓊脂(egg yolk agar,EYA)培養基、金黃色葡萄球菌顯色培養基、MAC培養基、木糖賴氨酸脫氧膽鹽瓊脂(xylose lysine deoxycholate salt agar,XLD)顯色培養基、氯化鎂、硼酸、鹽酸、甲基紅、次甲基藍、溴甲酚綠、三氯乙酸、TBA溶液、氯仿(試劑均為分析純) 銀川偉博鑫生物科技有限公司。
1.2 儀器與設備
pH-280手持pH計 杭州陸恒生物科技有限公司;AL240電子天平 上海精科儀器有限公司;DZ-2SD型真空包裝機 東莞市益健包裝機械有限公司;SF-100CZ
型超凈工作臺 深圳市云峰凈化技術有限公司;
HHS-11-4恒溫水浴鍋 杭州康納科技有限公司;
YX-280D型壓力蒸汽滅菌器 深圳市良誼實驗室儀器有限公司;LRH-142B生化培養箱 深圳岳鑫儀器有限公司;UDK127自動凱氏定氮儀 意大利Velp公司;
TDL-5B臺式低速大容量離心機 江蘇省金壇市友聯儀器研究所;721G-100分光光度計 深圳精科儀器設備有限公司;NMI20型低場核磁脈沖成像分析儀 上海紐曼電子科技有限公司。
1.3 方法
1.3.1 灘羊肉產品的制備
白切羊肉、涼手抓羊肉的制作工藝(作料相同):分割、切塊→清洗→預煮→煮制→冷卻→無菌包裝→減菌處理→貯藏;椒鹽羊肝的制作工藝:分割→清洗→預煮→清洗→煮制→冷卻→切片→無菌包裝→減菌處理→貯藏;醬羊肉、醬羊頭肉的制作工藝(作料相同):分割、切塊(去毛皮)→清洗→預煮→煮制→冷卻→無菌包裝→減菌處理→貯藏
1.3.2 樣品處理
1.3.2.1 減菌處理(實驗組)
活羊在屠宰和之后的排酸過程中嚴格按照良好生產規范(good manufacturing practice,GMP)操作,經冷鏈運輸至實驗室的無菌室內進行分割、切塊,無菌室內所有設備以及分割所用的案板、刀具和容器等提前用75%的酒精擦拭后紫外線照射45 min[3]。煮制過程所用的八角、花椒等先進行121 ℃、15 min的高壓滅菌,保證輔料中不攜帶致病菌。分割結束即可進行正常的煮制過程。
減菌包裝前對保鮮盒進行高壓滅菌(121 ℃、15 min),同時開啟無菌真空包裝倉的空氣過濾裝置,然后開啟紫外殺菌裝置照射45 min,無菌包裝倉內的空氣含菌量控制在10~20 個/m3。殺菌結束后,將保鮮盒置于無菌包裝倉中,對冷卻后的灘羊肉制品進行稱量和包裝,并在無菌包裝倉中對密封后的保鮮盒進行覆膜塑封包裝。最后,開啟無菌包裝倉內的殺菌裝置對塑封后的保鮮盒進行常溫紫外照射30 min,結束后置于0~5 ℃貯藏[4]。
1.3.2.2 微波殺菌處理(對照組1)
原料肉選自經普通方式宰殺的羊胴體,在正常環境中進行切割和分塊煮制,包裝前對保鮮盒進行121 ℃、15 min的高壓滅菌,待肉制品冷卻至常溫,在正常環境下稱量和包裝后放入微波爐進行殺菌處理(頻率2 450 MHz,功率800 W,時間130s[5]),冷卻后覆膜塑封包裝,置于0~5 ℃貯藏。
1.3.2.3 高壓滅菌處理(對照組2)
原料肉選自經普通方式宰殺的羊胴體,在正常環境中進行切割和分塊煮制,包裝前對保鮮盒進行121 ℃、15 min的高壓滅菌[6],待肉制品冷卻至常溫,在正常環境下稱量后放入保鮮盒內,進行高壓滅菌(121℃、15min),冷卻后覆膜塑封包裝,置于0~5 ℃貯藏[7]。endprint
1.3.3 指標測定
1.3.3.1 pH值
按照GB/T 9695.5—2008《肉與肉制品pH測定》[8]中的方法進行測定:稱取不同貯藏時間的樣品30 g,分成3 組,每組10 g,將每組樣品絞碎,并加入90 mL蒸餾水,測定灘羊肉制品的pH值。
1.3.3.2 菌落總數
按照GB 4789.2—2010《食品安全國家標準 食品微生物學檢驗 菌落總數測定》[9]中的方法進行測定。
1.3.3.3 TVB-N值
按照GB/T 5009.44—2003《肉與肉制品衛生標準的分析方法》[10]中的半微量定氮法進行測定。
1.3.3.4 TBARs值
采用白艷紅[11]的方法進行測定。樣品在組織搗碎機中進行均質,取搗碎的肉樣10 g,加入50 mL 7.5%的三氯乙酸(含0.1 mol/L的EDTA),振搖30 min,用雙層濾紙過濾2 次;取5 mL上清液,加入5 mL 0.02 mol/L的硫代巴比妥酸(thiobarbituric acid,TBA)溶液,90 ℃水浴保溫40 min,取出冷卻1 h,1 600 r/min條件下離心5 min;在上清液中加入5 mL氯仿,振搖,靜置分層后取上清液,分別在532 nm和600 nm波長處測定吸光度,按以下公式計算TBARs值[12]。
式中:TBARs為樣品的硫代巴比妥酸反應物值/(mg/100 g);A532 nm和A600 nm分別為溶液在532 nm和600 nm波長處的吸光度。
1.3.3.5 水分分布
核磁共振(nuclear magnetic resonance,NMR)弛豫特性的測定在NMI20低場脈沖核磁共振分析儀上進行。在溫度為32 ℃、質子共振頻率為22.4 MHz的條件下,采用CPMG脈沖序列(90°脈沖和180°脈沖之間的時間τ=200 μs),采樣點數TD=241 000,重復采樣次數NS=8,譜寬(spectral width,SW)100 kHz,重復間隔時間(repetition time,TR)1 200 ms,得到以指數形式衰減的核磁信號[13]。將2 g左右樣品放入直徑15 mm的核磁管中,用保鮮膜封口后放入分析儀中。每個樣品至少重復測定3 次。
1.3.3.6 致病菌
肉毒梭狀芽孢桿菌按照GB 4789.12—2003《食品衛生微生物學檢驗 肉毒梭菌及肉毒毒素檢驗》[14]進行檢測;金黃色葡萄球菌按照GB 4789.10—2010《食品安全國家標準 食品微生物學檢驗 金黃色葡萄球菌檢驗》[15]進行檢測;志賀氏菌按照GB 4789.5—2012《食品安全國家標準 食品微生物學檢驗 志賀氏菌檢驗》[16]進行檢測;沙門氏菌按照GB 4789.4—2010《食品安全國家標準 食品微生物學檢驗 沙門氏菌檢驗》[17]進行檢測。每隔5 d對產品進行抽樣檢測,做到實時監測,若發現產生肉毒梭狀芽孢桿菌的樣品,應及時進行高壓滅菌處理。
1.4 數據處理
所有實驗數據用Excel和Origin 8.6軟件進行繪圖。實驗均重復測定3 次,結果用平均值±標準差表示。
2 結果與分析
2.1 灘羊肉制品貯藏過程中菌落總數的變化
由圖1~2可知,減菌處理的白切羊肉和涼手抓羊肉貯藏30 d時的菌落總數達4.3~4.4 (lg(CFU/g)),
而此時對照組1(微波殺菌)和對照組2(高壓滅菌)的2 種樣品的菌落總數明顯大于4.5(lg(CFU/g))。
GB 2726—2005《熟肉制品衛生標準》[18]規定肉制品菌落總數不得大于30 000 CFU/g,即對數值不得大于
4.48(lg(CFU/g)),因此減菌處理的白切羊肉和涼手抓羊肉樣品在30 d內可以食用,微波殺菌和高壓滅菌的2 種樣品貯藏30 d時的菌落總數已超標。
由圖3可知,減菌處理的椒鹽羊肝在貯藏28 d時的菌落總數就已達到4.3~4.4 (lg(CFU/g)),2 組對照組已超過4.5(lg(CFU/g)),同樣按GB 2726—2005《熟肉制品衛生標準》[18]的要求,減菌處理的椒鹽羊肝在貯藏28 d內的菌落總數在正常范圍內,而微波殺菌和高壓滅菌樣品的菌落總數已超標。
由圖4~5可知,減菌處理的醬羊肉和醬羊頭肉的菌落總數在貯藏第35天時達4.8~4.9(lg(CFU/g)),
而微波殺菌和高壓滅菌樣品的菌落總數已大于
5 (lg(CFU/g)),國標規定醬鹵類肉制品菌落總數不得大于80 000 CFU/g[15],即菌落總數不得大于
4.9(lg(CFU/g)),因此,減菌處理的醬羊肉和醬羊頭肉在貯藏35 d內的菌落總數未超標,對照組樣品超標。
綜合分析樣品的菌落總數可知,5 種羊肉制品的菌落總數在貯藏初期緩慢上升,中期快速上升,后期趨于穩定,變化較顯著(P<0.05),菌落總數的變化趨勢呈S形曲線,形成這一變化趨勢的原因是在貯藏初期初始菌落較少,增長速度較慢,貯藏中期微生物開始生長繁殖,后期由于營養物質減少,微生物生長緩慢。此外,樣品菌落總數實驗組<對照組1<對照組2,原因是實驗組樣品在包裝時使用了無菌真空包裝倉,該設備運行時先將空氣進行過濾,使空氣中菌數降低,再進行紫外照射殺菌,稱量、入盒以及塑封過程均在無菌真空包裝倉內進行,之后在這個密閉環境內對包裝好的樣品進行常溫紫外照射30 min,即減菌處理,這一過程不僅殺死了肉制品中的致病菌,還保證了保鮮盒內空氣中菌的較低濃度,微生物的生長受限。因此,減菌處理組樣品在貯藏期間的菌落總數整體較低。而對照組1采用微波殺菌方式,對保鮮盒內的空氣滅菌不夠徹底,對照組2在高壓滅菌后會形成大量水蒸氣,降溫后會凝成水滴,使保鮮盒內濕度增大,細菌大量滋生,因此樣品菌落總數普遍較高。白切羊肉和涼手抓羊肉的保鮮期為30 d,椒鹽羊肝為28 d,而醬羊肉和醬羊頭肉為35 d,這是由于羊肝中含血液較多,而血液中富含微生物生長所需的營養物質,因此椒鹽羊肝的保鮮期相對較短,而醬羊肉和醬羊頭肉在煮制過程中使用了花椒、八角、醬油及食鹽等大量調味料,它們能在一定程度上抑制微生物的生長,因此保鮮期較長。endprint
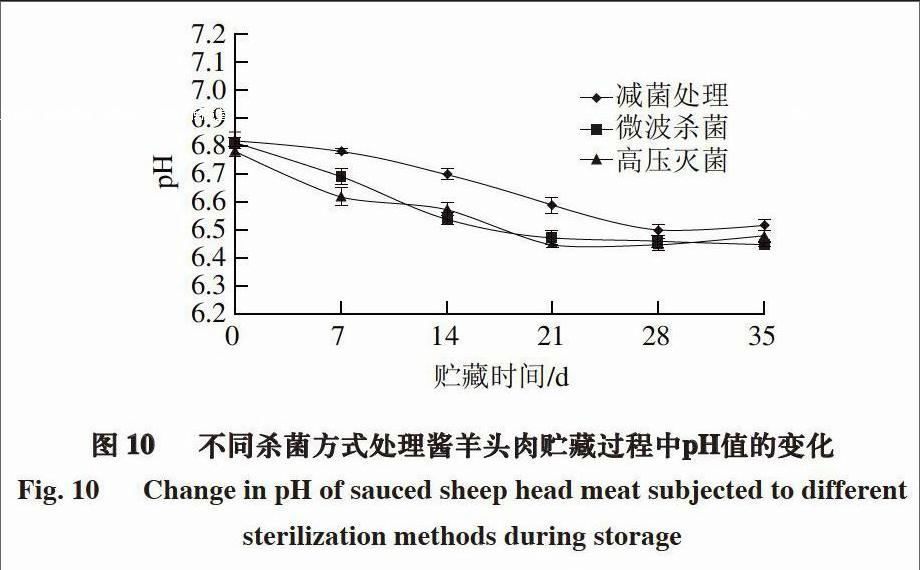
2.2 灘羊肉制品貯藏過程中pH值的變化
由圖6~7可知,白切羊肉和涼手抓羊肉貯藏過程中的pH值均呈先下降后平穩的變化趨勢,這是由于用保鮮盒包裝的肉制品不是處于完全無氧狀態,隨著初始菌落的生長,糖類被分解產生有機酸,使得肉制品pH值下降,貯藏后期pH值趨于穩定可能是由于密封的保鮮盒中氧氣被耗盡,需氧菌停止生長,厭氧菌產生的少量有機酸與蛋白質分解形成的低分子量含氮堿性物質發生中和反應造成的[19]。
由圖8可知,椒鹽羊肝貯藏過程中的pH值先上升后下降,這是由于肝臟中富含蛋白質,而脂肪含量較低,在低溫貯藏條件下,微生物可利用的營養物質較少,而大量蛋白質分解產生的含氮堿性物質使樣品pH值上升,隨著初始菌落的生長,微生物開始大量生長產酸,故pH值降低。
由圖9~10可知,2 種醬羊肉制品貯藏期間的pH值均呈現先下降后略有上升的趨勢,貯藏前期pH值下降的原因與白切羊肉相同,后期由于醬羊肉和醬羊頭肉制作過程中放入的花椒、八角等具有刺激性,對乳酸菌的生長有一定的抑制作用,同時,肉中蛋白質的分解使pH值有所升高。
綜合分析5 種羊肉制品pH值的變化可知,實驗組>對照組1 >對照組2,原因主要與殺菌方式有關,減菌處理的殺菌效果明顯優于微波殺菌和高壓滅菌。此外,白切羊肉和涼手抓羊肉的pH值小于醬羊肉和醬羊頭肉,這主要是由于醬肉制品中的香辛料及醬油等的使用量較大,能夠抑制微生物的生長,故其pH值相對較大。
2.3 灘羊肉制品貯藏過程中TVB-N值的變化
由圖11~15可知,5 種羊肉制品貯藏期間的TVB-N值均呈現先上升后略有下降的趨勢,肉品中所含TVB-N的量隨著腐敗進程逐漸增加,與肉品的腐敗程度成正比,因此TVB-N值可與菌落總數結合來鑒定肉制品的新鮮度[20]。在肉制品貯藏過程中,由于酶和細菌的作用,蛋白質、肌酸、次黃嘌呤核苷酸、肌肽等含氮大分子分解形成氨及胺類等堿性含氮物質,此類物質可以與腐敗過程中同時分解產生的有機酸結合,形成一種稱為鹽基態氮(NH4+·R-)的物質,積聚在肉品中,使產品TVB-N值增大。貯藏后期,這些含氮大分子被分解利用完,不再產生堿性化合物,同時部分與酸性物質中和,導致產品TVB-N值輕微下降。
綜合分析5 種羊肉制品TVB-N值的變化可知,減菌處理組<微波滅菌組<高壓殺菌組,其原因同上述分析。另外,白切羊肉和涼手抓羊肉的TVB-N值整體上小于醬羊肉和醬羊頭肉,而椒鹽羊肝的TVB-N值最大,原因可能是相對于白切羊肉和涼手抓羊肉來說,醬羊肉和醬羊頭肉含有的氨類及胺類物質在貯藏過程中由于酶和微生物的作用分解產生了更多的堿性含氮物質,使它們的TVB-N值偏高,而羊肝中大量蛋白質的分解使其TVB-N值較大。
2.4 灘羊肉制品貯藏過程中TBARs值的變化
由圖16~20可知,5 種灘羊肉制品貯藏過程中TBARs值的變化顯著(P<0.05)。脂類氧化是肉類及肉制品品質降低的重要原因之一,由于細胞膜上脂質雙分子層中的磷脂部分含有不飽和脂肪酸,使得肉類特別容易發生脂類氧化反應[21],肉類食品的脂質氧化程度通常用硫代巴比妥酸法(TBA法)進行評價[22]。5 種產品的TBARs值隨著貯藏時間的延長均呈先上升后下降,隨后趨于穩定的趨勢。這是由于保鮮盒包裝的產品中有空氣,這使得脂肪被氧化,導致產品TBARs值上升,而后生成的次級代謝產物與肉制品中的氨基成分發生化學反應生成聚合物,使得產品TBARs值下降[22]。在貯藏后期,樣品的TBARs值趨于穩定,這可能是由于產品包裝內的氧氣耗盡使TBARs值不再增加,最后趨于穩定。
減菌處理組<微波殺菌組<高壓滅菌組,這與殺菌方式有關。另外,醬羊肉和醬羊頭肉的TBARs值明顯低于其他3 種肉制品,相關研究表明,香辛料不僅具有抑菌作用,同時抗氧化能力較強,因此醬羊肉和醬羊頭肉樣品的TBARs值較低。
2.5 灘羊肉制品貯藏過程中水分分布的變化
水分作為肉與肉制品的主要成分,以一定數量定位、定向存在于其中,并以結合水(與大分子相互作用的水)、不易流動水(肌原纖維和網狀組織中的水)和自由水(細胞外的水)3 種形式存在,而結合水又分為強結合水和弱結合水[23]。水分子的存在形式和活性分布狀態不但決定了蛋白質的保水能力,也會對肉制品的貨架期產生一定影響。運用低場核磁共振技術(low-field nuclear magnetic resonance,LF-NMR)測定肉制品中的水分分布狀態、水分含量及其流動性,能夠科學準確地反映肉制品貯藏過程中的水分變化。在LF-NMR測定中得到的2 個主要參數是自旋-晶格弛豫時間(用T1表示,又稱為縱向弛豫時間)和自旋-自旋弛豫時間(用T2表示,又稱為橫向弛豫時間)。在肉與肉制品研究中,由于T2變化范圍較大,并且表示水分分布狀態比T1更加敏感,因此常用T2弛豫時間作為衡量肉品持水性的指標,T2弛豫時間的不同能夠較容易地區分自由水和結合水[24-26]。
由圖21~22可知,白切羊肉和涼手抓羊肉中均檢測出了4 種峰:T21在0.1~1 ms之間,代表與蛋白質等氨基、羰基以氫鍵相結合的單層水,這種結合十分緊密,流動性很差,稱為弱結合水;T22在0.5~8 ms之間,被認為是與蛋白質中的酰胺基、淀粉纖維素中的羥基形成鍵能較小的氫鍵的水,其結合強度比單分子層水略差些,稱為強結合水,T21和T22統稱為T2b;T23在10~100 ms之間,弛豫時間較長,為不易流動水;T24在80~350 ms之間,流動性最強,是可以自由移動的水分,稱為自由水[27-28]。
比較白切羊肉和涼手抓羊肉對應峰的面積發現,3 種不同殺菌方式下2 種肉制品的T21和T22峰面積隨著貯藏時間的延長幾乎未發生改變,而T23峰面積均逐漸減小,T24峰面積在減菌處理和微波殺菌樣品中逐漸增大,高壓滅菌樣品中逐漸減小,這表明2 種肉制品中的結合水由于強烈的束縛作用幾乎不發生轉移,不易流動水向自由水轉移。由于減菌處理和微波殺菌對肉制品組織及細胞膜的破壞性不是很大,因此自由水流失并不嚴重,而經過高壓滅菌,肉制品的細胞組織由于被高溫高壓破壞而變得松散,細胞壁和生物膜受到損傷,膜內水分流出,經不易流動水轉移過來的自由水大量散失[29-30]。endprint
由圖23可知,3 種不同殺菌方式處理的椒鹽羊肝樣品均出現了3 種峰,T2b在0.1~8 ms之間,為結合水,結合水因與顆粒表面的距離不同,受電場作用力的大小也不同,因此結合水分為強結合水和弱結合水,單峰和雙峰的出現并無本質區別[31]。T23在7~100 ms之間,為不易流動水,T24在80~350 ms之間,為自由水。3 種不同殺菌方式處理下,結合水的峰面積隨著貯藏時間的延長幾乎不發生改變,不易流動水和自由水峰面積均減小,且高壓滅菌樣品的自由水峰面積比減菌處理和微波殺菌的樣品更小,原因可能是肝臟作為機體主要的代謝器官,在物質合成、轉化和分解過程中比較活躍,分子進出細胞比較頻繁,加之與肌細胞相比,肝細胞膜厚度較小,且肝細胞組織較松散,在煮制過程中,肝細胞通透性增大,因此在低溫貯藏期間,肝細胞內的不易流動水向自由水轉移,自由水快速流失,而高壓滅菌加劇了肝細胞膜的破損,使得自由水流失的速率更快。
由圖24~25可知,3 種不同殺菌方式處理的醬羊肉和醬羊頭肉樣品的結合水、不易流動水及自由水的出峰時間均與椒鹽羊肝相似,峰面積隨貯藏時間延長的變化趨勢均與白切羊肉相似,原因同上述分析。
對比5 種灘羊肉冷拼菜肴分別在減菌處理、微波殺菌以及高壓滅菌后的貯藏期內水分分布的變化發現:1)椒鹽羊肝整體的水分含量明顯大于其他4 種冷拼菜肴,這是由于肝臟細胞的水分含量為86%左右,而肌細胞的水分含量為70%左右,且肝臟細胞小于肌肉細胞,相同質量的肝臟與肌肉相比,肝臟中的水分明顯高于肌肉,由于肝臟中水分基數較大,雖然貯藏過程中有所流失,但其水分活度仍有利于微生物的生長,因此肝臟制品的貨架期小于其他4 種肉制品;2)減菌處理的5 種肉制品的水分含量均大于微波殺菌及高壓滅菌,說明經減菌處理的肉制品水分流失相對較小,而經層層減菌處理的包裝盒內氣體與肉制品的初始菌落含量較低,因此肉制品同樣可以達到較長的貨架期。
2.6 樣品中致病菌的檢測
本研究對不同貯藏時期灘羊肉制品的致病菌進行檢測,主要檢測對象為肉毒梭狀芽胞桿菌、金黃色葡萄球菌、志賀氏菌和沙門氏菌。GB 2726—2005《熟肉衛生標準》[18]規定,以上所列出的幾種微生物均不得檢出。結果表明,5 種產品中均未檢出上述致病菌,表明產品在整個生產過程中的衛生安全控制得當。
2.7 利用柵欄技術減菌處理灘羊肉制品的貨架期
白切羊肉和涼手抓羊肉的菌落總數在貯藏30 d時接近國標中規定的30 000 CFU/g,貯藏超過30 d時的菌落總數超標,pH值的變化范圍在6.3~6.6之間,適口性較好,TVB-N值和TBARs值反應的腐敗與脂肪氧化情況均在可接受范圍內,因此可初步判斷白切羊肉和涼手抓羊肉的貨架期均為30 d。
椒鹽羊肝的菌落總數在貯藏28 d時接近30 000 CFU/g,貯藏超過28 d時的菌落總數超標,pH值先上升后下降,變化范圍在6.6~7.0之間,TVB-N值<15 mg/100 g(新鮮肉制品指標),脂肪氧化情況在可接受范圍內,水分流失相對較少,因此可初步判斷椒鹽羊肝的貨架期為28 d。
醬羊肉和醬羊頭肉的菌落總數在貯藏35 d時接近80 000 CFU/g,貯藏超過35 d時的菌落總數超標,pH值整體呈下降趨勢,TVB-N值<15 mg/100 g,脂肪氧化情況在可接受范圍內,水分流失相對較少,因此可初步判斷醬羊肉和醬羊頭肉的貨架期均為35 d。
3 結 論
通過對3 種不同殺菌方式處理的5 種肉制品的菌落總數、pH值、TVB-N值、TBARs值以及水分分布進行綜合分析,發現肉制品采用減菌處理后,低溫貯藏期間的各項理化指標及持水性均優于微波殺菌和高壓滅菌肉制品,在3 種不同的殺菌方式中,減菌處理作為一種新穎的二次滅菌方式,相對于微波滅菌和高壓滅菌這2 種技術相對成熟的滅菌方式來說,是一種操作簡單、安全性高、滅菌效果好的最佳滅菌方式。
參考文獻:
[1] 宣蘇哲. 寧夏鹽池: 美味灘羊何以香飄四方[N]. 中國畜牧獸醫報, 2016-09-11(001).
[2] 李威娜, 徐松濱, 張玲, 等. 低溫肉制品保鮮技術綜述[J]. 食品工程, 2013(3): 13-15; 40.
[3] 張偉威, 羅瑞明, 胡聰. 柵欄技術在傳統清蒸羊羔肉低溫制品加工中的應用[J]. 食品工業科技, 2014(19): 220-224. DOI:10.13386/j.issn1002-0306.2014.19.038.
[4] EISEL W G, LINTION R H, MURIANA P M. A survey of microbial levels for incoming raw beef, environmental sources, and ground beef in a red meat processing plant[J]. Food Microbiology, 1997, 14(3): 273-282. DOI:10.1006/fmic.1996.0094.
[5] 郭遼樸, 李洪軍, 杜杰, 等. 微波殺菌技術在肉制品中的應用[J]. 肉類研究, 2008, 22(5): 76-79.
[6] WU Chongman, LIU Suer. Volatile components of water-boiled duck meat and cantonese style roasted duck[J]. Journal of Agricultural and Food Chemistry, 1992, 40(5): 838-841. DOI:10.1021/jf00017a026.
[7] SAMELIS J, KAKOURI A, REMENTZIS J. Selective effect of the product type and the packaging condition on the species of lactic acid bacteria dominating the spoilage microbial association of cooked meats at 4 ℃[J]. Food Microbiology, 2000, 17(3): 329-340. DOI:10.1006/fmic.1999.0316.endprint
[8] 中國商業聯合會商業標準中心, 國家加工食品質量監督檢驗中心(廣州), 廣州市產品質量監督檢驗所. GB/T 9695.5—2008 肉與肉制品 pH測定[S]. 北京: 中國標準出版社, 2008.
[9] 中華人民共和國衛生部. GB 4789.2—2010 食品安全國家標準 食品微生物學檢驗 菌落總數測定[S]. 北京: 中國標準出版社, 2010.
[10] 上海市食品衛生監督檢驗所. GB/T 5009.44—2003 肉與肉制品衛生標準的分析方法[S]. 北京: 中國標準出版社, 2003.
[11] 白艷紅. 低溫熏煮香腸腐敗機理及生物抑菌研究[D]. 楊凌: 西北農林科技大學, 2005: 12-13.
[12] 于海, 秦春君, 葛慶豐, 等. 中式香腸加工及貯藏中脂肪氧化對其品質特性的影響[J]. 食品科學, 2012, 35(13): 119-125.
[13] 吳亮亮. 寧夏傳統特色低溫清真灘羊肉食品研發[D]. 銀川: 寧夏
大學, 2016: 24.
[14] 衛生部蘭州生物制品研究所, 中國疾病預防控制中心營養與食品安全所. GB 4789.12—2003 食品衛生微生物學檢驗 肉毒梭菌及肉毒毒素檢驗[S]. 北京: 中國標準出版社, 2003.
[15] 中華人民共和國衛生部. GB 4789.10—2010 食品安全國家標準 食品微生物學檢驗 金黃色葡萄球菌檢驗[S]. 北京: 中國標準出版社, 2010.
[16] 中華人民共和國衛生部. GB 4789.5—2012 食品安全國家標準 食品微生物學檢驗 志賀氏菌檢驗[S]. 北京: 中國標準出版社, 2012.
[17] 中華人民共和國衛生部. GB 4789.4—2010 食品安全國家標準 食品微生物學檢驗 沙門氏菌檢驗[S]. 北京: 中國標準出版社, 2010.
[18] 江蘇省疾病預防控制中心, 上海市衛生監督所, 黑龍江省食品衛生監督檢驗所. GB 2726—2005 熟肉制品衛生標準[S]. 北京: 中國標準出版社, 2005.
[19] 賀旺林, 俞龍浩. 基于腐敗微生物的低溫肉制品貨架期預測研究進展[J]. 黑龍江八一農墾大學學報, 2015(2): 51-56. DOI:10.3969/j.issn.1002-2090.2015.02012.
[20] 馬躍龍, 俞淑, 薛峰, 等. 調理肉制品揮發性鹽基氮的研究[J]. 農產品加工(學刊), 2012(5): 112-113; 119. DOI:10.3969/jissn.1671-9646(X).2012.05.035.
[21] 孫群. 肉制品脂類氧化: 硫代巴比妥酸試驗測定醛類物質[J]. 食品科學, 2002, 22(8): 331-334.
[22] 趙淑娥. 硫代巴比妥酸法(TBA模型)預測魚糜制品保藏貨架期研究[J]. 江西食品工業, 2012(2): 26-27.
[23] 姜曉文, 韓劍眾. 生鮮豬肉持水性的核磁共振研究[J]. 食品工業科技, 2009(7): 128-130; 133.
[24] 李欣, 蘇珊珊, 馬儷珍, 等. 利用LF-NMR研究牛肉粒微波干燥過程中水分遷移和分布變化[J]. 食品科技, 2013(1): 145-149. DOI:10.13684/j.cnki.spkj.2013.01.055.
[25] 李偉妮, 韓劍眾. 冷藏山羊肉品質變化的核磁共振研究[J]. 食品工業科技, 2010(1): 125-127.
[26] BERTRAM H C, KARLSSON A H, RASMUSEN M, et al. Origin of multi-exponential T2 relaxation in muscle my-owater[J]. Journal of Agricultural and Food Chemistry, 2001, 49(6): 3092-3100.
[27] 夏天蘭, 劉登勇, 徐幸蓮, 等. 低場核磁共振技術在肉與肉制品水分測定及其相關品質特性中的應用[J]. 食品科學, 2011, 32(21): 253-256.
[28] MORTENSEN M, ANDWESEN H J, ENGELSEN S B, et al. Effect of freezing temperature, thawing and cooking rate on water distribution in two pork qualities[J]. Meat Science, 2006, 72(1): 34-42.
[29] 戴妍, 常海軍, 郇興建, 等. 不同二次殺菌處理的南京鹽水鴨產品風味變化及感官特性[J]. 南京農業大學學報, 2011(5): 122-128.
[30] 潘興云, 薛妍君, 蔣林惠, 等. 肉多汁性的研究及核磁共振技術在多汁性檢測中的前景[J]. 科技信息, 2010(24): 6-7.
[31] 朱曉紅, 李春, 胡海濤, 等. 結合LF-NMR研究不同處理對醬牛肉保水性的影響[J]. 食品工業科技, 2012(4): 92-96. DOI:10.13386/j.issn1002-0306.2012.04.085.endprint

