轉基因植物發根農桿菌研究的進展及應用
熊笙屹++厙潤祥++張璐++孟令晨++于月華++倪志勇
摘 要:農桿菌轉化法作為植物基因工程使用最廣泛的轉化方法之一,分為根癌農桿菌Ti質粒和根瘤農桿菌Ri質粒2種類型。發根農桿菌(A gmbacterium rhiz-ogenes)的Ri質粒能夠誘導植物產生毛狀根。本文闡述了發根農桿菌的特性及 Ri質粒的分類、結構特征和轉化特點,介紹了發根農桿菌在實際生產中的應用,分析了影響發根農桿菌成功轉化的因素,綜述了發根農桿菌在理論研究、植物基因工程、植物品種改良、植物次生代謝產物生產和植物栽培生根等方面的應用,并指出未來領域研究的著重點。
關鍵詞:發根農桿菌;Ri質粒;研究進展;應用
中圖分類號:Q943 文獻標識碼:A DOI:10.11974/nyyjs.20170833061
目前,轉基因植物轉化的方法主要有農桿菌轉化法、花粉管通道法、核顯微注射法、基因槍法等,農桿菌介導的遺傳轉化體系是在植物基因工程中相對完整、成熟的方法之一。在轉基因植物中有80%以上是由農桿菌轉化的,但是其中大部分是由根癌農桿菌Ti質粒轉化獲得的[1]。1907年,Smith和Townsend 發現發根農桿菌(A grobacterium rhizogenes)能誘導植物形成毛狀根(hairy root),1934年Hildebrand就報道了發根農桿菌(A grobacterium rhizogenes)感染蘋果樹能誘導產生毛狀根(hairy root)[2]。1977年,Montoya等首次應用Ti質粒作為載體將T-DNA上的農桿堿基因轉入煙草細胞[3],標志著遺傳轉化新時代的到來。植物轉基因技術逐步走向成熟,并成為植物基因工程改良新品種的基礎技術。1982年,Chilton 報道發根農桿菌(A grobacterium rhizogenes)能誘導植物產生發狀根(Hairy root),這種發狀根又被稱為毛狀根,是由發根農桿菌所含有的 Ri質粒(Root inducing plasmid)引起的,Ri質粒不僅是遺傳轉化的優良載體 ,而且可直接感染植物細胞[4]。與根癌農桿菌Ti質粒相比 ,根瘤農桿菌Ri質粒轉化具有以下優點;用Ri質粒作為基因載體時,不需要通過“解除武裝”(disarmed)就可以很容易地從轉化來的細胞上獲得再生植株,即用野生型發根農桿菌感染植物可直接再生出完整的植株;由發根農桿菌轉化的植物,其產生的毛狀根均來源于同一個植物細胞[5]。毛狀根的每一個細胞都是轉基因的,更加有利于遺傳操作;根瘤農桿菌Ri質粒不含onc基因,對再生植物的染色體影響極小;由發根農桿菌Ri質粒轉化所產生的毛狀根分化為正常植株的分化率高,倍性穩定,遺傳穩定,并且容易建成一系列能夠在不同植物細胞核染色體上插入一個T-DNA拷貝的株系[6]。盡管發根培養技術的發展歷史雖然較短,但Ri質粒作為植物基因工程載體已顯現出其可行性與方便性。隨著科學研究的逐步深入,它將會成為比Ti質粒更理想的基因轉移系統。更多的次生代謝物將會通過發根培養系統來生產,并被用于難以插活植物的生根和生產外源基因產品,特別是在獲得轉基因植物、培育新品種等方面存在廣闊前景。
1 發根農桿菌及Ri質粒特征
1.1 發根農桿菌
發根農桿菌(A grobacterium rhizogenes)屬于根瘤菌科(Rhizobitaceae)農桿菌屬(A grobacterium)的革蘭氏陰性菌。發根農桿菌是一類宿主范圍廣泛土壤桿菌,在侵染植物后,能夠誘導植物產生大量高度分支的不定根,通常稱為發根。發根農桿菌侵染植物所產生的發根具有生長速度快、分化程度高、生理生化和遺傳性穩定、易于進行操作控制等特點[7]。發根農桿菌的致根特征結構包括染色體毒性基因(Chromosomal Virulence,ChV) 和Ri質粒2個部分。ChV是發根農桿菌的染色體基因,它的活化表達與發根農桿菌在植物細胞壁的附著有關。Ri,質粒是發根農桿菌染色體外的一個具有侵入性的質粒。在自然狀態下,發根農桿菌通過傷口入侵植物,Ri質粒上的T-DNA能插入植物基因組,其上所攜帶的基因在宿主細胞中整合表達,使植物產生毛狀根。發根農桿菌的宿主范圍隨菌株的不同而發生變化[8]。發根農桿菌能夠感染大多數雙子葉植物和少數單子葉植物以及個別裸子。到目前為止,已有160 多種植物成功誘導出了毛狀根,大多數集中在茄科、菊科、十字花科、旋花科、傘形科、豆科、石竹科、蓼科等,主要是草本植物,而木本植物較少有成功的報道 [9]。
1.2 發根農桿菌 Ri質粒的分類及基本特征
1.2.1 Ri質粒的分類
根據其合成冠癭堿的不同,可將Ri質粒分為4種類型:甘露堿型(Mannopine Type),合成甘露堿及其酸、農桿堿酸與農桿堿素A;黃瓜堿型(Cucumopin Type),合成黃瓜堿;農桿堿型(Agropine Type),合成農桿堿及其酸、甘露堿及其酸、農桿堿素A;米奇矛型(Mikimopine Type)。發根農桿菌的致根特性與Ri質粒類型有關, Petit等發現含農桿堿型Ri質粒的發根農桿菌較甘露堿型、黃瓜堿型和米奇矛型有更為廣泛的宿主范圍。即使對同一種農桿菌來說,致根特性又與被接種的寄主植物及接種的部位有關[10]。
1.2.2 結構和類型
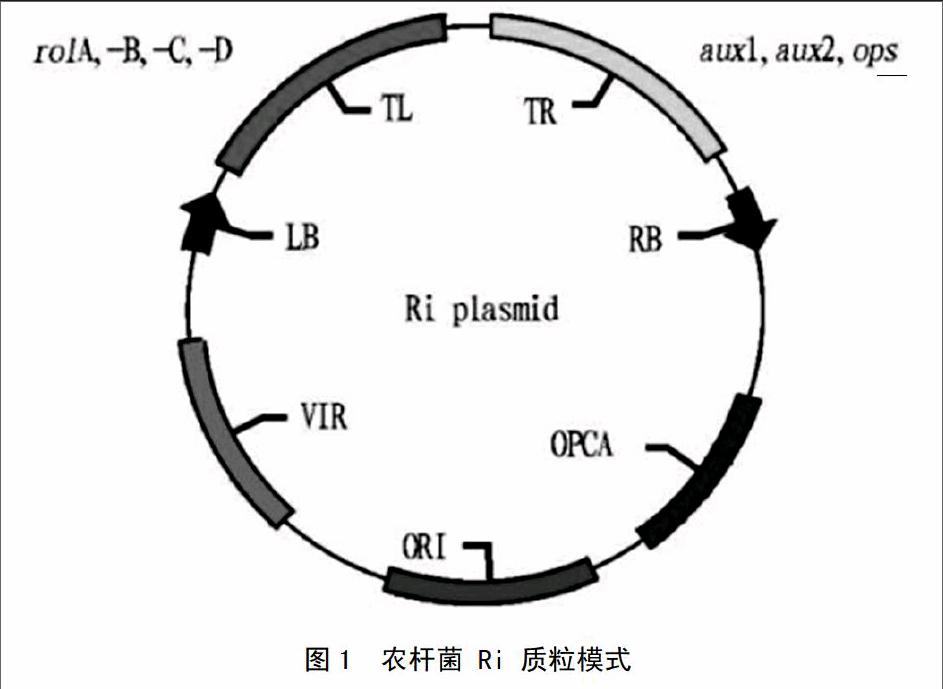
發根農桿菌 (含Ri質粒)侵染植物后會產生許多生長迅速、分枝呈毛狀的不定根,稱為毛狀根。圖1顯示,Ri質粒為根誘導質粒(Root Inducing Plas mid);Ri質粒的大小為200~800kb,它含有負責發根自主性生長和冠癭堿合成的基因,在結構上有致毒區(Vir區),轉移進入植物細胞核的T-DNA區及其內部的冠癭堿合成功能區等[11]。根據其合成冠癭堿的不同,可將Ri質粒分為 4 種類型:甘露堿型(Mannopine Type),合成甘露堿及其酸、 農桿堿酸與農桿堿素A;黃瓜堿型(Cucumopin Type),合成黃瓜堿;農桿堿型(Agrop-ine Type),合成農桿堿及其酸、甘露堿及其酸、農桿堿素A;米奇矛型(Mikimopine Type),Petit等發現含農桿堿型Ri質粒的發根農桿菌較甘露堿型、瓜堿型和米奇矛型有更為廣泛的宿主范圍[12]。endprint
圖1 農桿菌 Ri 質粒模式
1.2.3 Ri質粒轉化特點
Ri質粒轉化的優勢主要表現在以下5個方面:Ri質粒可誘導植物外植體生成毛狀根并由其再生成植株[13];生成的毛狀根屬于單克隆,可有效地避免嵌合體的形成;作為中間載體[14];Ri質粒與Ti質粒可共同構建雙元載體,使Ti質粒和Ri質粒的應用范圍更加廣闊;毛狀根在離體培養條件下具有合成原植株次生代謝產物的能力[15]。因此,Ri質粒作為植物基因工程的有效載體,可以生產出更多的次生代謝產物。近幾年,發根農桿菌的應用領域已經越來越寬泛,備受國內外學者關注。
2 影響毛狀根誘導的因素
2.1 菌株
目前采用的發根農桿菌主要有天然農桿堿型的A4、ATCCl5834、16834、LBA9402及1601、R1000、R1200等人工構造質粒;還有黃瓜堿型的2635、2657、2659等;以及甘露堿型的5196、TRl01、TR7等,不同菌株對不同植物或不同植株的侵染能力不同[16]。菌液濃度對毛狀根的誘導也存在一定的影響。一般菌種濃度過大,細菌生長迅速,在一定程度上抑制細胞代謝過程,且不易除菌;濃度太稀,能附著在細胞的細菌太少,不足以形成足夠的毛狀根。
2.2 外植體
目前轉化成功的植物主要是草本植物,尤以雙子葉植物為多,也有為數不多的單子葉植物(如栝樓、旱墨蓮、露水草)和少數木本植物(如銀杏)等誘導成功。已成功誘導出毛狀根的植物外植體有葉片,莖、子葉、愈傷組織、下胚軸等多種,但不同的外植體發狀根的誘導率不同。受傷后酚類化合物的合成是影響植物對Ri質粒的敏感性的主要因素。外植體的選取十分關鍵,一般采用的都是較幼嫩的組織,因為這些細胞處于旺盛的分裂期,容易接受外源DNA。Ackrmann等首次報道了應用發根農桿菌轉化高等植物之后,相繼有成功的報道,而且轉化植物的種類也不再僅僅局限于雙子葉植物,已擴展至玉米、楊樹、蘋果等植物,在藥用植物方面也有報道 [17]。
2.3 化學因子
植物受傷后產生的酚類物質能激活vir基因,促使Ri質粒向植物細胞轉移,在轉化系統中加入某種酚類物質可以促進基因轉化。目前廣泛使用的是AS、羥基乙酰丁香酮(OH-AS)和香草酚等酚類物質來誘導農桿菌, 并在一些轉化試驗中取得了好的效果,在發狀根的誘導過程中,添加適當濃度的外源激素對于提高發狀根的誘導頻率有明顯的促進作用。發根農桿菌Ri質粒的rolC生根基因的啟動子活性受蔗糖濃度的調節,糖類物質可以協助乙酰丁香酮等物質誘導產生高水平的vir區基因表達,從而提高轉化率[18]。
2.4 物理因子
2.4.1 光照強度、溫度、pH值對毛狀根的誘導有很大的影響
農桿菌與植物細胞進行共培養時,使用較低pH的培養基有利于轉化頻率的提高。原因可能是在偏酸的培養條件下,有利于農桿菌vir區基因的表達,但較低pH條件下,培養基的凝固狀態較差.不利于試驗操作,容易污染[19]。
2.4.2 超聲波、微波和真空滲透處理
趙東利等在轉化苦豆子時發現,采用真空7.0×10Pa滲透15min,可有效提高發根農桿菌對苦豆子的轉化頻率[20]。真空滲透處理在植物材料表面產生很多微損傷,抽真空后形成的負壓使農桿菌更緊密地吸附于外植體傷口及傷口內細胞間隙,促進T-DNA向植物細胞導入。超聲波處理也可在外植體上產生許多微小傷口,從而提高農桿菌與外植體之間的接觸面積,提高轉化頻率。短暫微波輻射產生的熱效應也有助于農桿菌T-DNA向植物細胞導入。
3 發根農桿菌的應用
3.1 用于獲得轉基因植物和培育作物新品種
由于發根農桿菌誘導生成的毛狀根生長迅速、條件可控且遺傳穩定性高,因而生成的毛狀根是進行許多與植物根相關的理論研究的理想試驗系統,將經過篩選的含有目的基因的毛狀根轉到分化培養基上誘導芽的產生,帶芽組織再經生根培養即可誘導生根,成為一株完整的轉基因再生植株。Ri質粒介導的轉化更可以將外源功能基因導入植物根系,使其獲得抗病、抗蟲、抗重金屬的多抗性。目前,煙草、苜蓿、豌豆、咖啡等植物都已經可以經毛狀根誘導再生出完整的轉基因植株。
此外,由發根農桿菌感染植物獲得的毛狀根所再生的后代會表現出頂端優勢喪失、葉片皺縮、節間縮短、花形改變等現象[21]。這種再生植株的矮化現象在花卉矮化育種中具有特別的意義。
3.2 用于生產次生代謝產物
發根農桿菌誘導植物產生的毛狀根能合成該植物的次生代謝物質,同時毛狀根具有生長周期、培養條件簡單、穩定性強、目的產物含量高等特點。因此, 發根培養技術是一種有效和可靠的生產合成植物次生代謝產物的有效途徑,從毛狀根培養物中尋找新的藥用化合物具有潛在的應用價值。目前,通過毛狀根培養可以生產的次生代謝物質有生物堿類(如吲哚生物堿、喹啉生物堿、茛菪烷生物堿等)、甙類(如人參皂甙、甜菜甙等)、黃酮類、醌類(如紫草寧等)、多糖類、 蛋白質(如天花粉蛋白等)和一些重要的生物酶(如超氧化物歧化酶)[22]。據不完全統計, 國內外已對23科50余種藥用植物進行了毛狀根誘導的研究,建立了長期的毛狀根培養系統,獲得了次生代謝產物[23]。
4 結語
近幾年來,發根農桿菌及其Ri質粒在植物基因工程研究、植物次生代謝產物的生產、改良植物品種特性等方面,都取得了廣泛的應用。但是利用發根農桿菌實際應用的研究開展的時間還比較短,理論基礎還不扎實,許多潛在的問題和技術有待解決和完善。就目前的狀況而言,未來該研究應注重研究以下2個方面:改善毛狀根誘導的環境條件使其更加簡單,降低對設備的需求,從而減少成本;次生代謝產物的合成機制,關鍵酶的作用機制以及收調控的核心因素。隨著對發根農桿菌轉化原理及次生代謝產物合成途徑的逐步研究,農桿菌介導轉化外源基因及表達的效率會不斷提高,可轉化的受體植物范圍不斷擴大,次生代謝產物合成的效率和產量不斷提高,將為更多植物體加入新遺傳特性的研究帶來新的動力。同時,高效細胞培養技術的建立與不斷完善,天然藥物生物技術產品的商品化和產業化進程將大大加快,基于發根農桿菌介導的植物次生代謝工程將在農業、健康食品、功能食品和植物抗性等領域更好地造福人類。endprint
參考文獻
[1]鄭秀芳,金治平.植物遺傳轉化技術研究概況[J].河西學院學報,2002,10(5):66-70.
[2] Chilton M.D.,Tepfer D.A.,Petit A.,et al..A grobacterium rhizogenes insets T-DNA into the genomes of the host plant root cell[J].Nature,1982,295(5848):432-434.
[3] Montoya A.L.,Chilton M.D.,Gordon M.P.,et al..Oct opine and nopaline metabolism in a grobacterium tumefaciens and grown gall tumor cells: role of plasmid genes[J].Bacteriol,1977,129(1):101-107.
[4] Dessaux Y.,Petit A.,Tempe J.,et al..Chemistry and biochemistry of opines,chemical mediators of parasitism[J].Phytochemistry,1993,34(1):31-34.
[5]張蔭麟,呂桂蘭.金蕎麥發狀根培養的研究[J].植物學報,
1992,34(8):603-608.
[6] Petit A.,David A.,Dahl G.A.,et al..Futher extention of the opine concept:plasmids in A grobacterium rhizogenes cooperate for opine degradation[J].Mol.Gen.Genet,1983,190(2):204-214.
[7]侯萌萌,岳彩鵬,喬瑞麗,等.發根農桿菌對不同煙草品種發狀根誘導和培養的影響[J].貴州農業科學,2010(11):8-11.
[8]杜旻,吳曉俊,王崢濤,等.發根農桿菌Ri質粒及其在植物基因工程中的應用[J].藥物生物技術,2005,12(3):193-196.
[9]戴均貴,朱蔚華.發根培養技術在植物次生代謝物生產中的應用[J].植物生理學訊,1999,35(1):70.
[10]張毅,沈文輝.植物基因的新載體--農桿菌Ri質粒[J].生物工程學報,1989,5(3):173.
[11]陶銳,李莉,邱強,等.質粒轉化藥用植物的研究進展[J].農業與技術,2007,27(3):31-36.
[12] CHRISTEY M.C..Use of Ri-mediated transformation for production of transgenic plants[J]. In Vitro Cell Dev B iol Plant,2001(37):687-700.
[13]周達鋒,卜學賢.發根農桿菌Ri質粒的分子生物學及其應用前景[J].植物學報,1993,10(2):24-34.
[14] SHIH-YOW H.,SHIH-NUNG C..Elucidation of the effects of nitrogen source on proliferation of transformed hairy roots and secondary metabolite productivity in a mist trickling reactor by redox potential measurement[J].Enzyme and Microbial Technology,2006,38(6):803-813.
[15]孫敏,陳安和.質粒轉化及其在植物基因工程中的應用[J].渝州大學學報,1995,12(1):65-67.
[16]林麗,范海延,潘野,等.發根農桿菌Ri質粒及其在植物次生代謝物質生產中的應用[J].北方園藝,2007(11):94-97.
[17]劉琴,吳震,翁忙玲,等.發根農桿菌Ri質粒及其在植物科學中的應用[J].生物技通報,2002(5).
[18]姚春娜,王亞馥.超聲波輔助的發根農桿菌對黃瓜的遺傳轉化[J].蘭州大學學報(自然科學版),2001,37(5):77-81.
[19]王欣月.花器噴霧法接種根癌農桿菌轉化矮生菜豆條件的初步探索[D].中國農業大學,2003.
[20]顧覺奮,陳光明,李淑珍,等.微生物轉化法合成輔酶Q10[J].藥學進展,2001,25(6):339-343.
[21]劉偉,郝建平.發根農桿菌的研究進展及其應用[J].山西農業科學,2007,35(7):13-16.
[22]王渭玲.膜莢黃芪營養特性及次生代謝調控的研究[D].西北農林科技大學,2008.
[23] SHAKYA N.M.,CHANDER S..Modelling of hillslope run off processes[J].Environmental Geology,1998,35(2):115-123.endprint

