人結直腸癌肝轉移瘤中CD11b+髓系細胞分選方法的建立與鑒定*
王東旭, 霍婷婷, 田耀文, 趙 磊1, △
(1濟南大學,山東省醫學科學院醫學與生命科學學院, 山東 濟南 250200; 2鄭州大學第一附屬醫院,河南 鄭州 450001; 3山東大學附屬山東省腫瘤醫院肝膽外科, 山東 濟南 250117)
·實驗技術·
人結直腸癌肝轉移瘤中CD11b+髓系細胞分選方法的建立與鑒定*
王東旭1, 3, 霍婷婷2, 3, 田耀文1, 3, 趙 磊1, 2, 3△
(1濟南大學,山東省醫學科學院醫學與生命科學學院, 山東 濟南 250200;2鄭州大學第一附屬醫院,河南 鄭州 450001;3山東大學附屬山東省腫瘤醫院肝膽外科, 山東 濟南 250117)
目的: 從結直腸癌肝轉移瘤組織中分選出高純度的CD11b+髓系細胞,從而建立從一種組織中獲得特異單細胞的方法。方法: 采用機械聯合酶消化法將實體瘤組織制備成單細胞懸液;利用流式細胞術分選出CD11b+髓系細胞,并回測細胞純度;采用免疫細胞化學技術對分選出細胞的特異性進行鑒定;采用吉姆薩和臺盼藍染色對獲得細胞進行評價。結果: 流式細胞術能從機械聯合酶消化法制備的單細胞懸液中分選出高純度、足夠數量的CD11b+細胞;分選前細胞陽性率與分選后純度的差異有統計學意義(P<0.01),分選后純度達到實驗研究的要求(P<0.05);免疫細胞化學技術驗證了分選細胞的特異性;分選后的細胞形態完整,活性良好。結論: 機械聯合酶消化法制備的單細胞懸液,經過流式細胞術分選,能夠分選出高純度、活性良好且形態完整的特異性細胞,操作方法穩定可重復,滿足進一步研究的要求。
結直腸癌肝轉移瘤; 流式細胞術; 細胞分選; CD11b+髓系細胞; 免疫細胞化學
結直腸癌是世界范圍內最常見的腫瘤類型之一,肝轉移是結直腸癌患者的主要致死因素[1-2]。目前而言結直腸癌肝轉移患者的五年生存期并沒有多大改觀,有效治療率依舊保持在低水平[3]。腫瘤的轉移是一個多步驟的復雜過程,對肝轉移的抑制是治療結直腸癌有效的手段[4]。大量研究表明髓系細胞廣泛參與了腫瘤轉移灶的形成與進展[5-6],而在結直腸癌肝轉移中,不同亞群的髓系細胞發揮著不同的作用。分泌腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)與誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的樹突狀細胞(TNF-α/iNOS producing dendritic cells,Tip-DCs)是一群表面分子表型為CD11b的特殊類型髓系細胞[7]。前期研究發現,在結直腸癌肝臟轉移灶中,機體通過趨化因子CCL2結合其受體CCR2,募集大量的CD11b+髓系細胞浸潤。而在動物實驗中,選擇性地去除該群CD11b+髓系細胞后肝轉移灶的生長明顯受到抑制,一些已形成的轉移灶縮小甚至消失[8-9]。
因此,對該群髓系細胞參與結直腸癌肝轉移的研究有利于更好地了解肝轉移的分子機制,為臨床工作提供新的方向。我們進一步研究發現肝轉移灶中CD11b+髓系細胞則較多存在于腫瘤浸潤組織的邊緣以及瘤組織的基質中[9]。因此我們探尋從手術取下的肝轉移瘤組織中,對該髓系細胞進行特異分離與提取。本實驗聯合機械-酶消化法與流式細胞術分選出目標細胞,并對獲取的細胞進行鑒定和評價,從而建立了一種從結直腸癌肝轉移瘤組織中獲取特異性細胞的分選方法。
材料和方法
1標本來源
收集2016.02~2016.11期間山東省腫瘤醫院外科七病區肝膽外科中10例結直腸癌肝轉移瘤患者的手術切除組織標本(年齡35~78歲,平均62.8歲),所有患者病理結果確診為結直腸癌肝轉移。取離體30 min內腫瘤邊緣組織1 cm×1 cm×1 cm,立即放入備好的裝有冰冷PBS的保存管內。
2試劑、材料與主要儀器
RPMI-1640培養基、紅細胞裂解液和胎牛血清(Gibco);膠原酶(Roche);胰酶抑制劑(Invitrogen);70 μm細胞篩網(北京優尼康生物科技有限公司);臺盼藍染液(Sigma);吉姆薩工作液(北京索萊寶科技有限公司);細胞計數板、載玻片與蓋玻片(ThermoFisher);抗體CD11b-FITC(11-0113)、抗體IgG1-K-FITC(11-4714)和抗體CD11b-PE(11-0128)均購自eBioscience;即用型DAPI溶液和抗熒光衰減封片劑(北京索萊寶科技有限公司);流式細胞檢測儀(BD,FACSCalibur);流式細胞分選儀(BD,FACSAria Ⅱ);恒溫水浴箱(常州精達儀器);造冰機(上海知信實驗儀器技術有限公司);離心機(Kendro);熒光顯微鏡(Olympus)。
3方法
3.1瘤組織分離成單細胞懸液 將轉移瘤組織放入小培養皿中(保持操作在冰上進行),剪成小塊,越小越好;將剪碎的轉移瘤組織轉移至裝有10 mL RPMI-1640培養基(內含有0.05%的膠原酶100 μL,0.01%的胰酶抑制劑200 μL)的50 mL離心管內;置于37 ℃恒溫水浴箱中保持30 min,每5 min搖晃1次;置于冰上冷卻,后用70 μm的細胞篩網過濾到另一個50 mL試管,用10~20 mL的冰冷PBS沖洗,確保過濾完全; 4 ℃下1 400 r/min離心5 min,去上清,可觀察到一些黏液狀黃色的絮狀物在試管底,用30 mL的冰冷PBS重懸;4 ℃下1 400 r/min離心5 min,去上清,用預熱的紅細胞裂解液(3~5)mL重懸裂解沉淀,室溫下裂解液中保持3 min以裂解紅細胞;用20 mL冰冷FACS緩沖液(PBS、2% FCS和0.09% NaN3)稀釋;再次用70 μm細胞篩網過濾到另一離心管中,去除脂質碎片;4 ℃下1 400 r/min離心5 min,去上清,用20 mL冰冷FACS緩沖液重懸; 4 ℃下1 400 r/min離心5 min,去上清;加入1 mL的FACS染色緩沖液,調整細胞密度到(1~2)×1010/L,取100 μL于顯微鏡下細胞計數;各取100 μL單細胞懸液到2個流式試管(細胞數目1×106左右),分對照(control)組和實驗(experimental)組,6 h內上機檢測。
3.2流式細胞術檢測與分選 實驗組試管加入CD11b-FITC抗體5 μL,對照組試管加入IgG1-K-FITC抗體5 μL,避光,4 ℃孵育(30~40) min;加3 mL FACS緩沖液到每個FACS試管,4 ℃下1 200 r/min離心3 min,去上清;再次加入3 mL FACS緩沖液,4 ℃下1 200 r/min離心3 min,去上清;(200~500) μL冰浴FACS緩沖液重懸細胞;調整流式細胞分選儀到最佳狀態,以CD11b+細胞設門,先檢測樣品中1萬個細胞中免疫表型為CD11b的髓系細胞的百分比,即分選前陽性率,然后對樣品進行分選,收集盡可能多的細胞。
3.3流式細胞術檢測分選后的細胞純度 取分選后的細胞懸液100 μL,加入100 μL冰PBS,以原對照管為基礎熒光,檢測分選得到的細胞懸液中CD11b+細胞的比例,即分選后的純度。
3.4鑒定分選后細胞的特異性 取分選得到的細胞懸液100 μL,加入CD11b-PE(與分選所用的CD11b-FITC克隆號以及結合表位均不同)抗體5 μL, 4 ℃避光孵育30 min;加入FACS緩沖液3 mL,4 ℃下1 200 r/min離心3 min,去上清; 加入適量FACS緩沖液,取細胞懸液滴于載玻片上,保持避光;待玻片上細胞涂層均勻后,滴加100 μL DAPI溶液,保持避光;滴加1滴抗熒光衰減封片劑,避免氣泡生成,加蓋蓋玻片;靜置1 min,立即置于熒光顯微鏡下觀察。
3.5分選后細胞的存活率 將0.4%的臺盼藍染液與分選出的細胞按1∶9混勻,滴入改良牛鮑計數板,3 min內顯微鏡下觀察細胞存活率。計算公式如下:細胞存活率(%)=染色陰性細胞數/細胞總數×100%。
3.6對比觀察細胞形態 取吉姆薩濃縮液0.1 mL和吉姆薩稀釋液0.9 mL充分混勻成1 mL染色液;細胞懸液滴于載玻片上,推片成膜,自然干燥,水平放置;用甲醇固定2~3 min;將細胞涂片放置于染色架上,滴加稀釋好的染色液,使其覆蓋全部細胞,室溫下靜置15~30 min;用PBS緩慢從玻片的一端沖洗(不要先倒去染液或直接對細胞沖洗);趁濕加蓋玻片或待干燥后鏡檢;用分選前后的細胞懸液分別進行染色,對比觀察。
4統計學處理
用軟件SPSS 19.0進行統計學分析。肝瘤組織中CD11b+髓系細胞的數量不一,因此分選前檢測單細胞懸液的陽性細胞的比例各不相同。采用配對樣本t檢驗對10例樣本的分選前陽性率以及分選后純度進行比較,以P<0.01為差異有統計學意義。同時根據以往研究[10-11],流式分選可以達到95%~100%的純度,采用單樣本均數t檢驗,判斷本研究的10例樣本分選純度是否不低于一般流式分選純度,以標準95%為已知總體的分選純度,以P<0.05為差異有統計學意義。
結 果
1流式細胞術檢測CD11b陽性細胞并分選
原始數據通過流式分析軟件FlowJo 7.6.1 分析。除去微小細胞碎片,選取對照組80%左右的樣品設門;以對照組的樣品區域劃分界線,非特異表達的陽性率控制在2%左右;將操作應用于實驗組樣品數據,結果顯示能夠將陽性細胞與陰性細胞分為2個細胞群,實驗組的陽性細胞比率為20%,即為分選前陽性率。表明從瘤組織中能夠分離出陽性細胞,而且分群明顯,進而將圖1C中Q2區域進行分選,見圖1。
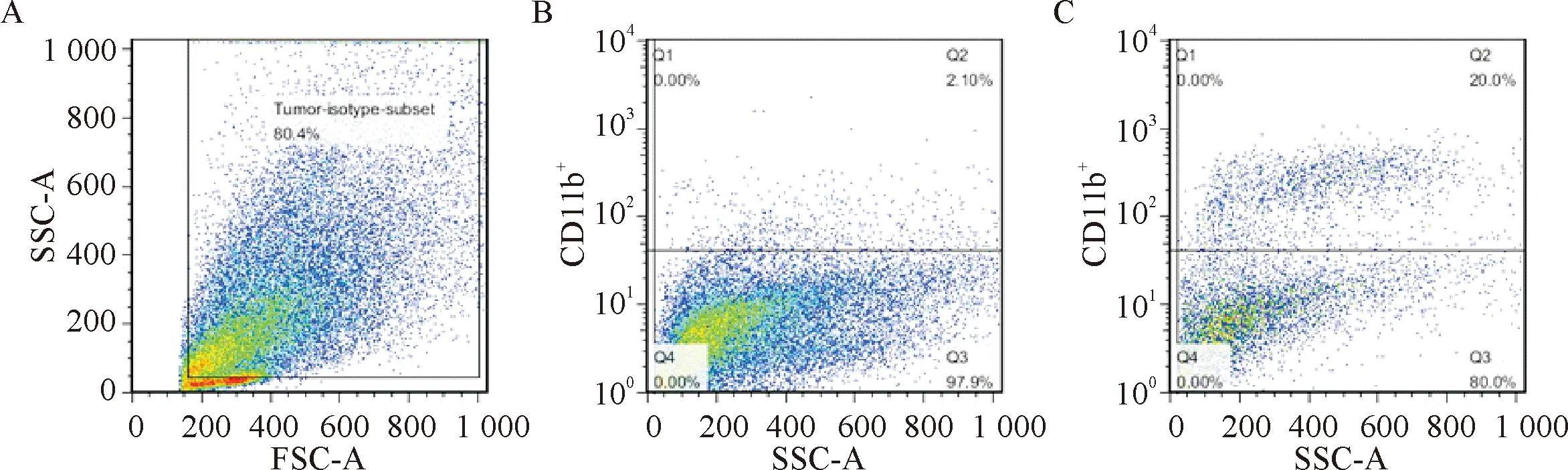
Figure 1. The single cell suspension in control group and experimental group was sorted by flow cytometry. A: selecting the 80.4% sample data in control group; B: defining the boundary according to the data of control group; C: in the experimental group, the negative and positive cells were clearly divided, and the positive rate was 20%.
圖1流式細胞術分選單細胞懸液
2流式細胞術分選后CD11b+細胞純度的測定
流式細胞術分選后得到的單細胞懸液中,檢測陽性細胞的比例,即為分選后純度。圖2A、B為對照組的基礎熒光結果;圖2C為分選后細胞的檢測結果,顯示陽性細胞率達到98%左右。結果表明分選后細胞具有較高純度,可以進行后續的細胞生物學和免疫學研究。
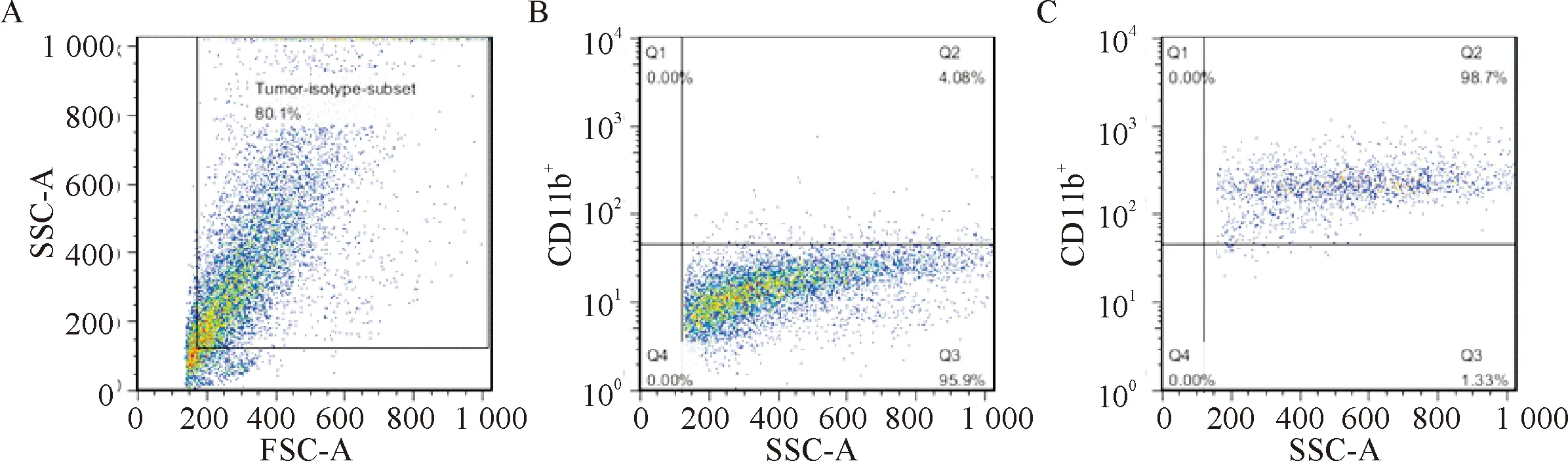
Figure 2. The sorted cells were tested, based on the original control group. A: selecting the 80.1% sample data in control group; B: defining the boundary, nonspecific expression 4.06%; C: the percentage of positive cells was 98.7%.
圖2分選所得單細胞懸液的陽性細胞純度的測定
3分選后細胞的特異性鑒定
采用直接免疫熒光技術對分選出細胞的特異性進行鑒定。熒光顯微鏡3個通道下觀察,1號通道下DAPI染色細胞核呈現藍色熒光(圖3A),2號通道下細胞表面黃綠色熒光為流式分選時標記的CD11b-FITC抗體(圖3B),3號通道下細胞表面呈現均勻的CD11b-PE紅色熒光(圖3C),圖3D為細胞DAPI染色和PE染色的圖片融合,顯示細胞膜呈現紅色熒光,核顯示藍色熒光。結果表明CD11b-PE抗體可以特異性地結合在分選后的細胞表面,證明分選后的細胞為一致的CD11b陽性細胞。
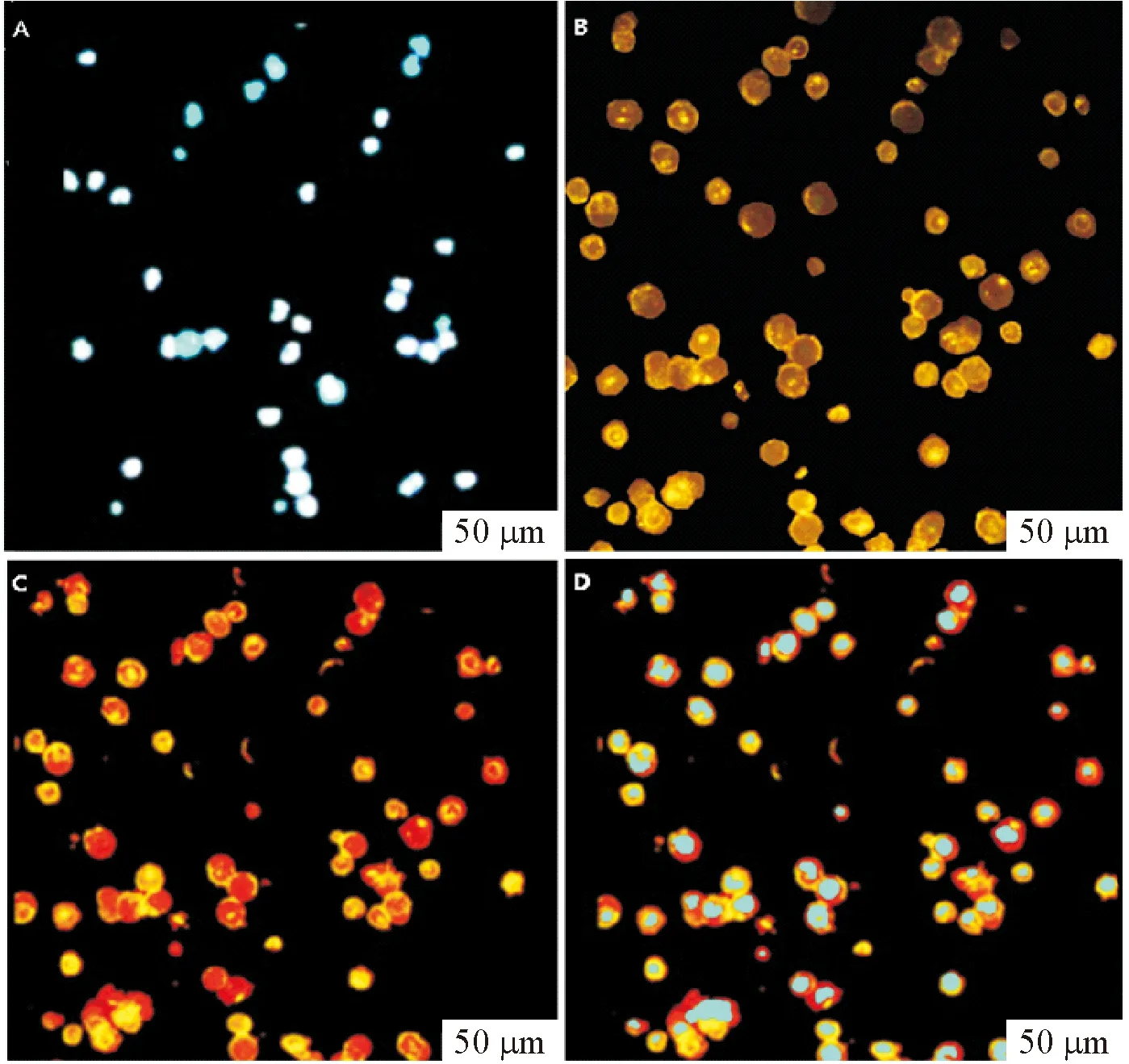
Figure 3. Direct immunofluorescence was observed (×40). A: under channel 1, DAPI staining showed that the nuclei were stained blue; B: under channel 2, the cell membrane showed yellow fluorescence; C: under channel 3, CD11b-PE staining showed that the cell membrane was stained with red; D: the fusion photograph of channel 1 and 3 showed that the cell membrane was red and nuclear was blue.
圖3直接免疫熒光觀察
4分選前后細胞的形態對比
采用吉姆薩染色法對分選前后的細胞形態對比觀察(圖片經過處理)。分選前的細胞成團成塊,形態各不相同,為各種細胞混合;分選后的細胞,不再成團塊,形態類型相似。證明分選后的細胞類型單一,且形態完整,見圖4。
5分選后細胞成活率的計算和分選差異的統計學分析
對10例分選后的細胞樣品進行臺盼藍染色后,根據染色結果計算平均存活率約為(90.2±1.2)%。
統計分析10例樣本分選前細胞陽性率與分選后細胞純度。分選前的陽性細胞率為(18.87±3.14)%,分選后細胞的純度為(96.97±0.66)%(P<0.01),分選效果明顯;分選后細胞純度與一般流式分選純度的差異比較有統計學意義,可以認為該10例樣本平均分選純度高于95%,同時表明所建立的方法具有良好的可重復性,見圖5。

Figure 4. The morphological changes of the cells before and after sorting were observed with Giemsa staining. A: the Giemsa staining showed that the cells were agglomerate before sorting; B: the cells were dissociative after sorting.
圖4吉姆薩染色下細胞分選前后的形態觀察
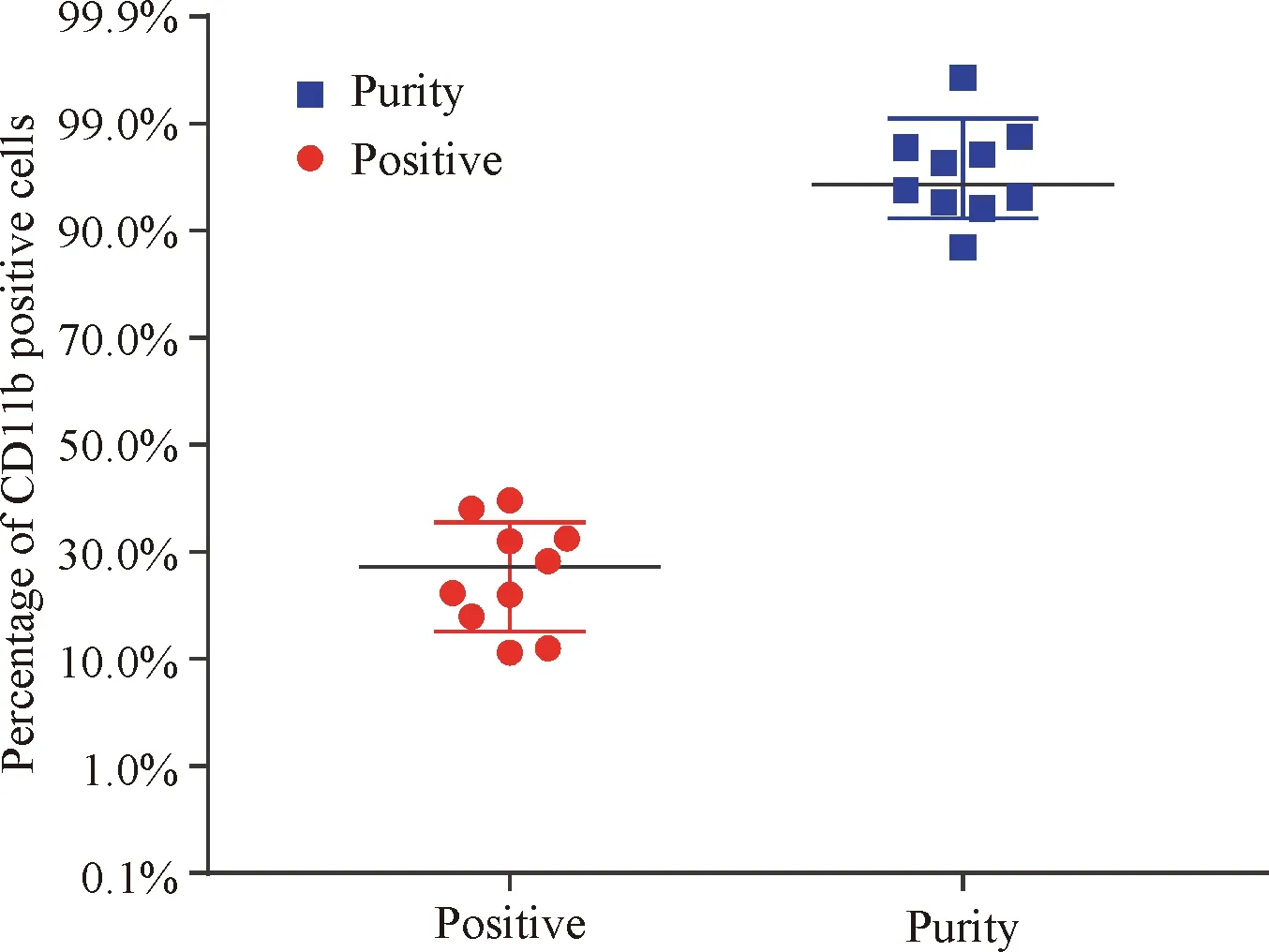
Figure 5. The statistical distribution of the positive rate before sorting and the purity after sorting. Thettest of paired samples proved that the difference was obvious between the positive rate [(18.87±3.14)%] and purity [(96.97±0.66)%] (P<0.01). The single-samplettest showed that the purity of the sorting was higher than that of the general flow sorting, and the difference was significant (single tail,P<0.05/2).n=10.
圖5分選前細胞陽性率以及分選后陽性細胞純度的統計分布
討 論
目前,從實體組織中分離出單細胞的方法分為機械法和化學法兩大類,機械法包括研磨法、網搓法等,化學法有酶消化法、化學試劑分解法等[12]。各類方法的原理各不相同,效果也參差不齊。由于腫瘤組織病理類型的不同,適用的分離方法也不相同[13-15]。結直腸癌肝轉移瘤中,單純的利用機械法處理組織制成單細胞懸液,經過流式檢測,發現分離的細胞數量很有限,同時單細胞懸液中的陽性細胞比例很少,達不到流式分選的上樣條件;而單純利用化學消化法,我們發現,結直腸癌肝轉移瘤的結締組織較多導致并不能充分消化組織塊,難以制成有效的單細胞懸液。因此,我們首先采用機械法將瘤組織剪成勻漿狀態,增大酶消化的接觸面積,然后采用膠原酶消化間質組織進而使充盈其中的髓系細胞游離出來,二者相互配合,不可或缺。同時,在37 ℃水浴消化時加入的胰酶抑制劑可以盡可能地避免細胞死亡破碎時釋放的胰酶對髓系細胞的破壞。
單細胞懸液的細胞純化方法主要有密度梯度離心法、磁珠分選和流式細胞術分選[16]。密度梯度離心法依靠細胞沉降系數,所得到的細胞純度低,并且細胞的表面標記不明確,現已很少使用。對于我們的研究來說,轉移瘤組織的取材部位不同、實驗操作時間的長短都會導致制備的單細胞懸液中CD11b陽性髓系細胞并不多,有時會低于10%。同時盡可能高的細胞純度和數量對于我們來說也是十分必要的,因此盡管磁珠分選能夠使細胞純度達到90%以上,但仍然達不到我們要求的95%以及更高,同時對于表達較低(10%以下)的細胞來說并不適合,而且容易污染[17-18]。流式細胞術具有高的精準度,操作過程封閉,能夠避免污染,分選純度以及回收率均高于磁珠分選,是目前公認的細胞純化的金指標。流式細胞術操作復雜、耗時長、費用昂貴,但是很好地滿足了我們的研究要求[19]。在分選出陽性細胞后,我們依然需要對所獲細胞進行鑒定以及評價。細胞免疫熒光技術鑒定了細胞的特異性,證明所分選的確實是CD11b陽性細胞,而吉姆薩染色表明分選后細胞的形態穩定。結直腸癌肝轉移瘤中的CD11b+髓系細胞的數量受個體差異的影響,實驗分選樣品的陽性率也因此有所不同,因而最后我們通過統計分析證明所建立的方法操作穩定,分選效果顯著。同時10例分選后細胞純度達到了一般流式分選的純度,滿足后續的分子生化以及免疫學研究的要求。通常,在國內外研究中采用細胞培養技術,特異地誘導培養出待研究觀察的細胞,并進行各種細胞生物學的實驗研究,在某些情況下特異性細胞株難以培養或是各種原因難以獲得;而利用手術標本中直接獲得特異性細胞,同樣可以滿足對細胞進行生物化學實驗的要求[20]。因此,這對于相類似的腸道肝轉移瘤組織獲取單細胞進行實驗研究來說,該實驗提供了一種可以參考的實驗技術。
總而言之,CD11b+髓系細胞參與了肝轉移瘤的進展過程,我們對該細胞的分選直接為后續進行的深入研究提供了條件,同時確立了一套結直腸癌肝轉移瘤獲取特異細胞的操作方法。但是受限于離體組織的活性較差且實驗中復雜的操作過程,獲取的細胞在活力與細胞狀態上與體外培養的細胞仍然有較大差距,這也是我們今后不斷改進研究的方向。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1):10-29.
[2] Weiss L, Grundmann E, Torhorst J, et al. Haematogenous metastatic patterns in colonic carcinoma: an analysis of 1541 necropsies[J]. J Pathol, 1986, 150(3):195-203.
[3] Cidón EU. The challenge of metastatic colorectal cancer[J]. Clin Med Insights Oncol, 2010, 4:55-60.
[4] Arru M, Aldrighetti L, Castoldi R, et al. Analysis of prognostic factors influencing long-term survival after hepatic resection for metastatic colorectal cancer[J]. World J Surg, 2008, 32(1):93-103.
[5] Medina-Echeverz J, Eggert T, Han M, et al. Hepatic myeloid-derived suppressor cells in cancer[J]. Cancer Immunol Immunother, 2015, 64(8):931-940.
[6] Sevko A, Umansky V. Myeloid-derived suppressor cells interact with tumors in terms of myelopoiesis, tumorigenesis and immunosuppression: thick as thieves[J]. J Cancer, 2013, 4(1):3-11.
[7] Wilsmann-Theis D, Koch S, Mindnich C, et al. Generation and functional analysis of human TNF-α/iNOS-producing dendritic cells (Tip-DC)[J]. Allergy, 2013, 68(7):890-898.
[8] Yang L, DeBusk LM, Fukuda K, et al. Expansion of myeloid immune suppressor Gr+CD11b+cells in tumor-bearing host directly promotes tumor angiogenesis[J]. Cancer Cell, 2004, 6(4):409-421.
[9] Zhao L, Lim SY, Gordon-Weeks AN, et al. Recruitment of a myeloid cell subset (CD11b/Gr1mid) via CCL2/CCR2 promotes the development of colorectal cancer liver metastasis [J]. Hepatology, 2013, 57(2):829-839.
[10] 陳朱波, 曹雪濤. 流式細胞術: 原理、操作及應用[M]. 第2版. 北京: 科學出版社, 2014: 14-32.
[11] Rieseberg M, Kasper C, Reardon KF, et al. Flow cytometry in biotechnology[J]. Appl Microbiol Biotechnol, 2001, 56(3-4):350-360.
[12] 任興昌, 方 黎, 陳洪勛. 實體組織單細胞懸液制備方法[J]. 臨床與實驗病理學雜志, 2007, 23(4):490-491.
[13] 顏 政, 方馳華.人肝細胞癌細胞亞群的克隆分離及異質性機制的初步研究[J]. 世界華人消化雜志, 2006, 14(5):481-485.
[14] Yovchev MI, Dabeva MD, Oertel M. Isolation, characterization, and transplantation of adult liver progenitor cells[J]. Methods Mol Biol, 2013,976:37-51.
[15] 劉勝軍, 方馳華. 流式細胞儀、免疫磁珠及親和板結合分離法分選c-kit+肝癌細胞的比較[J]. 中華消化外科雜志, 2007, 6(3):206-208.
[16] Fulwyler MJ. Flow cytometry and cell sorting[J]. Blood Cells, 1980, 6(2):173-184.
[17] 黃瑩瑩, 尹盛夏, 曹文強, 等. 高端流式分選與免疫磁珠法純化T細胞的比較[J]. 國際醫藥衛生導報, 2016, 22(22):3377-3383.
[18] 徐 勇, 霍 梅. 免疫磁珠分離及流式細胞儀分選純化外周血CD34+/CD90+干細胞[J]. 臨床檢驗雜志, 2004, 22(4):246-248.
[19] 胡 凡. 流式細胞分選術在生物醫學研究中的應用[J]. 藥物與人, 2014, 27(11):53-54.
[20] Xue K, Xia W, Zhang X, et al. Isolation and identification of stem cells in different subtype of cartilage tissue[J]. Expert Opin Biol Ther, 2015, 15(5):623-632.
(責任編輯: 陳妙玲, 宋延君)
Identification and establishment of sorting method for isolating CD11b+myeloid cells in human hepatic metastases from colorectal cancer
WANG Dong-xu1, 3, HUO Ting-ting2, 3, TIAN Yao-wen1, 3, ZHAO Lei1, 2, 3
(1School of Medicine and Life Sciences, University of Jinan-Shandong Academy of Medical Sciences, Jinan University, Jinan 250200, China;2The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450001, China;3Department of Hepatobiliary Surgery, Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117, China. E-mail: drzhaolei@hotmail.com)
AIM: To establish a method for obtaining specific cells in solid tumor tissue by sorting of CD11b+myeloid cells in hepatic metastases from colorectal cancer.METHODS: Tumor tissues were prepared into single cell suspension by mechanical method combined with enzyme digestion, and then the CD11b+myeloid cells were isolated by flow cytometry. The sorted cells were identified by immunocytochemistry. The viability and morphologiy of the sorted cells were evaluated by Giemsa and Typan blue staining. The cell purity was evaluated by flow cytometry.RESULTS: Sufficient numbers of CD11b+cells with high purity were isolated by sorting with flow cytometry from the single cell suspension prepared by mechanical and enzyme digestion. The purity of the cells was confirmed by statistical analysis (P<0.05). The positive rates of the cells before and after sorting were significantly different (P<0.01). The positive cells were verified by immunocytochemical method. Meanwhile, the sorted cells had complete morphology and good activity.CONCLUSION: The CD11b+myeloid cells in solid tumor tissue can be isolated by flow cytometry from the machine-enzyme digestion suspension with high purity, good activity and complete morphology.
Colorectal liver metastases; Flow cytometry; Cell sorting; CD11b+myeloid cells; Immunocytochemistry
1000- 4718(2017)09- 1723- 06
2017- 03- 20 [
] 2017- 06- 13
國家自然科學基金資助項目(No. 81272375; No. 81472713)
R735.3; R392.32
A
10.3969/j.issn.1000- 4718.2017.09.031
△通訊作者: Tel: 0531-67626242; E-mail: drzhaolei@hotmail.com

