補(bǔ)體旁路激活致內(nèi)皮細(xì)胞纖溶凝血功能的改變及干預(yù)研究
李 敏,路青瑜,李亞男,孫黔云,3
(1. 貴州省人民醫(yī)院干醫(yī)科,貴州 貴陽(yáng) 550002;2.貴州省中國(guó)科學(xué)院天然產(chǎn)物化學(xué)重點(diǎn)實(shí)驗(yàn)室藥理與生物活性研究中心,貴州 貴陽(yáng) 550014; 3.貴州醫(yī)科大學(xué)省部共建藥用植物功效與利用國(guó)家重點(diǎn)實(shí)驗(yàn)室,貴州 貴陽(yáng) 550014)
補(bǔ)體旁路激活致內(nèi)皮細(xì)胞纖溶凝血功能的改變及干預(yù)研究
李 敏1,路青瑜2,李亞男2,孫黔云2,3
(1. 貴州省人民醫(yī)院干醫(yī)科,貴州 貴陽(yáng) 550002;2.貴州省中國(guó)科學(xué)院天然產(chǎn)物化學(xué)重點(diǎn)實(shí)驗(yàn)室藥理與生物活性研究中心,貴州 貴陽(yáng) 550014; 3.貴州醫(yī)科大學(xué)省部共建藥用植物功效與利用國(guó)家重點(diǎn)實(shí)驗(yàn)室,貴州 貴陽(yáng) 550014)
目的研究補(bǔ)體旁路激活導(dǎo)致的微血管內(nèi)皮細(xì)胞纖溶凝血功能的變化以及吡咯烷二硫氨基甲酸(PDTC)和白藜蘆醇(Res)的干預(yù)作用。方法采用眼鏡蛇毒因子激活血清補(bǔ)體旁路途徑。將補(bǔ)體旁路活化的血清作用于人微血管內(nèi)皮細(xì)胞(HMEC),檢測(cè)多個(gè)時(shí)間點(diǎn)細(xì)胞培養(yǎng)上清的水解發(fā)色底物活性變化和對(duì)凝血酶原時(shí)間(PT)、活化部分凝血活酶時(shí)間(APTT)的影響,并制備細(xì)胞懸液,檢測(cè)細(xì)胞表面的抗凝血功能變化情況。采用PDTC、Res對(duì)上述變化指標(biāo)進(jìn)行干預(yù)研究。結(jié)果HMEC經(jīng)補(bǔ)體旁路活化產(chǎn)物刺激后,細(xì)胞培養(yǎng)上清的發(fā)色底物酶解活性明顯上調(diào);細(xì)胞培養(yǎng)上清導(dǎo)致正常血漿的APTT明顯縮短,同時(shí),對(duì)PT也有縮短的作用;經(jīng)補(bǔ)體旁路活化產(chǎn)物刺激HMEC后制備的各時(shí)間點(diǎn)細(xì)胞懸液對(duì)正常血漿的APTT有明顯的縮短作用,6 h刺激組的細(xì)胞懸液也表現(xiàn)出縮短PT的作用。PDTC和Res未能抑制發(fā)色水解活性的上調(diào),但Res對(duì)APTT的縮短有明顯的干預(yù)作用,而PDTC能在一定程度上抑制PT的縮短。結(jié)論補(bǔ)體旁路活化產(chǎn)物會(huì)導(dǎo)致HMEC纖溶凝血功能的失調(diào),而PDTC和Res有一定的干預(yù)作用。
補(bǔ)體;內(nèi)皮細(xì)胞;纖溶;凝血;PDTC;白藜蘆醇;眼鏡蛇毒因子
補(bǔ)體在天然免疫中具有重要作用,但其過(guò)度激活會(huì)引發(fā)炎癥和組織損傷。近年來(lái)研究表明,補(bǔ)體在與炎癥相關(guān)的膿毒癥、急性肺損傷、缺血/再灌注損傷、多器官功能衰竭等臨床急危重癥與病理?yè)p傷中扮演了重要的角色[1-2]。在這些病癥和損傷中往往伴隨有纖溶凝血功能的異常和廣泛的微血栓生成。研究表明,凝血系統(tǒng)功能的異常與補(bǔ)體的激活以及炎癥存在密切的關(guān)系[3-5]。我們之前的研究表明了補(bǔ)體旁路的過(guò)度激活能引起微血管內(nèi)皮細(xì)胞的活化和炎癥反應(yīng)[6-7],與纖溶凝血功能相關(guān)的分子出現(xiàn)了表達(dá)的變化,而PDTC和Res能在一定程度上影響這種變化[8],但尚不清楚這種分子表達(dá)上的變化及干預(yù)是否會(huì)引起相應(yīng)的功能改變。基于內(nèi)皮細(xì)胞在維持纖溶與凝血平衡方面的重要生理功能[9],本文研究了補(bǔ)體旁路激活對(duì)微血管內(nèi)皮細(xì)胞纖溶凝血功能的影響以及PDTC、Res對(duì)相關(guān)變化的干預(yù)作用。
1 材料與方法
1.1材料人微血管內(nèi)皮細(xì)胞(human microvascular endothelial cells,HMEC)由本實(shí)驗(yàn)室傳代培養(yǎng);RPMI 1640培養(yǎng)基購(gòu)自Gibco;胎牛血清為天津?yàn)笊镏破房萍加邢薰井a(chǎn)品;發(fā)色底物S-2251為意大利Chromogenix公司產(chǎn)品;吡咯烷二硫氨基甲酸(pyrrolidinedithiocarbamate,PDTC)、白藜蘆醇(resveratrol,Res)購(gòu)自美國(guó)Sigma公司;標(biāo)準(zhǔn)人血漿購(gòu)自德國(guó)SIEMENS公司;凝血酶原時(shí)間(prothrombin time, PT)、活化部分凝血活酶時(shí)間(activated partial thromboplastin time , APTT)測(cè)定試劑盒購(gòu)自上海太陽(yáng)生物技術(shù)有限公司;正常人血清(normal human serum,NHS)由本實(shí)驗(yàn)室多名健康志愿者獻(xiàn)血制備而成,分裝后凍存于-80℃,經(jīng)補(bǔ)體活性檢測(cè)正常,備用;滅活人血清(inactivated normal human serum,INHS)由NHS于56°C孵育30 min制備;眼鏡蛇毒因子(cobra venom factor,CVF)由本實(shí)驗(yàn)室純化制備,其制備方法和活性測(cè)定同文獻(xiàn)[6];其余試劑均為符合實(shí)驗(yàn)要求的分析純。
1.2主要儀器Forma 3111型CO2培養(yǎng)箱(美國(guó)Thermo公司);Nikon TS100倒置相差顯微鏡(日本Nikon公司);Milli Q超純水系統(tǒng)和Elix純水系統(tǒng)(美國(guó)Millipore公司);Molecular Devices Spectra MAX-190酶標(biāo)儀(美國(guó)MD公司);5810R冷凍離心機(jī)(德國(guó)Eppendorf公司);Revco超低溫冰箱(美國(guó)Thermo公司)。
1.3方法
1.3.1內(nèi)皮細(xì)胞培養(yǎng) 人微血管內(nèi)皮細(xì)胞株HMEC由本實(shí)驗(yàn)室傳代培養(yǎng),用含20%胎牛血清的RPMI 1640培養(yǎng)基在37℃,5% CO2飽和濕度培養(yǎng)箱內(nèi)培養(yǎng),收集對(duì)數(shù)生長(zhǎng)期細(xì)胞進(jìn)行實(shí)驗(yàn)。
1.3.2血清補(bǔ)體旁路活化 參照前期已發(fā)表文獻(xiàn)[6]的方法,將NHS與CVF(6.5×104U·L-1)等體積混合,在37 ℃水浴孵育30 min制成CAC(CVF-activated complement)備用。實(shí)驗(yàn)以INHS與CVF的孵育混合物作為對(duì)照。
1.3.3CAC對(duì)HMEC纖溶活性的影響 將HMEC以1×104cells·well-1接種于96孔細(xì)胞培養(yǎng)板,培養(yǎng)24 h后棄上清,用無(wú)血清RPMI 1640 洗1遍,加入140 μL無(wú)血清RPMI 1640培養(yǎng)基,再加入60 μL CAC至200 μL,分別孵育不同時(shí)間,取1、6、12、24 h細(xì)胞上清,離心,凍存。取100 μL細(xì)胞上清和50 μL的100 U·L-1纖溶酶原加入酶標(biāo)板中,加入100 μL 0.75 mmol·L-1發(fā)色底物S-2251后,37℃孵育3 h,酶標(biāo)儀測(cè)定405 nm處的OD值。
1.3.4CAC對(duì)HMEC凝血功能的影響
1.3.4.1CAC對(duì)細(xì)胞培養(yǎng)上清凝血功能的影響 將HMEC以1×104cells·well-1,接種于96孔細(xì)胞培養(yǎng)板,培養(yǎng)24 h后棄上清,用無(wú)血清RPMI 1640 洗1遍,加入140 μL無(wú)血清RPMI 1640培養(yǎng)基,再加入60 μL CAC至200 μL,分別孵育不同時(shí)間,取1、6、12、24 h細(xì)胞上清,離心,凍存。取解凍的20 μL細(xì)胞上清與100 μL標(biāo)準(zhǔn)人血漿在37℃孵育10 min,加入100 μL預(yù)溫的APTT試劑,繼續(xù)孵育5 min,加入100 μL預(yù)溫的CaCl2溶液,記錄凝固時(shí)間;取化凍的100 μL細(xì)胞上清與100 μL標(biāo)準(zhǔn)人血漿在37 ℃孵育3 min,加入100 μL預(yù)溫的CaCl2溶液,記錄凝固時(shí)間。
1.3.4.2CAC對(duì)細(xì)胞表面凝血功能的影響 將單層融合的HMEC收獲后以5×105個(gè)接種于細(xì)胞培養(yǎng)瓶,24 h后消化收集細(xì)胞,離心,將細(xì)胞沉淀用無(wú)血清RPMI 1640混勻,每個(gè)EP管加入200 μL細(xì)胞懸液(2×104cells),離心,棄上清,然后加入140 μL無(wú)血清RPMI 1640培養(yǎng)基懸浮細(xì)胞,加入60 μL CAC,分別培養(yǎng)1、2、6 h,離心,用預(yù)冷PBS洗滌細(xì)胞2次,然后分別配成1×109cells·L-1和2×108cells·L-1的細(xì)胞懸液。取1×109cells·L-1細(xì)胞懸液20 μL與100 μL標(biāo)準(zhǔn)人血漿在37 ℃孵育10 min,加入100 μL預(yù)溫的APTT試劑,37 ℃孵育5 min,加入100 μL預(yù)溫的CaCl2溶液,記錄凝固時(shí)間;取2×108cells·L-1細(xì)胞懸液100 μL與100 μL標(biāo)準(zhǔn)人血漿于37 ℃孵育3 min,加入100 μL預(yù)溫的CaCl2溶液,記錄凝固時(shí)間。
1.3.5PDTC、Res對(duì)CAC致HMEC凝血纖溶功能變化的作用
雖然濕地類型多種多樣,大都適合旅游開(kāi)發(fā)利用,但并不是所有的濕地都可以納入旅游資源的范圍。濕地旅游資源是指具有一定可進(jìn)入性和觀賞性,具有現(xiàn)存或潛在的客源市場(chǎng),并能為旅游業(yè)所利用的濕地。濕地利用是嚴(yán)格的保護(hù)性利用,即進(jìn)行濕地生態(tài)恢復(fù)和濕地生態(tài)建設(shè),目前安徽沿淮地區(qū)已經(jīng)開(kāi)發(fā)利用的濕地旅游資源主要有濕地保護(hù)區(qū)、濕地公園、水利風(fēng)景區(qū)三大類。
1.3.5.1PDTC、Res對(duì)HMEC纖溶活性的影響 將HMEC以1×104cells·well-1接種于96孔細(xì)胞培養(yǎng)板,24 h后棄上清,用無(wú)血清RPMI 1640 洗1遍。分別加入140 μL含PDTC(終濃度為20、50、100 μmol·L-1)、Res(終濃度為5、10、20 μmol·L-1)的無(wú)血清RPMI 1640,孵育1 h。每孔加入60 μL CAC,1 h取培養(yǎng)上清,凍存。纖溶活性測(cè)定方法同“1.3.3”。
1.3.5.2PDTC、Res對(duì)HMEC細(xì)胞培養(yǎng)上清凝血功能改變的影響 將HMEC以1×104cells·well-1接種于96孔細(xì)胞培養(yǎng)板,24 h后棄上清,用無(wú)血清RPMI 1640 洗1遍。分別加入140 μL含PDTC(終濃度為20、50、100 μmol ·L-1)、Res(終濃度為5、10、20 μmol·L-1)的無(wú)血清RPMI 1640,孵育1 h。每孔加入60 μL CAC,1 h取培養(yǎng)上清,凍存。APTT、PT測(cè)定方法同“1.3.4.1”。
1.3.5.3PDTC、Res對(duì)HMEC細(xì)胞表面凝血功能改變的影響 將單層融合的HMEC收獲后以5×105cells接種于細(xì)胞培養(yǎng)瓶,24 h后消化收集細(xì)胞,離心,將細(xì)胞沉淀用無(wú)血清RPMI 1640混懸,取200 μL(2×104cells)加入EP管中,離心,棄上清,分別加入140 μL含不同濃度PDTC(20、50、100 μmol·L-1)、Res(5、10、20 μmol·L-1)的無(wú)血清RPMI 1640培養(yǎng)基140 μL預(yù)處理細(xì)胞1 h,再加入60 μLCAC,分別培養(yǎng)1、6 h,離心,用預(yù)冷PBS洗滌細(xì)胞2次,后續(xù)操作及APTT、PT的測(cè)定同“1.3.4.2”。
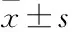
2 結(jié)果
2.1CAC對(duì)HMEC纖溶活性的影響HMEC暴露于CAC后,在1h時(shí)間點(diǎn)檢測(cè)到培養(yǎng)上清中酶切發(fā)色底物S-2251的活性有明顯的上升(P<0.01),而在后續(xù)的各時(shí)間點(diǎn)沒(méi)有出現(xiàn)進(jìn)一步的明顯變化(Fig 1)。(CVF+INHS)對(duì)照組培養(yǎng)上清中的酶活性在后續(xù)的時(shí)間點(diǎn)中有所上升。而NHS本底對(duì)照組酶切S-2251活性的OD值只有0.164±0.046。
2.2CAC對(duì)HMEC凝血功能的影響
2.2.1CAC刺激HMEC后細(xì)胞培養(yǎng)上清對(duì)凝血功能的影響 CAC刺激HMEC后,細(xì)胞培養(yǎng)上清導(dǎo)致了正常血漿的APTT和PT明顯縮短(P<0.01)(Fig 2)。

Fig 1 Effect of CAC on fibrinolysis of HMEC(n=4)
**P<0.01vscontrol

Fig 2 Effect of cell culture supernatant on coagulation after HMEC exposure to CAC(n=4)
**P<0.01vscontrol
2.2.2CAC對(duì)細(xì)胞表面凝血功能的影響 對(duì)細(xì)胞表面的凝血功能測(cè)定表明,CAC刺激HMEC后,導(dǎo)致了細(xì)胞表面凝血功能的變化,使正常血漿的APTT和PT均明顯縮短(P<0.01),其中PT的變化明顯晚于APTT(Fig 3)。

Fig 3 Effect of cell suspension on coagulation after HMEC exposure to CAC(n=4)
**P<0.01vscontrol;##P<0.01vsall other groups
2.2.3PDTC、Res對(duì)CAC致HMEC纖溶凝血功能變化的干預(yù) 干預(yù)實(shí)驗(yàn)的結(jié)果表明,PDTC和Res對(duì)HMEC受CAC刺激后的纖溶功能上調(diào)沒(méi)有明顯的影響(Fig 4);PDTC對(duì)培養(yǎng)上清和細(xì)胞懸液致正常血漿APTT、PT的縮短有一定的干預(yù)作用,但在統(tǒng)計(jì)學(xué)上沒(méi)有顯著性;Res對(duì)培養(yǎng)上清和細(xì)胞懸液導(dǎo)致的APTT縮短有明顯的干預(yù)作用(P<0.01),但對(duì)PT縮短的干預(yù)作用不明顯(Fig 5、6)。

Fig 4 Effect of PDTC and Res on fibrinolysis after HMEC exposure to CAC(n=4)

Fig 5 Effect of PDTC and Res on coagulation function of cell culture supernatant after HMEC exposure to CAC(n=4)
**P<0.01vsmodel
3 討論
我們之前的研究表明,補(bǔ)體旁路激活會(huì)導(dǎo)致HMEC纖溶凝血相關(guān)分子(t-PA、PAI-1、TF、TM、NO)的表達(dá)變化,PDTC、Res對(duì)這種表達(dá)的變化具有一定的干預(yù)作用[ 8 ]。這些纖溶凝血相關(guān)分子的表達(dá)變化能否引起相應(yīng)的功能變化,在本工作中進(jìn)一步研究了HMEC暴露于CAC后在纖溶凝血功能方面的變化情況以及PDTC、Res的干預(yù)作用。
研究結(jié)果顯示,HMEC受到CAC刺激后,1 h時(shí)間點(diǎn)的培養(yǎng)上清水解發(fā)色底物S-2251的活性明顯增強(qiáng),而在后續(xù)各時(shí)間點(diǎn)中,沒(méi)有進(jìn)一步的明顯變化。這與之前研究揭示HMEC受到CAC刺激后t-PA、PAI-1分子表達(dá)的比值變化的結(jié)果是相一致的,表明補(bǔ)體旁路激活對(duì)t-PA、PAI-1分子表達(dá)的改變會(huì)影響HMEC的纖溶功能。對(duì)各時(shí)間點(diǎn)細(xì)胞上清的凝血功能的測(cè)定結(jié)果表明,細(xì)胞上清能導(dǎo)致正常血漿APTT的明顯縮短,其次,也導(dǎo)致了PT的縮短。在接下來(lái)對(duì)細(xì)胞表面的凝血功能進(jìn)行檢測(cè)后發(fā)現(xiàn),經(jīng)CAC刺激后的HMEC表面能明顯縮短正常血漿APTT,與APTT相比,對(duì)PT的影響相對(duì)滯后。此前我們的研究表明,補(bǔ)體旁路激活產(chǎn)物刺激HMEC后,組織因子TF分子的表達(dá)上調(diào),在6 h時(shí)間點(diǎn)開(kāi)始與對(duì)照組出現(xiàn)顯著性的差異[8]。因此,上述PT的變化較APTT滯后,其原因可能與激活PT路徑的TF分子在細(xì)胞表面的表達(dá)變化情況相關(guān)。從細(xì)胞培養(yǎng)上清和細(xì)胞表面的檢測(cè)結(jié)果表明,兩者對(duì)正常血漿凝血功能的影響情況較為一致。我們之前的研究表明,CAC刺激HMEC后,具有抗凝作用的NO的分泌和血栓調(diào)節(jié)蛋白TM的表達(dá)均下調(diào)[8],提示HMEC經(jīng)CAC刺激后抗凝功能減弱。本研究中的纖溶凝血功能測(cè)定結(jié)果則進(jìn)一步表明HMEC經(jīng)CAC刺激后,纖溶促凝分子表達(dá)的上調(diào)和抗凝分子的下調(diào)會(huì)促使其抗凝/促凝調(diào)控功能失衡,從而導(dǎo)致凝血功能紊亂。

Fig 6 Effect of PDTC and Res on coagulation function of cell after HMEC exposure to CAC(n=4)
**P<0.01vsmodel
PDTC和Res對(duì)HMEC纖溶凝血功能變化的干預(yù)研究表明,PDTC和Res對(duì)纖溶活性的上調(diào)基本沒(méi)有影響,但Res對(duì)上述的APTT縮短有明顯的干預(yù)作用,而PDTC能在一定程度上干預(yù)PT的縮短。PDTC是NF-κB信號(hào)通路p65的特異抑制劑,同時(shí)也能通過(guò)清除活性氧中間產(chǎn)物發(fā)揮抗氧化作用,而Res具有抗炎、抗氧化等作用,其機(jī)制與直接抑制NF-κB信號(hào)通路的活化以及通過(guò)抑制煙酰胺腺嘌呤二核苷酸磷酸氧化酶的活化從而減少活性氧的產(chǎn)生有關(guān)[10]。PDTC和Res對(duì)纖溶、凝血功能變化的干預(yù)作用的不同,既反映了兩者在作用機(jī)制上的差異,也為深入開(kāi)展相關(guān)的調(diào)控機(jī)制及干預(yù)研究提供了線索和參考。
本研究通過(guò)體外細(xì)胞實(shí)驗(yàn)表明補(bǔ)體旁路激活會(huì)導(dǎo)致微血管內(nèi)皮細(xì)胞纖溶凝血功能的變化和失調(diào),而PDTC、Res對(duì)這種變化具有一定的干預(yù)作用,這有助于進(jìn)一步認(rèn)識(shí)炎癥情況下纖溶凝血功能改變的發(fā)生機(jī)制以及補(bǔ)體激活在其中扮演的角色,并可能為臨床治療新策略及新藥的篩選和研發(fā)提供參考和適宜的細(xì)胞模型。
(致謝:本實(shí)驗(yàn)是在貴州省中國(guó)科學(xué)院天然產(chǎn)物化學(xué)重點(diǎn)實(shí)驗(yàn)室藥理與生物活性研究中心孫黔云研究員實(shí)驗(yàn)室完成。)
[1] Karpman D, Tati R. Complement activation in thrombotic microangiopathy[J].Hamostaseologie, 2013,33(2): 96-104.
[2] Ricklin D, Hajishengallis G, Yang K, Lambris J D. Complement: a key system for immune surveillance and homeostasis[J].NatImmunol, 2010,11(9): 785-97.
[3] Semeraro N, Ammollo C T, Semeraro F, Colucci M. Sepsis, thrombosis and organ dysfunction[J].ThrombRes, 2012,129(3): 290-5.
[4] Carter A M. Complement activation: an emerging player in the pathogenesis of cardiovascular disease[J].Scientifica(Cairo),2012,2012: 402783.
[5] 李 敏,孫黔云,趙 瓊,等. 補(bǔ)體旁路過(guò)度激活影響體內(nèi)凝血功能[J]. 中國(guó)藥理學(xué)通報(bào),2014,30(1):39-44.
[5] Li M,Sun Q Y,Zhao Q,et al. Abnormality of blood coagulation induced by excessive activation of the alternative complement pathway[J].ChinPharmacolBull,2014,30(1):39-44.
[6] 孫黔云, 李 敏, 葉巧玲, 李紅玲. 補(bǔ)體旁路激活導(dǎo)致內(nèi)皮細(xì)胞活化和損傷[J]. 中國(guó)藥理學(xué)通報(bào),2012,28(7): 925-9.
[6] Sun Q Y, Li M, Ye Q L, Li H L. Endothelial cell activation and injury induced by complement alternative pathway[J].ChinPharmacolBull, 2012,28(7): 925-9.
[7] 李紅玲, 孫黔云,李 敏, 石京山. 補(bǔ)體旁路激活產(chǎn)物刺激內(nèi)皮細(xì)胞NF-κB、p38MAPK、JAK2通路活化及抑制劑的干預(yù)研究[J]. 中國(guó)細(xì)胞生物學(xué)學(xué)報(bào),2013,35(6): 836-41.
[7] Li H L, Sun Q Y, Li M, Shi J S. Activation of NF-κB, p38MAPK, and JAK2 in endothelial cells induced by activated complement alternative pathway and intervention by inhibitors[J].ChinJCellBiol, 2013,35(6): 836-41.
[8] 路青瑜,李 敏,孫黔云. 補(bǔ)體旁路激活致內(nèi)皮細(xì)胞纖溶凝血相關(guān)分子表達(dá)變化及干預(yù)研究[J]. 中國(guó)藥理學(xué)通報(bào),2015,31(8):1142-6.
[8] Lu Q Y,Li M,Sun Q Y. Expression of coagulation-and fibrinolysis-related molecules of endothelial cells induced by activated complement alternative pathway and intervention[J].ChinPharmacolBull,2015,31(8):1142-6.
[9] Pober J S, Sessa W C. Inflammation and the blood microvascular system[J].ColdSpringHarbPerspectBiol, 2014 ,7(1): a016345.
[10] Ma T,Tan M S,Yu J T,Tan L. Resveratrol as a therapeutic agent for Alzheimer’s disease[J].BiomedResInt, 2014,2014: 350516.
Abnormalityofcoagulationandfibrinolysisfunctionsofendothelialcellsinducedbyactivatedcomplementalternativepathwayandintervention
LI Min1, LU Qing-yu2, LI Ya-nan2, SUN Qian-yun2, 3
(1.GeneralWard,GuizhouProvincialPeople’sHospital,Guiyang550002,China; 2.CenterforPharmacologyandBioactivityResearch,theKeyLabofChemistryforNaturalProducts,GuizhouProvinceandChineseAcademyofSciences,Guiyang550014,China; 3.StateKeyLabofFunctionsandApplicationsofMedicinalPlants,GuizhouMedicalUniversity,Guiyang550014,China)
AimTo investigate the change of coagulation and fibrinolysis functions of human microvascular endothelial cells (HMEC) induced by activated complement alternative pathway and effect of pyrrolidine-dithiocarbamate (PDTC) and resveratrol (Res) on intervention.MethodsNormal human serum was activated by cobra venom factor (CVF). After exposure of HMEC to activated complement for various time points, supernatant was removed and assayed for activities of hydrolysing chromogenic substrate and affecting activated partial thromboplastin time (APTT) and prothrombin time (PT). The cells exposed to activated complement were collected and washed, and then the cell suspension was assayed for activity of affecting coagulation function of normal plasma. Lastly, the coagulation and fibrinolysis functions of HMEC pretreated with PDTC and Res were also investigated after HMEC was exposed to activated complement alternative pathway.ResultsThe hydrolysis activity of chromogenic substrate of supernatant was up-regulated significantly after HMEC exposed to activated complement alternative pathway. The supernatant induced APTT decreased significantly, and also shortened PT. The cell suspension of various time points induced APTT decreased significantly, and also shortened PT by suspension of 6 h time point. PDTC and Res failed to inhibit the up-regulation of the chromogenic hydrolysis activity, but Res showed significant intervention on decrease of APTT, and PDTC had better effect on inhibiting the decrease of PT than that of Res.ConclusionActivated complement alternative pathway can induce abnormality of coagulation and fibrinolysis functions of HMEC, and PDTC and Res can affect this change.
complement; endothelial cells; fibrinolysis; coagulation; PDTC; resveratrol; cobra venom factor
10.3969/j.issn.1001-1978.2017.10.020
A
:1001-1978(2017)10-1430-05
R284.1;R322.12;R329.24;R392.11;R331.11;R916.4;R996.3
時(shí)間:2017-9-5 9:26 網(wǎng)絡(luò)出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170905.0925.040.html
2017-05-24,
2017-08-20
國(guó)家自然科學(xué)基金資助項(xiàng)目(No 81260494);貴州省高層次創(chuàng)新型人才項(xiàng)目(黔科合人才[2016]4018號(hào));貴州省科技創(chuàng)新人才團(tuán)隊(duì)項(xiàng)目(黔科合平臺(tái)人才[2016]5625號(hào))
李 敏(1967-),女,主任醫(yī)師,研究方向:血管內(nèi)皮損傷保護(hù),E-mail:limin_67@hotmail.com; 孫黔云(1968- ),男,博士,研究員,研究方向:生化及心血管藥理與新藥發(fā)現(xiàn),通訊作者,Tel:0851-83805095,E-mail:sunqy@hotmail.com
 中國(guó)藥理學(xué)通報(bào)2017年10期
中國(guó)藥理學(xué)通報(bào)2017年10期
- 中國(guó)藥理學(xué)通報(bào)的其它文章
- 槲皮素通過(guò)激活Kv1.5保護(hù)糖尿病大鼠冠脈損傷
- 組蛋白去乙酰化酶抑制劑調(diào)控p21WAF1/CIP1啟動(dòng)子乙酰化水平影響乳腺癌MCF-7細(xì)胞周期
- 腺苷酸環(huán)化酶抑制劑和激動(dòng)劑在脂多糖誘導(dǎo)的急性肺損傷中的作用
- 梓醇對(duì)AGEs刺激腎系膜細(xì)胞介導(dǎo)巨噬細(xì)胞極化的影響
- 吡咯烷二硫代氨基甲酯抑制TNF-α和MMP-9表達(dá)延緩大鼠頸椎間盤(pán)退變及機(jī)制研究
- 金雀異黃酮對(duì)三陰乳腺癌MDA-MB-231細(xì)胞凋亡及EGFR/PI3K/Akt通路的影響
