姜黃素通過調節組織蛋白酶K改善高脂誘導C57BL/6J小鼠骨結構和骨質量的實驗研究
馬如風,王麗麗,左加成,朱如愿,劉海霞,柳辰玥,李 琳,陳貝貝,趙丹丹,莫芳芳,牛建昭,高思華,張東偉
(北京中醫藥大學 1. 中醫學院, 2. 中藥學院, 3. 糖尿病研究中心,北京 100029)
姜黃素通過調節組織蛋白酶K改善高脂誘導C57BL/6J小鼠骨結構和骨質量的實驗研究
馬如風1,王麗麗1,左加成1,朱如愿1,劉海霞1,柳辰玥2,李 琳1,陳貝貝1,趙丹丹3,莫芳芳3,牛建昭1,高思華3,張東偉3
(北京中醫藥大學 1. 中醫學院, 2. 中藥學院, 3. 糖尿病研究中心,北京 100029)
目的探討姜黃素對高脂誘導的C57BL/6J小鼠骨結構和骨質量的影響及其與組織蛋白酶K(cathepsin K)表達的相關性。方法用姜黃素(50 mg·kg-1)干預高脂飼料誘導的C57BL/6J小鼠骨質疏松模型12周后,取小鼠股骨和脛骨,分別用HE染色、茜素紅染色和番紅O /固綠染色觀察骨組織微結構變化、骨代謝以及骨發育情況;用免疫組化法和Western blot法檢測小鼠骨組織中組織蛋白酶K蛋白的表達。結果病理形態學結果顯示,姜黃素能明顯改善高脂誘導的C57BL/6J小鼠的骨組織微結構,促進軟骨發育和改善骨鈣化程度;骨生物力學結果表明,姜黃素能明顯提高高脂誘導C57BL/6J小鼠的骨強度;免疫組化和Western blot檢測結果顯示,姜黃素能夠明顯抑制小鼠骨組織中的組織蛋白酶K表達。結論姜黃素能提高高脂誘導C57BL/6J小鼠的骨強度,改善骨微結構,其發揮骨保護作用機制之一可能與抑制組織蛋白酶K的表達相關。
姜黃素;骨微結構;骨生物力學;骨鈣化;組織蛋白酶K;C57BL/6J小鼠
糖尿病性骨質疏松(diabetic osteoporosis, DOP)是一種由糖尿病誘發的慢性骨代謝疾病,臨床研究表明,1/2~2/3的糖尿病患者伴有骨強度的下降,其中有近1/3的患者可診斷為骨質疏松[1]。糖尿病誘發骨代謝紊亂,使骨骼變脆而缺少韌性,尤其是在發病后期稍遇外力則易發生骨折[2-3]。DOP的發病機制涉及到破骨細胞活性增強、成骨細胞活性減弱、骨微循環異常、氧化應激以及晚期糖基化終末產物增加等因素[2,4-5]。有研究證明,糖尿病大鼠[6]和糖尿病絕經期婦女[7]骨組織中組織蛋白酶K的表達水平明顯升高,從而促進破骨細胞的活化和骨吸收增強。因此,組織蛋白酶K在DOP的發生和發展過程中有重要的作用。
姜黃首載于唐代《新修本草》中,具有行氣活血、通經止痛、祛風痹痛等功效。姜黃素(Curcumin)是從姜科姜黃屬植物姜黃、郁金、莪術等根莖中提取的一種酚類化合物,是中藥郁金、姜黃的主要活性成分,具有抗炎、抗氧化、防治糖尿病[8]及其并發癥[9-10]的作用。本實驗室和其他實驗室的前期研究結果均表明,姜黃素能降低2型糖尿病模型動物的血糖水平,改善胰島素抵抗[11-13],但是姜黃素是否具有改善DOP的作用目前還未知。因此,為了探索姜黃素對DOP的作用和可能的作用機制,本研究擬以高脂飼料誘導C57BL/6J模型為基礎,觀察姜黃素治療12周后,小鼠骨組織的病理變化和生物力學變化,以及其對骨質疏松關鍵酶組織蛋白酶K的調節作用。1材料
1.1儀器萊卡石蠟切片機(德國);Olympus BX53倒置熒光顯微鏡(日本);博勒飛質構儀CT3(美國);Azure c300化學發光成像系統(美國)。
1.2試劑與藥物姜黃素(上海升華醫藥科技有限公司);ECL超敏發光液(北京普利萊基因技術有限公司);鹽酸吡格列酮片(pioglitazone,北京太平洋藥業有限公司,批號:140908,規格:15 mg/片);茜素紅、番紅O、固綠(Sigma-Aldrich,美國);Cathepsin K抗體(H-130,sc28867, Santa Cruz)。
1.3動物♂ SPF級C57BL/6J小鼠,平均體質量20 g,購自斯貝福(北京)實驗動物科技有限公司,許可證號SCXK(京)2011-0004。飼養于北京中醫藥大學科研實驗中心清潔級動物實驗室,合格證號SCXK(京)2011-0024,室溫22℃,相對濕度(55±5)%,光暗周期12 h/12 h。實驗期間小鼠給予自由飲水。2方法
2.1高脂動物模型的構建將C57BL/6J ♂小鼠用高脂飼料(20%蔗糖、2.5%膽固醇、10%豬油、1%膽酸鈉、66.5%基礎飼料,購于北京華阜康生物科技股份有限公司)喂養1個月后,選取血糖≥11.1 mmol·L-1的小鼠30只,隨機等分為模型組(Model group)、陽性藥吡格列酮組(pioglitazone group)和姜黃素組(curcumin group),同時設正常組(Normal group)小鼠10只,普通飼料喂養。實驗時,正常組和模型組小鼠給予去離子水灌胃,陽性藥組小鼠給予吡格列酮(10 mg·kg-1),姜黃素組小鼠給予姜黃素(50 mg·kg-1),連續給藥12周。除正常組外,其余各組小鼠均給予高脂飼料喂養。
2.2取材及樣品制備12周后,小鼠用1%戊巴比妥(0.04 mL·kg-1)腹腔麻醉處死。然后分離兩側股骨和脛骨,剝離附著的肌肉組織。將右側股骨、脛骨用生理鹽水浸濕的紗布包被,置-80℃備用,左側股骨先置于10%中性福爾馬林中固定72 h后,用15% EDTA鈉(pH 7.4)溶液脫鈣,脫鈣液每2周更換1次,連續脫鈣3個月后沖水,包埋,切片備用。
2.3骨生物力學的測定用質構儀對各組小鼠股骨進行三點彎曲實驗。將小鼠股骨置于跨距為7 mm的2個支撐點上,標本的寬面朝上水平放置,使探頭以10 mm·min-1的速度緩慢下降,標本斷裂后繼續運行2 mm停止。根據探頭下降的距離與載荷,結合骨斷端直徑,計算出第一循環硬度、硬度形變量、峰值壓力等骨生物力學參數。
2.4骨組織HE染色將股骨石蠟切片(5 μm)常規HE染色,透明,封片,顯微鏡下觀察病理變化并拍照。
2.5茜素紅染色(AlizarinRedSStain) 按郭魚波等[14]描述的實驗方法,將股骨石蠟切片常規脫蠟;茜素紅染色2 min;用丙酮和丙酮-二甲苯混合液分別分色20 s;透明,封片,顯微鏡下觀察并拍照。用Image Pro Plus 6.0圖像分析軟件分析Alizarin Red S Stain的相對IOD值。
2.6番紅O/固綠染色(SafraninO/FastGreenStain) 將股骨石蠟切片常規脫蠟,蘇木精染色5 min,自來水沖洗3 min,1% HCl-乙醇分化2 s,去離子水洗3次,0.05% Fast Green染色5 min后,用1%醋酸洗30 s,0.1% Safrain O染色5 min后,95%乙醇洗3次,100%乙醇洗2次,透明,封片,顯微鏡下觀察,拍照。用Image Pro Plus 6.0圖像分析軟件分析Safranin O/Fast Green Stain的相對IOD值。

Fig 1 HE staining of femoral metaphysis in mice(×100)
A:Normal;B:Model;C:Pioglitazone;D:Curcumin

Fig 2 Alizarin red S staining offemoral metaphysis in mice(±s,n=7)
Alizarin red S staining(A×100) and its analysis(B). 1:Normal;2:Model;3:Pioglitazone;4:Curcumin.#P<0.05vsnormal group;*P<0.05vsmodel group
2.7免疫組織化學染色參照Guo等[15]描述的實驗方法,將股骨石蠟切片常規脫蠟,骨組織抗原修復液(上海舜百生物科技有限公司)進行抗原修復后,用3% H2O2室溫孵育30 min,然后用10%山羊血清封閉30 min,滴加1 ∶200稀釋的Cathepsin K抗體,4℃孵育過夜,然后滴加辣根酶標記的二抗工作液,室溫孵育30 min,DAB顯色,蘇木精復染后常規脫水、透明、封片,顯微鏡下觀察,拍照。用Image Pro Plus 6.0分析軟件進行圖像分析,測定陽性細胞的平均吸光度(A)。
2.8Westernblot參照Guo等[15]描述的實驗方法,用RIPA裂解液提取在液氮里研碎的骨組織蛋白后,取80 μg蛋白溶液,加到12%的SDS-PAGE電泳膠電泳分離,然后轉印至PVDF膜,分別將膜與Cathepsin K(1 ∶500)和β-actin(1 ∶1 000)抗體4℃孵育過夜。次日,將膜與相應的二抗室溫共孵育1 h,然后用ECL超敏發光液顯色,Azure c300化學發光成像系統拍照,并用Image Pro Plus 6.0圖像分析軟件進行半定量灰度值分析。

Fig 3 Safrain O/Fast Green stainingof femoral epiphysis in mice(±s,n=7)
Safranin O/fast green staining(A×100) and its analysis(B). 1:Normal; 2:Model; 3:Pioglitazone; 4:Curcumin.#P<0.05vsnormal group;*P<0.05vsmodel group
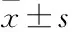

Fig 4 Femur bone biomechanics in mice(±s,n=7)
Three-point bending examination results of the hardness variable(A), first cycle hardness(B) and peak pressure(C).#P<0.05vsnormal group;*P<0.05vsmodel group.
3 結果
3.1姜黃素對高脂喂養小鼠股骨病理形態學的影響實驗小鼠的股骨組織切片HE染色結果如Fig 1所示。光鏡(×100)下觀察發現,正常小鼠股骨干骺端鏡下骨小梁呈網狀,排列整齊,骨微結構完整。與正常組小鼠相比,模型組小鼠股骨干骺端脂滴增多,骨小梁結構紊亂、變細、斷裂。與模型組小鼠相比,陽性藥組和姜黃素組小鼠的骨小梁排列相對整齊,骨微結構形態明顯改善,脂滴明顯減少,骨小梁增粗排列較規則,但與正常組小鼠相比,姜黃素組小鼠骨組織結構仍然未恢復到正常狀態。
3.2姜黃素對高脂喂養小鼠股骨組織鈣化的影響在成骨細胞分化過程中,鈣離子與茜素紅反應后,沉積形成鈣結節。鈣結節數量反映了成骨細胞的活化程度和骨形成速度。茜素紅染色(Fig 2A)和圖像分析結果(Fig 2B)顯示,與正常組小鼠相比,模型組小鼠股骨成骨細胞鈣化結節數量減少(P<0.05);與模型組小鼠相比,陽性藥組和姜黃素組小鼠的鈣結節和數量明顯增加,分布也相對比較均勻(P<0.05)。3.3姜黃素對高脂喂養小鼠軟骨組織修復的影響骨組織軟骨中的糖胺聚糖可以被番紅O染成紅色,鈣化骨則可以被固綠染成綠色。如Fig 3A的Safrain O/Fast Green染色所示,光鏡下觀察發現,模型組小鼠可見到形態不均勻的紅色,正常組、陽性藥組、姜黃素組小鼠可見到形態相對均勻的紅色。圖像分析結果(Fig 3B)表明,同正常組小鼠相比,模型組小鼠股骨的糖胺聚糖含量明顯減少(P<0.05)。同模型組小鼠相比,給予姜黃素和吡格列酮連續治療12周后,高脂飲食小鼠股骨干骺端的糖胺聚糖含量明顯增加(P<0.05),分布也相對比較均勻。
3.4姜黃素對高脂喂養小鼠股骨生物力學的影響各組小鼠股骨生物力學檢測結果見Fig 4。與正常組小鼠相比,模型組小鼠股骨的硬度形變量、第一循環硬度和峰值壓力均明顯降低(P<0.05)。與模型組小鼠相比,經吡格列酮和姜黃素治療12周后的高脂飲食小鼠股骨硬度形變量、第一循環硬度和峰值壓力均升高(P<0.05)。

Fig 5 Effect of curcumin on expression of cathepsin K in mouse bone tissues
A, B: Immunohistochemical staining and the analyses of cathepsin K level in the femurs of mice. a1, a2: Normal; b1, b2: Model; c1, c2: Pioglitazone; d1, d2: Curcumin. C: Western blot images and the analyses of cathepsin K level in the tibias of mice.#P<0.05vsnormal group;*P<0.05vsmodel group
3.5姜黃素對高脂喂養小鼠骨組織中組織蛋白酶K表達的影響如Fig 5所示,與正常組小鼠相比,模型組小鼠骨組織中的組織蛋白酶K的表達明顯升高(P<0.05);與模型組小鼠相比,經姜黃素和吡格列酮治療12周后的高脂飲食小鼠組織蛋白酶K的表達明顯降低(P<0.05),且免疫組化法和Western blot的檢測結果一致。
4 討論
糖尿病患者糖脂代謝異常,可通過不同的途徑影響骨代謝,從而導致DOP的發生。現代醫學認為1型糖尿病可以導致骨質疏松[16],2型糖尿病發病機制復雜[17],糖尿病病程、性別、年齡、體質量指數、糖尿病合并癥及部分治療糖尿病的藥物等因素,均可導致骨基質轉換下降、鈣鹽丟失、骨脆性增加、骨微結構退變,由此誘發骨質量下降及骨折的發生率明顯增高,進而誘發骨質疏松[18]。
近年來,具有膠原酶活性的組織蛋白酶K越來越受到關注。組織蛋白酶K參與多種疾病的發病過程中,且與骨質疏松的關系最為密切,是破骨細胞中目前發現的最主要、表達水平最高、溶骨活性最強的細胞因子,參與細胞外基質的降解[19]。在骨降解中,活化的破骨細胞能分泌酸性物質溶解骨表面的礦物質,同時骨膠原或骨基質也被破骨細胞分泌的組織蛋白酶K降解。研究表明,破骨細胞中組織蛋白酶K的膠原蛋白酶活性過高是導致骨和軟骨組織等處骨基質和骨軟骨膠原蛋白的過度降解,進而誘發骨質疏松的主要原因[20]。
國內外大量研究證實,姜黃素能明顯地改善胰島素抵抗和糖脂代謝紊亂,能在一定程度上預防和治療2型糖尿病及其慢性并發癥。Arun等[12]和Mahesh等[13]研究表明,姜黃素能明顯降低糖尿病模型大鼠的血糖水平。Suryanarayana等[21]研究發現,姜黃素可以延緩由鏈脲佐菌素(streptozotocin,STZ)誘導的糖尿病大鼠白內障的進展及成熟。體外研究發現,姜黃素可通過刺激破骨細胞的凋亡,抑制骨吸收[22],還可以抑制破骨細胞的形成和分化[23]。本實驗室的前期研究[15]也發現,組織蛋白酶K的過度表達與糖尿病小鼠骨質的惡化關系密切。本實驗的結果也表明,姜黃素連續治療12周后,可以明顯改善高脂喂養小鼠的骨微結構,促進骨鈣化和軟骨的發育;提高小鼠股骨的第一循環硬度、硬度形變量,峰值壓力,增強骨生物力學性能。免疫組化法和Western blot研究結果表明,姜黃素能夠明顯抑制股骨和脛骨組織中Cathespin K的蛋白表達水平,進而保護高脂誘發的骨質惡化,以上結果同研究報道相一致。
綜上所述,本實驗研究證明,姜黃素能改善高脂喂養的C57BL/6J小鼠的骨微結構、骨鈣沉積水平和骨生物力學性能,其作用機制可能是通過調節誘發骨質疏松的關鍵因子組織蛋白酶K,進而發揮改善高脂飲食小鼠骨代謝作用的。
(致謝:本文實驗在北京中醫藥大學逸夫科研樓高思華團隊實驗室完成,在此對指導老師和實驗參與人員表示感謝!)
[1] Strotmeyer E S, Cauley J A. Diabetes mellitus, bone mineral density, and fracture risk[J].CurrOpinEndocrinolDiabetesObes, 2007,14(6): 429-35.
[2] Wongdee K, Charoenphandhu N. Osteoporosis in diabetes mellitus: Possible cellular and molecular mechanisms[J].WorldJDiabetes, 2011,2(3): 41-8.
[3] Saito M, Marumo K. Collagen cross-links as a determinant of bone quality: a possible explanation for bone fragility in aging, osteoporosis, and diabetes mellitus[J].OsteoporosisInt, 2010,21(2): 195-214.
[4] 劉幗靜,呼曉雷,何發忠,等. 2型糖尿病骨質疏松研究進展[J]. 中國藥理學通報, 2016,32(10): 1333-6.
[4] Liu G J, Hu X L, He F Z, et al. The research progress of type 2 diabetes osteoporosis[J].ChinPharmacolBull,2016,32(10): 1333-6.
[5] 李 近,楊亞軍,劉鈺瑜. FoxOs與骨質疏松[J]. 中國藥理學通報, 2016,32(2): 169-71.
[5] Li J, Yang Y J, Liu Y Y. FoxOs and osteoprosis[J].ChinPharmacolBull,2016,32(2): 169-71.
[6] Hie M, Tsukamoto I. Increased expression of the receptor for activation of NF-kappaB and decreased runt-related transcription factor 2 expression in bone of rats with streptozotocin-induced diabetes[J].IntJMolMed, 2010,26(4): 611-8.
[7] Alselami N M, Noureldeen A F, Al-Ghamdi M A, et al. Bone turnover biomarkers in obese postmenopausal Saudi women with type-II diabetes mellitus[J].AfrHealthSci, 2015,15(1): 90-6.
[8] Zhang D W, Fu M, Gao S H, et al. Curcumin and diabetes: a systematic review[J].EvidBasedComplementAlternatMed, 2013, 2013: 636053.
[9] 于冬青,鄧華聰. 姜黃素對糖尿病大鼠糖、脂代謝及氧化應激的影響[J]. 重慶醫學, 2005,34(1): 37-9.
[9] Yu D Q, Deng H C. Effect of curcumin on glucose and lipid metabolism and oxidative stress in diabetic rats[J].ChongqingMed, 2005,34(1): 37-9.
[10] 付海爾,李建民,劉玉紅. 姜黃素對STZ誘導C57BL/6小鼠血糖、血脂影響[J]. 遼寧中醫藥大學學報, 2016,18(5): 56-8.
[10] Fu H E, Li J M, Liu Y H. Effects of blood glucose and blood lipid of curcumin on C57BL/6 mice induced by STZ[J].LiaoningUnivTraditChinMed, 2016,18(5): 56-8.
[11] 秦培潔. 姜黃素對2型糖尿病模型大鼠及3T3-L1前脂肪細胞PTP1B通路的影響研究[D]. 北京:北京中醫藥大學, 2014.
[11] Qin P J. Effect of curcumin on PTP1B pathway in type 2 diabetic rats and 3T3-L1 preadipocytes[D]. Beijing:Beijing University of Chinese Medicine,2014
[12] Arun N, Nalini N. Efficacy of turmeric on blood sugar and polyol pathway in diabetic albino rats[J].PlantFoodsHumNutr, 2002,57(1): 41-52.
[13] Mahesh T, Balasubashini M S, Menon V P. Effect of photo-irradiated curcumin treatment against oxidative stress in streptozotocin-induced diabetic rats[J].JMedFood, 2005,8(2): 251-5.
[14] 郭魚波,王麗麗,馬如風,等. 女貞子水提液對去卵巢大鼠骨結構和骨代謝的影響研究[J]. 中草藥, 2016,47(7): 1155-62.
[14] Guo Y B, Wang L L, Ma R F, et al. Effects of water extract from Ligustri Lucidi Fructus on bone structure and metabolism in ovariectomized rats[J].ChinTraditHerbalDrugs,2016,47(7): 1155-62.
[15] Guo Y, Wang L, Ma R, et al. JiangTang XiaoKe granule attenuates cathepsin K expression and improves IGF-1 expression in the bone of high fat diet induced KK-Ay diabetic mice[J].LifeSci, 2016,148: 24-30.
[16] Dhaon P, Shah V N. Type 1 diabetes and osteoporosis: a review of literature[J].IndianJEndocrinolMetab, 2014,18(2): 159-65.
[17] Yamaguchi T, Sugimoto T. Bone metabolism and fracture risk in type 2 diabetes mellitus[J].EndocrJ, 2011,58(8): 613-24.
[18] Lee R H, Pieper C F, Colon-Emeric C. Functional impairments mediate association between clinical fracture risk and type 2 diabetes mellitus in older women[J].JAmGeriatrSoc, 2015,63(8): 1546-51.
[19] Garnero P, Borel O, Byrjalsen I, et al. The collagenolytic activity of cathepsin K is unique among mammalian proteinases[J].JBiolChem, 1998,273(48): 32347-52.
[20] Duong L T, Leung A T, Langdahl B. Cathepsin K inhibition: a new mechanism for the treatment of osteoporosis[J].CalcifTissueInt, 2016,98(4): 381-97.
[21] Suryanarayana P, Saraswat M, Mrudula T, et al. Curcumin and turmeric delay streptozotocin-induced diabetic cataract in rats[J].InvestOphthalmolVisSci, 2005,46(6): 2092-9.
[22] Ozaki K, Kawata Y, Amano S, et al. Stimulatory effect of curcumin on osteoclast apoptosis[J].BiochemPharmacol, 2000,59(12): 1577-81.
[23] von Metzler I, Krebbel H, Kuckelkorn U, et al. Curcumin diminishes human osteoclastogenesis by inhibition of the signalosome-associated I kappaB kinase[J].JCancerResClinOncol, 2009,135(2): 173-9.
Anexperimentalstudyofeffectofcurcuminonimprovementofbonemicroarchitectureandbonequalityinhigh-fat-dietC57BL/6JmiceanditsassociationwithcathepsinK
MA Ru-feng1, WANG Li-li1, ZUO Jia-cheng1, ZHU Ru-yuan1, LIU Hai-xia1, LIU Chen-yue2, LI Lin1,CHEN Bei-bei1, ZHAO Dan-dan3, MO Fang-fang3, NIU Jian-zhao1, GAO Si-hua3, ZHANG Dong-wei3
(1.PreclinicalMedicineSchool,BeijingUniversityofChineseMedicine,Beijing100029,China;2.CollegeofTraditionalChineseMedicine,BeijingUniversityofChineseMedicine,Beijing100102,China;3.DiabetesResearchCenter,BeijingUniversityofChineseMedicine,Beijing100029,China)
AimTo investigate the effect of curcumin against high-fat-diet induced C57BL/6J mice bone changes and the correlation between the expression of cathepsin K and curcumin.MethodsCurcumin treated C57BL/6J mice had been on high fat diet for 12 weeks. The HE, Alizarin red S staining and Safranin O/fast green staining of femur were employed to evaluate bone microstructure, bone metabolism and bone development. The expressions of cathepsin K were assessed by Western blot and immunohistochemical staining.ResultsHistopathological results showed that curcumin could improve the destruction of trabecular bone structure, cartilage development and bone calcification. Biomechanical results proved that curcumin could improve the bone strength of the type 2 diabetic mice induced by high fat. The results of immunohistochemistry and Western blot assay indicated that curcumin could significantly inhibit the expression of cathepsin K in bone tissues of mice.ConclusionCurcumin can increase bone strength, improve bone microstructure, and enhance the degree of bone calcification, which may be achieved by inhibiting the expression of cathepsin K.
curcumin; bone microarchitecture; bone mechanical strength; bone calcification: cathepsin K; C57BL/6J diabetic mice
10.3969/j.issn.1001-1978.2017.10.023
A
:1001-1978(2017)10-1446-06
R-332;R282.71;R336;;R587.2;R681.01;R977.3
時間:2017-9-5 9:26 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170905.0925.046.html
2017-05-20,
2017-08-15
國家自然科學基金資助項目(No 81273995,81274140);國家科技部“重大新藥創制”科技重大專項(No 20122X09103201);高等學校學科創新引智計劃資助項目(No B07007);北京市自然科學基金資助項目(No 7172126)
馬如風(1988-),男,碩士生,研究方向:代謝性疾病的發病機制,E-mail:marufeng5188@126.com; 張東偉(1974-),男,博士,副研究員,研究方向:中藥活性成分的篩選和作用機制,通訊作者,Tel:010-64286915,E-mail:zhdw1006@163.com