褐飛虱熱激蛋白70在不同溫度脅迫下的差異表達(dá)特性研究
單丹 王利華 張?jiān)铝?韓陽(yáng)春 牛洪濤 潘磊 方繼朝1,,*
(1南京農(nóng)業(yè)大學(xué) 植物保護(hù)學(xué)院,南京 210095;2江蘇省農(nóng)業(yè)科學(xué)院 植物保護(hù)研究所,南京 210014;#共同第一作者;*通訊聯(lián)系人,E-mail: fangjc126@126.com)
褐飛虱熱激蛋白70在不同溫度脅迫下的差異表達(dá)特性研究
單丹1,2,#王利華2,#張?jiān)铝?韓陽(yáng)春2牛洪濤2潘磊2方繼朝1,2,*
(1南京農(nóng)業(yè)大學(xué) 植物保護(hù)學(xué)院,南京 210095;2江蘇省農(nóng)業(yè)科學(xué)院 植物保護(hù)研究所,南京 210014;#共同第一作者;*通訊聯(lián)系人,E-mail: fangjc126@126.com)
【目的】褐飛虱是我國(guó)主要水稻害蟲(chóng)之一,隨著全球氣候變暖,其越冬范圍逐年擴(kuò)大。為了明確褐飛虱對(duì)溫度的適應(yīng)機(jī)制,研究了其熱激蛋白70基因家族的組成及溫度誘導(dǎo)表達(dá)特性。【方法】利用轉(zhuǎn)錄組測(cè)序和GenBank數(shù)據(jù)庫(kù)獲取熱激蛋白70基因序列,采用MEGA4.1鄰接法構(gòu)建進(jìn)化樹(shù),利用實(shí)時(shí)熒光定量PCR研究其溫度誘導(dǎo)表達(dá)特性。【結(jié)果】篩選出與熱激蛋白70基因同源性較高且具有完整開(kāi)放閱讀框的序列共15個(gè),其中8個(gè)在正常或溫度脅迫下表達(dá),可能分布在細(xì)胞質(zhì)/細(xì)胞核、內(nèi)質(zhì)網(wǎng)、線(xiàn)粒體等器官,且本身表達(dá)豐度存在顯著差異。30~44℃高溫脅迫后KX976471、KX976473、KX976475、KX976476、KX976477和KX976478等6個(gè)基因的表達(dá)量不同程度上調(diào),最大上調(diào)倍數(shù)為1.72~245.33;0~22℃低溫脅迫后,除KX976475表達(dá)量上調(diào)2.38倍外,其余基因表達(dá)量變化不顯著或下降。【結(jié)論】褐飛虱8個(gè)熱激蛋白70基因在正常或溫度脅迫下表達(dá),可能分布于細(xì)胞質(zhì)/核、線(xiàn)粒體、內(nèi)質(zhì)網(wǎng);在其高溫適應(yīng)性中可能起重要作用,但在低溫適應(yīng)性中的作用有限。
褐飛虱;溫度;熱激蛋白70;誘導(dǎo)表達(dá)
褐飛虱是危害我國(guó)水稻的三種主要稻飛虱之一。據(jù)統(tǒng)計(jì),自20世紀(jì)以來(lái),褐飛虱在東亞的暴發(fā)次數(shù)超過(guò)10次,而且危害有加重的趨勢(shì)[1]。江蘇省2004-2013 年的 10 年間,有3年褐飛虱大發(fā)生,3年偏重及偏重至大發(fā)生。廣西省1991-2012年的22年間,褐飛虱偏重或大發(fā)生年份竟占17年,中等發(fā)生年份僅為5年[2]。貴州省江口縣在1977-2007間,大發(fā)生年份有5年,中等偏重發(fā)生年份有5年[3]。
褐飛虱的發(fā)生受多種因素的影響。稻田生態(tài)系統(tǒng)自我調(diào)節(jié)能力差、水稻品種敏感、遷入蟲(chóng)量大、氣候適宜等是褐飛虱大發(fā)生的主要原因[1]。褐飛虱最適發(fā)育溫度為24~28℃[4,5]。28℃時(shí)產(chǎn)卵量最高,發(fā)育歷期最短;34℃是其發(fā)育的限制性高溫,該溫度下卵不能孵化[5]。褐飛虱對(duì)高溫具有一定的適應(yīng)性。在一定的范圍內(nèi),適當(dāng)提高溫度有利于褐飛虱繁殖,促進(jìn)其種群發(fā)展[6,7]。Ghobadifar等[8]發(fā)現(xiàn),在29~32℃氣溫下田間仍有褐飛虱活動(dòng);但是發(fā)生季節(jié)連續(xù)低溫抑制褐飛虱的發(fā)育,導(dǎo)致低齡幼蟲(chóng)死亡,使其種群數(shù)量急劇減少[9]。
熱激蛋白70是熱激蛋白家族主要成員之一,在進(jìn)化上高度保守。熱激蛋白70家族主要包括4個(gè)成員,分別是誘導(dǎo)性熱激蛋白70、組成型熱激蛋白70、葡萄糖調(diào)節(jié)蛋白78 和GRP75[10]。其中,誘導(dǎo)性熱激蛋白70正常情況下不表達(dá)或者低表達(dá),但在溫度等脅迫因子處理后,其表達(dá)量急劇上升;組成型熱激蛋白70在正常環(huán)境下表達(dá),在溫度等脅迫因子作用下,其表達(dá)量輕微上升或不變;葡萄糖調(diào)節(jié)蛋白78主要位于內(nèi)質(zhì)網(wǎng);GRP75主要位于線(xiàn)粒體內(nèi)[10]。熱激蛋白70在生物對(duì)溫度脅迫的抗逆性中起重要作用。如蘋(píng)果實(shí)蠅、始紅蝽熱激蛋白70表達(dá)量增加使其對(duì)高溫或低溫的耐受性增強(qiáng)[11,12]。為了明確褐飛虱對(duì)溫度脅迫的適應(yīng)機(jī)制,本研究篩選并克隆了正常或溫度脅迫下表達(dá)的熱激蛋白70家族基因序列,比較了這些基因在高溫和低溫處理后的表達(dá)特性,以期為了解溫度脅迫下褐飛虱種群發(fā)展的內(nèi)在機(jī)制提供理論參考。
1 材料與方法
1.1 供試褐飛虱
供試褐飛虱于2006年采自南京,室內(nèi)采用武運(yùn)粳7號(hào)飼養(yǎng),飼養(yǎng)條件如下:溫度27±1℃,相對(duì)濕度為65%,光周期為14h光照/10h黑暗。
1.2 熱激蛋白70基因的篩選
褐飛虱熱激蛋白70基因序列來(lái)源于轉(zhuǎn)錄組數(shù)據(jù)庫(kù)。首先根據(jù)基因注釋?zhuān)瑥奈覀儨y(cè)定的褐飛虱轉(zhuǎn)錄組數(shù)據(jù)庫(kù)中篩選熱激蛋白70基因,然后再根據(jù)基因同源性搜索GenBank 褐飛虱轉(zhuǎn)錄組數(shù)據(jù)庫(kù),獲得已登錄的熱激蛋白 70基因序列。在獲得這些序列后,采用Sequencher 4.7組裝排除重復(fù)序列。
1.3 褐飛虱溫度相關(guān)熱激蛋白70基因的克隆和序列分析
分別采用39℃、14℃溫度處理褐飛虱,收集處理1h試蟲(chóng)和未處理試蟲(chóng),提取總 RNA。總 RNA提取參照Promega公司的總RNA提取試劑盒(SV Total RNA Isolation System)說(shuō)明書(shū)進(jìn)行。將液氮速凍試蟲(chóng)研磨后加入175 μL裂解液,然后加入350 μL RNA稀釋緩沖液,70℃下 3 min后,4℃下離心20 min。然后過(guò)柱、加入DNA酶后漂洗;最后加入100 μL無(wú)核酸酶的雙蒸水洗脫。提取總RNA后使用1%瓊脂糖凝膠電泳和微量分光光度計(jì)(Eppendorf BioPhotometer Plus) 檢測(cè)RNA的完整度、純度與濃度,-80℃下超低溫冰箱貯存。
熱激蛋白70基因克隆時(shí)將39℃、14℃溫度處理和對(duì)照總 RNA等比例混合,反轉(zhuǎn)錄成cDNA,然后根據(jù)熱激蛋白70基因序列,設(shè)計(jì)引物,克隆溫度相關(guān)的熱激蛋白70基因。采用ScanProsite 分析克隆序列的保守區(qū)域,預(yù)測(cè)其等電點(diǎn)、分子量等,采用DNAssist進(jìn)行序列比對(duì),利用Mega 4.1構(gòu)建分子進(jìn)化樹(shù)。
1.4 熱激蛋白70基因表達(dá)量分析
1.4.1 試蟲(chóng)處理
褐飛虱熱激蛋白70基因豐度分析時(shí),試蟲(chóng)直接取羽化1d的雌成蟲(chóng),提總 RNA,然后進(jìn)行qPCR分析。
溫度誘導(dǎo)熱激蛋白70基因表達(dá)特性分析時(shí),收集羽化1d雌成蟲(chóng),分別在低溫0、6、10、14、18、22℃和高溫30、33、36、39、42、44℃下處理1h,26℃恢復(fù)1h,液氮速凍后存于-80℃冰箱,用于總RNA提取。每處理3次重復(fù),每重復(fù)6頭。
1.4.2 總 RNA提取
總 RNA提取采用Promega公司總RNA提取試劑盒(SV Total RNA Isolation System)進(jìn)行。方法與1.3同。在微量分光光度計(jì)測(cè)定RNA的濃度后,根據(jù)濃度計(jì)算cDNA第1鏈合成時(shí)所需的模板體積。
1.4.3 cDNA第1鏈的合成
cDNA第1鏈的合成采用TaKaRa的實(shí)時(shí)定量PCR反轉(zhuǎn)錄試劑盒[PrimeScript? RT Master Mix (Perfect Real Time)]進(jìn)行。根據(jù)試劑盒說(shuō)明書(shū),以500 ng總 RNA為模板,加入2 μL 含反轉(zhuǎn)錄酶預(yù)混液(5×PrimeScript RT Master Mix),然后以無(wú)RNA酶雙蒸水補(bǔ)至10 μL,37℃下溫育30 min,85℃下10s滅活反轉(zhuǎn)錄酶即得到第1鏈cDNA。

表1 褐飛虱熱激蛋白70基因qPCR引物序列Table 1. Primer sequences of heat shock protein 70 genes for qPCR in N. lugens.
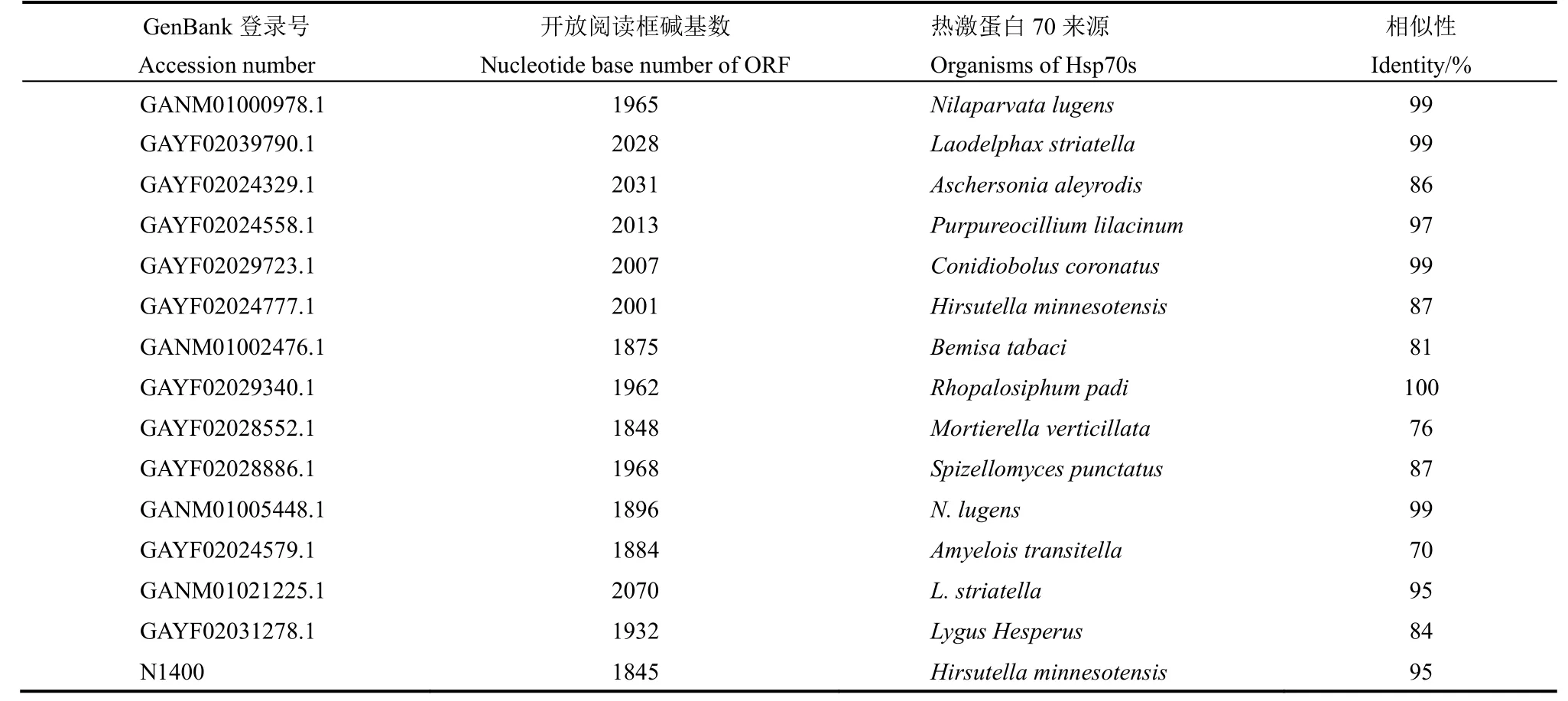
表2 從轉(zhuǎn)錄組數(shù)據(jù)庫(kù)篩選到的褐飛虱熱激蛋白70基因Table 2. Heat shock protein 70 genes of N. lugens screened from transcriptomic database.
1.4.4 實(shí)時(shí)熒光定量PCR
實(shí)時(shí)熒光定量PCR(qPCR)參考王利華等[13]的方法進(jìn)行,以β-actin(EU179846)為內(nèi)參[14],取1 μL稀釋20倍的cDNA為模板,分別加入10 μL含Taq酶的qPCR預(yù)混液[ SYBR?Premix Ex Taq?、0.4 μL ROX Reference Dye (50×)]、和0.4 μL 10 μmol/L 上游和下游引物(引物序列見(jiàn)表1),以水補(bǔ)至20 μL。先95℃下預(yù)變性30 s,然后95℃下 5 s,60℃下31 s,共40個(gè)循環(huán),最后進(jìn)行溶解曲線(xiàn)的擴(kuò)增。
1.5 數(shù)據(jù)分析
熱激蛋白相對(duì)表達(dá)量的計(jì)算采用2-ΔΔCT法[15]。豐度比較時(shí),以表達(dá)量最低的基因?yàn)閷?duì)照,分別計(jì)算其他7個(gè)基因的相對(duì)表達(dá)量。溫度誘導(dǎo)表達(dá)量的計(jì)算以正常飼養(yǎng)試蟲(chóng)為對(duì)照,結(jié)果采用SPSS 19.0ANOVA進(jìn)行方差分析,最小顯著性差異法在0.05水平上進(jìn)行差異顯著性分析。
2 結(jié)果與分析
2.1 熱激蛋白70基因篩選
從GenBank轉(zhuǎn)錄組數(shù)據(jù)庫(kù)獲得與熱激蛋白70同源性超過(guò)70%的基因序列22個(gè),我們測(cè)定的轉(zhuǎn)錄組數(shù)據(jù)注釋為熱激蛋白70的序列共12個(gè),排除重復(fù)序列后發(fā)現(xiàn)具有完整ORF的熱激蛋白70基因共15個(gè),其中GANM01000978.1等14個(gè)基因可以在GenBank轉(zhuǎn)錄組數(shù)據(jù)庫(kù)中找到同源序列,N1400首次在褐飛虱中發(fā)現(xiàn)。這些基因與熱激蛋白70基因的氨基酸同源性最高達(dá)到100%(表2)。進(jìn)化樹(shù)分析結(jié)果顯示同一物種不同組織間熱激蛋白70的同源性低于不同物種相同組織。GAYF02039790.1、GAYF02024777.1 與果蠅和人類(lèi)的內(nèi)質(zhì)網(wǎng)熱激蛋白70序列聚為一類(lèi),GAYF02024329.1、GAYF02029723.1和GANM01021225.1 與線(xiàn)粒體熱激蛋白70聚為一類(lèi)(圖1)。
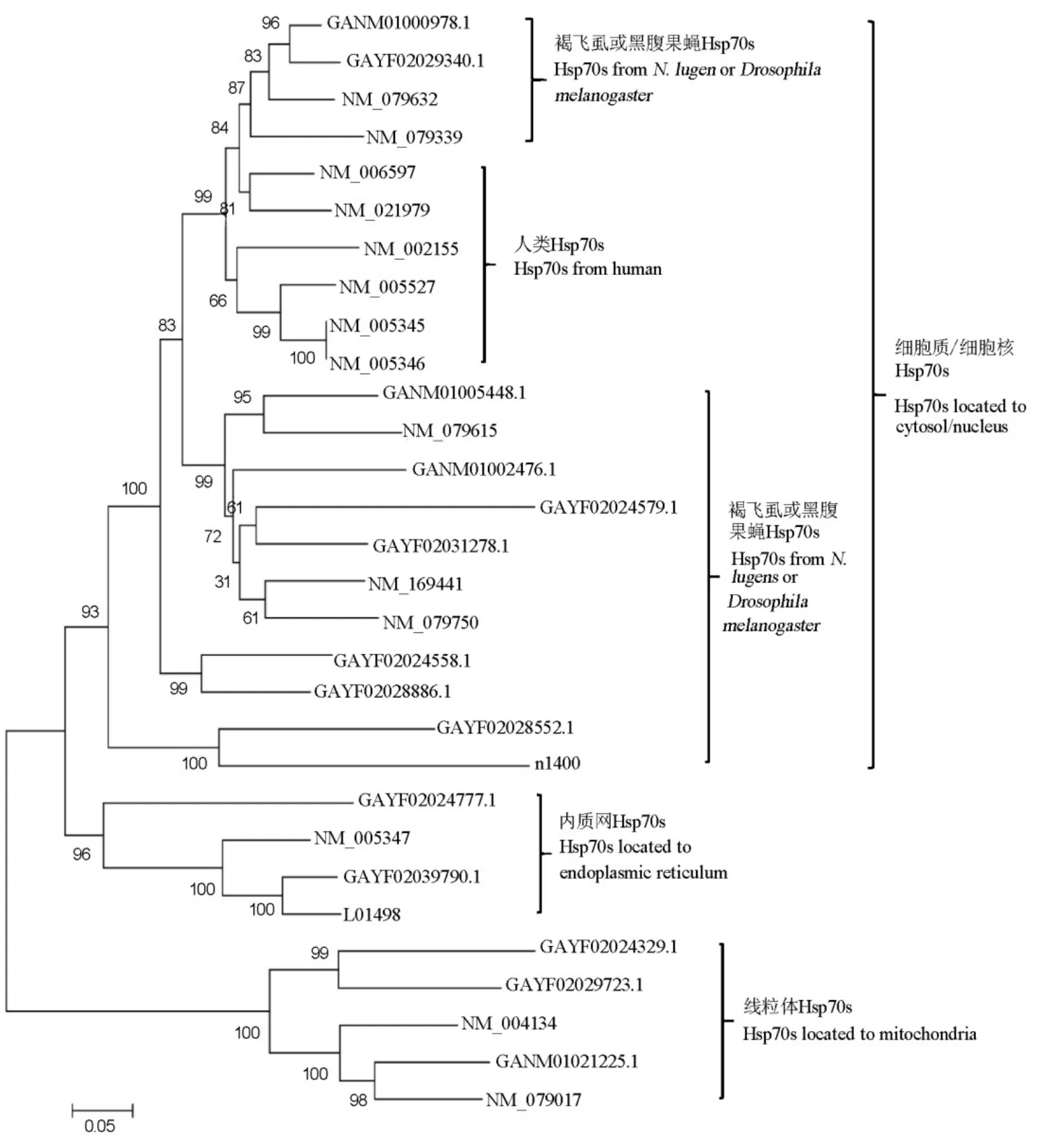
圖1 褐飛虱與黑腹果蠅和人類(lèi)的熱激蛋白70的進(jìn)化樹(shù)Fig.1. Phylogenetic tree of HSP70 from N. lugens, Homo sapiens and Drosophila melanogaster based on Neighbor-Joining method.
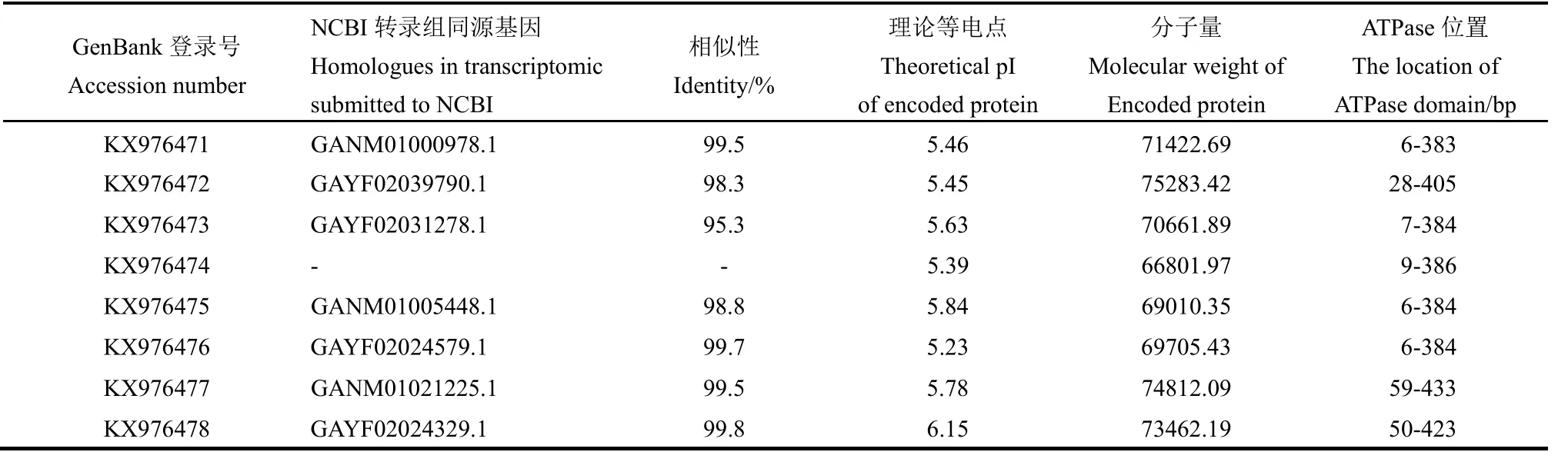
表3 褐飛虱正常或溫度脅迫下表達(dá)的熱激蛋白70序列及特征Table 3. Heat shock protein 70 genes cloned from N. lugens reared in normal condition or treated by high temperature stress.
2.2 褐飛虱正常或溫度脅迫下表達(dá)的熱激蛋白70基因克隆及序列分析
RT-PCR結(jié)果表明在正常或溫度脅迫后,褐飛虱體內(nèi)表達(dá)的熱激蛋白70基因共有8個(gè),基因登錄號(hào)為KX976471-8。與NCBI轉(zhuǎn)錄組數(shù)據(jù)庫(kù)中相關(guān)重復(fù)序列的相似性為95.3%~99.8%。預(yù)測(cè)這些基因編碼的蛋白質(zhì)分子量為66 801.97~75 283.42,等電點(diǎn)為4.94~6.15(表3)。所有基因都含有熱激蛋白70的三個(gè)標(biāo)志性序列,N端有ATPase結(jié)構(gòu)域。KX976472 C端還有內(nèi)質(zhì)網(wǎng)靶向序列,N端含有信號(hào)肽序列(圖2)。KX976477、KX976478 與其他6個(gè)基因相比N端ATPase結(jié)合區(qū)域前具有更長(zhǎng)的堿基序列。
2.3 熱激蛋白70的豐度比較

圖2 克隆的褐飛虱熱激蛋白70氨基酸序列比對(duì)Fig. 2. Amino acid alignment of heat shock protein 70 cloned from N. lugens.
褐飛虱熱激蛋白70的豐度如圖3所示。正常情況下,8個(gè)熱激蛋白基因的表達(dá)存在顯著差異。按從高到低的順序排列依次為KX976471>KX976472> KX976477> KX976473> KX976475>KX976478> KX976476> KX976474。ANOVA數(shù)據(jù)分析結(jié)果顯示KX976471和 KX976472的表達(dá)量顯著高于其他6個(gè)熱激蛋白70基因。
2.4 溫度對(duì)熱激蛋白70的誘導(dǎo)
2.4.1 高溫對(duì)熱激蛋白70的誘導(dǎo)
30~44℃高溫處理后,褐飛虱熱激蛋白70的表達(dá)量存在顯著差異,KX976473和KX976476表達(dá)顯著上升,尤其是KX976473,在42~44℃處理后,其表達(dá)量提高200倍以上。KX976472和KX976474在處理前后表達(dá)量無(wú)顯著變化。其余4個(gè)基因KX976471、KX976475、KX976477和KX976478分別在44、30、39、33℃具有最高表達(dá)量,但是上升倍數(shù)均小于3倍(圖4)。
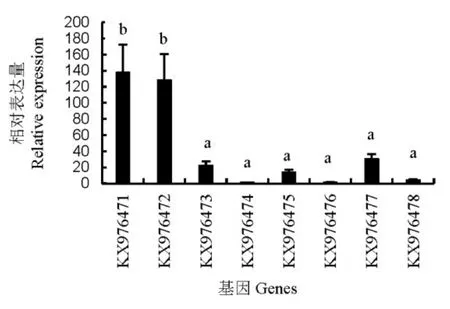
圖3 褐飛虱熱激蛋白70豐度分析Fig. 3. Comparison of abundance of heat shock protein 70 cloned from N.lugens.
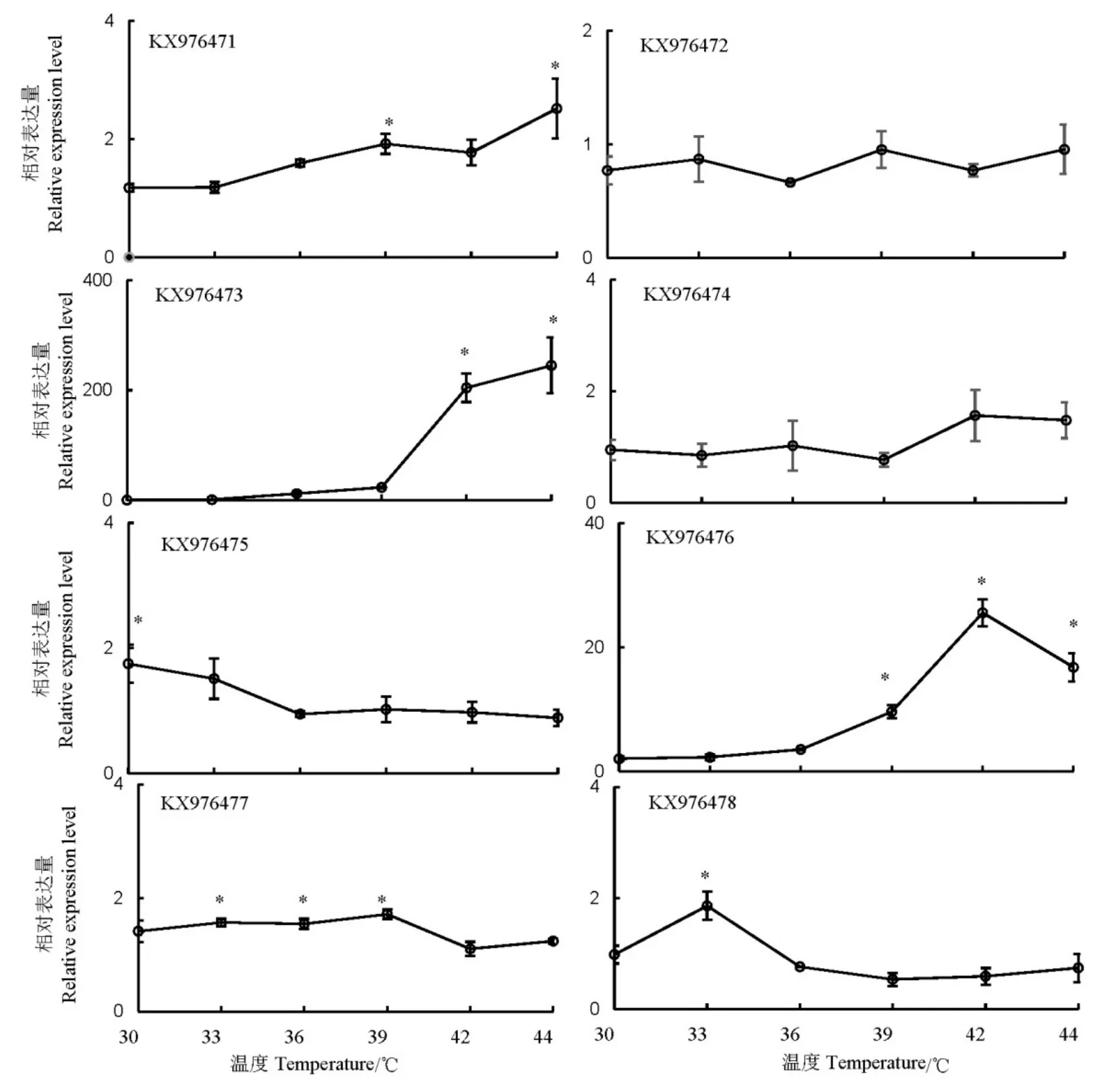
圖4 高溫脅迫對(duì)褐飛虱熱激蛋白70基因表達(dá)量的誘導(dǎo)Fig. 4. Expression of heat chock protein 70 genes induced by high temperature in N. lugens.
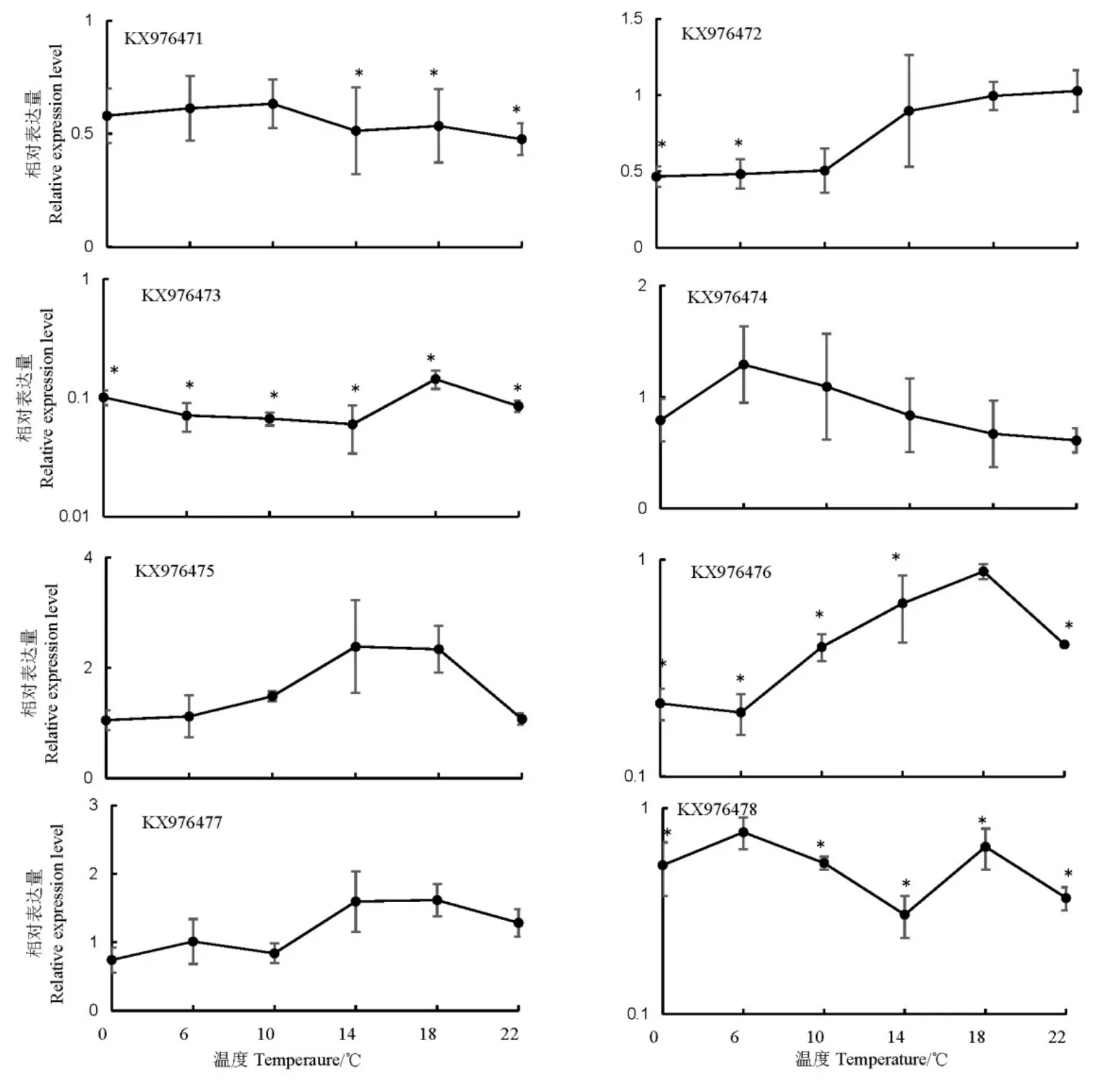
圖5 低溫脅迫對(duì)褐飛虱熱激蛋白70基因表達(dá)量的誘導(dǎo)Fig. 5. Expression of heat chock protein 70 genes induced by low temperatures in N.lugens.
2.4.2 低溫對(duì)熱激蛋白70的誘導(dǎo)
低溫脅迫對(duì)褐飛虱熱激蛋白70表達(dá)的影響與高溫脅迫存在顯著差異。0~22℃低溫脅迫后,除KX976475的表達(dá)量在14℃上升2.38倍外,KX976474和KX976477的表達(dá)量變化不顯著,其余5個(gè)基因KX976471、KX976472、KX976473、KX976476和KX976478的表達(dá)被抑制,尤其是KX976473在14℃處理后,表達(dá)量下降約17倍(圖5)。
3 討論
昆蟲(chóng)熱激蛋白70家族成員數(shù)量在不同種間差異較大。如家蠶(Bombyx mori)有10個(gè)熱激蛋白70基因,其中4個(gè)為誘導(dǎo)型,6個(gè)為組成型[16]。珍珠邊豹紋蝶(Glanville fritillary)有7個(gè)熱激蛋白70基因,其中1個(gè)可能位于內(nèi)質(zhì)網(wǎng),6個(gè)位于細(xì)胞質(zhì)[17]。褐飛虱熱激蛋白70家族至少包括15個(gè)成員,2個(gè)可能位于內(nèi)質(zhì)網(wǎng),3個(gè)位于線(xiàn)粒體,其余位于細(xì)胞質(zhì)或細(xì)胞核。位于內(nèi)質(zhì)網(wǎng)和線(xiàn)粒體的熱激蛋白70與一般熱激蛋白70的親緣關(guān)系較遠(yuǎn),其遺傳距離大于不同物種間相同器官來(lái)源的熱激蛋白70,這與果蠅熱激蛋白70進(jìn)化特征一致[18]。
正常和溫度脅迫下表達(dá)的褐飛虱熱激蛋白70基因有8個(gè),其中KX976473和KX976476為誘導(dǎo)型熱激蛋白70,KX976472位于內(nèi)質(zhì)網(wǎng),KX976477和KX976478位于線(xiàn)粒體,其余4個(gè)基因?yàn)榻M成型熱激蛋白70。以溫度脅迫和正常試蟲(chóng)混合cDNA為模板,尚有7個(gè)熱激蛋白70基因沒(méi)有克隆出來(lái)。這可能有兩方面的原因。一是這些基因表達(dá)豐度很低,在檢測(cè)下限之下;二是這些基因可能與溫度脅迫保護(hù)無(wú)關(guān),而是對(duì)溫度以外的其他脅迫因子負(fù)責(zé)。
熱激蛋白70在生物應(yīng)對(duì)高溫、農(nóng)藥等環(huán)境脅迫中起重要作用[19]。研究發(fā)現(xiàn)害蟲(chóng)如梨小食心蟲(chóng)(Grapholita molesta)、珍珠邊豹紋蝶、柑桔紅螨(Panonychus citri)、三葉草斑潛蠅(Liriomyza trifolii)、煙粉虱(Bemisia tabaci)、蘋(píng)果蠹蛾(cydia pomonella)、臭蟲(chóng)(Cimex lectularius)等熱激蛋白70與其溫度適應(yīng)性有關(guān),在溫度脅迫后表達(dá)量急劇上升[17,20-25]。而且不同器官來(lái)源的熱激蛋白70在減少脅迫傷害中具有一定的協(xié)同作用,如內(nèi)質(zhì)網(wǎng)和細(xì)胞質(zhì)熱激蛋白70通過(guò)協(xié)同作用提高機(jī)體對(duì)高溫的適應(yīng)性[26]。線(xiàn)粒體熱激蛋白70 (PnHSP70)在生物高溫、鹽、干旱等環(huán)境脅迫保護(hù)中也起重要作用[27]。高溫脅迫后,褐飛虱線(xiàn)粒體熱激蛋白和細(xì)胞質(zhì)/細(xì)胞核熱激蛋白70表達(dá)量不同程度上升,可能促進(jìn)其對(duì)高溫的適應(yīng)。
熱激蛋白70家族不同成員具有不同的脅迫保護(hù)譜。蘋(píng)果蠹蛾CpHsp70-1對(duì)高溫脅迫具有保護(hù)作用,在高溫脅迫后表達(dá)量顯著上升,但對(duì)殺蟲(chóng)劑脅迫不敏感[20]。珍珠邊豹紋蝶Hsp70和Hsc70在高溫?zé)峒ず蟊磉_(dá)量顯著上升,但低溫脅迫后,Hsp70表達(dá)量不變,Hsc70表達(dá)量?jī)H輕微上升[17]。西花薊馬Fo-HSP70 的表達(dá)量與誘導(dǎo)溫度有關(guān);0℃脅迫時(shí)表達(dá)量顯著上升;-4℃脅迫其表達(dá)量顯著下降;31~46℃高溫脅迫其表達(dá)量顯著上升[28]。柑桔紅螨3個(gè)熱激蛋白70基因?qū)涿{迫無(wú)反應(yīng),但PcHsp70-2在熱激后表達(dá)上調(diào)[22]。褐飛虱Nlhsc70在高溫脅迫后表達(dá)量顯著上升,但低溫脅迫后表達(dá)量變化不大[29]。本研究發(fā)現(xiàn)褐飛虱8個(gè)熱激蛋白70中,僅有2個(gè)對(duì)高溫脅迫不敏感,其余6個(gè)基因在高溫處理后其表達(dá)量不同程度上升;而低溫脅迫后,除1個(gè)基因表達(dá)量輕微上調(diào)外,其余基因表達(dá)下降或無(wú)顯著變化。尤其是KX976473在高溫脅迫時(shí)表達(dá)量急劇上升,但低溫脅迫時(shí)顯著下降。這些結(jié)果說(shuō)明褐飛虱高溫和低溫脅迫的保護(hù)機(jī)制可能存在差異,熱激蛋白70在褐飛虱高溫脅迫保護(hù)中起重要作用,但在低溫脅迫傷害中的作用不大。這可能與褐飛虱的生物學(xué)特性有關(guān)。褐飛虱是一種遷飛性害蟲(chóng),其越冬北界隨各年冬季氣溫高低而擺動(dòng)于北緯21~25℃間,這些地區(qū)冬季日均最低氣溫在15℃左右,所以褐飛虱野外生存中一般不需應(yīng)對(duì)極端低溫,因此,在進(jìn)化上較少保留應(yīng)對(duì)低溫脅迫的基因。
綜上所述,本研究通過(guò)轉(zhuǎn)錄組獲取了15個(gè)褐飛虱熱激蛋白70基因,其中8個(gè)可能與其溫度適應(yīng)性有關(guān)。這些與溫度相關(guān)的熱激蛋白70基因可能分布在細(xì)胞質(zhì)/細(xì)胞核、內(nèi)質(zhì)網(wǎng)、線(xiàn)粒體等器官,在褐飛虱溫度適應(yīng)性中起不同的作用。正常情況或溫度脅迫后,這些基因的表達(dá)量存在顯著差異。大部分基因在高溫脅迫后表達(dá)量上升,低溫脅迫后下降或無(wú)變化,說(shuō)明這些熱激蛋白70基因在高溫脅迫中可能起重要作用,但對(duì)低溫脅迫不敏感。
[1] Cheng J A. Rice Planthoppers in the Past Half Century in China. Hangzhou: Zhejiang University Press, 2014: 1-33.
[2] 唐廣田, 包云軒. 廣西褐飛虱發(fā)生特點(diǎn)及其遷飛路徑分析. 中國(guó)農(nóng)業(yè)氣象, 2015, 36(1): 74-82. Tang G T, Bao Y X. Analysis on occurrence pattern and migratory paths of brown plant-hopper in Guangxi Province. Chin J Agrometeorol, 2015, 36(1):74-82. (in Chinese with English abstract)
[3] 閆香慧, 劉懷, 趙志模, 何恒果, 代建平, 程登發(fā). 水稻褐飛虱燈下發(fā)生期及種群數(shù)量動(dòng)態(tài)分析. 植物保護(hù)學(xué)報(bào), 2008, 35(6): 501-506. Yan X H, Liu H, Zhao Z M, He H G, Dai J P, Cheng D F. Population dynamics and occurrence period of brown planthoppers based on the historic data analysis of light trap catches. J Plant Prot, 2008, 35(6): 501-506.(in Chinese with English abstract)
[4] 祝樹(shù)德, 陸自強(qiáng), 杭杉保, 徐海. 溫度對(duì)褐飛虱種群調(diào)控作用研究. 華東昆蟲(chóng)學(xué)報(bào), 1994, 3(1): 53-59. Zhu S D, Lu Z Q, Hang S B,Xu H.Study of the temperature regulation on brown planthopper population. Entomol J East China,1994, 3(1): 53-59. (in Chinese with English abstract)
[5] 石保坤, 胡朝興, 黃建利, 侯茂林. 溫度對(duì)褐飛虱發(fā)育、存活和產(chǎn)卵影響的關(guān)系模型. 生態(tài)學(xué)報(bào), 2014, 34(20): 5868-5874. Shi B K, Hu C X, Huang J L,Hou M L. Modeling the influence of temperature on development, survival and oviposition of the brown planthopper, Nilaparvata lugens. Acta Ecol Sin, 2014, 34(20): 5868-5874. (in Chinese with English abstract)
[6] Shi B K, Huang J L, Hu C X, Hou M L. Interactive Effects of Elevated CO2and Temperature on Rice Planthopper, Nilaparvata lugens. J Integ Agric, 2014, 13(7): 1520-1529.
[7] Pandi G G P, Chander S, Singh M .P, Pathak H. Impact of Elevated CO2and temperature on brown planthopper population in rice ecosystem. Proc Nat Acad Sci, India Sec B: Biol Sci, 2016: 1-8.
[8] Ghobadifar F, Aimrun W, Jebur M N. Development of an early warning system for brown planthopper (BPH) (Nilaparvata lugens) in rice farming using multispectral remote sensing. Prec Agric, 2016, 17(4): 377-391.
[9] 彭兆普, 馬明勇, 傅強(qiáng), 李一波, 鄧龍飛. 湖南近三年褐飛虱發(fā)生規(guī)律研究. 植物保護(hù), 2012, 38(4): 147-151. Peng Z P, Ma M Y, Fu Q, Li Y B, Deng L F. Occurrenceof the brown planthopper in Hunan Province in recent years. Plant Prot, 2012, 38(4): 147-151. (in Chinese with English abstract)
[10] Daugaard M, Rohde M, J??ttel? M. The heat shock protein 70 family: Highly homologous proteins with overlapping and distinct functions. FEBS letters, 2007, 581(19): 3702-3710.
[11] Vladimír K, Michaela T B. The 70 kDa heat shock protein assists during the repair of chilling injury in the insect,Pyrrhocoris apterus. Plos One, 2009, 4(2): e4546.
[12] Giancarlo L, Davidl D. Regulation of heat shock proteins in the apple maggot Rhagoletis pomonella during hot summer days and overwintering diapause. Physiol Entomol, 2008, 33(4): 346-352.
[13] 王利華, 單丹, 方繼朝. 灰飛虱LHSC70基因表達(dá)特性及功能研究. 中國(guó)水稻科學(xué),2015, 29(4): 424-430. Wang L H, Shan D, Fang J C. Expression profiling and function analyses of LHSC70 in Laodelphax striatellus, Chin J Rice Sci, 2015, 29(4): 424-430.(in Chinese with English abstract)
[14] Jiang J J, Huang L F, Chen H S, et al. Identification of reference genes and expression analysis of heat shock protein genes in the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae), after exposure to heat stress. Acta Entomol Sin, 2015, 58(5): 479- 486.
[15] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T)) Method. Methods, 2001, 25(4): 402-408.
[16] Lin H J, Li Z, Dang X Q, Su W J, Zhou Z Y. Short-term increased expression of the heat shock protein 70 family members during heat shock is positively correlated with basal thermotolerance in the midgut of three strains of the silkworm. Bombyx mori. African Entomol, 2009, 22(1): 24-29.
[17] Luo S, Ahola V, Shu C, Xu C, Wang R. Heat shock protein 70 gene family in the Glanville fritillary butterfly and their response to thermal stress. Gene , 2015, 556(2): 132-141.
[18] Rubin D M, Mehta A D, Zhu J, Shoham S, Chen X, Wells Q R, Palter K B. Genomic structure and sequence analysis of Drosophila melanogaster HSC70 genes. Gene, 1993, 128(2): 155-163.
[19] Wang L, Shan D, Zhang Y, Liu X, Sun Y, Zhang Z, Fang J C. Effects of high temperature on life history traits and heat shock protein expression in chlorpyrifos-resistant Laodelphax striatella. Pestic Biochem Physiol, 2017, 136: 64-69.
[20] Yang X Q, Wu Z W, Zhang Y L, Barrosparada W. Toxicity of six insecticides on codling moth (Lepidoptera: Tortricidae) and effect on expression of detoxification genes. J Econ Entomol, 2016, 109(1): 320-326.
[21] Chen H, Xu X L, Li Y P, Wu J X. Characterization of heat shock protein 90, 70 and their transcriptional expression patterns on high temperatures in adults of Grapholita molesta (Busck). Insect Sci, 2014, 21(4): 439 -448.
[22] Yang L H, Jiang H B, Liu Y H, Dou W, Wang J J. Molecular characterization of three heat shock protein 70 genes and their expression profiles under thermal stress in the citrus red mite. Mol Biol Reports, 2012, 39(4): 3585–3596.
[23] 鄭丹, 崔旭紅, 李紅亮, 蔡沖, 高永生, 商晗武. 三葉草斑潛蠅hsp70的克隆及其表達(dá)量在高低溫脅迫下的變化. 植物保護(hù)學(xué)報(bào), 2010, 37(2): 159-164. Zheng D, Cui X H, Li H L, Cai C, Gao Y S, Shang H W. Cloning of heat shock protein gene, hsp70, in Liriomyza trifolii and its expression under temperature stress. J Plant Prot, 2016, 37(2): 159-164. (in Chinese with English abstract)
[24] 崔旭紅, 謝明, 萬(wàn)方浩. 高溫脅迫下B型煙粉虱熱激蛋白基因hsp70表達(dá)量的變. 昆蟲(chóng)學(xué)報(bào), 2007, 50(11): 1087-1091. Cui X H, Xie M, Wang F H. Changes in expression level of heat shock protein 70 gene in Bemisia tabaci B-biotype (Homoptera: Aleyrodidae)under high temperature stress. Acta Entomol Sin, 2007, 50(11): 1087-1091.(in Chinese with English abstract)
[25] Benoit J B, Lopez-Martinez G, Teets N M, Phillips S A, Denlinger D L. Responses of the bed bug, Cimex lectularius, to temperature extremes and dehydration: Levels of tolerance, rapid cold hardening and expression of heat shock proteins. Med Veterin Entomol, 2009, 23(4): 418-425.
[26] Xu X, Gupta S, Hu W,Mcgrath B C,Cavener D R. Hyperthermia Induces the ER Stress Pathway. PloS One, 2011, 6(8): 366-366.
[27] Liu S, Wang J, Cong B, Huang X H, Chen K S, Zhang P Y. Characterization and expression analysis of a mitochondrial heat shock protein 70 gene from the Antarctic moss Pohlia nutans. Polar Biol, 2014, 37(8): 1145-1155.
[28] Wang H H, Reitz S R, Wang L X, Wang S Y, Li X, Lei Z R. The mRNA expression profiles of five heat shock protein genes from Frankliniella occidentalis at different stages and their responses to temperatures and insecticides. J Integ Agric, 2014, 13(10): 2196-221.
[29] Lu K, Chen X, Liu W, Zhou Q. Characterization of heat shock cognate protein 70 gene and its differential expression in response to thermal stress between two wing morphs of Nilaparvata lugens (St?l).Comp Biochem Physiol A Mol Integr Physiol, 2016, 199: 47-53.
Induced Expression Profiles of Hsp70s in Brown Planthoppers, Nilaparvata lugens, Under Different Temperatures
SHAN Dan1,2,#, WANG Lihua2,#, ZHANG Yueliang2, HAN Yangchun2, NIU Hongtao2, PAN Lei2, FANG Jichao1,2,*
(1College of Plant Protection, Nanjing Agricultural University, Nanjing 210095, China;2Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;#These authors contributed equally to this work;*Corresponding author, E-mail: fangjc126@126.com)
【Objective】The brown planthopper (BPH), Nilaparvata lugens, is one of the major insect pests on rice in China. In recent years, the overwintering area of BPH expanded with global warming. In order to explore the response mechanisms of BPH to temperature, the hsp70s were cloned and the induced expression profiles of these genes were analyzed. 【Method】 The nucleotide sequences of hsp70s were gotten from transcriptome sequencing and GenBank database, the phylogenetic tree of HSP70 was based on neighbor-joining method by MEGA4.1, and the induced expression profiles were analyzed by real-time quantitative PCR. 【Result】 It was found that fifteen hsp70 homologous genes with complete open reading frame were gotten in BPH, and 8 out of 15 genes were expressed in normal conditions or temperature stress. These eight hsp70s were distributed in the cytoplasm/nucleus, endoplasmic reticulum or mitochondria, and had significantly different expression in normal conditions. After 30-44°C high temperature treatment, the expression levels of KX976471, KX976473, KX976475, KX976476, KX976477 and KX976478 were up-regulated, and the maximum increased times was 1.72-245.33. However, only the expression level of KX976475 increased by 2.38 times, the other seven were not changed or even significantly decreased in expression level after 0-22°C temperature treatment.【Conclusion】It was found that eight hsp70s were expressed in normal conditions or temperature stress in the cytoplasm/nucleus, endoplasmic reticulum or mitochondria. These hsp70s might play an important role in high temperature adaptation, but a limited role in cold adaptation in BPH.
Nilaparvata lugens; temperature; heat shock protein 70; induced expression
Q786; S435.112+.4
A
1001-7216(2017)05-0533-09
2016-12-23; 修改稿收到日期:2017-02-17。
國(guó)家自然科學(xué)基金資助項(xiàng)目(31572004;31301660);江蘇省自然科學(xué)基金資助項(xiàng)目(BK20130711),江蘇省農(nóng)業(yè)自主創(chuàng)新資金資助項(xiàng)目(6111608)。

