兩種鄰苯二甲酸酯類污染物對斑馬魚胚胎發育的影響
穆希巖,李成龍,黃 瑛,沈公銘,李緒興,雷云雷,黃 嵐,逄 森,李應仁,李學鋒,王成菊*(.中國水產科學研究院資源與環境研究中心,北京 004;.中國農業大學理學院,北京 0093)
兩種鄰苯二甲酸酯類污染物對斑馬魚胚胎發育的影響
穆希巖1*,李成龍2,黃 瑛1,沈公銘1,李緒興1,雷云雷1,黃 嵐2,逄 森2,李應仁1,李學鋒2,王成菊2*(1.中國水產科學研究院資源與環境研究中心,北京 100141;2.中國農業大學理學院,北京 100193)
研究了鄰苯二甲酸二辛酯(DEHP)和鄰苯二甲酸二丁酯(DBP)對斑馬魚胚胎發育形態學指標的影響,并利用酶聯免疫法檢測了DEHP和DBP暴露后兩種與胚胎發育相關的蛋白(Nkx2.5和LOX)及甲狀腺素(T3、T4)水平的變化.結果發現試驗濃度下(10~500 μg/L)的DEHP和 DBP可誘導斑馬魚胚胎出現一系列發育異常,包括自主運動異常、心率下降、脊柱彎曲及心包水腫等,同時伴隨心臟發育蛋白 Nkx2.5含量顯著下降.ELISA檢測結果表明,500μg/L的DEHP和DBP暴露后,斑馬魚胚胎T3、T4含量顯著上升.上述結果表明DEHP和DBP對魚類早期生命階段同樣具備內分泌干擾作用.另外,本研究中DEHP和DBP對斑馬魚胚胎的最低可觀察效應濃度(LOEC)為10μg/L,已經接近它們在一些環境水域的檢出濃度,因此其對水環境中處于早期生命階段的生物的潛在危害急需重視.
鄰苯二甲酸二辛酯;鄰苯二甲酸二丁酯;斑馬魚胚胎;發育毒性;激素含量
增塑劑(又稱塑化劑)是一種能夠增加材料可塑性、柔韌性和膨脹性的添加劑,在塑料生產中的使用十分頻繁.鄰苯二甲酸酯(Phthalate Esters,PAEs)是目前應用最為普遍的增塑劑,廣泛用于食品包裝、兒童玩具、建筑材料、醫療用品和化妝品等領域[1].鄰苯二甲酸酯與塑料分子之間由氫鍵或范德華力連接,彼此保留各自相對獨立的化學性質,因此隨著時間的推移,PAEs很容易從塑料中擴散到外環境[2],從而污染水和空氣等.目前鄰苯二甲酸酯類污染物已經引起國際環保部門的普遍重視,美國環保局(EPA) 將鄰苯二甲酸二辛酯(DEHP)、鄰苯二甲酸二甲酯(DMP)等六種鄰苯二甲酸酯類化合物列入了重點控制的環境污染物名單中[3].中國將DMP、DEHP和鄰苯二甲酸二丁酯(DBP)列為優先控制的環境污染物[4].《地表水環境質量標準》也已經將DBP和DEHP 作為檢測項目[5].
隨著我國對鄰苯二甲酸酯環境監測工作的重視,國內不斷有環境地表水中PAEs的檢出情況被報道.如重慶主城長江和嘉陵江中豐水期時 DEHP和 DBP的檢出濃度分別達到 5.2和 4.6μg/L[6].而在松花江、長江武漢段、黃河中下游等重要水域中均檢測出較高濃度的鄰苯二甲酸酯類污染物(表1),其中DEHP和DBP在一些漁業水域的檢出濃度已經超過《地表水環境質量標準》中的限量(DEHP: 8μg/L; DBP: 3μg/L)[5].因此,環境水體中的PAEs可能對所在水域中的水生生物產生影響,開展鄰苯二甲酸酯類污染物對水生生物生態毒理學研究十分必要.
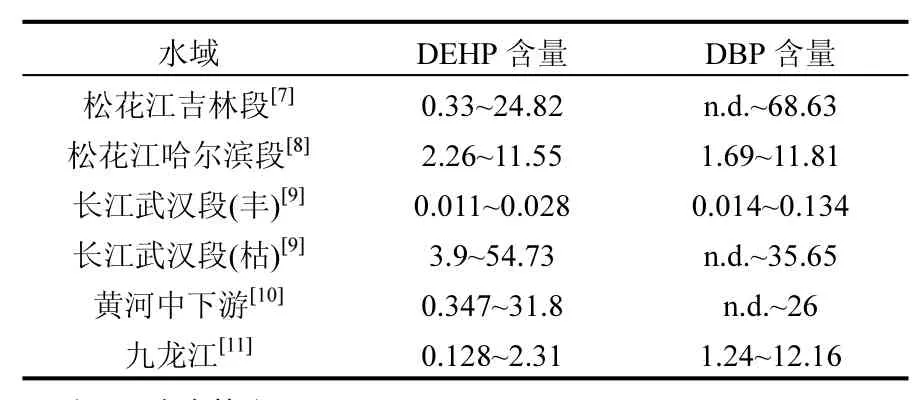
表1 鄰苯二甲酸二辛酯和鄰苯二甲酸二丁酯在我國重要環境水域中的含量(μg/L)Table 1 Detected concentrations of DEHP and DBP in Chinese important environmental water areas (μg/L)
大量的離體試驗和哺乳動物活體試驗已經證實鄰苯二甲酸酯類污染物屬于環境激素,具有較強的內分泌干擾作用.因此在鄰苯二甲酸酯類污染物的水生生物毒理學研究中,其對激素水平和生殖系統影響的研究一直占據著重要地位. Wang等[12]的研究表明,成年稀有鮈鯽在 DEHP暴露21d后,雌魚血液中雌二醇含量顯著下降;而雄性血液中雌二醇含量顯著上升.Golshan等[13]發現1μg/L的DEHP長期暴露后,雄性金魚的精子質量和精子活性均顯著下降,同時伴隨雄魚體內睪丸酮含量下降和類固醇合成基因StAR表達量下調.除對水生生物成年個體的內分泌干擾作用外,近些年鄰苯二甲酸酯類污染物對水生生物早期生命階段的影響也逐漸受到關注.Jia等[14]的研究發現DEHP可干擾斑馬魚胚胎甲狀腺,包括影響仔魚體內甲狀腺素含量及甲狀腺相關基因表達水平.Wood等[15]檢測了 DEHP對黑頭呆魚的 DNA甲基化作用,研究發現環境濃度下的DEHP暴露14d后,黑頭呆魚仔魚體內DNA甲基轉移酶基因表達量未見明顯異常,也未發現DNA甲基化.
斑馬魚胚胎具備量大易得、體外發育、透明、發育周期短等特點,可以全程、完整觀察和研究其內部所有器官和結構的變化,目前被廣泛用于污染物的毒性評價研究中[16].另外胚胎毒性試驗還可以避免殺死動物或解剖動物,這符合環境毒理學為保護動物權利而尋求替代的毒性試驗材料發展方向[17].本試驗通過形態學觀察,研究兩種鄰苯二甲酸酯類污染物DEHP和DBP對斑馬魚胚胎的發育影響,同時利用酶聯免疫方法檢測DEHP和DBP暴露后,斑馬魚胚胎中兩種發育相關蛋白和雌激素及甲狀腺素水平的變化情況,進而揭示鄰苯二甲酸酯類污染物對水生生物早期生命階段的影響和危害.
1 材料與方法
1.1 試驗魚與飼養條件
斑馬魚親魚,體長 3.50~4.50cm,體重 0.30~0.60g,按照本試驗組已報道的方法[18]在實驗室條件下長期馴養. 斑馬魚胚胎由試驗室親魚產卵獲得,斑馬魚親魚繁殖過程和胚胎收集過程均按照本試驗組已發表論文中的方法進行[19].
1.2 藥品與試劑
99.5 %鄰苯二甲酸二辛酯(CAS: 117-81-7)和 99%鄰苯二甲酸二丁酯(CAS: 84-74-2)均購自 Sigma-Aldrich公司.用分析純丙酮配置鄰苯二甲酸酯儲存溶液,儲存液進一步用重組水稀釋至指定濃度作為暴露介質.重組水配置方法參考OECD的推薦方法[20],配好的重組水中含分別含有2mmol/L Ca2+、0.5mmol/L Mg2+、0.75mmol/LNa+和0.074mmol/L K+.
1.3 暴露試驗
1.3.1 形態學指標檢測暴露試驗 參照 OECD試驗指導和 Fraysse et al. (2006)的方法進行試驗
[20-21],將斑馬魚胚胎暴露在10, 50, 500μg/L濃度的DEHP和DBP溶液中(實驗用水均為重組水).設助劑對照(丙酮含量為0.01mL/L)和重組水空白對照.分別把受精卵轉移到 24孔板中,每板使用20個孔,每孔含有2mL試驗藥液和1枚受精卵,一張板為一個重復,對照和各暴露組均設置三個重復.保證在胚胎發育囊胚期階段(產卵受精后 2h)開始前完成暴露.把孔板蓋好放在人工氣候箱中培養,27~28℃,光照:黑暗=14h:10h.按照Nagel提出的致死終點(卵凝結、發育停滯、心跳停止)記錄胚胎的死亡情況[22].暴露持續 96h,其間每24h更換3/4藥液以保持穩定的測試物濃度和潔凈的水質.
1.3.2 蛋白和激素水平檢測暴露試驗 將斑馬魚胚胎暴露于50和500μg/L濃度的DEHP和DBP溶液中,以1L燒杯為暴露容器,每個燒杯中呈有暴露溶液500mL和胚胎100顆,作為一個重復,每個處理組設3個重復.暴露持續96h,其間每24h更換3/4藥液以保持穩定的測試物濃度和潔凈的水質.
1.4 胚胎發育形態學指標檢測
參考Nagel提出的毒理指標,用倒置顯微鏡觀察其致死效應、亞致死效應和致畸效應.其中亞致死效應的檢測包括:(1)每天觀察所有胚胎的發育情況,記錄發育異常和畸形的個體; (2)24hpf (hours post fertilization,受精后小時數)時,從每個重復隨機取 5粒有活性的胚胎,在倒置顯微鏡下觀察斑馬魚胚胎自主運動(明顯的全身性扭動)情況,記錄 20S內自主運動的次數.(3)分別在48、72hpf時,在倒置顯微鏡下觀察斑馬魚心跳情況,每個重復隨機取 5粒活胚胎,記錄20S內心跳次數.
1.5 激素含量檢測
1.5.1 樣品收集與前處理 在 96hpf暴露結束后,用吸管從每個重復中移取40個胚胎到1.5mL EP管(即eppendorf 離心管)中,小心吸出藥液后,用蒸餾水輕柔沖洗胚胎3次,然后將蒸餾水吸出,置于冰上放置,待所有樣品收集完畢后,統一儲存于-20℃冰箱中,等待下一步檢測.
1.5.2 ELISA檢測 將樣品置于冰水混合物中解凍后,向胚胎樣品中加入適量生理鹽水后勻漿,3000r/min離心10min后,取上清液待測.
賴氨酰氧化酶(LOX)、心臟特異性同源盒轉錄因子 Nkx2.5、三碘甲狀腺原氨酸(T3)和四碘甲狀腺原氨酸(T4)的檢測均使用商品化試劑盒(北京冬歌生物科技有限公司)進行,操作過程及每種激素濃度的計算方法參照試劑盒說明書完成.
1.6 數據統計與分析
使用SPSS 16.0對試驗所得數據進行統計分析.采用One-Way ANOVA法進行單因素方差分析,以 Dunnett post hoc方法完成顯著性比較; P<0.05表示差異顯著,P<0.01表示差異極顯著.
2 結果
2.1 溶劑效應
顯著性分析結果表明,溶劑對照組和空白對照組中試驗涉及的所有指標的檢測結果之間不存在顯著差異(數據未給出).在本文中出現的對照組(control)數據均來自于溶劑對照.
2.2 PAEs對斑馬魚胚胎發育形態學指標的影響
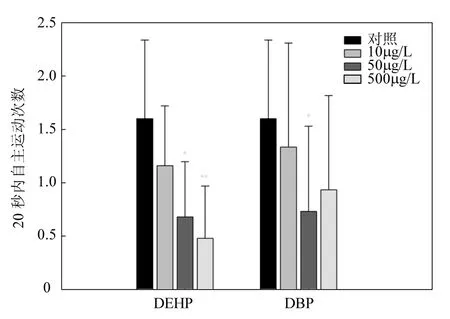
圖1 DEHP和DBP對斑馬魚胚胎24hpf自主運動的影響Fig.1 The effect of DEHP and DBP on spontaneous movements of zebrafish embryos
2.2.1 PAEs對斑馬魚胚胎24hpf自主運動的影響 斑馬魚胚胎發育到 24hpf時,會出現有規律的自主運動.DEHP和DBP在試驗濃度下均對斑馬魚胚胎的 24hpf自主運動產生了較明顯的抑制作用,其中 DEHP的抑制作用更強.由圖 1可知,DEHP對斑馬魚胚胎 24hpf自主運動的抑制作用呈現出濃度梯度效應,隨暴露濃度升高,抑制作用逐漸加強.DBP僅在50μg/L濃度時,可顯著抑制斑馬魚胚胎自主運動.
2.2.2 PAEs對斑馬魚胚胎心率的影響 由圖2可知,DEHP和DBP在試驗濃度下對斑馬魚胚胎心率有明顯的抑制作用,且抑制作用隨暴露濃度的升高和暴露時間的延長而增強.在 72hpf時, DEHP-500μg/L和DBP-500μg/L組,胚胎20s心跳次數分別為對照組的75%的79%.
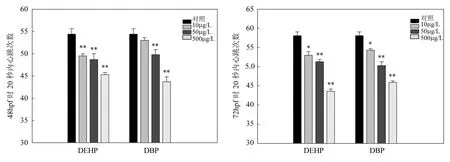
圖2 DEHP和DBP對斑馬魚胚胎心率的影響Fig.2 The effect of DEHP and DBP on heart rate of zebrafish embyos
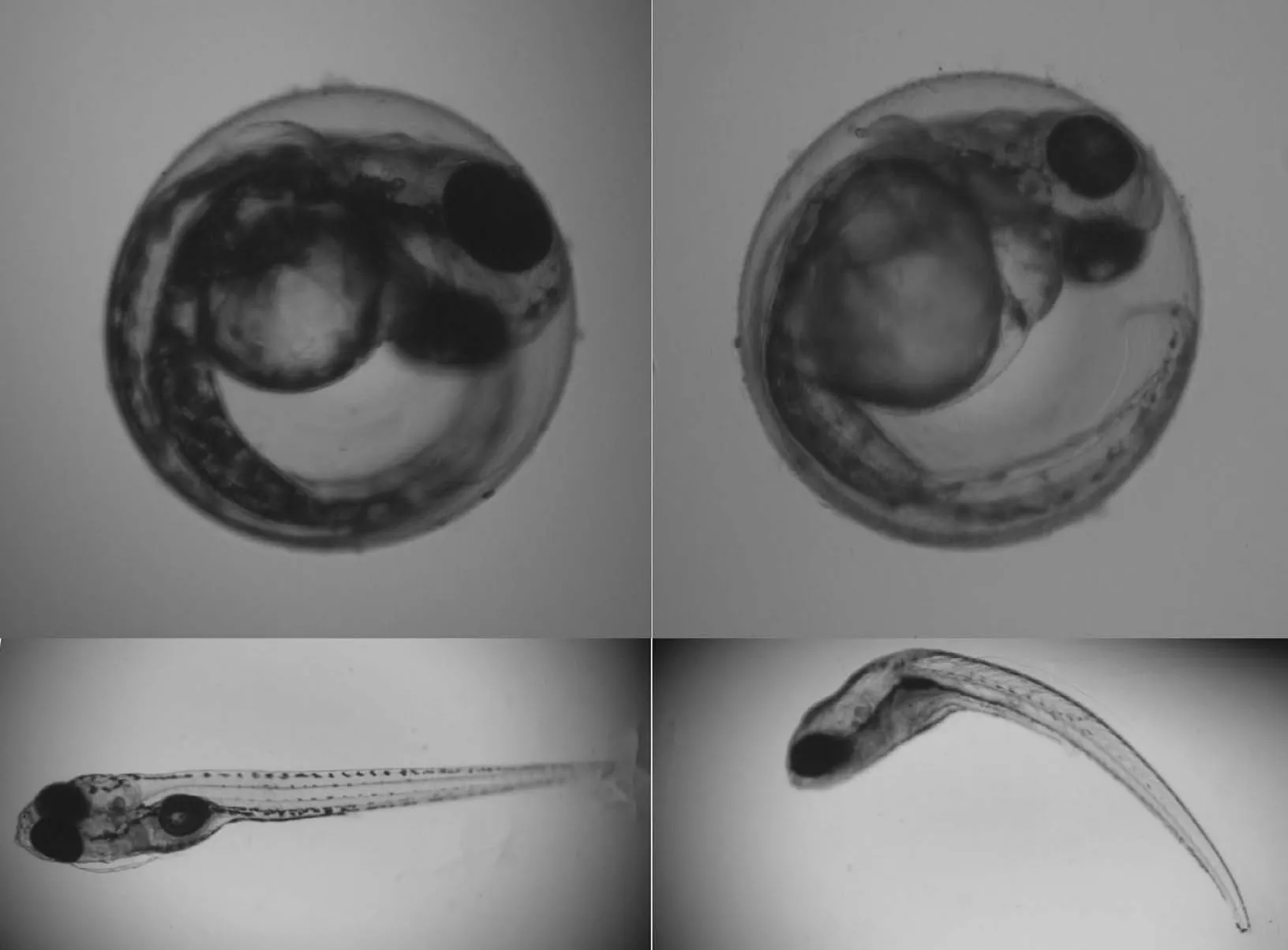
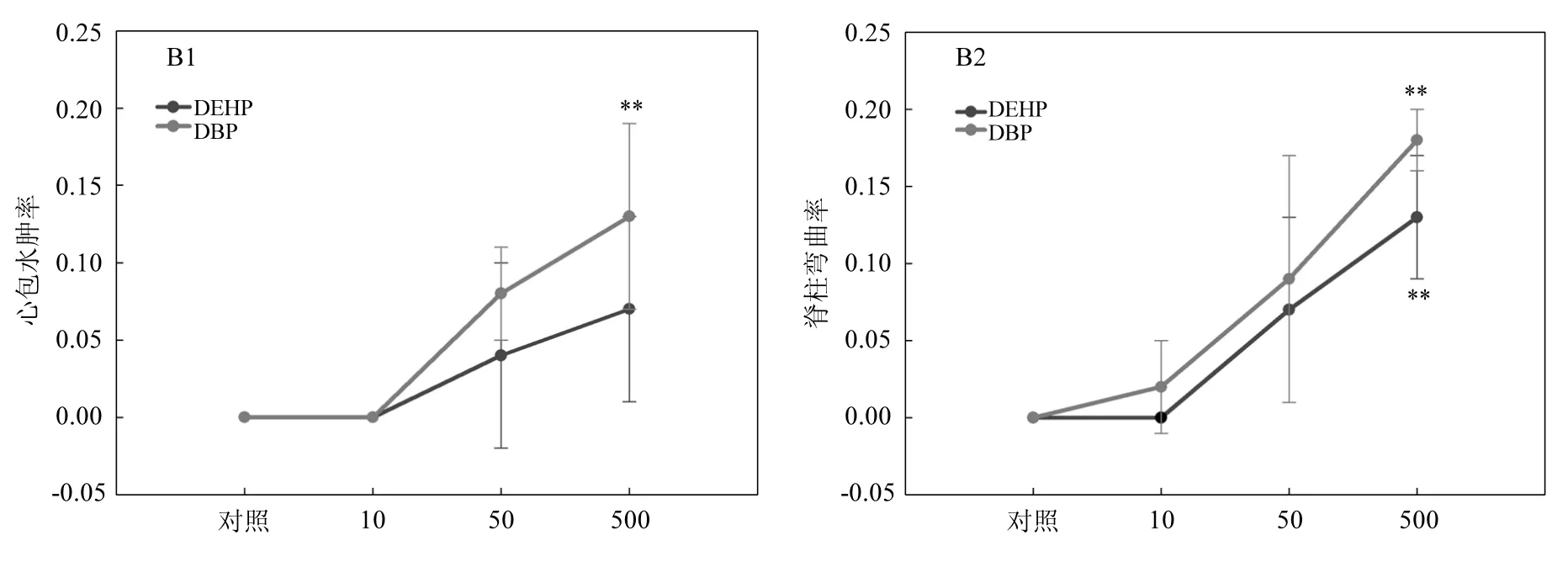
圖3 DEHP和DBP的致畸作用Fig.3 The teratogenic effects of DEHP and DBP
2.2.3 PAEs對斑馬魚的致畸作用 DEHP和DBP暴露后,斑馬魚胚胎出現多種畸形癥狀,主要包括心包水腫(圖 3A2)、脊柱彎曲(圖 3A4).而對照組胚胎未觀測到這些畸形癥狀.其中,最明顯的畸形是脊柱彎曲.在96hpf,當DEHP和DBP的暴露濃度達到 50μg/L時可引起斑馬魚胚胎出現脊柱彎曲,畸形率分別為為7%和9%.隨著暴露濃度的增加,胚胎的畸形率進一步升高,500μg/L的DEHP和 DBP引起的脊柱彎曲率分別為 13% (P<0.01)和18%(P<0.01)(圖3B1).心包水腫的出現率相對較低,500μg/L的DEHP和DBP誘導的心包水腫率分別為7%和13%(P<0.01)(圖3B2).
2.3 PAEs對斑馬魚胚胎發育相關蛋白含量的影響
由圖4A可知,DEHP和DBP均能明顯抑制斑馬魚胚胎Nkx2.5蛋白含量,DEHP-500 μg/L和DBP-500μg/L暴露組中的Nkx2.5含量分別為對照組的73%和61%.
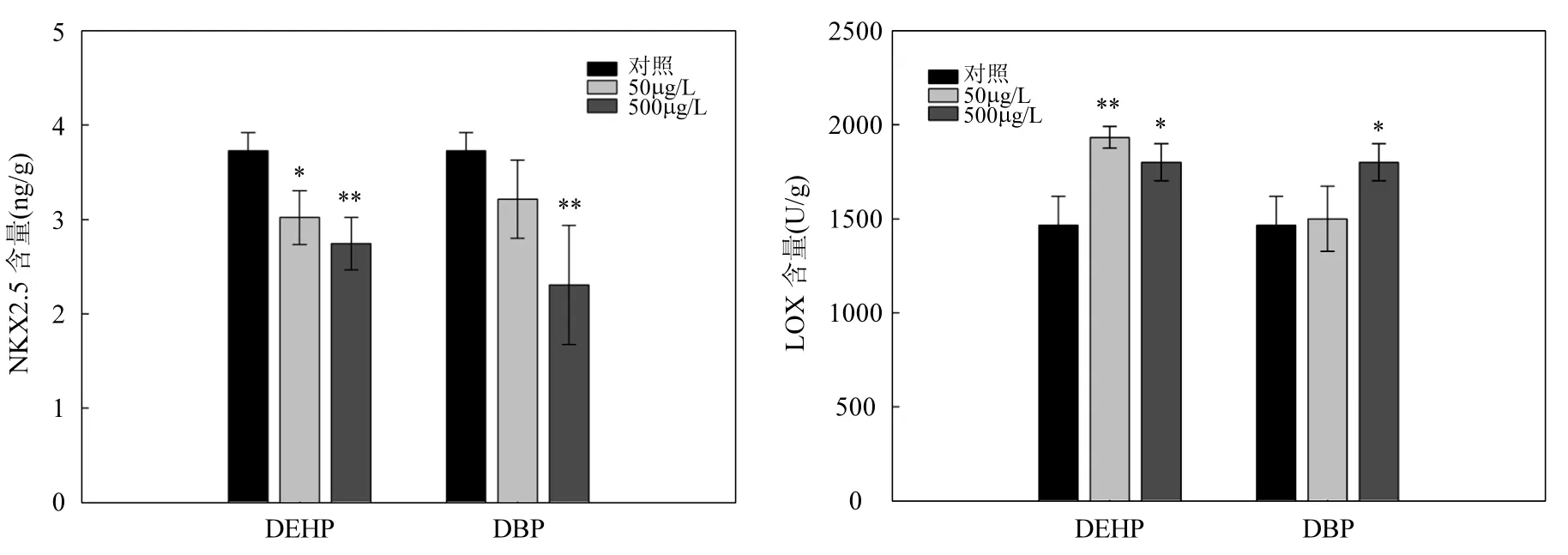
圖4 DEHP和DBP暴露后,斑馬魚胚胎中Nkx2.5(A)和LOX(B)蛋白含量Fig.4 The protein level of Nkx2.5 and LOX in zebrafish embryos after DEHP and DBP exposure
DEHP和DBP均能促進斑馬魚胚胎中LOX含量(圖4B).50和500μg/L的DEHP暴露后,斑馬魚胚胎中 LOX含量分別為對照組的 1.3倍 (P<0.01)和1.2倍(P<0.05).500μg/L的DBP可顯著誘導LOX水平,蛋白含量約為對照組的1.2倍(P<0.05),而50μg/L的DBP對斑馬魚胚胎LOX含量無明顯影響.
2.4 PAEs對斑馬魚胚胎甲狀腺素含量的影響
由圖5可知, T3含量在DEHP和DBP暴露后顯著上升,DEHP-500μg/L組和 DBP-500μg/L組中T3含量分別為對照組的 1.4倍(P<0.01)和1.6倍(P<0.01).T4含量在暴露后變化趨勢與 T3的趨勢接近,500μg/L的 DEHP和 DBP暴露后,斑馬魚胚胎 T4含量明顯升高,分別為對照組含量的1.6倍(P<0.01)和1.5倍(P<0.01).
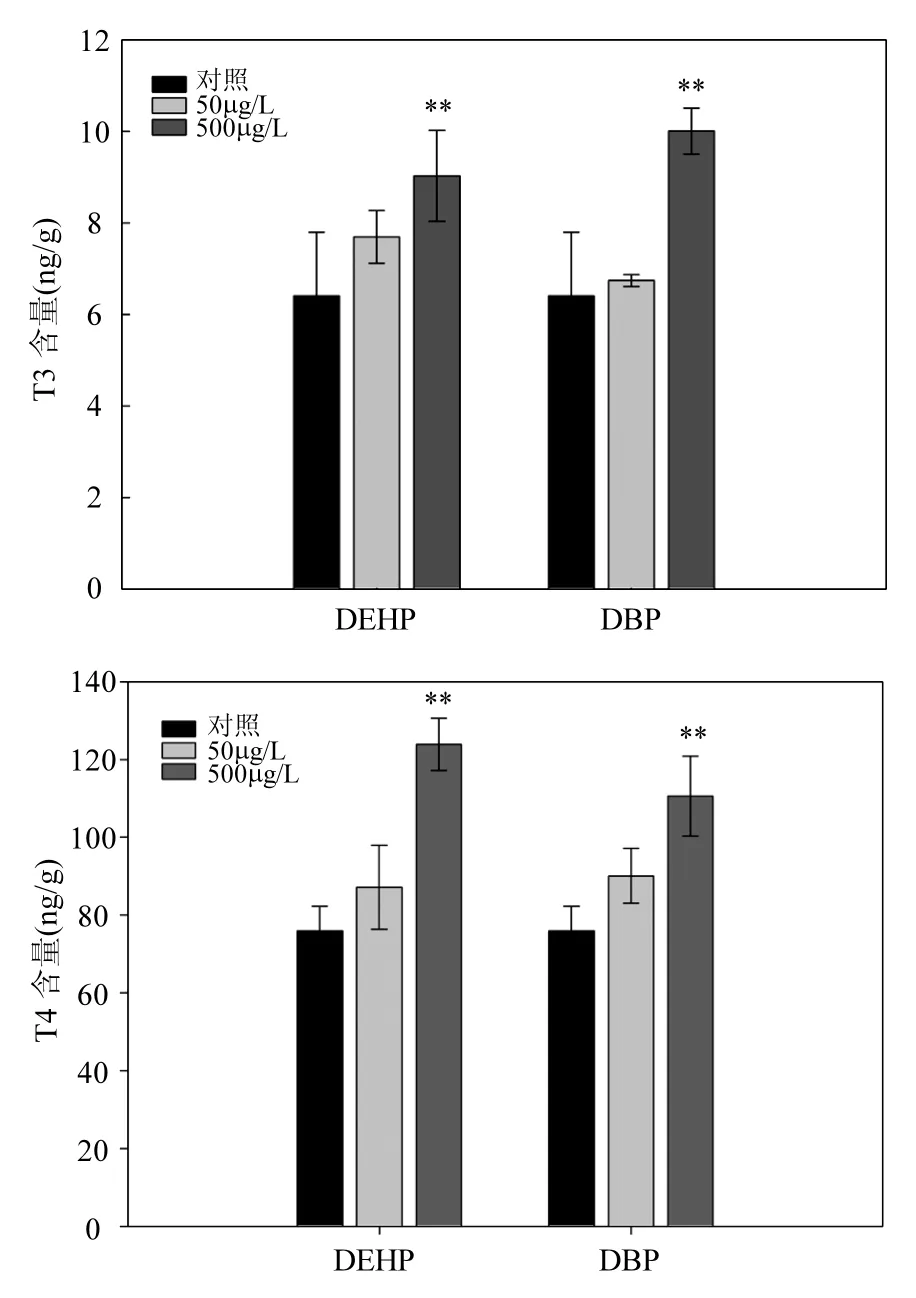
圖5 DEHP和DBP暴露后,斑馬魚胚胎中甲狀腺素含量Fig.5 The level of T3and T4in zebrafish embryos after DEHP and DBP exposure
3 討論
由于鄰苯二甲酸酯類污染物在水環境中分布廣泛,其對水生生物早期發育的影響時有報道.Shen等(2011)[23]研究發現,DBP及其主要代謝產物鄰苯二甲酸單丁酯(MBP)可顯著影響非洲爪蟾(Xenopus laevis)的生長發育,包括體長生長抑制和眼間距離變短等,LOEC值為 15mg/L. Gardner等(2016)[24]比較了三種鄰苯二甲酸酯類污染物(DBP,DEP和DnPP)對非洲爪蟾胚胎的致死能力和致畸能力,發現三種污染物中,DBP毒性最強,致死和致畸的 LOEC分別為 14.7和8.3mg/L,DEP毒性最弱,致死和致畸的LOEC分別為50.3和41.7mg/L.而根據本研究結果, DBP對斑馬魚胚胎的致畸 LOEC僅為 500μg/L,說明斑馬魚對 DBP的敏感性遠高于非洲爪蟾.Wood等[25]檢測了 DEHP對黑頭呆魚(Pimephales promelas)的發育影響,其研究結果表明 0.1~100μg/L的DEHP暴露14d,對黑頭呆魚的發育無明顯影響.而在本研究中,10μg/L的DEHP即可顯著抑制斑馬魚胚胎的心率,50μg/L的DEHP還能干擾胚胎的 24hpf自主運動.而本研究的暴露時間比Wood等[26]的周期更短,由此推斷斑馬魚對DEHP的敏感性可能高于黑頭呆魚.Chikae等的研究發現,0.01~10μg/L的 DEHP暴露后,青鳉魚(Oryzias latipes)胚胎的死亡率顯著升高,且體長生長較對照組明顯被抑制.古皮魚(Poecilia reticulata)長期(91d)暴露于 1μg/L 和 10μg/L DEHP后,出現了多種發育異常,包括體長生長抑制和體重抑制等,其中10μg/L DEHP還能顯著引起古皮魚死亡[27].上述研究中DEHP對魚類發育影響的 LOEC值低于本研究結果(10μg/L),一方面可能由于暴露周期較長;另一方面可能因為青鳉魚和古皮魚的敏感性比斑馬魚更高.
近年來,多個研究對DEHP和DBP對水生生物的毒性進行了比較.Zhao等[28]的研究發現DBP對鯉魚(Cyprinus carpio)的毒性比DEHP更強,它們對鯉魚的 96h-LC50值分別為 16.30and 37.95mg/L.相反,Huang等[29]以大型溞(Daphnia magna)為模型開展的急性毒性試驗發現 DEHP的毒性高于DBP,它們對大型溞的24h-EC50值分別為 2.1和 8.0mg/L.在本研究中,相同濃度暴露后,DBP引起斑馬魚胚胎的畸形率高于DEHP,說明DBP對斑馬魚胚胎的致畸能力強于DEHP;而胚胎發育指標結果表明 DEHP對斑馬魚心率和24hpf自主運動的影響比DBP更強,因此根據本研究結果難以判斷DEHP和DBP對斑馬魚胚胎的毒性順序.
脊柱彎曲是DEHP和DBP暴露后斑馬魚胚胎出現的最明顯的畸形效應,多種污染物已經被證實能夠引起水生生物出現脊柱彎曲的癥狀.造成脊柱彎曲的可能原因之一是賴胺酰氧化酶(LOX)的活性被抑制,Zhou等[30]和 van Boxtel等[31]先后證明了殺螟丹和二硫代胺類農藥引起水生生物脊柱畸形的機制在于對賴胺酰氧化酶的抑制作用.而在本研究中,DEHP和DBP對賴胺酰氧化酶蛋白含量表現為促進作用(圖3),由此推斷鄰苯二甲酸酯類污染物引起斑馬魚胚胎出現脊柱彎曲的原理可能與上述兩類農藥不同.
心包水腫是斑馬魚胚胎發育階段最典型的畸形癥狀之一.多種污染物都被證明能夠誘導斑馬魚胚胎出現此類畸形,但不同類別的化合物引起心包水腫的機制存在差異.已有研究證明視黃酸缺乏是引起斑馬魚胚胎出現心包水腫的原因之一[32],Mu等[33]的研究發現苯醚甲環唑處理后的斑馬魚胚胎出現明顯心包水腫,同時伴隨視黃酸代謝基因 CYP26A1表達顯著上調,由此作者推斷苯醚甲環唑引起的斑馬魚心包水腫可能與CYP26A1上調引起的視黃酸缺乏有關[33].而本課題組之前的研究發現0.60mg/L的嘧菌酯可顯著誘導斑馬魚胚胎出現心包水腫,結合嘧菌酯的殺菌機理(阻礙線粒體呼吸電子傳遞進而抑制ATP合成),推斷其引起的心臟功能異常是由于嘧菌酯抑制線粒體呼吸,進而引起能量供應不足導致的[34].而在本研究中,DBP和DEHP在達到一定濃度時均可引起斑馬魚胚胎出現心包水腫.為研究DEHP和DBP導致胚胎出現心包水腫的機制,進一步檢測了兩種鄰苯二甲酸酯類污染物暴露后,與胚胎心臟發育相關的蛋白Nkx2.5的表達變化情況.Nkx2.5是調節胚胎心臟發育的重要蛋白,參與了心臟的形成及心肌生長等過程.已有研究證實Nkx2.5的突變可導致心臟傳導異常,室間隔缺損(VSD)和心房間隔缺損(ASD)等先天性心臟疾病[35].Jamali等通過P19細胞體外試驗發現,在抑制Nkx2.5活性后,P19細胞的心肌生長同時被阻遏,由此證明Nkx2.5的活性在心肌發育過程中是必不可少的[36].本研究中,斑馬魚胚胎Nkx2.5蛋白含量在DEHP和DBP暴露后,較對照組明顯下降,尤其是 DBP-500 μg/L組中的Nkx2.5含量僅為對照組的 61%.由此推斷,DBP和 DEHP引起的心率異常和心包水腫,可能與Nkx2.5含量的下降有關.Zhang等(2012)的研究發現低濃度的芘可引起斑馬魚胚胎心臟出現一系列異常,包括心率異常、心包水腫和心臟循環缺陷等,同時伴隨Nkx2.5蛋白的編碼基因表達顯著下調,這一結果與本研究的結果相符[37].
內分泌干擾效應一直是鄰苯二甲酸酯類污染物生態毒理學研究的重點內容,近十年來,大量研究關注于 PAEs對魚類激素水平的影響.Wang等檢測了環境相關濃度下的DEHP長期暴露對成年稀有鮈鯽的內分泌干擾作用,發現39.4μg/L及更高濃度的DEHP暴露后,雄魚血液中 17β-雌二醇含量顯著上升,同時雌魚血液中 17β-雌二醇明顯下調12.除性腺外,甲狀腺是鄰苯二甲酸酯類污染物在生物體內的另一重要靶標.Ye等[38]的研究表明,DEHP可抑制大鼠血液中的 T3、T4和促甲狀腺激素釋放激素含量.Dong等[39]同樣發現DEHP暴露可以抑制大鼠血液中甲狀腺素含量,并能干擾多個調節甲狀腺素的基因表達.Park等(2017)[40]通過對6000名韓國成人的調查,發現成人血液中的T3和T4含量與其尿液中的鄰苯二甲酸酯類代謝產物呈負相關性.上述結果均表明,鄰苯二甲酸酯類污染物對哺乳動物血液中的甲狀腺素具有抑制作用.而根據本研究的結果,500 μg/L 的DEHP和DBP能夠顯著促進斑馬魚胚胎中的T3和T4含量,這一結果與哺乳動物研究結果趨勢相反.Jia等[14]的研究發現400μg/L的DEHP暴露168小時后,斑馬魚仔魚中T3和T4含量均顯著上升,而低濃度(40~200μg/L)的DEHP對胚胎中的T3和 T4含量無顯著影響,上述結果與本研究的結果呈現出良好的一致性.綜合上述研究結果可知,鄰苯二甲酸酯類污染物對不同類生物的甲狀腺素含量的影響可能存在差異.
近年來,關于DEHP代謝物的內分泌干擾效應也開始受到關注.Zhai等[41]的研究發現DEHP的代謝產物鄰苯二甲酸單乙基己基酯(MEHP)能夠顯著影響斑馬魚仔魚中的T3、T4含量,LOEC值為200μg/L,在該濃度下的MEHP暴露后,斑馬魚仔魚中T3含量顯著上升,而T4含量則顯著下降.而根據本研究和Jia等的研究,DEHP影響斑馬魚胚胎甲狀腺素含量的LOEC值分別為500μg/L和 400μg/L.以上結果表明,MEHP對魚類甲狀腺的干擾能力可能比DEHP更強.相反,葉婷等比較DEHP和MEHP對海洋青鳉的內分泌干擾作用后,發現0.1和0.5mg/L的DEHP長期暴露可通過激活肝性激素受體調控肝雌激素響應基因(VTG和Chg)和過氧化物增殖激活受體(PPARα和PPARγ)的表達而對海洋青鳉產生內分泌干擾效應,并且顯示出性別特異性,而MEHP對海洋青鳉的內分泌干擾效應弱于 DEHP[42].綜合上述結果說明,以不同指標評價鄰苯二甲酸酯類污染物的內分泌干擾能力,可能得到不同的結論.
除發育毒性和內分泌干擾作用外,鄰苯二甲酸酯類污染物還可導致魚類出現氧化應激作用和免疫反應.Huang等的研究發現,0.1和 1mg/L的 DEHP暴露后,海洋青鳉(Oryzias melastigma)肝臟中免疫基因IL-1β和CCL20表達量顯著上調,而 CAT和 GPx基因表達水平未見明顯變化[43].Xu等[44]發現 2μmol/L(約為 0.28mg/L)的DBP可導致斑馬魚胚胎出現明顯的免疫反應,包括巨噬細胞減少和免疫相關基因表達異常.為比較鄰苯二甲酸酯類污染物引起的三種毒性效應的敏感性,將以斑馬魚胚胎為模式生物的研究結果進行對比(表 2),根據已報道的 LOEC數據,在DEHP和DBP暴露后,胚胎發育指標比內分泌干擾效應和免疫反應指標更加敏感.
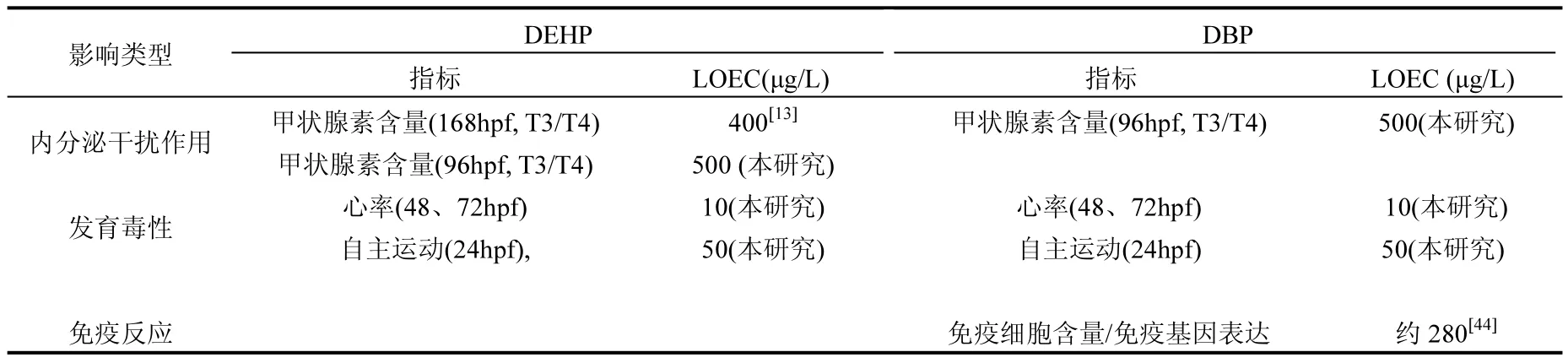
表2 DEHP和DBP暴露后斑馬魚胚胎中三類毒性指標敏感性比較Table 2 Comparison of sensitivity of three categories of indicators towards DEHP and DBP exposure
4 結論
4.1 試驗濃度下(10~500μg/L)DEHP和DBP能誘導斑馬魚胚胎出現心率下降、自主運動異常、脊柱彎曲和心包水腫等一系列發育影響,并能顯著抑制心臟發育相關蛋白Nkx2.5的含量.
4.2 500μg/L的DEHP和DBP暴露后,斑馬魚胚胎中三碘甲狀腺原氨酸和四碘甲狀腺原氨酸含量顯著上升.表明DEHP和DBP對斑馬魚胚胎同樣具備內分泌干擾作用.
4.3 10μg/L的DEHP和DBP即可對斑馬魚胚胎的發育造成影響,這一濃度低于兩種污染物在一些水域的檢出濃度,因此DEHP和DBP對環境中水生生物的危害急需重視.
[1]Boas M, Frederiksen H, Feldt-Rasmussen U, et al. Childhood exposure to phthalates: associations with thyroid function, insulin-like growth factor I, and growth [J]. Environ. Health. Perspect. 2010,118(10):1458-1464.
[2]Zota A R, Calafat A M, Woodruff T J. Temporal trends in phthalate exposures: findings from the National Health and Nutrition Examination Survey, 2001~2010 [J]. Environ. Health. Perspect., 2014,122(3):235-41.
[3]李 彬,吳 山,梁金明,等.中山市農業區域土壤-農產品中鄰苯二甲酸酯(PAEs)污染特征 [J]. 環境科學, 2015,36(6):2283-2291.
[4]楊 彥,于云江,李定龍.太湖流域(蘇南地區)農業活動區人群PAEs健康風險評估 [J]. 中國環境科學, 2013,33(6):1097-1105.
[5]國家環境保護總局,國家質量監督檢驗檢疫總局.地表水環境質量標準(GB3838-2002) [S]. 2002,中國環境科學出版社出版,北京.
[6]杜 嫻.重慶主城兩江水體與沉積物中鄰苯二甲酸酯和多環芳烴污染水平及特征 [D]. 重慶:重慶大學, 2012.
[7]魏 薇,謝 瑩,王建剛,等.鄰苯二甲酸酯在松花江吉林段水體中的分布規律 [J]. 中國環境監測, 2011,27(5):60-64.
[8]宋郭靜.松花江水體部苯二甲分布特征及研究 [D]. 長春:東北師范大學, 2014.
[9]王 凡,沙玉娟,夏星輝,等.長江武漢段水體鄰苯二甲酸酯分布特征研究 [J]. 環境科學, 2008,29(5):1163-1169.
[10]沙玉娟,夏星輝,肖翔群.黃河中下游水體中鄰苯二甲酸酯的分布特征 [J]. 中國環境科學, 2006,26(1):120-124.
[11]陸 洋,袁東星,鄧永智.九龍江水水源及其出廠水鄰苯二甲酸酯污染調查 [J]. 環境與健康雜志, 2007,2(6):438-440.
[12]Wang X, Yang Y, Zhang L, et al. Endocrine disruption by di-(2-ethylhexyl)-phthalate in Chinese rare minnow (Gobiocypris rarus) [J]. Environ Toxicol Chem., 2013,32(8):1846-1854.
[13]Golshan M, Hatef A, Socha M, et al. Di-(2-ethylhexyl)-phthalate disrupts pituitary and testicular hormonal functions to reduce sperm quality in mature goldfish [J]. Aquat. Toxicol,. 2015,163: 16-26.
[14]Jia P, Ma Y, Lu C, et al. The Effects of Disturbance on Hypothalamus-Pituitary-Thyroid (HPT) Axis in Zebrafish Larvae after Exposure to DEHP [J]. PLoS One, 2016,11(5): e0155762.
[15]Wood R K, Crowley E, Martyniuk C J. Developmental profiles and expression of the DNA methyltransferase genes in the fathead minnow (Pimephales promelas) following exposure to di-2-ethylhexyl phthalate [J]. Fish Physiol. Biochem., 2016,42:7-18.
[16]Yang L, Ho N Y, Alshut R, et al. Zebrafish embryos as models for embryotoxic and teratological effects of chemicals [J]. Reprod. Toxicol., 2009,28:245-253.
[17]Embry M R, Belanger S E, Braunbeck T A, et al. The fish embryo toxicity test as an animal alternative method in hazard and risk assessment and scientific research [J]. Aquat. Toxicol., 97:79-87.
[18]穆希巖,黃 瑛,沈公銘,等.苯醚甲環唑對斑馬魚抗氧化酶的影響 [J]. 中國環境科學, 2016,36(4):1242-1249.
[19]Mu X, Pang S, Sun X, et al. Evaluation of acute and developmental effects of difenoconazole via multiple stage zebrafish assays [J]. Environ. Pollut., 2013,175:147-157.
[20]OECD. OECD Guidelines for the Testing of Chemicals [S]. In: Section 2: Effects onBiotic Systems Test No. 236: Fish Embryo Acute Toxicity (FET) Test. Organization for Economic Cooperation and Development, Paris, France.
[21]Fraysse B, Mons R, Garric J. Development of a zebrafish 4-day embryolarval bioassay to assess toxicity of chemicals [J]. Ecotoxicol. Environ. Saf., 2006,63:253-267.
[22]Nagel, R. DarT: the embryo test with the zebrafish Danio rerio e a general model in ecotoxicology and toxicology [J]. ALTEX, 2002,19:38-48.
[23]Shen O, Wu W, Du G, et al. Thyroid Disruption by Di-n-Butyl Phthalate (DBP) and Mono-n-Butyl Phthalate (MBP) in Xenopus laevis [J]. PLoS ONE, 2011,6(4):e19159.
[24]Gardner S T, Wood A T, Lester R, et al. Assessing differences in toxicity and teratogenicity of three phthalates, Diethyl phthalate, Di-npropyl phthalate, and Di-n-butyl phthalate, using Xenopus laevis embryos [J]. J. Toxicol. Environ. Health. Part A, 2016, 79(2):71-82.
[25]Wood R K, Crowley E, Martyniuk C J. Developmental profiles and expression of the DNA methyltransferase genes in the fathead minnow (Pimephales promelas) following exposure to di-2-ethylhexyl phthalate [J]. Fish Physiol. Biochem., 2016,42:7-18.
[26]Chikae M, Hatano Y, Ikeda R, et al. Effects of bis (2-ethylhexyl) phthalate and benzo[a]pyrene on the embryos of Japanese medaka (Oryzias latipes) [J]. Environ. Toxicol. Pharmacol., 2004,16:141-145.
[27]Zanotelli V R, Neuhauss S C, Ehrengruber M U. Longterm exposure to bis (2-ethylhexyl) phthalate (DEHP) inhibits growth of guppy fish (Poecilia reticulata) [J]. J Appl. Toxicol., 2010,30: 29-33.
[28]Zhao X, Gao Y, Qi M. Toxicity of phthalate esters exposure to carp (Cyprinus carpio) and antioxidant response by biomarker [J]. Ecotoxicology, 2014,23:626-632.
[29]Huang B, Li D, Yang Y. Joint Toxicity of Two Phthalates with Waterborne Copper to Daphnia magna and Photobacterium phosphoreum [J]. Bull. Environ. Contam. Toxicol., 2016,97:380-386.
[30]Zhou S, Dong Q, Li S, et al. Developmental toxicity of cartap on zebrafish embryos [J]. Aquat Toxicol, 2009,95:339-346.
[31]van Boxtel A L, Kamstra J H, Fluitsma D M, et al. Dithiocarbamates are teratogenic to developing zebrafish through inhibition of lysyl oxidase activity [J]. Toxicol. Appl. Pharmacol., 2010,244:156-161.
[32]侯 佳.視黃酸缺乏對斑馬魚心臟發育影響的機制研究 [D].上海:復旦大學, 2008.
[33]Mu X, Chai T, Wang K, et al. The developmental effect of difenoconazole on zebrafish embryos: A mechanism research [J]. Environ. Pollut. 2016,212:18-26.
[34]穆希巖,黃 瑛,羅建波,等.通過多階段暴露試驗評價嘧菌酯對斑馬魚的急性毒性與發育毒性 [J]. 環境科學學報, 2017,37(3): 1122-1132.
[35]Olson E N. Gene regulatory networks in the evolution and development of the heart [J]. Science, 2006,313:1922-1927.
[36]Jamali M, Rogerson P, Wilton S, et al. 2001. Nkx2—5Activity IsEssential for Cardiomyogenesis [J]. J. Biol. Chem. 2001,276(45): 42252-42258.
[37]Zhang Y, Wang C, Huang L, et al. Low-level pyrene exposure causes cardiac toxicity in zebrafish (Danio rerio) embryos [J]. Aquat. Toxicol. 2012,114-115:119-124.
[38]Ye H, Ha M, Yang M, et al. Di2-ethylhexyl phthalate disrupts thyroid hormone homeostasis through activating the Ras/Akt/ TRHr pathway and inducing hepatic enzymes [J]. Sci. Rep. 2017, 7:40153.
[39]Dong X, Dong J, Zhao Y, et al. Effects of Long-Term In Vivo Exposure to Di-2-Ethylhexylphthalate on Thyroid Hormones and the TSH/TSHR Signaling Pathways in Wistar Rats [J]. Int. J. Environ. Res. Public Health, 2017,14:44.
[40]Park C, Choi W, Hwang M, et al. Associations between urinary phthalate metabolites and bisphenol A levels, and serum thyroid hormones among the Korean adult population - Korean National Environmental Health Survey (KoNEHS) 2012~2014 [J]. Sci Total Environ. 2017,S0048-9697(17):30154-7.
[41]Zhai W, Huang Z, Chen L, et al. Thyroid Endocrine Disruption in Zebrafish Larvae after Exposure to Mono-(2-Ethylhexyl) Phthalate (MEHP) [J]. PLoS ONE, 2014,9(3):e92465.
[42]葉 婷,康 美,黃乾生,等.鄰苯二甲酸二(2-乙基己)酯(DEHP)和鄰苯二甲酸單乙基己基酯(MEHP)長期暴露對海洋青鳉(Oryzias melastigma)內分泌干擾效應的評價 [J]. 生態毒理學報, 2014,9(2):253-260.
[43]Huang Q, Chen Y, Chi Y, et al. Immunotoxic effects of perfluorooctane sulfonate and di (2-ethylhexyl) phthalate on the marine fish Oryzias melastigma [J]. Fish Shellfish Immunol., 2015,44:302-306.
[44]Xu H, Dong X, Zhang Z, et al. Assessment of immunotoxicity of dibutyl phthalate using live zebrafish embryos [J]. Fish Shellfish Immunol. 2015,45:286-292.
Effects of two phthalate esters on zebrafish embryos.
MU Xi-yan1*, LI Cheng-long2, HUANG Ying1, SHEN Gong-ming1, LI Xu-xing1, LEI Yun-lei1, HUANG Lan2, PANG Sen2, LI Ying-ren1, LI Xue-feng2, WANG Cheng-ju2*(1.Fishery Resource and Environment Research Center, Chinese Academy of Fishery Sciences, Beijing 100141, China;2.College of Sciences, China Agricultural University, Beijing 100193). China Environmental Science, 2017,37(9):3566~3575
The effects of di (2-ethylhexyl) phthalate (DEHP) and dibutyl phthalate (DBP) on morphological indicators during zebrafish embryonic development were investigated in this study. In addition, the protein level of Nkx2.5 and LOX (two proteins that are associated with embryonic development) as well as the thyroid hormone level (triiodothyronine (T3) and tetraiodothyronine (T4)) were detected after DEHP and DBP exposure. The results indicated that the exposure of tested concentrations (10~500μg/L) of DEHP and DBP could induce a suite of abnormities on zebrafish embryos, including abnormal spontaneous movement, heart rate decrease, pericardial edema and spinal curvature, which occurred along with the decrease of Nkx2.5level. ELISA assay results showed that the level of T3 and T4 significantly increased after exposure of 500 μg/L DEHP and DBP, which indicated that PAEs have endocrine disrupting effects on fish during early life stage. Furthermore, the LOEC of DEHP and DBP towards zebrafish embryos was 10μg/L, which was close to their detected concentrations in environmental water areas. Thus their potential risk on environmental aquatic organisms during early life stages should be concerned.
DEHP;DBP;zebrafish embryo;developmental toxicity;hormone level
X171.5
A
1000-6923(2017)09-3566-10
2017-02-10
中央級公益性科研院所基本科研業務費專項(2016C008);中央級公益性科研院所基本科研業務費專項(2017HY-ZD0201)
* 責任作者, 博士, muxiyan@cafs.ac.cn;wangchengju@cau.edu.cn
穆希巖(1987-),男,博士,北京人,中國水產科學研究院資源與環境研究中心助理研究員.主要研究方向為漁業污染物的生態毒理學研究.發表論文20余篇.

