多重實時熒光定量PCR分析轉基因煙草外源基因拷貝數
余婧,鄒頡,付強,郭玉雙,林世鋒,趙杰宏
貴州省煙草科學研究院,煙草行業煙草分子遺傳重點實驗室,貴州省貴陽市龍灘壩路29號 550081
多重實時熒光定量PCR分析轉基因煙草外源基因拷貝數
余婧,鄒頡,付強,郭玉雙,林世鋒,趙杰宏
貴州省煙草科學研究院,煙草行業煙草分子遺傳重點實驗室,貴州省貴陽市龍灘壩路29號 550081
【目的】采用多重實時熒光定量PCR方法在一個反應內同時檢測轉基因煙草中插入外源基因35S、NOS、NPT II的拷貝數。【方法】將轉基因陽性參照煙草基因組DNA經梯度稀釋,通過多重熒光定量PCR反應同時獲得煙草內源參照基因NR、外源基因35S、NOS、NPT II的相關性標準曲線方程,將待測株系外源基因的Ct值代入標準曲線方程后估算其拷貝數。【結果】獲得了上述4個基因的標準曲線,其R2均接近于1,相關性較高。在檢測的六個轉基因株系中初篩到3株3個外源基因均為單拷貝的株系。【結論】可使用該方法對轉基因煙草外源基因插入拷貝數進行估算,為獲得穩定遺傳材料提供初篩依據。
轉基因煙草;多重實時熒光定量PCR;外源基因;拷貝數
1983年,第一株轉基因煙草問世[1],煙草作為植物分子生物學研究的模式植物,30多年來,人們對煙草的轉基因研究從未停歇,包括將煙草自身基因進行超量表達以驗證其基因功能[2-4],外源基因在煙草中表達后的功能驗證[5-7]等,這些研究均需使用轉基因技術。然而,無論是內源基因的過表達或外源基因的轉入和表達,轉基因植物中插入基因的拷貝數是影響其表達水平及遺傳穩定性的主要因素,外源基因的拷貝數過多會導致基因沉默或不能穩定表達。因此,通常應篩選出含有拷貝數為1~2個,最好是單拷貝外源基因的轉基因植株[8-9]。
檢測外源基因拷貝數主要采用Southern blot技術,該方法穩定、可靠,但其價格昂貴、程序復雜、耗時較長、需要大量高純度DNA,靈敏度相對較低,且對實驗技術條件要求較高[10]。近年來,研究人員開始利用實時熒光定量PCR檢測外源基因拷貝數,該方法經PCR反應獲得樣品Ct值并制作標準曲線,根據起始模板數的相關性方程,將樣品的Ct 值代入該方程便可計算目的基因的起始模板數,將其與內源參照基因起始模板數作比較,便可估算出基因組中外源基因的拷貝數[11]。目前,已有多篇關于實時熒光定量PCR檢測轉基因植物中外源基因拷貝數的報道,但均為單重熒光定量PCR[12-15],即內源基因及外源基因需分別做二次標準曲線,待測樣品內、外源靶標的檢測也在不同PCR管內進行,這對于定量要求較高的定量PCR而言,易受加樣誤差的影響。多重PCR技術是在同一PCR管中同時加入多對引物,只需1次反應便能同時檢測2種以上靶標序列[16],該方法已用于動物源成分檢測[17]、轉基因作物檢測[18]、食品中細菌的檢測[19]等,而用多重實時熒光定量PCR檢測轉基因煙草外源基因拷貝數的相關文獻未見報道。
本研究建立了一種使用多重實時熒光定量PCR分析轉基因煙草外源基因拷貝數的方法,該體系在一次PCR反應內便完成了以煙草內源硝酸還原酶基因NR[20]為內參基因、外源基因35S啟動子、終止子NOS及卡那霉素抗性標記基因NPT II標準曲線的制備及待測樣品Ct值的檢測工作,并根據Ct值及公式測算了外源基因拷貝數。由于本研究在1個反應內便能獲得上述4個基因的Ct值,這可消減內參基因與目的基因在不同PCR反應間產生的加樣誤差。另外,對3個外源基因拷貝數同時進行檢測,可排除部分可能發生基因重排而未穩定遺傳的株系。因此,該方法可用于估算轉基因煙草外源基因插入拷貝數,為初篩并獲得穩定遺傳材料提供技術支撐。
1 材料與方法
1.1 實驗材料
轉基因煙草株系T31為陽性參照株系,其遺傳轉化載體由pBI121改造,該載體含有外源基因35S、NOS、NPT II,T31種子經卡那霉素抗性測試已穩定遺傳至T6代;A1-A6待測單株為T5代轉基因材料;陰性對照為貴煙1號。上述材料于貴州省煙草科學研究院人工氣候室種植,T31取群體葉片,A1-A6取單株葉片用于DNA提取。
1.2 實驗試劑
植物基因組DNA提取試劑盒購自天根生化科技(北京)有限公司,用于熒光定量PCR的Premix Ex Taq?(Probe qPCR)購自寶生物工程(大連)有限公司。
1.3 實驗設備
ViiA 7 實時熒光定量PCR儀(美國ABI公司);NanoDrop 2000超微量分光光度計(美國Thermo Fisher公司);離心機(德國Eppendorf公司);C1000 Touch PCR儀( 美 國BIO-RAD公 司);ChemiDocXRS凝膠成像系統(美國BIO-RAD公司)。
1.4 實驗方法
1.4.1 定性PCR檢測
引物序列、反應體系及條件參照余婧等[16],引物由上海捷瑞生物工程有限公司合成。
1.4.2 煙草基因組DNA提取
采用試劑盒提取煙草基因組DNA用于熒光定量PCR測試,提取方法參照試劑盒使用說明書。待測樣品DNA經NanoDrop 2000測定濃度及純度后統一用ddH2O稀釋至100 ng/μL,用于制備標準曲線的T31 DNA測定濃度后備用。本研究中所提取DNA的OD260/OD280比值均在1.80~1.90之間。
1.4.3 Southern印跡雜交
陽性參照株系T31外源基因35S啟動子Southern印跡雜交參照J.薩姆布魯克等[21],基因組DNA經EcoRI、HindIII、NdeI、TaqI四組酶酶切。待測株系基因組DNA經HindIII酶切,對外源基因NPT II進行Southern印跡雜交。
1.4.4 定量PCR標準曲線制備
用ddH2O按2倍濃度梯度稀釋T31的基因組DNA制作標準曲線,標準曲線設置5個點,3次重復獲得標準曲線。
1.4.5 多重定量 PCR反應體系及條件
20μL PCR反應體系(4個靶標的引物及探針均加入同一PCR管中):Premix Ex Taq 10μL,探針10 μM,上下游引物各 10 μM,50×ROX Dye II 0.4 μL,DNA 2 μL;PCR反 應條 件:95℃ 30s;95℃5s,60℃ 34s,40個循環。引物及探針見表1,由上海捷瑞生物工程有限公司合成。

表1 多重定量PCR引物、探針序列Tab.1 Multiplex real-time PCR primer and probe sequence
1.4.6 轉基因煙草外源基因拷貝數估算
定量PCR結束后,獲得標準曲線及待測樣品Ct值,根據NR及35S、NOS、NPT II的Ct值并依據公式X0/R0=10[(Ct,X-IX)/SX]-[(Ct,R-IR)/SR](其中Ct,X為外源基因的 Ct 值,IX 為外源基因標準曲線的截距,SX為外源基因標準曲線的斜率;Ct,R為內參基因的Ct值,IR為內參基因標準曲線的截距,SR為內參基因標準曲線的斜率),拷貝數即根據X0/R0的平均值進行估算[24]。
2 結果與分析
2.1 轉基因陽性植株定性PCR檢測
為確保參試樣品為轉基因陽性,提取待測植株葉片DNA為模板進行多重定性PCR擴增目的基因35S、NOS、NPT II。擴增產物經2%瓊脂糖凝膠電泳(圖1),A1-A6號樣品均帶有目的基因35S(345bp)、NOS(199bp)、NPT II(490bp)特異性擴增片段,初步確定6個單株均為轉基因陽性單株,另外,內源參照基因NR(137bp)擴增條帶單一,特異性好,表明DNA提取質量附合PCR檢測要求。

圖1 多重PCR定性檢測電泳結果Fig.1 Results of multiplex qualitative PCR detection
2.2 陽性參照株系35S Southern印跡拷貝數檢測
為避免2個拷貝所在片段大小相同的巧合,分別采用EcoR I、HindIII、NdeI、TaqI四組酶對陽性參照株系T31基因組DNA進行酶切。插入基因35S經四組酶切的Southern結果均有雜交目的條帶(圖2),這表明35S已被整合到T31陽性參照株系基因組中,且為單拷貝插入。
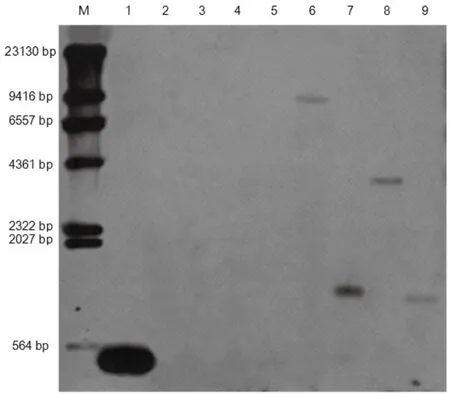
圖2 陽性參照株系T31 35S啟動子插入拷貝數Southern檢測結果Fig.2 Southern detection results for 35S promoter insertion copy number of the positive reference plants T31
2.3 標準曲線制作及待測樣品Ct值
T31基因組DNA測定濃度后直接用ddH2O 2倍稀釋后制作3組重復標準曲線(本研究T31 DNA初始濃度為170 ng/μL),以模板起始拷貝數對數為X軸,以Ct值為Y軸,在一次PCR反應中同時獲得到了內源參照基因NR及外源基因35S、NOS、NPT II的擴增曲線(圖3)及標準曲線(圖4),四條標準曲線擴增效率在99.565%~102.748之間,相關系數R2在0.997~0.999之間,相關性較好,可用于目的基因拷貝數的檢測。在待測樣品Ct值的測試中,4個基因Ct值的標準偏差在0.02~0.17之間,相對標準偏差在0.10%~0.84%之間,說明Ct值重復性良好,陽性參照株系、對照株系及各待測單株Ct值見表2。

圖3 多重熒光定量PCR擴增曲線Fig.3 Multiplex real-time PCR amplification curve
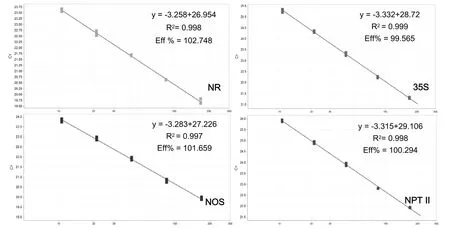
圖4 多重熒光定量PCR標準曲線Fig.4 Multiplex real-time PCR standard curve

表2 各株系擴增靶標Ct值Tab.2 Ct value of target gene
2.4 待測株系外源基因插入拷貝數的估算
以陽性株系T31外源基因35S的Southern檢測結果及符合高世代穩定遺傳的標準為參照,以T31的35S、NOS、NPT II插入拷貝數均為1來比較、估算待測基因拷貝數。按1.4.6中公式X0/R0=10[(Ct,X-IX)/SX]-[(Ct,R-IR)/SR]估算外源基因拷貝數,實驗中,以A3樣品為例,跟據內源基因NR及外源基因35S、NOS、NPT II的標準曲線(圖4),將A3樣品Ct值(表2)代入公式計算三個外源基因 的 拷 貝 數:35S0=10[(21.11-28.72)/-3.332]-[(20.42-26.954)/-3.258],NOS0=10[(19.14-27.226)/-3.283]-[(20.42-26.954)/-3.258],NPT II0=10[(21.45-29.106)/-3.315]-[(20.42-26.954)/-3.258]計算出35S0=1.9,NOS0=2.9,NPT II0=2.0,即A3樣品35S、NOS、NPT II插入拷貝數的估算值分別為1.9、2.9、2.0。在對待測樣品A1-A6各外源基因拷貝數的估算中(表3),A1、A3二個單株部分外源基因插入拷貝數為2~3個拷貝,這表明A1、A3為外源基因多拷貝插入,而A4拷貝數估算值不到1,這可能由于外源基因發生了重排、丟失,為不穩定遺傳[25]。A2、A5、A6三個單株三個外源基因插入拷貝數估算值均1,為單拷貝。

表3 外源基因插入拷貝數估算Tab.3 Estimation of exogenous gene insertion copy number
2.5 待測株系NPT II Southern印跡雜交拷貝數檢測
為了驗證經多重熒光定量PCR所估算的外源基因插入拷貝數與Southern雜交的結果是否一致,對各株系的外源基因NPI II進行了Southern印跡檢測,結果表明(圖5),株系A2、A4、A5、A6中NPT II基因的Southern印跡檢測拷貝數為1個,其中A4在定量PCR中估算值不足1個拷貝,A4可能為雜合株,并未穩定遺傳。而株系A1、A3中NPT II基因的Southern印跡檢測拷貝數為2個,這與定量PCR中所估算的NPT II基因的插入拷貝數一致。
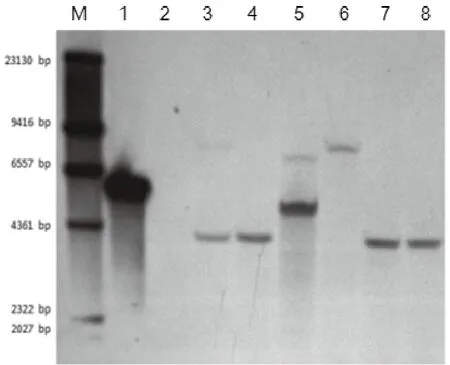
圖5 待測株系NPT II插入拷貝數Southern檢測結果Fig.5 Southern detection of NPT II insertion copy number
3 討論
本研究建立了一種多重實時熒光定量PCR,該方法通過一次PCR反應便可同時獲得煙草內源參照基因NR,外源基因35S、NOS、NPT II的標準曲線,并通過標準曲線及待測樣品Ct值計算出待測樣品外源基因拷貝數。根據文獻報道[26],用實時熒光定量PCR檢測外源基因拷貝數,其陽性參照植株必須是純度為100%的轉基因植物樣品,本研究選取了本實驗室高世代穩定遺傳材料T31作為轉基因陽性參照株系,在Southern測試中,T31外源基因35S的插入拷貝數為1,因此,實驗以T31的35S、NOS、NPT II插入拷貝數均為1來比較、估算出待測樣品3個外源基因的拷貝數。蘇慧慧等[12]指出轉基因植物中同一單株不同外源基因拷貝數不一致,這可能是發生了基因重排或缺失,因此,我們的多重熒光定量PCR特意對3種外源基因的拷貝數同時進行估算,能有效排除因外源基因的重排或缺失而造成植株遺傳不穩定的可能性。值得提出的是,我們后期特意對A1-A6后代種子萌發進行卡那霉素抗性測試,單拷貝單株A2、A5、A6萌發率為100%,而A1、A3、A4均為80%左右,這表明該3個株系可能由于外源基因多拷貝插入或重排、缺失,并未穩定遺傳,這與我們估算的外源基因是否為單拷貝結果一致。因此,本方法可用于轉基因煙草外源基因插入拷貝數的估算,為初篩并獲得穩定遺傳材料提供技術支撐。
[1]趙彥平,趙春海.植物轉基因育種的分析與研究[J].生物技術通報,2011(3):72-77.ZHAO Yanping, ZHAO Chunhai.Research and analysis of transgenic breeding in plants[J].BIOTECHNOLOGY BULLETIN ,2011(3):72-77.
[2]Mi SL, Hwang S.Cyc07, enhances arsenite tolerance by reducing As levels in Nicotianatabacum, and Arabidopsis thaliana[J].Plant Biotechnology Reports, 2012, 6(4):391-395.
[3]李洋,李明,岳瑋,等.煙草NtHCT基因對次生代謝物質綠原酸和類黃酮合成的影響[J].中國煙草學報,2015,21(6):127-131.LI Yang, LI Ming, YUE Wei, et al.Effect ofNtHCTgene on synthesis of chlorogenic acid and fl avonoid in tobacco[J].ActaTaba cariaSinica,2015,21(6):127-131.
[4]張興坦.煙草MAPK基因的功能研究[D].重慶大學,2015.ZHANG Xingtan.Functional Characterization of Nicotianatabacum MAPK genes[D].Chongqing University, 2015.
[5]Cai R, Zhao Y, Wang Y, et al.Overexpression of a maize WRKY58,gene enhances drought and salt tolerance in transgenic rice[J].Plant Cell, Tissue and Organ Culture (PCTOC), 2014, 119(3):565-577.
[6]Zhou M, Wu L, Liang J, et al.Cold-induced modulation of CbICE53 gene activates endogenous genes to enhance acclimation in transgenic tobacco[J].Molecular Breeding, 2012, 30(4):1611-1620.
[7]Xu Q, Nan G, Ruan M, et al.Ectopic expression of the PttKN1,gene induced altered leaf morphology and hormonal levels in transgenic tobacco[J].Journal of Plant Biochemistry and Biotechnology, 2015, 24(2):197-203.
[8]Weng H, Pan A, Yang L, et al.Estimating number of transgene copies in transgenic rapeseed by real-time PCR assay withHMG I/Y as an endogenous reference gene[J].Plant Molecular Biology Reporter, 2004, 22(3):289-300.
[9]王海慧, 田源, 白國輝,等.轉基因植物遺傳穩定性影響因素的研究現狀[J].貴州農業科學, 2013, 41(9):5-8.WANG Haihui, TIAN Yuan, BAI Guohui,et al.Advances in influencing factors of genetic stability of transgenic plants[J].Guizhou Agricultural Sciences,2013, 41(9):5-8.
[10]羅濱,陳永康,王瑩.植物外源基因拷貝數及插入位點的檢測方法與技術[J].河南師范大學學報(自然版),2012,40(6):111-116.LUO Bing, CHEN Yongkang, WANG Ying.Methods and techniques for estimating the copy number and fl anking sequences of exogenous gene in transgenic plants[J].Journal of Henan Normal University(Natural Science Edition),2012,40(6):111-116.
[11]李敏, 汪洋, 張銀萍,等.TaqMan探針與SYBR Green實時定量PCR法檢測轉基因植物外源基因拷貝數的差異分析[J].安徽農業大學學報, 2012, 39(4):568-570.LI Min, WANG Yang, ZHANG Yinping,et al.Variance analysis between TaqMan probe and SYBR Green real-time quantitative PCR for determining the copy number of transgene in transformed plants[J].Journal of Anhui Agricultural University, 2012,39(4):568-570.
[12]蘇慧慧,李濤,謝雯琦,等.基于實時熒光定量PCR對轉基因櫻桃番茄外源基因拷貝數的檢測[J].分子植物育種,2015,13(2):345-354.SU Huihui, LI Tao, XIE Wenqi, et al.Detecting exogenous gene copy numbers of exogenous gene in transgenic tomato based on fluorescent quantitative real-time PCR[J].Molecular Plant Breeding,2015,13(2):345-354.
[13]Yang X.Analysis of the copy number of exogenous genes in transgenic cotton using real-time quantitative PCR and the 2-△△CTmethod[J].African Journal of Biotechnology, 2012, 11(23):6226-0233.
[14]甄貞,段俊枝,于艷波,等.轉基因小麥B73-6-1外源基因拷貝數的確定[J].河南農業科學,2016,45(4):19-22.ZHEN Zhen, DUAN Junzhi, YU Yangbo,et al. Determination of exogenous gene copy number for transgenic wheat B73-6-1[J].Journal of Henan Agricultural Sciences,2016,45(4):19-22.
[15]韓強,劉瑞芳,陸玲鴻,等.實時熒光PCR檢測轉基因大豆外源基因的拷貝數[J].核農學報, 2016, 30(4):646-653.HAN Qing, LIU Ruifang, LU Linghong, et al.Dectection of transgene copy number in transgenic soybean by real-time fluorescence quantitative PCR[J].Journal of Nuclear Agricultural Sciences,2016, 30(4):646-653.
[16]余婧,郭玉雙,林世鋒,等.多重PCR技術快速檢測烤后煙葉轉基因成分[J].生物技術通報, 2015, 31(7):64-68.YU Jing, GUO Yushuang, LIN Shifeng, et al.A multiplex PCR for rapid detection of genetically modi fi ed ingredient in fl ue-cured tobacco[J].BIOTECHNOLOGY BULLETIN,2015, 31(7):64-68.
[17]Iwobi A, Sebah D, Kraemer I, et al.A multiplex real-time PCR method for the quanti fi cation of beef and pork fractions in minced meat[J].Food Chemistry, 2015, 169(169):305-313.
[18]Samson, Cristina M, Gulli, et al.Multiplex real-time PCR assays for simultaneous detection of 'maize; MON810 and GA21 in food samples[J].Food Control, 2013, 30(2):518-525.
[19]Feng C, Mansouri S, Bluhm B H, et al.Multiplex real-time PCR assays for detection of four seedborne spinach pathogens.[J].Journal of Applied Microbiology, 2014, 117(2):472-84.
[20]Bindler G, Borne F D, Gadani F et al.Task Force Genetically Modi fi ed Tobacco-Detection Methods [C]// CORESTA.1999.
[21]J.薩姆布魯克, D.W.拉塞爾.分子克隆實驗指南(第三版)[M].科學出版社, 2002.Sambrook J J, Russell D W.Molecular cloning: a laboratory manual(Third Edition) [M].Academic press, 2002.
[22]中國國家標準化管理委員會.GB/T 24310-2009《煙草及煙草制品轉基因檢測方法》[S].北京:中國標準出版社,2009.Standardization Administration of the People's Republic of China.GB/T 24310-2009 Tobacco and tobacco products-detecting method of genetically modified organism contents[S].Beijing: China Standards Press, 2009.
[23]Wang F, Zhang X, Feng J, et al.Establishment of a quadruplex real-time PCR for screening of genetically modi fi ed tomatoes[J].European Food Research and Technology, 2014, 238(4):683-690.
[24]王愛民.實時熒光定量PCR(TaqMan)法測定外源基因的拷貝數[J].廣西植物, 2009, 29(3):408-412.WANG Aiming.Estimating copy number of transgenic gene by real-time fl uorescent quantitative PCR(TaqMan)[J].Guihaia,2009,29(3):408-412.
[25]金萬梅, 潘青華, 尹淑萍,等.外源基因在轉基因植物中的遺傳穩定性及其轉育研究進展[J].分子植物育種, 2005, 3(6):864-868.JIN Wanmei, PAN Qinghua, YIN Shuping, et al.Progress of the genetic stability and breeding behavior of foreign gene in genetically modified plants[J].Molecular Plant Breeding, 2005,3(6):864-868.
[26]劉海礁, 王哲, 李雪君,等.轉fps基因煙草純合系的獲得及其特性分析[J].中國煙草學報, 2006, 12(4):41-43.LIU Haijiao, WANG Zhe, LI Xuejun, et al.A method of obtaining fps transgenic homozygous lines in tobacco and the analysis of their characteristics[J].ActaTabacariaSinica,2006, 12(4):41-43.
Detecting copy number of exogenous genes in transgenic tobacco by multiplex RT-PCR
YU Jing, ZOU Jie, FU Qiang, GUO Yushuang, LIN Shifeng, ZHAO Jiehong*
Guizhou Academy of Tobacco Science, Key Laboratory of Molecular Genetics, China National Tobacco Corporation,Guiyang 550081, China
This paper utilized a multiplex real-time PCR assay to simultaneously detect copy number of inserted exogenous gene 35S,NOS and NPT II in transgenic tobacco within one reaction.Gradient dilution was applied to positive reference tobacco genome DNA,and multiplex real-time PCR assay was used to obtain standard curve equation of tobacco endogenuous reference gene NR and exogenous gene 35S, NOS, as well as NPT II.Copy number of exogenous genes was estimated after substituting the Ct values of both endogenuous and exogenous genes of the strains to be tested into the standard curve equation.Results showed that standard curves of the 4 genes were obtained, and all R2 values were close to 1 with relatively high correlation.In the tested 6 transgenic strains, preliminarily screened 3 strains with their 3 exogenous genes were all single copy.This method can be used for the estimation of copy number of inserted exogenous genes in transgenic tobacco, so as to provide preliminary screen basis for obtaining stable genetic materials.
transgenic tobacco; multiplex RT-PCR; exogenous genes; copy number
余婧,鄒頡,付強,等.多重實時熒光定量PCR分析轉基因煙草外源基因拷貝數[J].中國煙草學報,2017, 23(4)
中國煙草總公司貴州省公司科技項目(201604);貴州省科技支撐計劃農業攻關科技計劃項目(黔科合NY[2013]3020號);貴州省科學技術基金(黔科合J字[2014]2117號)
余 婧(1983—),碩士,助理研究員,主要從事煙草分子生物學研究工作, Email:yujingbio@126.com
趙杰宏(1978—),博士,研究員,主要從事煙草分子生物學研究工作,Email: zhaojiehong@126.com
2017-03-02;< class="emphasis_bold">網絡出版日期:
日期:2017-06-02
:YU Jing, ZOU Jie, FU Qiang, et al.Detecting copy number of exogenous genes in transgenic tobacco by multiplex RT-PCR [J].Acta Tabacaria Sinica, 2017, 23(4)
*Corresponding author.Email:zhaojiehong@126.com

