土壤中盾殼霉雙標記平板計數法的建立及應用
楊秀超, 俞文靜, 段作營, 夏森玉, 沈志松, 金 堅, 李華鐘*
(1. 江南大學工業微生物技術教育部重點實驗室, 無錫 214122; 2. 無錫楗農生物科技有限公司,無錫 214122; 3. 江南大學藥學院, 無錫 214122)
土壤中盾殼霉雙標記平板計數法的建立及應用
楊秀超1, 俞文靜1, 段作營1, 夏森玉2, 沈志松2, 金 堅3, 李華鐘1*
(1. 江南大學工業微生物技術教育部重點實驗室, 無錫 214122; 2. 無錫楗農生物科技有限公司,無錫 214122; 3. 江南大學藥學院, 無錫 214122)
盾殼霉是一種重要的生防菌,其在土壤中的存活數量直接關系到防治病害的效果。然而目前沒有對土壤中盾殼霉直接計數的方法,構建一種簡單易行的土壤中盾殼霉計數方法對研究盾殼霉在土壤中的存活動態具有重要意義。本研究利用農桿菌轉化法構建了潮霉素基因和綠色熒光蛋白基因標記的雙標記盾殼霉菌株,并測定轉化子的生長速度、產孢量和菌核致腐能力,初步分析了該方法計數土壤盾殼霉的有效性和可行性。結果顯示,潮霉素基因和綠色熒光蛋白基因可以穩定地遺傳和表達,并且部分轉化子生長速度、產孢量和菌核致腐能力與出發盾殼霉菌株JN-CM沒有顯著差異。加入土壤中的盾殼霉轉化子可以在含潮霉素(50 μg/mL)、氯霉素(100 μg/mL)和鏈霉素(100 μg/mL)的PDA平板培養,雜菌得到充分抑制,呈現綠色熒光的盾殼霉轉化子被有效檢出,檢出限達到2×103個/g土。本研究所構建的計數方法能有效檢出施入土壤中的盾殼霉并進行活菌計數,可以用于盾殼霉JN-CM產品在土壤中的定殖、生長、繁殖和存活情況的研究。應用雙標記平板計數法研究了不同溫度、濕度、接種量和添加菌核等條件下盾殼霉JN-CM在土壤中的存活規律。結果顯示,在含有核盤菌菌核的土壤中,盾殼霉JN-CM可以通過重寄生維持一段時間(12周)的數量增長,在長達半年左右(24周)的時間里其存活率仍然可以維持在65%左右。在不含菌核的土壤中,在一般土壤溫度(10~20℃)范圍內,無論土壤水分含量高低,其半年存活率也可以維持在50%左右。因此,可以預測,連續施用盾殼霉JN-CM生防制劑,可以使其數量在土壤中長期維持在一定的水平范圍,達到長效防治效果。
生物防治; 盾殼霉; 農桿菌介導轉化; 平板計數
核盤菌Sclerotiniasclerotiorum(Lib.)de Bary是一種世界性分布的植物病原真菌,能侵染75科450種植物,以草本植物居多[1]。在我國,核盤菌的寄主植物也高達36科214種,核盤菌引起的菌核病給我國糧油作物和蔬菜作物造成了嚴重的危害[2]。目前,我國主要采用化學殺菌劑來控制菌核病,但化學殺菌劑引起的環境污染、抗性菌株產生和農藥殘留等問題越來越嚴重,尋找安全、環保、高效的防治方法成為了必然選擇。盾殼霉Coniothyriumminitans是核盤菌的重寄生菌,被認為是防治菌核病最有效的生防菌之一[3-4]。國內外許多研究表明在土壤中施用盾殼霉培養物可以有效地控制核盤菌菌核的存活及子囊盤萌發,從而控制核盤菌的初侵染源數量,目前已有多種商品化盾殼霉產品用于防治大田作物、溫室及園藝作物菌核病[5-10]。
本實驗室篩選獲得一株盾殼霉菌株,并命名為JN-CM,通過與無錫楗農生物科技有限公司合作已完成了JN-CM盾殼霉產品的生產工藝開發,并取得盾殼霉新農藥正式登記證,進入生產和推廣階段。推廣中農民普遍關心藥效持續時間和施藥次數等問題。而盾殼霉防效與其在土壤中存活的數量是直接相關的[11-12]。因此,有必要了解盾殼霉施入土壤后的定殖、生長、繁殖和存活情況。由于施入土壤中盾殼霉的數量有限,且土壤中存在大量雜菌,因此不能采用普通的平板菌落計數法對盾殼霉進行直接計數,必須構建抗性菌株采用選擇性平板或者PCR擴增的方法進行檢測[13-14]。為了提高檢出的靈敏度和特異性,本研究構建了含有潮霉素抗性選擇標記和綠色熒光蛋白鑒別標記的雙標記盾殼霉重組菌株,其生長速度、產孢量和致腐能力與出發菌株JN-CM沒有顯著差異,可以用來代替JN-CM盾殼霉產品進行土壤定殖、生長、繁殖和存活情況研究。
1 材料與方法
1.1 材料
供試菌株和質粒:大腸桿菌DH5α購自天根生化科技有限公司;農桿菌EHA105感受態細胞購自上海士峰生物科技有限公司;盾殼霉菌株JN-CM由本實驗室分離保存;雙元載體pTFCM由華中農業大學姜道宏教授惠贈;含有紅綠熒光基因的載體pCI-eGFP-DsRed和pET-20b(+)由本實驗室保存。
試劑:T4 DNA連接酶、限制性內切酶XbaⅠ、HindⅢ、ClaⅠ、BamHⅠ、KpnⅠ、SacⅠ、EcoRⅠ和DNA聚合酶等購自TaKaRa公司(中國);質粒提取試劑盒、膠回收試劑盒、PCR產物回收試劑盒、乙酰丁香酮、硫酸鏈霉素、氯霉素、卡那霉素等購自上海生工生物公司;2-(N-嗎啉)乙磺酸鈉 (MES)購自上海麥克林生化科技有限公司;潮霉素購自北京索萊寶科技有限公司;其余均為國產或進口分析純試劑。
1.2 PCR擴增引物
本文中進行PCR擴增的引物見表1,均由上海生工生物工程股份有限公司合成。用下劃線標出了限制性內切酶位點,各引物對對應的限制性內切酶分別是:P1 和P2,XbaⅠ和λ-HindⅢ;P3和P4,ClaⅠ和BamHⅠ;P5和P6,SacⅠ和KpnⅠ。
表1質粒構建所用引物
Table1Primersusedforplasmidconstruction

引物Primers擴增片段Amplifiedfragment片段長度/bpLength序列(5′?3′)SequencesP1P2P3P4P5P6PtrpC?HYG?TtrpC2110eGFP738PtrpC?eGFP?TtrpC1794GCTCTAGAAAGAAGGATTACCTCTAAACACGCAAGCTTCGACAGAAGATGATATTGAAGGCCATCGATGCCTCGAGAATTCACCATCGGGATCCGATTACTTGTACAGCTCGTCCGAGCTCGAAAGAAGGATTACCTCTAAACACGGGGTACCCGACAGAAGATGATATTGAAGG
1.3 潮霉素抑制盾殼霉生長最低濃度測定
潮霉素是抗真菌類抗生素,但不同真菌對潮霉素敏感程度不同,因此在將潮霉素抗性基因導入盾殼霉之前需要確定盾殼霉對潮霉素的敏感程度。盾殼霉菌株JN-CM在PDA平板培養活化直至菌落長滿整個平板,用打孔器打取直徑為0.5 cm的瓊脂塊分別接種到潮霉素濃度為20、25、30、35、40、45、50和55 μg/mL的PDA平板中央,置于20℃培養,每個濃度設3個重復。十字交叉法測定5 d和9 d時菌落直徑,計算抑制盾殼霉JN-CM生長的最低濃度。
1.4 雙標記雙元載體pTFCM-eGFP構建
以表1中所列引物進行PCR擴增,按照圖1所示流程構建雙標記雙元載體。采用熱激轉化法將構建好的質粒轉入DH5α感受態細胞,并用含50 μg/mL卡那霉素的LB平板進行篩選,挑取單菌落進行培養并提取質粒,進行PCR和單酶切電泳圖譜鑒定,對鑒定正確的質粒進行測序驗證。

圖1 雙標記雙元載體構建流程圖Fig.1 Flow chart of construction of double-labeling binary vector
1.5 農桿菌的轉化
將-80℃保存的農桿菌感受態細胞取出于冰上融化,每100 μL感受態細胞加1 μg質粒DNA混勻,依次于冰上靜置10 min、液氮5 min、37℃水浴5 min、冰上靜置5 min,加入700 μL無抗生素的LB液體培養基,于28℃振蕩培養2~3 h。取100 μL培養后的菌液涂布到含有卡那霉素的LB平板上,倒置放于28℃培養箱培養2~3 d。挑取單菌落,液體培養5~8 h,取1 μL菌液做模板,以P3、P4為引物進行PCR驗證。
1.6 盾殼霉的共轉化
農桿菌的培養參考Bundock等所描述方法[15]。農桿菌介導的盾殼霉轉化試驗參考李模孝等所描述方法,并進行部分改動[16-17]。挑取含有重組質粒的農桿菌到含50 μg/mL卡那霉素的LB培養基中,28℃,200 r/min振蕩培養1 d,取100 μL農桿菌菌液加入到含有50 μg/mL卡那霉素的10 mL MM培養基中,200 r/min, 28℃培養2 d,測定菌液的OD600,用含有4 μmol/mL乙酰丁香酮(As)和1.0 g/L 2-(N-嗎啉)乙磺酸鈉 (MES)的誘導培養基(IM)稀釋至OD600為0.15,在28℃,220 r/min振蕩培養6 h備用。將盾殼霉JN-CM接種到PDA平板培養21 d,用無菌水洗下平板上孢子并離心收集分生孢子,用農桿菌細胞懸液稀釋孢子數到108個/mL備用。制備含有4 μmol/mL As 和1.0 g/L MES共轉化誘導培養基(CO-IM)的無菌平板,并在上面鋪上一層硝酸纖維素膜,取制備好的農桿菌和盾殼霉孢子懸液200 μL涂布在平板上,25℃黑暗培養2 d,將硝酸纖維素膜揭起正面朝下蓋在含有50 μg/mL潮霉素和500 μg/mL氨芐青霉素的PDA平板上。20℃培養5~8 d,長出來的菌落轉移到含60 μg/mL潮霉素的PDA平板,能繼續生長推定為轉化子。隨機選擇幾株可能的轉化子進行培養,收集菌絲提取總DNA,以P3和P4為引物擴增綠色熒光基因片段,PCR產物經1%瓊脂糖凝膠電泳分析鑒定。
1.7 轉化子穩定性測定
隨機選擇5株轉化子在不含抗生素的PDA平板培養10 d以上,用無菌水洗脫平板上孢子,并用2層擦鏡紙過濾掉菌絲,得到純孢子懸浮液。將孢子懸浮液涂布到無抗生素PDA平板,20℃培養10 d。如此重復直至第10代。測定第10代轉化子中潮霉素抗性基因和綠色熒光基因表達情況。
1.8 轉化子生長速度、產孢量和菌核致腐能力測定
菌絲生長速度:用打孔器打取直徑0.5 cm的盾殼霉菌落邊緣的瓊脂塊接種到不含抗生素的PDA平板中央,20℃培養,十字交叉法測定培養5 d和9 d的菌落直徑,每菌株設置3個重復。比較出發菌株和轉化菌株1~5的差異[18-20]。
孢子萌發率:將出發菌株和轉化子在PDA平板培養至產生大量孢子,洗脫孢子并計數。稀釋使孢子濃度為107個/mL,取100 μL涂布到無抗生素PDA平板,每株菌3個重復。分別培養36 h后置于顯微鏡下(200×)計數孢子萌發情況,每個平板隨機檢測5個視野(每鏡頭孢子數≥30),統計各平板孢子的萌發率[18-20]。
產孢量:用接種環刮取盾殼霉點接到PDA平板中央于20℃培養21 d,用直徑0.5 cm打孔器隨機打取5個瓊脂塊加入10 mL無菌水并充分研磨,用血球計數板計數。每株菌設3個重復[21]。
菌核致腐能力:將河沙洗凈滅菌后干燥,稱取20 g到無菌培養皿,加入大小均勻的菌核20粒,將出發菌株和5株轉化子在PDA平板培養15 d,洗脫孢子并稀釋孢子數到106個/mL,每個平板加4 mL稀釋好的孢子懸浮液并攪拌混勻,20℃避光培養28 d,每株菌設3個重復[19]。菌核腐爛程度分級標準按姜道宏等的分級方法[22],參照方中達的病情指數計算公式計算菌核腐爛指數[23]。
1.9 施入土壤中盾殼霉轉化子計數
將得到的轉化子在PDA平板上培養,無菌水洗下平板表面孢子得到分生孢子懸浮液,將孢子懸浮液分別稀釋到104、106、108個/mL,將同一批孢子懸浮液分別加入到滅菌土和未滅菌土中使孢子濃度達到104、106和108個/g。放置約4~6 h使孢子懸浮液充分被土壤吸收。取樣后進行梯度稀釋,用含潮霉素(50 μg/mL)、氯霉素(100 μg/mL)和鏈霉素(100 μg/mL)的PDA平板20℃培養6 d,對呈綠色熒光的菌落進行計數。同時,對孢子懸浮液直接稀釋,在上述平板上進行計數,并比較不同試驗組的結果。
1.10 不同條件土壤中盾殼霉存活情況
土壤中盾殼霉的存活與生長往往會受到溫度、水分等條件的影響,同時菌核的存在對盾殼霉的保留和生長具有促進作用。因此,本研究對含水量11%、17%、23%,溫度10、20、30℃,接種量2×104、2×105、2×106個/g,是否添加菌核等4個方面進行試驗,每組3個重復,并用構建的雙標記平板計數法進行計數。
1.11 數據處理
潮霉素抑制盾殼霉最低濃度,轉化子和JN-CM菌株生長、繁殖、菌核致腐能力比較,盾殼霉選擇性平板計數結果等數據采用SPSS 22軟件進行處理,用Duncan氏新復極差法進行差異顯著性檢驗。
2 結果與分析
2.1 潮霉素抑制盾殼霉生長最低濃度
用0.5 cm直徑的打孔器打取生長旺盛的菌落邊緣瓊脂塊接種到含不同潮霉素濃度的PDA平板中央,通過十字交叉法測定菌絲生長速度。從表2中可以看出,隨著潮霉素濃度增加,盾殼霉菌株JN-CM生長速度明顯受到抑制,當潮霉素濃度達到40 μg/mL時,JN-CM完全不能生長,因此培養基中潮霉素濃度為40 μg/mL是抑制盾殼霉JN-CM生長的最低濃度。
表2潮霉素對盾殼霉JN-CM菌株在PDA平板生長的影響1)
Table2EffectofhygromycinonthegrowthofJN-CMstrainonPDAplate
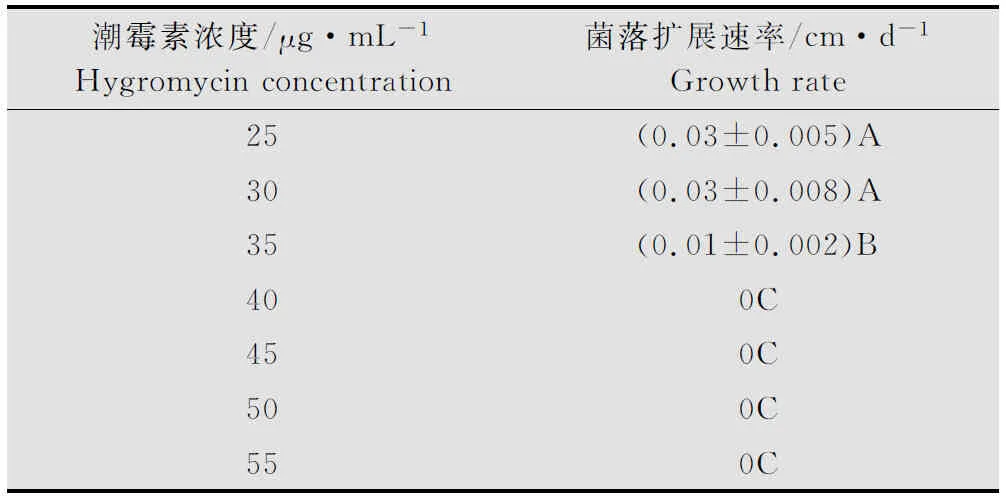
潮霉素濃度/μg·mL-1Hygromycinconcentration菌落擴展速率/cm·d-1Growthrate25(0.03±0.005)A30(0.03±0.008)A35(0.01±0.002)B400C450C500C550C
1) 不同大寫字母表示差異極顯著(P<0.01)。 The different capital letters indicated significant difference at 0.01 level.
2.2 雙標記雙元載體pTFCM-eGFP構建
平板上隨機挑取8個單克隆,經菌液PCR擴增eGFP片段,8個克隆在738 bp附近都有陽性條帶。選擇其中6個提取質粒,用EcoRⅠ進行酶切鑒定,形成的3條大小為1 535、2 083、10 121 bp片段與圖中特異性條帶所在位置相符(圖2)。測序結果與設計序列比對結果一致,表明雙標記雙元載體構建成功。
2.3 農桿菌的轉化
在平板上隨機挑取10個單克隆,經菌液PCR鑒定, 7個克隆在738 bp處有特異性條帶,與擴增的eGFP片段大小相符。說明雙元載體pTFCM-eGFP導入農桿菌成功。
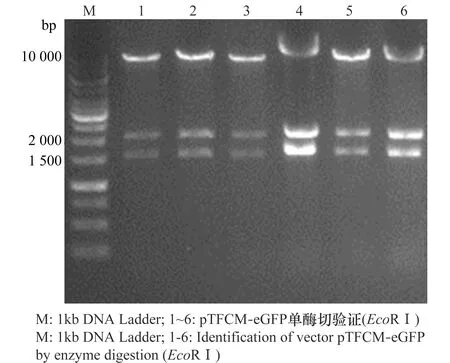
圖2 雙元載體pTFCM-eGFP酶切鑒定Fig.2 Identification of binary vector pTFCM-eGFP by enzyme digestion
2.4 盾殼霉轉化子驗證
隨機選取5株可能的轉化子,并編號為1~5。提取5株轉化子總DNA進行PCR驗證。擴增條帶為2 110 bp的PtrpC-HYG-TtrpC片段和1 794 bp的PtrpC-eGFP-TtrpC片段,5株轉化子電泳圖特異性條帶位置與理論值相符,出發菌株CK沒有條帶,說明兩個片段完整插入盾殼霉中。
2.5 轉化子穩定表達抗性基因和綠色熒光基因
轉化子轉代培養10代后仍能在含50 μg/mL潮霉素平板上生長,而出發菌株JN-CM不能生長(圖3a)。同時將培養8 d的轉化子制片用熒光顯微鏡觀察,5株轉化子都能觀察到明顯綠色熒光(圖3c)。表明潮霉素基因和增強型綠色熒光基因在轉化子內是穩定表達的,并具有良好的遺傳穩定性。
2.6 轉化子生長繁殖能力和對菌核致腐能力
比較轉化子與出發菌株JN-CM生長速度、產孢量和對菌核致腐能力,結果見表3。從結果可以看出,5株轉化子菌絲生長速度與出發菌株JN-CM沒有顯著差異;轉化子孢子36 h萌發率與出發菌株JN-CM也無顯著差別,且都超過了94%。這表明外源基因的插入未影響菌絲生長和孢子萌發。除轉化子3的產孢量和菌核致腐能力顯著低于其他轉化子和出發菌株JN-CM,其他轉化子產孢量和致腐能力沒有明顯變化,這可能是基因的插入破壞了產孢相關基因,而產孢量的下降導致了其對菌核寄生能力的降低。

圖3 盾殼霉轉化子抗性基因和熒光基因表達情況Fig.3 Expression of resistance gene and fluorescent gene in transformants of Coniothyrium minitans
由于除轉化子3外,其他轉化子的孢子萌發率、菌絲生長速度、產孢量、致腐能力等與出發菌株JN-CM均無顯著變化,可以代替盾殼霉JN-CM產品進行土壤定殖、存活和生長、繁殖研究,因此,隨機選取轉化子1進行后續試驗。
表3盾殼霉轉化子及JN-CM生長速度、產孢量和菌核致腐能力比較1)
Table3Growthrate,conidiaproductionandsclerotiaparasiticabilityofConiothyriumminitanstransformantsandstrainJN-CM
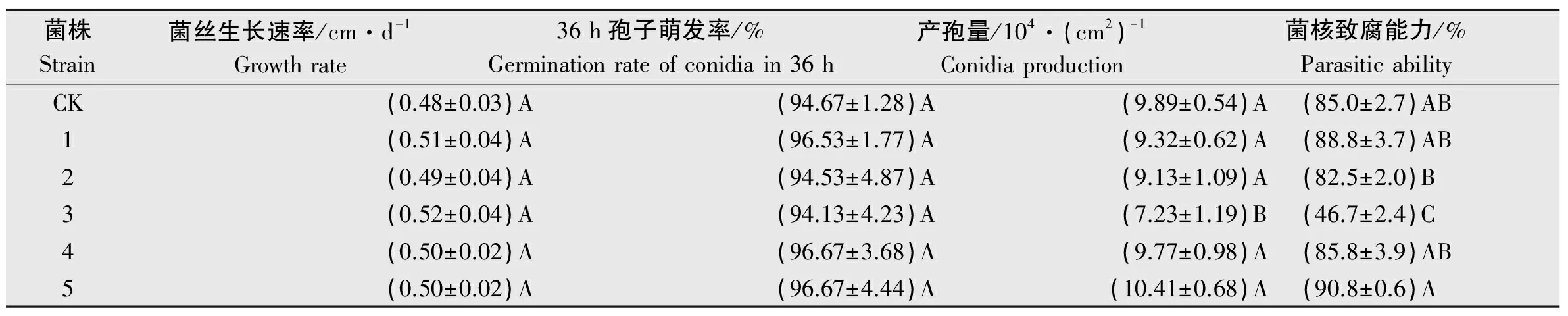
菌株Strain菌絲生長速率/cm·d-1Growthrate36h孢子萌發率/%Germinationrateofconidiain36h產孢量/104·(cm2)-1Conidiaproduction菌核致腐能力/%ParasiticabilityCK(0.48±0.03)A(94.67±1.28)A(9.89±0.54)A(85.0±2.7)AB1(0.51±0.04)A(96.53±1.77)A(9.32±0.62)A(88.8±3.7)AB2(0.49±0.04)A(94.53±4.87)A(9.13±1.09)A(82.5±2.0)B3(0.52±0.04)A(94.13±4.23)A(7.23±1.19)B(46.7±2.4)C4(0.50±0.02)A(96.67±3.68)A(9.77±0.98)A(85.8±3.9)AB5(0.50±0.02)A(96.67±4.44)A(10.41±0.68)A(90.8±0.6)A
1) 不同大寫字母表示差異極顯著(P<0.01)。 The different capital letters indicated significant difference at 0.01 level.
2.7 施入盾殼霉轉化子選擇平板計數結果
選擇兩個不同的地點挖取土樣,去掉表面雜草和碎石后取表層10 cm的土壤,將土壤自然風干研磨過篩。取兩種不同土樣各5 g分別加入50 mL無菌水,稀釋后涂布到抗性平板。鏈霉素100 μg/mL 和氯霉素100 μg/mL可以完全抑制土壤細菌在PDA平板上的生長。50、100、150 μg/mL 3種濃度潮霉素對土壤真菌的抑制沒有明顯區別,都表現為少量個別種類的真菌可以生長。標記后的盾殼霉帶有綠色熒光,可以和雜菌進行區分,因此盾殼霉可以用抗性平板檢出,檢出限達到2×103個/g。
為驗證土壤微生物和土壤對平板計數有無明顯影響,分別測定了盾殼霉孢子濃度為104、106和108個/mL的孢子懸浮液和孢子含量為104、106和108個/g滅菌土、未滅菌土在選擇平板上生長情況,結果顯示,同一濃度下滅菌土壤和未滅菌土壤平板計數結果與對孢子懸浮液直接稀釋進行平板計數處于同一水平,且不同濃度和不同稀釋度下平板計數結果也無明顯差異(圖4)。表明土壤微生物和土壤對平板計數無明顯影響,施入土壤中的盾殼霉可以用所建立的雙標記平板法進行計數。

圖4 不同樣品中盾殼霉轉化子在抗性平板上的萌發情況Fig.4 Germination of Coniothyrium minitans transformants in different samples on the resistant plate
2.8 不同條件土壤中盾殼霉存活情況
2.8.1 溫度對盾殼霉在土壤中存活的影響
溫度是影響盾殼霉菌絲生長和分生孢子萌發的重要因素。將含水量為17%,盾殼霉孢子濃度為2.0×105個/g的土壤分別置于10、20、30℃培養24周,考察溫度對土壤中盾殼霉數量變化的影響,平板菌落計數法測定結果如圖5所示。10℃和20℃條件下盾殼霉存活曲線下降趨勢非常相似,在24周時仍能維持50%左右的存活率;30℃條件下,土壤中盾殼霉的存活率下降較快,施入后第3周存活率便降為20%以下,在24周時存活率僅有5%。說明高溫不利于盾殼霉在土壤中的存活,這可能是持續的高溫對孢子造成了損傷甚至致其死亡。當溫度較低時,這種影響明顯降低,存活時間也變得更長。
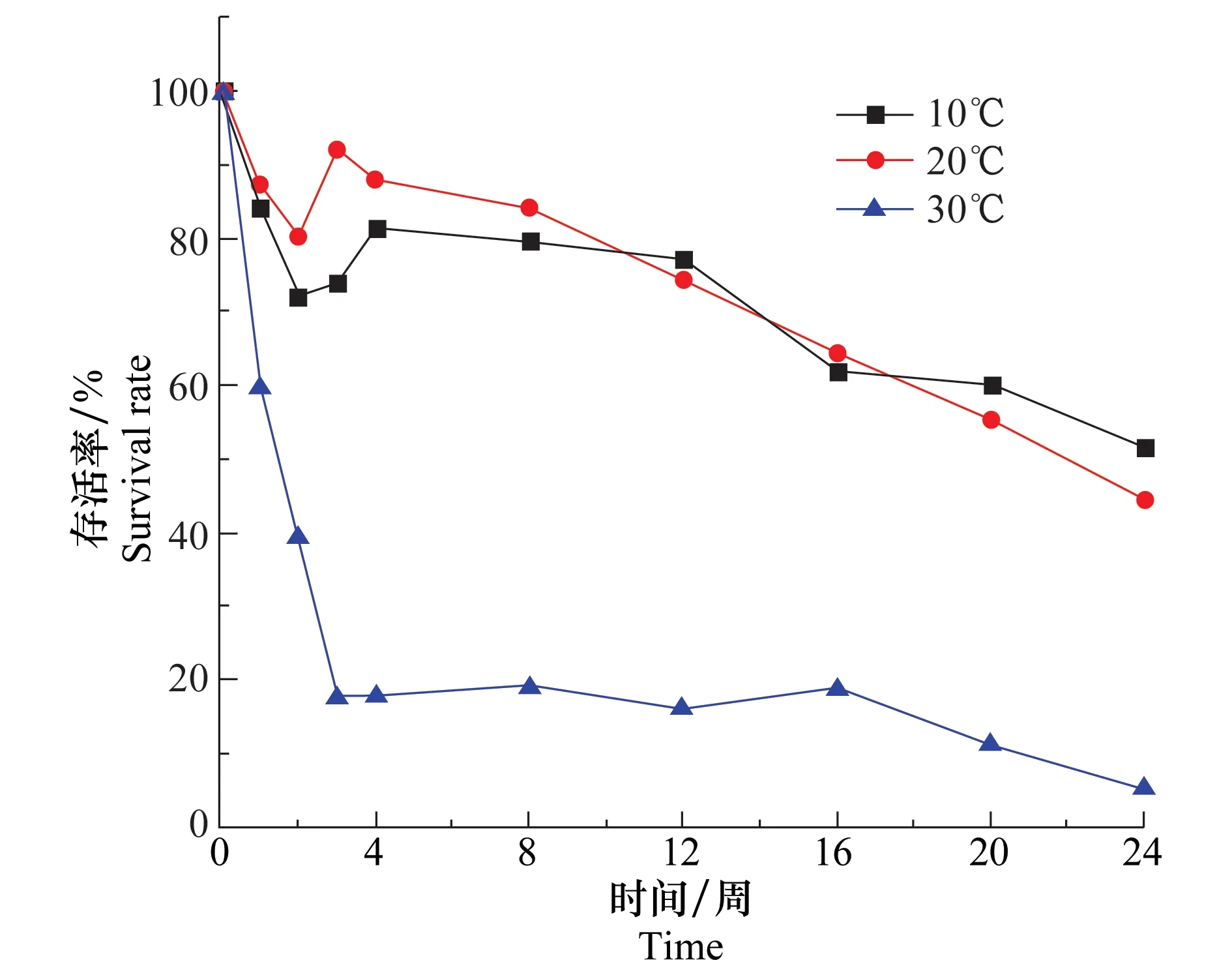
圖5 溫度對土壤中盾殼霉存活的影響Fig.5 Effect of temperature on the survival of Coniothyrium minitans in soil
2.8.2 土壤水分含量對盾殼霉存活的影響
水分會影響盾殼霉分生孢子的萌發和菌絲的生長,并且寄生菌核時,需要較高的水分含量。因此,土壤水分含量是影響盾殼霉存活的重要因素。在20℃,土壤中盾殼霉孢子含量為2.0×105個/g時測定3種含水量(11%、17%、23%)條件下盾殼霉在土壤中存活情況,結果如圖6所示。由圖中曲線可知,3種不同含水量條件下盾殼霉存活率下降趨勢相同,在24周時,3組試驗盾殼霉存活率均能保持在45%以上,表明土壤水分含量不會顯著影響盾殼霉孢子在土壤中的存活。
2.8.3 接種量對盾殼霉數量變化的影響
在大田試驗中,不同的報道所使用盾殼霉的濃度不盡相同。在20℃,土壤含水量為17%條件下,孢子濃度為2.0×104、2.0×105、2.0×106個/g的盾殼霉在土壤中存活情況如圖7所示。雖然3組試驗存活率曲線沒有重合,但3條曲線下降的趨勢差別不大,24周時,3個接種濃度存活率都在40%左右,這說明施入土壤的盾殼霉的量對其在土壤中的存活規律影響不顯著。
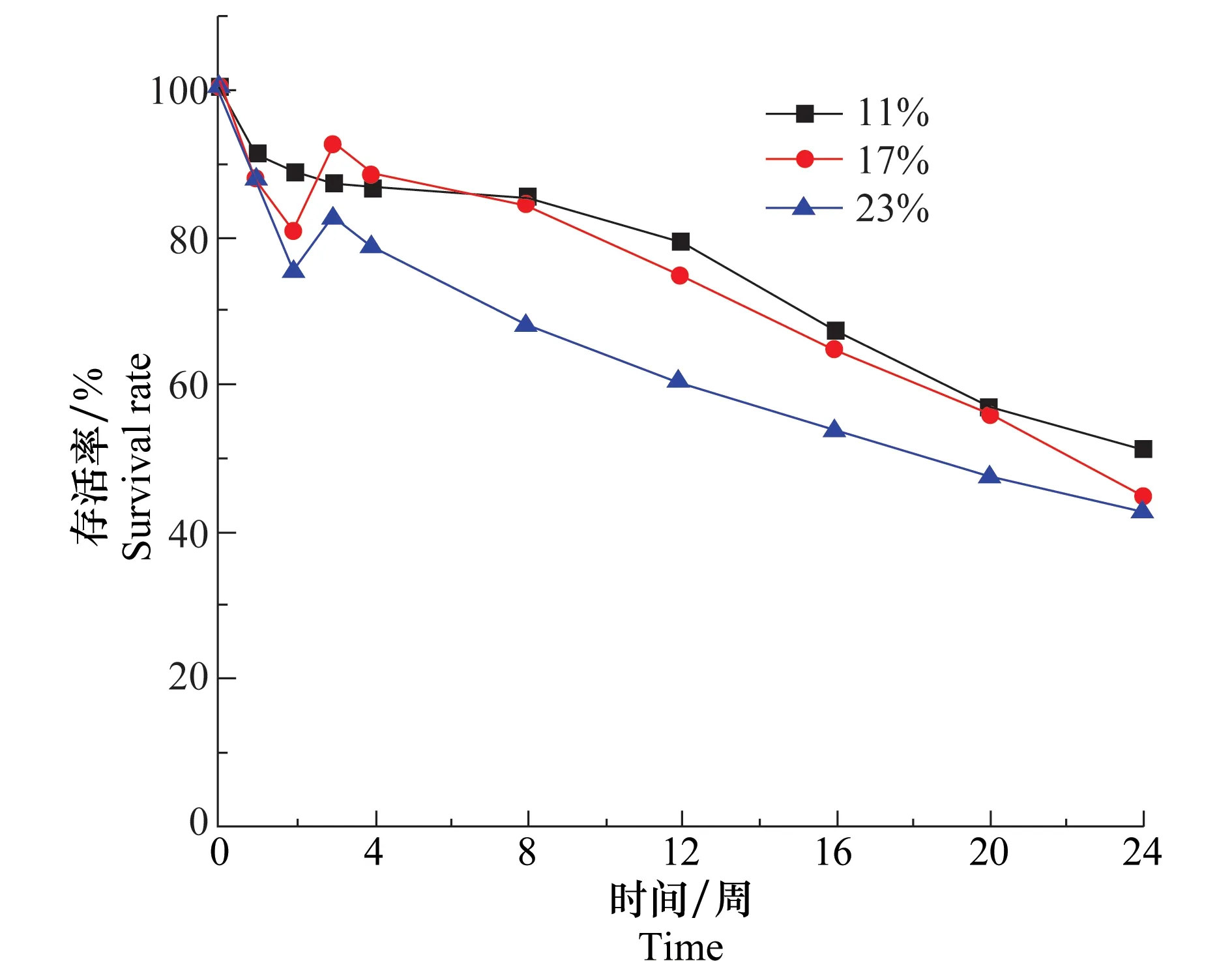
圖6 土壤水分含量對盾殼霉存活的影響Fig.6 Effect of soil humidity on the survival of Coniothyrium minitans in soil
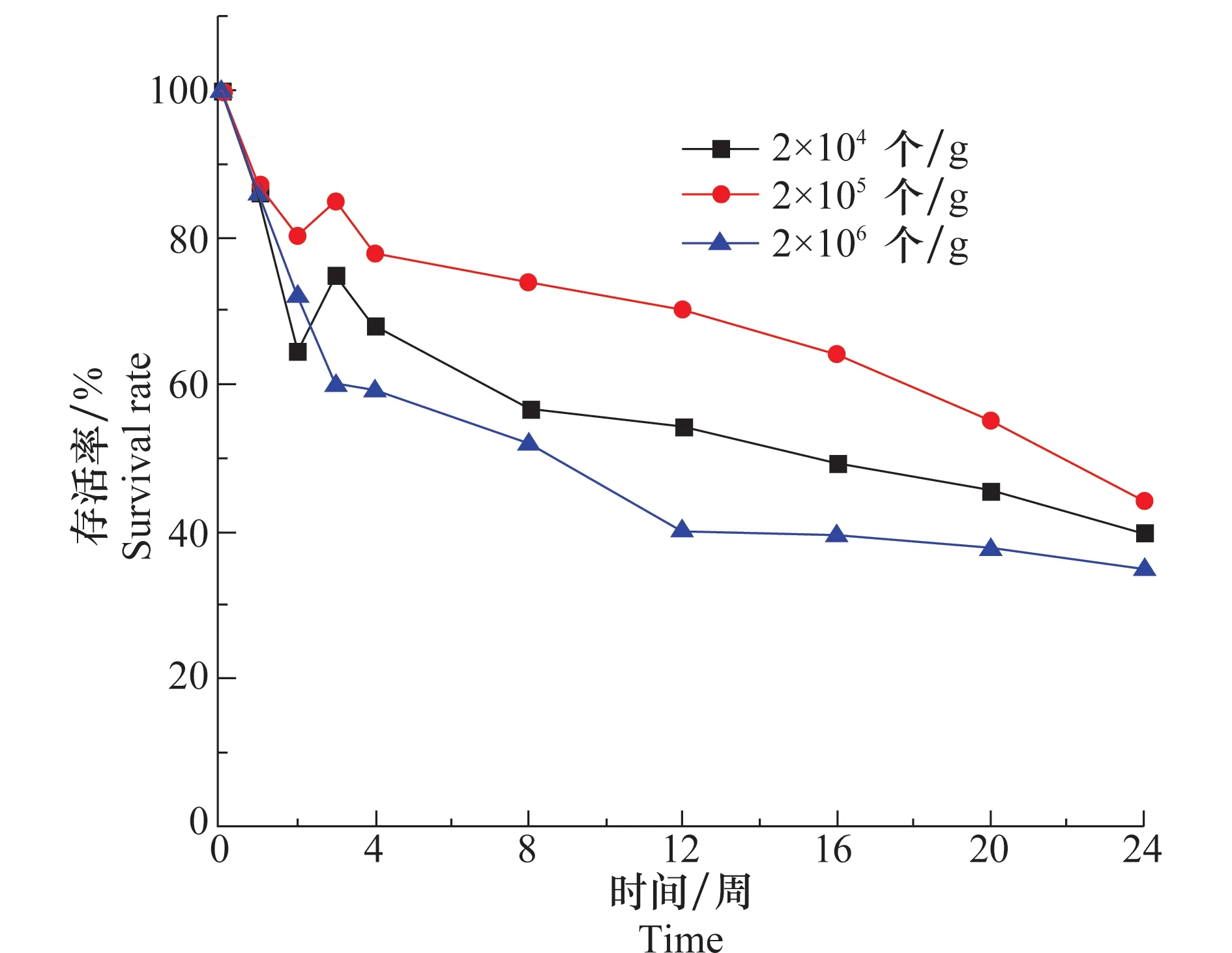
圖7 不同接種量時盾殼霉在土壤中存活情況Fig.7 Survival of Coniothyrium minitans in soil at different inoculation amount
2.8.4 添加菌核對盾殼霉存活的影響
現有研究普遍認為,菌核的存在有利于盾殼霉在土壤中的保留,并且可以刺激盾殼霉數量的增加。將一定量的菌核加入含水量為17%,盾殼霉孢子濃度為2.0×105個/g的土壤中,置于20℃培養24周,測定不同時間盾殼霉數量,并與不加菌核土壤組進行對比,確定在土壤含有菌核時盾殼霉數量變化規律,結果如圖8所示。從圖中可知,未添加菌核組盾殼霉數量持續下降,而添加菌核組在施入盾殼霉第3周開始出現明顯的上升趨勢并一直持續到了12周,并在12周開始呈現下降趨勢,但到第24周其存活率還可以維持在65%左右。這可能是由于在不含有菌核或菌核數量非常少時,土壤中的微生物對盾殼霉形成競爭和拮抗,從而導致盾殼霉數量持續下降,而在土壤含有菌核時,菌核會對盾殼霉產生刺激并引起盾殼霉對菌核進行寄生,以菌核為營養進行繁殖,從而引起盾殼霉數量的快速上升,當寄生結束時,一些菌體可能快速死亡,從而表現出盾殼霉數量的快速下降。
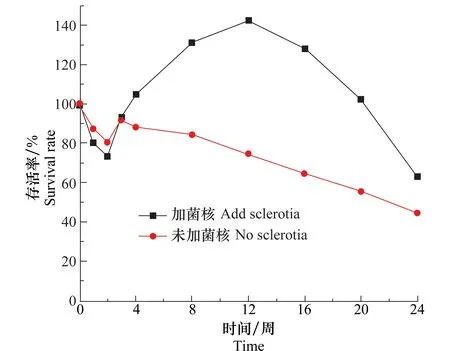
圖8 土壤添加菌核對盾殼霉存活的影響Fig.8 Effects of adding sclerotia in soil on the survival of Coniothyrium minitans
3 結論與討論
本研究成功構建了潮霉素篩選標記和綠色熒光鑒別標記的雙標記雙元載體,并用農桿菌轉化法成功導入盾殼霉菌株,轉化子中潮霉素抗性基因和綠色熒光基因能夠穩定地遺傳和表達。轉化子36 h萌發率與對照組JN-CM處于同一水平,萌發率均在94%以上。除了轉化子3以外,其他轉化子產孢量和對菌核致腐能力沒有明顯改變,說明可以用它們代替JN-CM用于土壤定殖、存活和生長、繁殖研究。
將含有轉化子孢子的滅菌土和未滅菌土壤稀釋液以及孢子懸浮液涂布到含潮霉素的PDA平板上,在各供試濃度下同濃度不同樣品的計數結果無明顯差異,表明土壤微生物和土壤對盾殼霉計數沒有明顯影響。Bennett等[24]用滅菌土壤、巴氏消毒的土壤、未滅菌土壤研究盾殼霉在土壤中存活情況,使用含金霉素(25 mg/mL)和 Triton X-100 (2 mL/L)的PDA平板進行檢測,在施入盾殼霉濃度為106個/g時,3種土壤中盾殼霉的數量變化情況區別不大,但在施入103個/g時,未滅菌土壤一組由于存在過多的其他真菌生長,只有少數盾殼霉能被檢測到,而本研究構建的方法在盾殼霉孢子濃度較低時(2×103個/g),只有個別種類的少數雜菌長出,對計數沒有明顯影響,因此可以將本研究構建的方法應用到盾殼霉在自然土壤中存活情況的研究中,這將為盾殼霉在田間的存活動態提供重要參考。楊龍[25]通過適應性誘變獲得抗農利靈盾殼霉突變菌株,建立了盾殼霉的抗性平板檢測方法,并對盾殼霉在土壤中存活進行了研究,然而這種方法是在抗藥突變機理尚不明確的情況下建立的,抗性是在壓力環境下的一種適應還是產生了抗藥基因也未知,而本研究構建的方法將潮霉素抗性基因插入盾殼霉基因組,抗藥原理明確,遺傳表達穩定。同時本研究構建的檢測方法能夠排除自然土壤中存在的野生盾殼霉菌株的干擾,可以用于施入土壤盾殼霉存活動態的研究。
通過對不同條件土壤中盾殼霉存活情況研究發現,在含有核盤菌菌核的土壤中,盾殼霉JN-CM可以通過重寄生維持一段時間(12周)的數量增長,在長達半年左右(24周)的時間里其存活率仍然可以維持在65%左右。即使在不含菌核的土壤中,在一般土壤溫度(10~20℃)范圍內,無論土壤水分含量高低,其半年存活率也可以維持在50%左右。雖然較高溫度(30℃)條件下,其存活率快速下降,但除夏天的表層土外,大田土壤溫度很少會持續維持30℃以上。因此,可以預測,連續施用盾殼霉JN-CM生防菌,可以使其數量在土壤中長期維持在一定的水平范圍,達到長效防治效果。
[1] Boland G J, Hall R. Index of plant hosts ofSclerotiniasclerotiorum[J]. Canadian Journal of Plant Pathology, 1994, 16: 93-108.
[2] 楊新美. 油菜菌核病(Sclerotiniasclerotiorum)在我國的寄主范圍及生態特性的調查研究[J]. 植物病理學報, 1959, 5(2): 111-122.
[3] Huang H C, Erickson R S.Factors affecting biological control ofSclerotiniasclerotiorumby fungal antagonists [J]. Journal of Phytopathology, 2008, 156(10): 628-634.
[4] Zeng Wenting, Kirk W W, Hao Jianjun. Field management ofSclerotiniastem rot of soybean using biological control agents [J]. Biological Control, 2012, 60(2): 141-147.
[5] De V T, Antoine N, Buitelaar R M, et al. The fungal biocontrol agentConiothyriumminitans: production by solid-state fermentation, application and marketing [J]. Applied Microbiology and Biotechnology, 2001, 56(1):58-68.
[6] Campbell W A.A new species ofConiothyriumparasitic on sclerotia [J]. Mycologia, 1947, 39(2): 190-195.
[7] Rabeendran N, Jones E E, Moot D J, et al. Biocontrol ofSclerotinialettuce drop byConiothyriumminitansandTrichodermahamatum[J]. Biological Control, 2006, 39(3): 352-362.
[8] Turner G J, Tribe H T. Preliminary field plot trials on biological control ofSclerotiniatrifoliorumbyConiothyriumminitans[J]. Plant Pathology, 1975, 24(2): 109-113.
[9] Jones E E, Mead A, Whipps J M. Evaluation of differentConiothyriumminitansinoculum sources and application rates on apothecial production and infection ofSclerotiniasclerotiorumsclerotia [J]. Soil Biology & Biochemistry, 2003, 35(3): 409-419.
[10] Yang Long, Li Guoqing, Zhang Jing, et al. Compatibility ofConiothyriumminitans, with compound fertilizer in suppression ofSclerotiniasclerotiorum[J]. Biological Control, 2011, 59(2):221-227.
[11] Gerlagh M, Goossen-van de Geijn H M, Hoogland A E, et al. Effect of volume and concentration of conidial suspensions ofConiothyriumminitanson infection ofSclerotiniasclerotiorumsclerotia [J]. Biocontrol Science and Technology, 2004, 14(7): 675-690.
[12] Jones E E, Clarkson J P, Mead A, et al. Effect of inoculum type and timing of application ofConiothyriumminitansonSclerotiniasclerotiorum: influence on apothecial production [J]. Plant Pathology, 2004, 53(5): 621-628.
[13] Jones E E, Stewart A, Whipps J M. Use ofConiothyriumminitanstransformed with the hygromycin B resistance gene to study survival and infection ofSclerotiniasclerotiorumsclerotia in soil [J]. Mycological Research, 2003, 107(3): 267-276.
[14] Jones E E, Stewart A.Coniothyriumminitanssurvival in soil and ability to infect sclerotia ofSclerotiniasclerotiorum[J]. New Zealand Plant Protection, 2011, 64: 168-174.
[15] Bundock P, Den D A, Beijersbergen A, et al. Trans-kingdom T-DNA transfer fromAgrobacteriumtumefacienstoSaccharomycescerevisiae[J].The EMBO Journal, 1995,14(13):3206-3214.
[16] Li Moxiao, Gong Xiaoyan, Zheng Jin, et al. Transformation ofConiothyriumminitans, a parasite ofSclerotiniasclerotiorum, withAgrobacteriumtumefaciens[J]. FEMS Microbiology Letters, 2005, 243(2): 323-329.
[17] 李模孝. 盾殼霉T-DNA標記插入突變體庫的構建及其質量評估[D]. 武漢: 華中農業大學, 2013.
[18] 夏森玉, 雷楗勇, 金堅, 等. 生防菌盾殼霉抗藥性突變菌株的選育[J]. 工業微生物, 2013, 43(5): 57-62.
[19] 夏森玉. 生防菌盾殼霉抗藥性突變菌株的選育[D]. 無錫: 江南大學, 2013.
[20] 金強, 段作營, 夏森玉,等. 盾殼霉抗逆性菌株的篩選[J]. 工業微生物, 2016, 46(4):8-13.
[21] 魏瑋. 盾殼霉產孢和生長相關基因的克隆及功能驗證[D]. 武漢: 華中農業大學, 2013.
[22] 姜道宏, 李國慶, 易先宏, 等. 菌核寄生菌盾殼霉的研究Ⅱ.不同菌株培養特性及寄生致腐菌核能力的比較[J]. 華中農業大學學報, 1996(3): 229-232.
[23] 方中達. 植病研究方法[M]. 北京: 中國農業出版社, 1998.
[24] Bennett A J, Leifert C, Whipps J M. Survival of the biocontrol agentsConiothyriumminitans, andBacillussubtilis, MBI 600 introduced into pasteurised, sterilised and non-sterile soils [J]. Soil Biology & Biochemistry, 2003, 35(12):1565-1573.
[25] 楊龍. 生防菌盾殼霉防治油菜菌核病的生態學基礎及其應用研究[D]. 武漢: 華中農業大學, 2009.
(責任編輯: 楊明麗)
Establishmentandapplicationofdouble-labelingplatecountingmethodfordetectionofConiothyriumminitansinsoil
Yang Xiuchao1, Yu Wenjing1, Duan Zuoying1, Xia Senyu2,Shen Zhisong2, Jin Jian3, Li Huazhong1
(1.KeyLaboratoryofIndustrialBiotechnology,MinistryofEducation,SchoolofBiotechnology,JiangnanUniversity,Wuxi214122,China; 2.WuxiJiannongBiologicalTechnologyCo.,Ltd,Wuxi214122,China;3.SchoolofPharmaceuticalSciences,JiangnanUniversity,Wuxi214122,China)
Coniothyriumminitansis an important biocontrol fungus. The quantity of the fungus surviving in the soil affects control efficacy directly. At present, there is still no direct way to count the quantity ofC.minitansin the soil, therefore, a simple and easy method for countingC.minitansin the soil will be very important. In this study, a double-labelingC.minitansstrain with hygromycin resistance gene and enhanced green fluorescent protein gene was constructed byAgrobacterium-mediated transformation. Subsequently, the stability, growth rate, reproduction capacity and sclerotium-parasitizing ability of the transformants were measured. The effectiveness and feasibility of the method were also analyzed. The results showed that the hygromycin resistance gene and enhanced green fluorescent gene could inherited and expressed stably, and there was no significant difference betweenC.minitansstrain JN-CM and the transformants in the ability of growth rate, reproduction and parasitizing on sclerotia ofSclerotiniasclerotiorum. PDA plates containing hygromycin (50 μg/mL), chloramphenicol (100 μg/mL) and streptomycin (100 μg/mL) could inhibit most of the microbes in the soil, while the transformants with green fluorescence could be detected and counted. The detection limit was 2 × 103spores per gram soil. Thus, the counting method can be used to study the colonization, growth, reproduction and survival ofC.minitansJN-CM in soil. The effects of temperature, soil humidity, inoculation amount, sterilization and adding of sclerotia on the survival ofC.minitansin soil were further investigated by the double-labeling plate counting method. The results showed that in the soil with sclerotia, the number ofC.minitansJN-CM increased in a period of time (12 weeks) and its survival rate can be maintained at about 65% in about half a year (24 weeks). While, in the soil without sclerotia, regardless of the soil moisture, the half-year survival rate can still be maintained at about 50% under the soil temperature of 10-20℃. Therefore, it can be predicted that continuous application ofC.minitansJN-CM biocontrol agent can keep the number ofC.minitansin the soil within a certain range for a long time, indicating that the long-term control effect can be achieved.
biological control;Coniothyriumminitans;Agrobacterium-mediated transformation; plate count
S 476
: ADOI: 10.3969/j.issn.0529-1542.2017.05.022
2017-01-19
: 2017-03-30
2015江蘇省重點研發計劃(現代農業)重點項目(BE2015309)
* 通信作者 E-mail: hzhli@jiangnan.edu.cn

