PAMAM樹狀大分子負載和釋放阿霉素的耗散粒子動力學模擬
蘇運祥,全學波,閔文鳳,喬來聰,李理波,周健
?
PAMAM樹狀大分子負載和釋放阿霉素的耗散粒子動力學模擬
蘇運祥,全學波,閔文鳳,喬來聰,李理波,周健
(華南理工大學化學與化工學院,廣東省綠色化學產品技術重點實驗室,廣東廣州510640)
采用耗散粒子動力學模擬方法研究了藥物輸送載體聚酰胺-胺(PAMAM)樹狀大分子對抗癌藥物阿霉素(DOX)的負載和釋放行為。構建了PAMAM樹狀大分子的粗粒化模型,該模型能準確地重現樹狀大分子的構象性質。考察了PAMAM樹狀大分子代數(G)對DOX負載以及pH環境對DOX釋放的影響。模擬結果表明,PAMAM樹狀大分子主要通過疏水作用將DOX包封于內部空腔,G6和G7 PAMAM樹狀大分子的負載能力較強,因為其孔隙率較高,內部有更多的疏水空腔。在低pH環境下,PAMAM樹狀大分子結構發生變化,DOX分子能快速地從其中釋放,主要原因是PAMAM的伯胺、叔胺和DOX伯胺發生質子化,質子化基團間的靜電排斥作用使得PAMAM樹狀大分子發生溶脹,導致其內部空腔暴露,促進了DOX的釋放。本工作可以為基于樹狀大分子的藥物輸送體系的設計和優化提供參考。
藥物輸送;樹狀大分子;包封;模型;介尺度;分子模擬
引 言
目前癌癥已經成為威脅人類健康的主要殺手之一,癌癥治療的方法主要有手術切除、放療和化療。化療是屬于全身治療的方法,其治療劑量和頻率由于惡心、脫發、骨髓抑制、免疫力下降、心臟毒性等副作用而受到限制[1]。此外,大多數化療藥物水溶性差,難以被吸收利用。因此,開發新型的藥物輸運載體來提高抗癌藥物的溶解度和降低其毒副作用顯得十分重要,要解決這些問題首先需要理解載體和藥物分子間的相互作用機制。
樹狀大分子是一類新型的人工合成的具有超支化結構的高分子聚合物[2-5],它具有高度對稱的球形結構,其結構可分為3部分:內核、內部重復亞單元、末端基構成的殼。其中,連接中心核的重復亞單元向外發散開,組成一系列同心圈層,也就是樹狀大分子的代數(G),樹狀大分子的內核被稱為第0代(G0),重復亞單元組成的同心圈層依次為第1,2,…,代(Gn)。由于它是逐步合成的,所以其分子大小、形狀和官能團可被精確控制。此外,樹狀大分子良好的水溶性和生物相容性使其成為理想的藥物輸送載體[6-8],近年來它已經被用于化療藥物的負載研究。Yellepeddi等[9]研究了PAMAM/順氯氨鉑復合物的毒性和毒性機理,順氯氨鉑在PAMAM樹狀大分子中的負載量接近11%(mass),結果表明PAMAM樹狀大分子可作為順氯氨鉑的潛在輸送載體治療卵巢癌。Ooya等[10]采用聚丙三醇(PGDs)樹狀大分子作為紫杉醇(PTX)的增溶劑,與單純的藥物相比,通過PGDs樹狀大分子包封,PTX的水溶性增強了400倍。Markatou等[11]將二甲氧基姜黃素分別與G3.5和G4代PAMAM樹狀大分子混合以提高二甲氧基姜黃素的水溶性,它們對二甲氧基姜黃素的最大包封率可達到90%和95%。Kojima等[12]將分子量為550和2000的聚乙二醇(PEG)單甲醚分別接枝到G3和G4代PAMAM樹狀大分子表面,其對阿霉素(DOX)和甲氨蝶呤(MTX)的包封能力隨著PAMAM代數和PEG接枝鏈長增長而增強。Bhadra等[13]采用表面PEG化的G4代PAMAM樹狀大分子負載5-氟尿嘧啶,發現表面PEG化不但可以增強PAMAM樹狀大分子的藥物負載能力,還可以降低藥物釋放的速率和溶血毒性。
雖然實驗上對樹狀大分子負載藥物分子進行了大量研究,但是對其包封和釋放的機理認識還不足。這方面可以通過計算機分子模擬增強理解,當前的模擬研究主要是采用分子動力學(MD)研究藥物分子與PAMAM樹狀大分子的相互作用[14-17]。如Shi等[15]采用MD模擬了以羧基為端基的PAMAM樹狀大分子與2-甲氧基雌二醇的復合物結構;pH為5時,PAMAM的羧基與其內部的叔氨基間的強靜電作用使復合物的結構很緊密,導致2-甲氧基雌二醇無法釋放,失去生物活性。雖然MD能夠研究復合物的結構及它們的形成驅動力,但是難以得到藥物復合和釋放的整個動態過程,因為研究這一過程需要更大更長時空尺度的模擬方法。耗散粒子動力學(dissipation particle dynamics, DPD)就是其中一種,自1992年由Hoogerbrugge等[18]提出以來,已被廣泛地用于聚合物體系自組裝和藥物負載行為研究[19-21]。本文將采用DPD模擬方法研究PAMAM樹狀大分子和DOX在水溶液中的自組裝,考察PAMAM代數對DOX負載及pH環境對DOX釋放的影響,從介尺度揭示PAMAM樹狀大分子載體對藥物分子的負載和釋放機理。
1 模擬方法
1.1 DPD基本原理
DPD模擬采用粗粒化模型,體系由一系列質量和體積相同的軟相互作用粒子組成。1個DPD珠子對應若干個小分子或高分子的幾個鏈段。所有珠子的運動遵守牛頓運動方程[22]
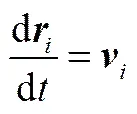
(2)
其中,、、m、分別表示珠子的位置矢量、速度、質量和總的作用力。為了簡化計算,在DPD中物理量均采用約化單位(reduced unit)。所有珠子的質量設定為1 DPD單位。珠子受到的總作用力包括保守力(C)、耗散力(D)、隨機力(R)、鍵作用力(S)、靜電力(E)5種[23]

珠子之間的相互作用力在超過截斷半徑(c)時消失,DPD中c作為長度的約化單位,取c=1。前3種力的大小和方向由珠子位置和速度決定,其計算公式如下
(4)
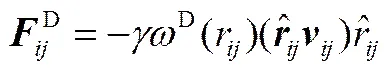
(6)
式中,a代表珠子和之間的排斥參數;=-,r=||,,=-;為噪聲振幅;為耗散力系數;是平均值為0的隨機漲落變量;D(r)和R(r)為權重函數。兩個權重函數的關系及選取滿足式(7),而噪聲振幅和耗散力系數存在式(8)的關系
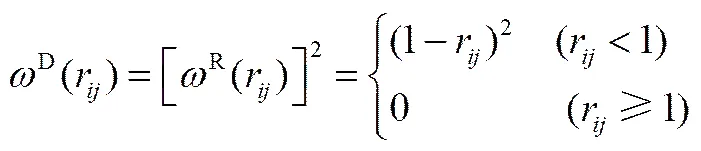
2=2kB(8)
式中,B為Boltzmann常數;為熱力學溫度。在DPD模擬中,B為能量約化單位,取B=1。耗散力系數取值4.5,從而=3。同一分子中相連接的兩個成鍵珠子之間存在彈簧力,表示為
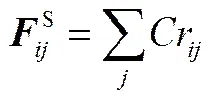
式中,為彈簧力常數,取值=4。
靜電力E的求解采用Ewald sum方法[24],表示為
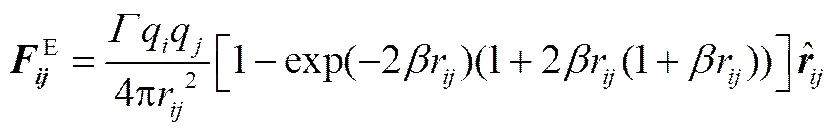
式中,=2/(B0rc),為電子電量,0為真空介電常數,r為室溫時水的介電常數;為珠子電荷數;=c/,為電荷衰減長度。
1.2 模型和相互作用參數
本文模擬的體系由PAMAM樹狀大分子、藥物DOX和水組成,該體系的粗粒化模型如圖1所示。PAMAM樹狀大分子由3種珠子構成,分別標記為P1、P2和P3;其中,P1珠子代表N—(CH2)3片段,P2珠子代表CH2—C(O)—NH—CH2片段,P3珠子代表CH2—NH2片段,圖1(a)所示的是G1 代的PAMAM,更高代的PAMAM分子以相同的方式構建。模型藥物DOX也由3種珠子構成,分別標記為D1、D2、D3,1個水分子作為1個W珠子。PAMAM樹狀大分子的伯胺基(P3珠子)和叔氨基(P1珠子),以及DOX分子的伯胺基(D3珠子)在不同的pH環境下有不同的解離狀態。在生理pH(約7.4)下,所有的P3珠子質子化,帶1個單位正電荷;在低pH(約5)時,所有的P1、P3和D3珠子質子化,都帶1個單位正電荷[25-26]。
在DPD模擬中,不同珠子間的保守力排斥參數a取決于相對應原子的相互作用,與Flory-Huggins ()參數滿足如下線性關系[27]
a=a+ 3.27(11)
式中,a為相同珠子間的排斥參數,可由Groot等[28]給出的公式計算
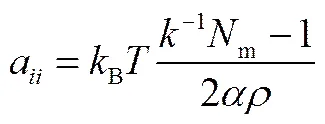
式中,-1為常溫常壓下水的量綱1壓縮因子,其值約為15.98;m表示1個DPD水珠子所代表的水分子數;常數=0.101±0.001;為體系的珠子數密度。當=1,m=1,=3時,計算得到a=25。不同珠子間的參數可通過計算混合能求出
(13)
式中,是配位數;E是組分和組分的混合能;為理想氣體常數;為熱力學溫度。本文采用Materials Studio 4.4軟件中的blends模塊在298 K的溫度下,選擇COMPASS力場計算得到參數。每一對組分的混合能都是通過Monte Carlo方法產生的2000000個不同構型進行平均得到的。最后通過式(11)計算得到不同珠子間的排斥參數a,其值如表1所示。由于P1、P3和D3珠子在不同pH時發生質子化而帶上正電,故加入一定量的反號離子C以保持體系的電中性。
表1 不同珠子之間的排斥參數aij
Table 1 Repulsive parameters aij between different beads

表1 不同珠子之間的排斥參數aij
aijD1D2D3P1P2P3WC D125.00 D268.8825.00 D383.5332.9525.00 P172.4131.5424.6725.00 P276.3711.9234.9441.5425.00 P3114.4031.4727.3824.5840.8925.00 W150.8044.4439.7930.1335.2025.0425.00 C25.0025.0025.0025.0025.0025.0025.0025.00
本文進行DPD模擬所采用的是DL_MESO 2.5模擬軟件包[29]。長程靜電力采用Ewald sum方法處理,為避免帶電珠子重疊在一起,采用slater-type電荷密度分布,smearing系數=0.929,靜電截斷半徑Cele=3,實空間收斂常數取值0.97,倒易空間向量max=(5,5,5),介電耦合常數=13.87。模擬盒子大小為30×30×303C,由于珠子數密度選為3,體系的DPD珠子總數為81000個,盒子的、、3個坐標方向上均采用周期性邊界條件。模擬積分時間步長為0.05,藥物負載和釋放的模擬步數分別為100000和30000步。珠子質子化后與其他珠子間的排斥參數不變,只是其帶電量改變。
2 結果與討論
2.1 PAMAM樹狀大分子的構象性質
樹狀大分子的構象性質可由回轉半徑(g)定性描述,對于一個含有個粗粒化珠子的PAMAM樹狀大分子,其g可由式(14)求出
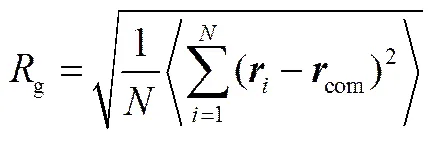
式中,為珠子的位置矢量;com為PAMAM分子質心位置矢量。本文模擬體系中每個珠子的平均體積約為0.03 nm3,由于珠子的數密度為3,因此3C= 0.09,從而可計算出C=0.45 nm。為了驗證PAMAM樹狀大分子的粗粒化模型是否合理,本文模擬計算了代數為G3到G7的PAMAM樹狀大分子在溶液中的g,結果列于表2。為了比較,表2也列出了Rathgeber等[30]采用小角度X射線散射(SAXS)獲得的實驗值和Maiti等[31]采用全原子MD得到的模擬值。從表2可觀察到本DPD模擬計算得到的g值與SAXS實驗值和MD模擬值基本一致,這表明PAMAM的CG模型是準確可靠的。因此,在接下來的模擬中,將采用該CG模型研究G3~G7代的PAMAM樹狀大分子對DOX的負載和釋放過程。
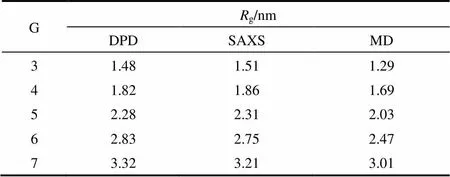
表2 不同代數的PAMAM樹狀大分子的回轉半徑以及SAXS實驗值和MD模擬值
2.2 PAMAM樹狀大分子對DOX負載過程和藥物分布
PAMAM樹狀大分子可作為單分子膠束,將小分子藥物溶解包封于其內部空腔。本模擬采用DPD研究了G5代PAMAM樹狀大分子負載藥物時對DOX的包封動態過程,如圖2所示。模擬體系中放入1個G5代的PAMAM樹狀大分子,DOX和水的體積分數分別為0.4%和99%。為了清楚地顯示分子聚集形貌,水珠子W未顯示。
由圖2 可以看出,模擬開始時DOX分子隨機地分布在水中[圖2(a)]。隨著模擬時間的增加,一部分DOX分子逐漸地擴散進入PAMAM分子的內部空腔;同時,另一部分DOX由于自身的疏水性互相聚集在一起[圖2(b)~(f)]。此后,繼續增加模擬時間,PAMAM載藥膠束和DOX分子的聚集形態均未發生較大變化[圖2(g)~(h)]。因此,100000步的時間足以使模擬達到平衡狀態。進一步研究了體系達到平衡后,PAMAM載藥膠束中DOX藥物的分布和DOX與PAMAM樹狀大分子各個珠子間的徑向分布函數。膠束中PAMAM的P1、P2和P3珠子和DOX的密度分布曲線如圖3所示。
從圖3中可見,距離PAMAM載藥膠束中心較近時,DOX的珠子密度出現峰值,而此時PAMAM的P3珠子未出現,當P3珠子的密度逐漸升高時,DOX的密度迅速下降,說明DOX主要分布在由PAMAM樹狀大分子的P1和P2珠子構成的內部空腔中。
徑向分布函數(RDF)提供了膠束中不同珠子間的相對位置信息,珠子間的RDF出現峰值時的距離近則表明它們親和性好,所以可以用RDF來分析不同組分的相容性。PAMAM樹狀大分子的徑向分布函數如圖4所示。從圖4(a)可以看出,D1珠子與P1和P2珠子的徑向分布函數的峰值較高,而與P3珠子的則較低,且出現峰值時D1珠子與P3珠子的距離較D1與P1和P2珠子的距離遠,說明D1珠子與P1和P2珠子的相容性較好。D2和D3珠子與PAMAM各個珠子間的徑向分布函數曲線與D1珠子的相似[圖4(b)、(c)],說明P1和P2珠子與DOX分子的各珠子相容性較好,而P3珠子與DOX珠子的相容性則較差,這和表1中PAMAM樹狀大分子與DOX分子各珠子間的排斥參數a相一致。
此外由表1 還以看出,P1和P2珠子與水珠子W間的排斥參數較大(30.13和35.20),而P3珠子的則較小(25.04),說明P1和P2珠子較疏水,P3珠子較親水,同時DOX分子的3種珠子也較疏水(與W的排斥參數分別為150.80、44.44和39.79),這充分證明DOX分子主要是靠疏水作用聚集在PAMAM樹狀大分子的內部疏水空腔中。
2.3 PAMAM樹狀大分子代數對DOX負載的影響
不同代數的PAMAM樹狀大分子具有不同的分子構象,其內部空腔的大小和數量也不同,所以PAMMA樹狀大分子的代數會影響其對DOX分子的包封能力。G3~G7代的PAMAM樹狀大分子對DOX的包封平衡構象如圖5所示。各模擬體系中均放入1個PAMAM樹狀大分子,藥物分子的體積分數固定為0.4%,其余均為水分子。從圖5中可以看出,隨著PAMAM樹狀大分子代數的增加,更多的DOX被包封進PAMAM樹狀大分子中。
包封率可以用來衡量PAMAM樹狀大分子的包封能力,其定義為被負載的DOX分子占體系總的DOX分子的百分比。經計算,G3~G7 PAMAM樹狀大分子對DOX的包封率分別為21.1%、56.6%、65.7%、92.5%和100%。
由于DOX主要包封于PAMAM樹狀大分子的內部空腔中,內部空腔的體積直接影響PAMAM的載藥量,為了定量地表征PAMAM樹狀大分子的空腔體積的含量,本文計算了G3~G7代的PAMAM樹狀大分子的孔隙率[32],如圖6 所示。PAMAM樹狀大分子的孔隙率定義為其內部空腔體積占分子體積的百分比。為計算PAMAM樹狀大分子的內部空腔體積,假設PAMAM是一個球體模型,其任一珠子的半徑為c,用一個球形溶劑探針在PAMAM表面滾動,球形探針中心所形成的軌跡就是PAMMA的溶劑可及表面積(SASA),SASA表面包圍的體積則為溶劑可及體積(SAV),其計算公式如下
SAV=(4p/3)(+p)3(15)
式中,為PAMAM球體模型的半徑;p為探針的半徑。在voss volume voxelator軟件包[33]中采用不同半徑的探針(p的值為1c到8c),可以計算得到一系列的SAV值。由于較大的探針分子無法探測到PAMAM的空腔,而較小的探針則可以探測到空腔,所以將用較大半徑的探針得到的PAMAM分子的SAV值做一線性擬合,得到的擬合值與計算值之差即為PAMAM的空腔體積。
從圖6可以看出,G3代PAMAM樹狀大分子的孔隙率較低,所以其對DOX的包封能力較差,包封率僅有21.1%,而G5 PAMAM樹狀大分子的孔隙率比G4的稍低,所以其對DOX的包封率略高于G4代PAMAM 樹狀大分子(包封率分別為65.7%和56.6%),G6和G7 代PAMAM的樹狀大分子的孔隙率較高,包封能力較強(包封率分別為92.5%和100%),所以負載藥物時,采用G6或G7代PAMAM 樹狀大分子負載DOX較好。因此,下面將主要研究G6代PAMAM 樹狀大分子對藥物的釋放過程。
2.4 pH對藥物釋放的影響
PAMAM 樹狀大分子的伯胺基和叔胺基,以及DOX分子的伯胺基在不同的pH環境下發生質子化,從而改變分子的結構。本DPD模擬研究了生理pH和低pH時,G6代PAMAM樹狀大分子釋放DOX藥物的動態過程。模擬體系中放入一個G6 代的PAMAM樹狀大分子,藥物的體積分數為0.4%,其余為水分子和反號離子。模擬結果分別如圖7和圖8所示。從圖7可以看出,在生理pH時,沒有DOX分子從G6代PAMAM樹狀大分子中釋出,這是因為PAMAM樹狀大分子發生溶脹,分子由致密的核結構變為致密的殼結構,而致密的殼結構抑制了DOX從PAMAM樹狀大分子的空腔中釋放。這有利于載藥膠束在體內循環時保持其穩定性。
低pH時,DOX從G6代PAMAM樹狀大分子中釋放的動態過程如圖8所示。模擬以G6 代PAMAM樹狀大分子在負載藥物平衡后的構型作為釋放過程的初始構型[圖8(a)]。模擬時間為2000 步時,G6代PAMAM樹狀大分子的結構不再發生大的變化,此時有少量的DOX分子釋出[圖8(b)]。進一步增加模擬時間,不斷有DOX從PAMAM樹狀大分子中釋放[圖8(c)~(e)],模擬時間為30000步時,DOX藥物全部釋放[圖8(f)]。藥物的釋放主要是由PAMAM 樹狀大分子的P1和P3珠子以及DOX的D3珠子質子化造成的。一方面P1和P3珠子帶正電后,帶電珠子間相互產生排斥,使PAMAM樹狀大分子結構發生較大變化。圖9所示的是在不同pH環境下,G6代PAMAM 樹狀大分子的回轉半徑隨模擬時間的變化。從圖中可以觀察到,在低pH時G6代PAMAM樹狀大分子的回轉半徑要比其在生理pH時的大26.7%,說明低pH時,PAMAM樹狀大分子發生了更大的溶脹,這使得其內部疏水空腔直接暴露于外部溶液環境。另一方面,PAMAM樹狀大分子P1、P2珠子與DOX的D3珠子間的靜電排斥作用進一步促進了DOX分子從PAMAM樹狀大分子中釋放出來。
3 結 論
本文采用耗散粒子動力學模擬的方法研究了PAMAM樹狀大分子在水溶液中對DOX的包封和釋放行為。首先構建了G3~G7代PAMAM樹狀大分子的粗粒化模型,通過與SAXS實驗和其他MD模擬對比,發現該模型能很好地重現PAMAM樹狀大分子的構象性質。模擬結果表明DOX藥物主要分布在由P1和P2珠子構成內部空腔中,對珠子間的徑向分布函數和排斥參數分析表明PAMAM主要是通過疏水作用將DOX包封于其內部疏水空腔中。模擬發現G6和G7代PAMAM樹狀大分子對DOX的包封率分別為92.5%和100%,通過對G3~G7代PAMAM樹狀大分子孔隙率的分析,發現G6和G7代PAMAM樹狀大分子對DOX的包封能力較強,是因為其孔隙率較高,相同體積情況下,內部有更多的空腔可用于負載疏水藥物。模擬揭示了DOX在兩種pH環境下的釋放動態過程。在生理pH條件下,沒有DOX分子從G6代PAMAM樹狀大分子中釋出,但是PAMAM樹狀大分子發生溶脹,分子由致密的核結構變為致密的殼結構,抑制藥物釋放。在低pH時,DOX分子能快速地從PAMAM樹狀大分子中釋出,主要是因為PAMAM 樹狀大分子的伯胺(P3珠子)和叔氨基(P1珠子)以及DOX分子的伯胺基(D3珠子)發生了質子化,一方面使得PAMAM 樹狀大分子進一步溶脹,導致其內部疏水空腔暴露于外部溶液環境,另一方面質子化基團間的靜電排斥進一步促進了DOX分子的釋放。本文模擬結果可為基于樹狀大分子的藥物輸送體系的設計和優化提供有價值的參考。
符 號 說 明

aij——珠子i、j之間的DPD排斥參數,kJ·mol-1·nm-2 C——同一分子鏈中兩個成鍵珠子之間的彈簧力常數,kJ·mol-1·nm-2 Eij——珠子i、j之間的混合能,kcal·mol-1 e——元電荷,=1.602176565 ×10-19 C FCij——珠子i、j之間的保守力,N FDij——珠子i、j之間的耗散力,N FEij——珠子i、j之間的靜電力,N FRij——珠子i、j之間的隨機力,N FSij——相連珠子i、j之間的鍵作用力,N fi——珠子i所受到的總作用力,N k-1——常溫常壓下水的量綱1壓縮因子 kB——Boltzmann常數,J·K-1 kmax——倒易空間矢量 mi——珠子i的質量,kg N——樹狀大分子所含珠子數 Nm——1個水珠子所代表的水分子數 q——珠子電荷量,C R——理想氣體常數,R=8.314 J·mol-1·K-1 Rg——回轉半徑,nm rCele——珠子靜電截斷半徑,nm rc——珠子截斷半徑,nm rcom——樹狀大分子質心矢量,nm ri——珠子i的位置矢量,nm T——熱力學溫度,K vi——珠子i的速度,m·s-1 G——介電耦合常數 a——實空間收斂常數 b——slater-type電荷密度分布涂布系數 cij——珠子i、j之間的Flory-Huggins參數 er——室溫時水的介電常數,F·m-1 e0——真空介電常數,F·m-1 g——耗散力系數 qij——均值為0的隨機漲落變量 r——珠子數密度 s——噪聲振幅 wD(rij)——耗散力權重函數 wR(rij)——隨機力權重函數 下角標 i,j——珠子
References
[1] FOX M E, SZOKA F C, FRéCHET J M J. Soluble polymer carriers for the treatment of cancer: the importance of molecular architecture[J]. Acc. Chem. Res., 2009, 42(8): 1141-1151.
[2] TOMALIA D A, BAKER H, DEWALD J,. A new class of polymers: starburst-dendritic macromolecules[J]. Polym. J., 1985, 17(1): 117-132.
[3] WU P, FELDMAN A K, NUGENT A K,. Efficiency and fidelity in a click-chemistry route to triazole dendrimers by the copper(Ⅰ)-catalyzed ligation of azides and alkynes[J]. Angew. Chem. Int. Ed., 2004, 43(30): 3928-3932.
[4] CARNAHAN M A, GRINSTAFF M W. Synthesis of generational polyester dendrimers derived from glycerol and succinic or adipic acid[J]. Macromolecules, 2006, 39(2): 609-616.
[5] ZHONG T P, AI P F, ZHOU J. Structures and properties of PAMAM dendrimer: a multi-scale simulation study[J]. Fluid Phase Equilib., 2011, 302(1/2): 43-47.
[6] GILLIES E R, FRéCHET J M J. Dendrimers and dendritic polymers in drug delivery[J]. Drug Discovery Today, 2005, 10(1): 35-43.
[7] GUPTA U, AGASHE H B, ASTHANA A,. Dendrimers:? novel polymeric nanoarchitectures for solubility enhancement[J]. Biomacromolecules, 2006, 7(3): 649-658.
[8] CHENG Y Y, WANG J R, RAO T L,. Pharmaceutical applications of dendrimers: promising nanocarriers for drug delivery[J]. Frontiers in Bioscience-Landmark, 2008, 13: 1447-1471.
[9] YELLEPEDDI V K, VANGARA K K, PALAKURTHI S. Poly(amido)amine (PAMAM) dendrimer-cisplatin complexes for chemotherapy of cisplatin-resistant ovarian cancer cells[J]. J. Nanopart. Res., 2013, 15(9): 1-15.
[10] OOYA T, LEE J, PARK K. Hydrotropic dendrimers of generations 4 and 5:? synthesis, characterization, and hydrotropic solubilization of paclitaxel[J]. Bioconjugate Chem., 2004, 15(6): 1221-1229.
[11] MARKATOU E, GIONIS V, CHRYSSIKOS G D,. Molecular interactions between dimethoxycurcumin and Pamam dendrimer carriers[J]. International Journal of Pharmaceutics, 2007, 339(1/2): 231-236.
[12] KOJIMA C, KONO K, MARUYAMA K,. Synthesis of polyamidoamine dendrimers having poly(ethylene glycol) grafts and their ability to encapsulate anticancer drugs[J]. Bioconjugate Chem., 2000, 11(6): 910-917.
[13] BHADRA D, BHADRA S, JAIN S,. A PEGylated dendritic nanoparticulate carrier of fluorouracil[J]. International Journal of Pharmaceutics, 2003, 257(1/2): 111-124.
[14] TANIS I, KARATASOS K. Association of a weakly acidic anti-inflammatory drug (ibuprofen) with a poly(amidoamine) dendrimer as studied by molecular dynamics simulations[J]. J. Phys. Chem. B, 2009, 113(31): 10984-10993.
[15] SHI X, LEE I, CHEN X,. Influence of dendrimer surface charge on the bioactivity of 2-methoxyestradiol complexed with dendrimers[J]. Soft Matter, 2010, 6(11): 2539-2545.
[16] ABDERREZAK A, BOURASSA P, MANDEVILLE J-S,. Dendrimers bind antioxidant polyphenols and-platin drug[J]. PLoS ONE, 2012, 7(3): e33102.
[17] MAINGI V, KUMAR M V S, MAITI P K. PAMAM dendrimer-drug interactions: effect of pH on the binding and release pattern[J]. J. Phys. Chem. B, 2012, 116(14): 4370-4376.
[18] HOOGERBRUGGE P J, KOELMAN J M V A. Simulating microscopic hydrodynamic phenomena with dissipative particle dynamics[J]. Europhys. Lett., 1992, 19(3): 155-160.
[19] 郭泓雨, 崔潔銘, 孫德林, 等. 溫敏性兩親嵌段共聚物相行為的耗散粒子動力學模擬[J]. 化工學報, 2012, 63(11): 3707-3715. GUO H Y, CUI J M, SUN D L,. Dissipative particle dynamics simulation on phase behavior of thermo-responsive amphiphilic copolymer PCL-PNIPAM-PCL[J]. CIESC Journal, 2012, 63(11): 3707-3715.
[20] 孫德林, 周健. 耗散粒子動力學模擬Nafion膜和PVA/Nafion共混膜的介觀結構[J]. 物理化學學報, 2012, 28(4): 909-916. SUN D L, ZHOU J. Dissipative particle dynamics simulations on mesoscopic structures of Nafion and PVA/Nafion blend membranes [J]. Acta Physica-Chimica Sinica, 2012, 28(14): 909-916.
[21] 劉紅艷, 郭泓雨, 周健. PLGA-PEG共聚物負載多西紫杉醇的藥物輸運體系的計算機模擬[J]. 化學學報, 2012, 70(23): 2445-2450. LIU H Y, GUO H Y, ZHOU J. Computer simulations on the anticancer drug delivery system of docetaxel and PLGA-PEG copolymer[J]. Acta Chimica Sinica, 2012, 70(23): 2445-2450.
[22] GROOT R D, WARREN P B. Dissipative particle dynamics: bridging the gap between atomistic and mesoscopic simulation[J]. J. Chem. Phys., 1997, 107(11): 4423-4435.
[23] GROOT R D. Electrostatic interactions in dissipative particle dynamics-simulation of polyelectrolytes and anionic surfactants[J]. J. Chem. Phys., 2003, 118(24): 11265-11277.
[24] GONZ LEZ-MELCHOR M, MAYORAL E, VEL ZQUEZ M E,. Electrostatic interactions in dissipative particle dynamics using the Ewald sums[J]. J. Chem. Phys., 2006, 125(22): 224107.
[25] LIN S T, MAITI P K, GODDARD W A. Dynamics and thermodynamics of water in PAMAM dendrimers at subnanosecond time scales[J]. J. Phys. Chem. B, 2005, 109(18): 8663-8672.
[26] WEN X F, LAN J L, CAI Z Q,. Dissipative particle dynamics simulation on drug loading/release in polyester-PEG dendrimer[J]. J. Nanopart. Res., 2014, 16(5): 2403.
[27] GROOT R D, MADDEN T J. Dynamic simulation of diblock copolymer microphase separation[J]. J. Chem. Phys., 1998, 108(20): 8713-8724.
[28] GROOT R D, RABONE K L. Mesoscopic simulation of cell membrane damage, morphology change and rupture by nonionic surfactants[J]. Biophys. J., 2001, 81(2): 725-736.
[29] SEATON M A, ANDERSON R L, METZ S,. DL_MESO: highly scalable mesoscale simulations[J]. Molecular Simulation, 2013, 39(10): 796-821.
[30] RATHGEBER S, MONKENBUSCH M, KREITSCHMANN M,. Dynamics of star-burst dendrimers in solution in relation to their structural properties[J]. J. Chem. Phys., 2002, 117(8): 4047-4062.
[31] MAITI P K, MESSINA R. Counterion distribution and ζ-potential in PAMAM dendrimer[J]. Macromolecules, 2008, 41(13): 5002-5006.
[32] MAITI P K, CAGIN T, WANG G F,. Structure of PAMAM dendrimers:? generations 1 through 11[J]. Macromolecules, 2004, 37(16): 6236-6254.
[33] VOSS N R, GERSTEIN M, STEITZ T A,. The geometry of the ribosomal polypeptide exit tunnel[J]. J. Mol. Biol., 2006, 360(4): 893-906.
Dissipative particle dynamics simulations on loading and release of doxorubicin by PAMAM dendrimers
SU Yunxiang, QUAN Xuebo, MIN Wenfeng, QIAO Laicong, LI Libo, ZHOU Jian
(School of Chemistry and Chemical Engineering, Guangdong Provincial Key Laboratory for Green Chemical Product Technology, South China University of Technology, Guangzhou 510640, Guangdong, China)
Dissipative particle dynamics (DPD) simulations were employed to study the loading and release behaviors of anticancer drug doxorubicin (DOX) by drug delivery carrier polyamidoamine (PAMAM) dendrimers. A coarse-grained (CG) model for PAMAM dendrimers was first constructed, which reproduced the conformational properties of PAMAM dendrimers accurately. The effects of PAMAM dendrimer generation (G) on DOX loading and the environment pH on DOX release were investigated. Simulation results showed that PAMAM dendrimers mainly encapsulated DOX into their interior cavities through hydrophobic interaction. The encapsulation capacity of G6 and G7 PAMAM dendrimers were much better than PAMAM of lower generations, because there were more hydrophobic cavities inside G6 or G7 dendrimers for their high porosity. At low pH, PAMAM dendrimers underwent conformational changes, thus DOX molecule escaped from dendrimers quickly. Such phenomena are mainly caused by the protonation of primary amines and tertiary amines in PAMAM dendrimers and primary amines in DOX. The electrostatic repulsion between these charged groups will lead PAMAM dendrimers swelling immensely and the inner cavities being exposed, which promotes the release of DOX molecules. This work could provide useful guidance for the design and optimization of dendrimer-based drug delivery systems.
drug delivery; dendrimer; encapsulation; model; mesoscale; molecular simulation
10.11949/j.issn.0438-1157.20161736
O 641.3
A
0438—1157(2017)05—1757—10
周健。
蘇運祥(1990—),男,碩士研究生。
國家自然科學基金項目(91334202, 21376089);國家重點基礎研究發展計劃項目(2013CB733500);廣東省自然科學基金項目(2014A030312007);中央高校基本科研業務費項目(SCUT-2015ZP033)。
2016-12-12收到初稿,2017-02-15收到修改稿。
2016-12-12.
Prof. ZHOU Jian, jianzhou@scut.edu.cn
supported by the National Natural Science Foundation of China(91334202, 21376089), the National Basic Research Program of China(2013CB733500), the Natural Science Foundation of Guangdong Province(2014A030312007) and the Fundamental Research Founds for the Central Universities (SCUT-2015ZP033).

